靶向HER2治疗药物在转移性尿路上皮癌中的研究进展
2023-10-10陶铸磊
陶铸磊,方 立,马 琪
0 引言
吉西他滨/顺铂(GC)或甲氨蝶呤/长春碱/阿霉素/顺铂(MVAC)是治疗转移性尿路上皮癌(Metastatic urothelial cancer,mUC)的标准化疗方案[1]。然而,mUC患者即使接受了一线铂类化疗,中位总生存期(Overall survival,OS)也仅为15个月[2]。在铂类为基础的一线化疗失败后,二线化疗如多西他赛、白蛋白、紫杉醇等治疗效果非常有限[3]。免疫检查点抑制剂目前已成为mUC的重要治疗手段,用于mUC二线治疗、一线铂类化疗后的维持治疗以及不符合铂类化疗条件的转移性膀胱癌患者的一线治疗[4-5]。随着对mUC发生发展分子机制认识的增加,成纤维细胞生长因子受体(Fibroblast growth factor receptor,FGFR)抑制剂、靶向人表皮生长因子受体2 (Human epidermal growth factor receptor-2,HER2) 制剂和靶向Nectin-4、Trop-2等的抗体药物偶联物(Antibody-drug conjugates,ADCs)也成为新的治疗选择。本文对近年来靶向HER2治疗药物在mUC的研究进展进行综述。
1 HER2在尿路上皮癌中的表达
HER2基因位于染色体17q,编码具有酪氨酸激酶活性的跨膜受体蛋白,当HER2与表皮生长因子结合后会发生磷酸化,调节RAS信号通路的激活,促进细胞生长和增殖。表皮生长因子受体(Human epidermal growth factor receptor,EGFR)家族有4种,包括HER1(EGFR)、HER2(ERBB2)、HER3和HER4[6]。其中HER2通常以未激活的单体形式存在于细胞膜上,在与其他EGFR家族成员发生同源或异源二聚化后,在相应的配体刺激下被激活。HER2在激活后,进一步激活其下游信号,如MAPK和PI3K-AKT信号通路,最终促进细胞增殖、抑制凋亡、增加血管生成、减少细胞间黏附,是肿瘤发生和进展的重要因素[7-8]。HER2在乳腺癌、肺癌、胃癌和尿路上皮癌等肿瘤存在基因扩增与蛋白过表达,是这些肿瘤的重要治疗靶点。膀胱癌的癌症基因组图谱(TCGA)项目对131例尿路上皮癌(Urothelial cancer,UC)的首次综合分析显示,受体酪氨酸激酶/RAS通路的改变包括FGFR3的激活(17%),EGFR的扩增(9%),ERBB3的突变(6%),ERBB2的突变或扩增(9%)[9]。UC中约有6%~17%的样本存在ERBB2突变和扩增(有时同时存在),其中ERBB2扩增的发生率约为6%,在mUC中甚至更高(8.5%);ERBB2突变(约5%~11%)在UC中富集(40%),表现为微乳头状组织学[10]。HER2的单独表达或与EGFR及ERBB3共表达均与非肌层浸润性UC和肌层浸润性UC患者的生存有关[11]。Chakravarti等[12]研究显示,在接受同步放疗和顺铂为基础的化疗的肌层浸润性膀胱癌患者中,HER2表达阳性与放疗和化疗后完全缓解(Complete response,CR)率降低显著相关(P=0.026)。这些结果提示,HER2的表达是UC患者预后和完全缓解率降低的预测因素。
2 靶向HER2的小分子酪氨酸激酶受体抑制剂(Tyrosine kinase receptor inhibitors,TKIs)
由于HER2在乳腺癌、胃癌等实体瘤是相对成熟的靶点,目前已经开发了多种靶向HER2的小分子酪氨酸激酶受体抑制剂,并应用于这些实体瘤的治疗。研究者对靶向HER2的小分子酪氨酸激酶受体抑制剂对转移性尿路上皮癌患者进行了探索治疗。靶向HER2的药物作用机制见图1。
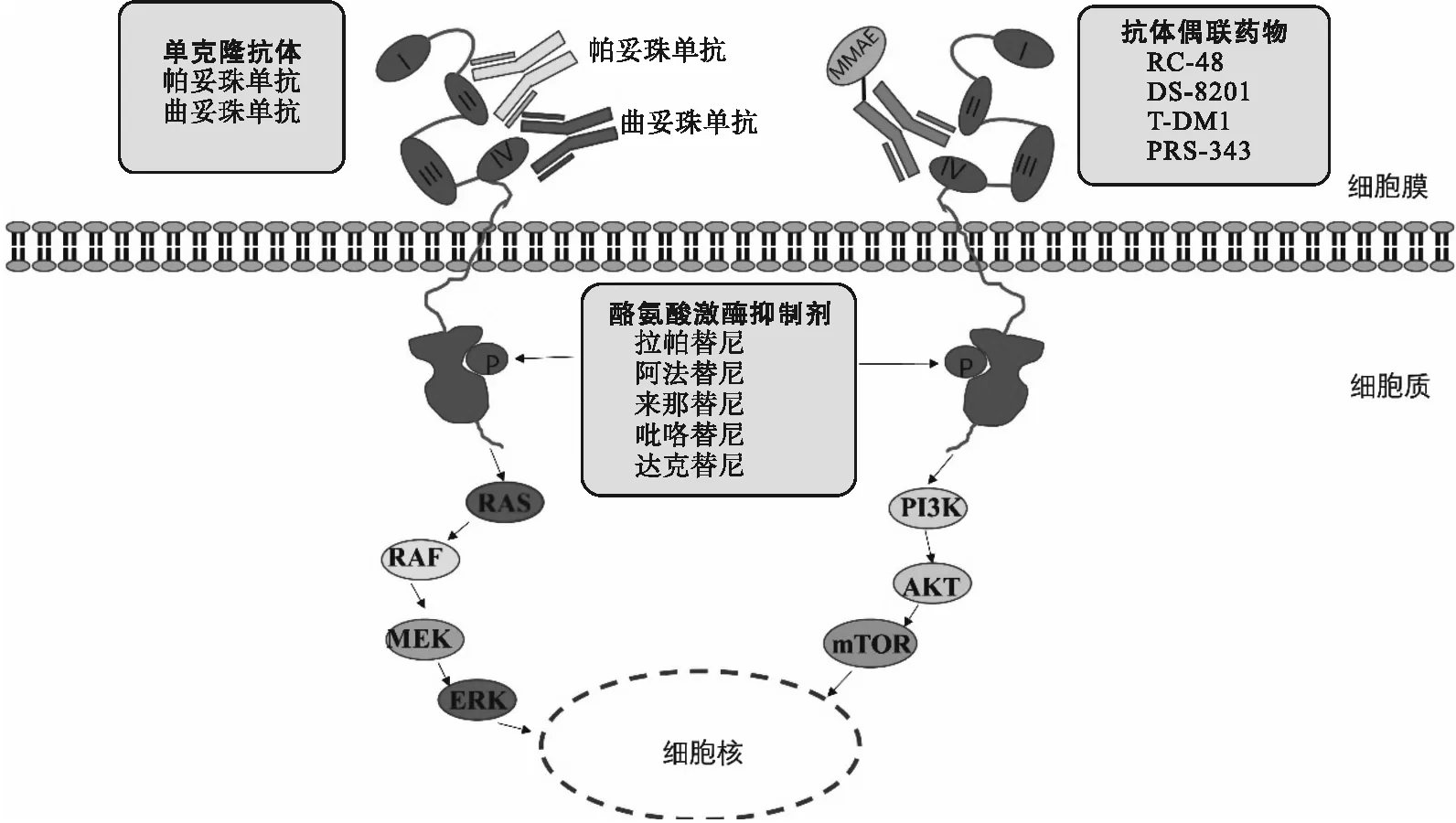
图1 靶向HER2药物的作用机制
2.1 拉帕替尼 拉帕替尼是一种双重酪氨酸激酶抑制剂,可抑制EGFR和HER2。一项前瞻性Ⅱ期研究评估了拉帕替尼作为局部晚期或转移性UC患者的二线治疗的疗效,只有1.7%的局部晚期或转移性UC患者表现出客观缓解,无进展生存期(Progression free survival,PFS)和总生存期(Overall survival,OS)的中位时间分别为8.6周和17.9周,该研究被认为是阴性的。然而,进一步的分析表明,过表达EGFR和/或HER2的肿瘤亚组患者的OS有所改善[13]。一项III期试验在HER1/2阳性的转移性膀胱癌患者一线化疗结束后,使用拉帕替尼与安慰剂进行维持治疗,拉帕替尼和安慰剂的中位PFS分别为4.5个月和5.1个月。拉帕替尼和安慰剂的OS分别为12.6个月和12.0个月,该试验未能发现在标准治疗中加入维持性拉帕替尼对治疗结局有改善作用[14]。
2.2 阿法替尼 阿法替尼是一种新型、口服、不可逆的ERBB受体家族酪氨酸激酶抑制剂。阿法替尼被批准用于治疗携带EGFR外显子19缺失或外显子21(L858R)突变的转移性非小细胞肺癌[15]。在一项II期试验中,阿法替尼对伴有ERBB2或ERBB3突变的铂类难治性mUC展示出显著活性,HER2/ERBB3突变的mUC患者的中位PFS为6.6个月,而HER2/ERBB3无突变的mUC患者中位PFS为1.4个月[16]。目前阿法替尼在mUC领域正在开展更多临床研究,如NCT02795156和NCT02780687[14]。
2.3 来那替尼 来那替尼是HER1、HER2和HER4的抑制剂。来那替尼在美国获批用于先前接受过基于曲妥珠单抗的辅助治疗方案的 HER2阳性早期乳腺癌患者的延长辅助治疗。然而,在靶向HER2和HER3突变癌症患者的多中心“篮子”试验中,来那替尼在mUC中未观察到任何治疗效应[17]。
2.4 吡咯替尼 吡咯替尼是一种不可逆的双泛ERBB受体酪氨酸激酶抑制剂,用于治疗HER2阳性晚期实体瘤。2018年8月,吡咯替尼在中国获得首个全球有条件批准,用于治疗HER2阳性、晚期或转移性乳腺癌患者。有一篇关于吡咯替尼治疗mUC的个案报道,1例携带HER2 V842I突变的mUC患者接受了吡咯替尼治疗,获得了良好的治疗效果[18]。
2.5 达克替尼 达克替尼是一种不可逆的酪氨酸激酶抑制剂,对EGFR、HER2和HER4的催化结构域具有结构特异性,用于治疗含有EGFR基因激活突变的非小细胞肺癌[19]。研究表明,达克替尼在人膀胱癌的体外和体内模型中具有单药活性[20]。达克替尼的抗肿瘤活性与HER受体的表达和下游信号通路的抑制相关,如抑制细胞分裂和诱导细胞凋亡[20]。
3 靶向HER2的单克隆抗体
3.1 曲妥珠单抗 曲妥珠单抗是一种针对HER2的人源化单克隆抗体,它结合HER2细胞外结构域的IV域,从而抑制非配体细胞内信号通路。此外,曲妥珠单抗可与自然杀伤细胞的Fcγ受体结合,引发抗体依赖的细胞介导的细胞毒性[21]。一项单臂II期研究分析曲妥珠单抗联合卡铂、紫杉醇和吉西他滨治疗HER2阳性的mUC患者的有效性和安全性,研究显示,曲妥珠单抗联合化疗是可行的。该研究的中位治疗周期为6个周期(1~12个周期),HER2阳性的mUC患者的客观缓解率(Objective response rate,ORR)为70%,中位PFS和OS分别为9.3个月和14.1个月,但心脏毒性高于预期[22]。另一项Ⅱ期试验评估了接受单纯化疗(铂类+吉西他滨)或联合曲妥珠单抗在HER2阳性局部晚期或转移性UC患者的有效性和安全性,结果显示,中位PFS(10.2个月vs.8.2个月)、ORR(65.5%vs.53.2%)和中位OS(15.7个月vs.14.1个月)无显著差异,但探索性分析显示,曲妥珠单抗治疗的患者接受顺铂(而非卡铂)化疗的效果更好(PFS:10.6个月vs.8.0个月;OS:33.1个月vs.9.5个月)[23]。
3.2 帕妥珠单抗 帕妥珠单抗是一种针对HER2的人源化单克隆抗体,它与HER2的细胞外结构域的II域结合后,可以阻断HER2与其他ERBB家族受体的二聚体化[24]。一项Ⅱ期试验(NCT02091141)通过基因测序、FISH或IHC,对12例伴有HER2扩增或激活突变的铂耐药mUC患者进行了帕妥珠单抗和曲妥珠单抗联合治疗。初步结果显示,联合治疗对HER2扩增或激活突变的铂耐药mUC的患者具有抗肿瘤活性,达到完全缓解(CR)1例,部分缓解(PR)2例,病情稳定(SD)2例,安全性可控[25]。
4 靶向HER2 的抗体偶联药物(ADC)
4.1 维迪西妥单抗(Disitamab vedotin,RC-48) 维迪西妥单抗是一种靶向HER2的新型ADC,由人源化抗HER2的单克隆抗体通过可切割连接子与细胞毒素MMAE偶联[26]。一项Ⅰ期临床试验评估了RC-48在HER2过表达(IHC 2+或3+)晚期实体癌患者中的疗效,包括4例mUC患者,结果显示,RC-48在mUC具有良好的抗肿瘤活性,ORR为50%,疾病控制率(DCR)为100%[27]。一项在43例HER2+(IHC 3+和2+)局部晚期或mUC患者中进行的Ⅱ期研究评估了RC-48的有效性和安全性,结果显示,中位PFS和OS分别为6.9个月和13.9个月,ORR为51%。研究表明,RC-48在至少一线全身化疗失败的HER2局部晚期或mUC患者中显示出可控的疗效和安全性[28]。该试验显示,在局部晚期或mUC患者的二线治疗中,RC-48与免疫检查点抑制剂(ICIs)相比,患者的ORR更高[29]。另一项正在进行的II期试验(NCT04879329)纳入了100例患者,以评估RC-48是否对表达HER2的尿路上皮癌有效[15]。一项正在进行的1b/2期试验的初步结果显示,局部晚期或转移性UC患者接受RC-48联合PD-1(特瑞普利单抗)治疗的ORR为75%,DCR为95%,CR为15%,且患者的ORR与HER2表达水平相关,HER2表达为(3+)的患者ORR为100%,HER2 (2+)的患者ORR 为77.8%,HER2 (1+)的患者ORR 为66.7%,HER2 (-) 的患者ORR 为50%[30-31]。一项Ⅲ期临床试验(NCT05302284)即将测试该组合在未治疗的HER2阳性mUC患者一线治疗中的疗效,并与一线铂类化疗进行比较[31]。
4.2 Trastuzumab deruxtecan(DS-8201) 目前正在研究的另一种HER2靶向药物是Trastuzumab deruxtecan (T-DXd)。T-DXd (DS-8201)是一种ADC,由特异性靶向HER2的人源化单克隆抗体曲妥珠单抗与强效拓扑异构酶I抑制剂连接,作为细胞毒药物(有效载荷)组成。在DESTINY-Breast 01试验中,DS-8201在HER2阳性转移性乳腺癌预处理患者中显示出持久的抗肿瘤活性[32]。
4.3 恩美曲妥珠单抗(T-DM1) T-DM1是一种靶向HER2的抗体-药物偶联物,它结合了曲妥珠单抗和一种名为Emtansine的微管抑制剂[33-34]。尽管T-DM1在HER2过表达膀胱癌的临床前模型中显示了良好的抗肿瘤作用[35],但在HER2扩增的膀胱癌患者中,TDM-1的多组织学II期“篮子”试验未能证明该药物在mUC患者中具有显著活性[17]。
4.4 PRS-343 PRS-343是一种双价双特异性融合蛋白,它具有抗HER2和抗CD137的双靶向抗体特性。目前正在研究该化合物单独(NCT03330561,I期)或与atezolizumab (NCT03650348,I期)联合治疗HER2阳性晚期实体肿瘤[27]。
5 结论
长期以来,HER2都被认为是mUC的一个潜在治疗靶点。然而,无论是靶向HER2的小分子抑制剂,还是单克隆抗体,在mUC均未能取得优异的研究结果,使针对HER2的靶向治疗在mUC进展缓慢。然而,随着我国自主研发的维迪西妥单抗获批mUC的适应证,靶向HER2的ADC药物在mUC领域展现出了良好的应用前景。目前,多项维迪西妥单抗单药或与PD-1联合治疗的临床试验正在进行,继DS-8201在乳腺癌治疗中取得重大进展后,其在mUC领域的临床试验也在开展。可以预测,HER2将成为mUC最重要的治疗靶点之一,靶向HER2的ADC药物将为mUC的治疗带来新的革命性的进步。
