河鲀毒素的检测技术与应用*
2023-10-10杨成芳赵鲁明王梁华
杨成芳 郭 晗 赵鲁明 王梁华
(海军军医大学基础医学院生物化学与分子生物学教研室,上海 200433)
海洋生物毒素是微藻、微生物等多种海洋生物产生的次级代谢产物,可在鱼类、贝类等组织中积累,经食物链传递至人类,导致人类中毒或死亡事件的发生。在沿海地区的食物中毒事件中,河鲀毒素(tetrodotoxin,TTX)中毒较为常见且病死率较高[1],对食品安全与人类健康造成了严重威胁,故TTX是重要的生物安全风险因子,需警惕并加强监管。在法规方面,日本政府规定河鲀鱼组织中的TTX含量不得超过2 mg/kg[2],欧洲则禁止四齿豚科鱼类流入市场,同时,针对贝类中的TTX,欧洲食品安全局建议贝类中的TTX不得超过44 μg/kg[3]。为方便监管部门日常监测,保障人类食用海产品的安全性,有效防范TTX污染的食品流入市场,发展快速、灵敏、有效、可靠的分析方法来检测这些TTX对于海产品管理和预防食源性中毒至关重要。
1 TTX是重要的生物安全风险因子
1.1 结构
20 世纪60 年代,Woodward[4]、Tsuda[5]、Goto[6]团队分别解析了TTX的结构(图1),为氨基全氢喹唑啉,分子质量为319 u,分子式为C11H17N3O8,是罕见的笼状分子,有一个胍基连接在高含氧碳骨架上,碳骨架由2,4-二氧杂金刚烷结构组成,并修饰有5个羟基。TTX至少有27种衍生物,其结构与分子式分别如图2与表1所示,因其衍生物难以实现商业化生产故限制了其研究进展。
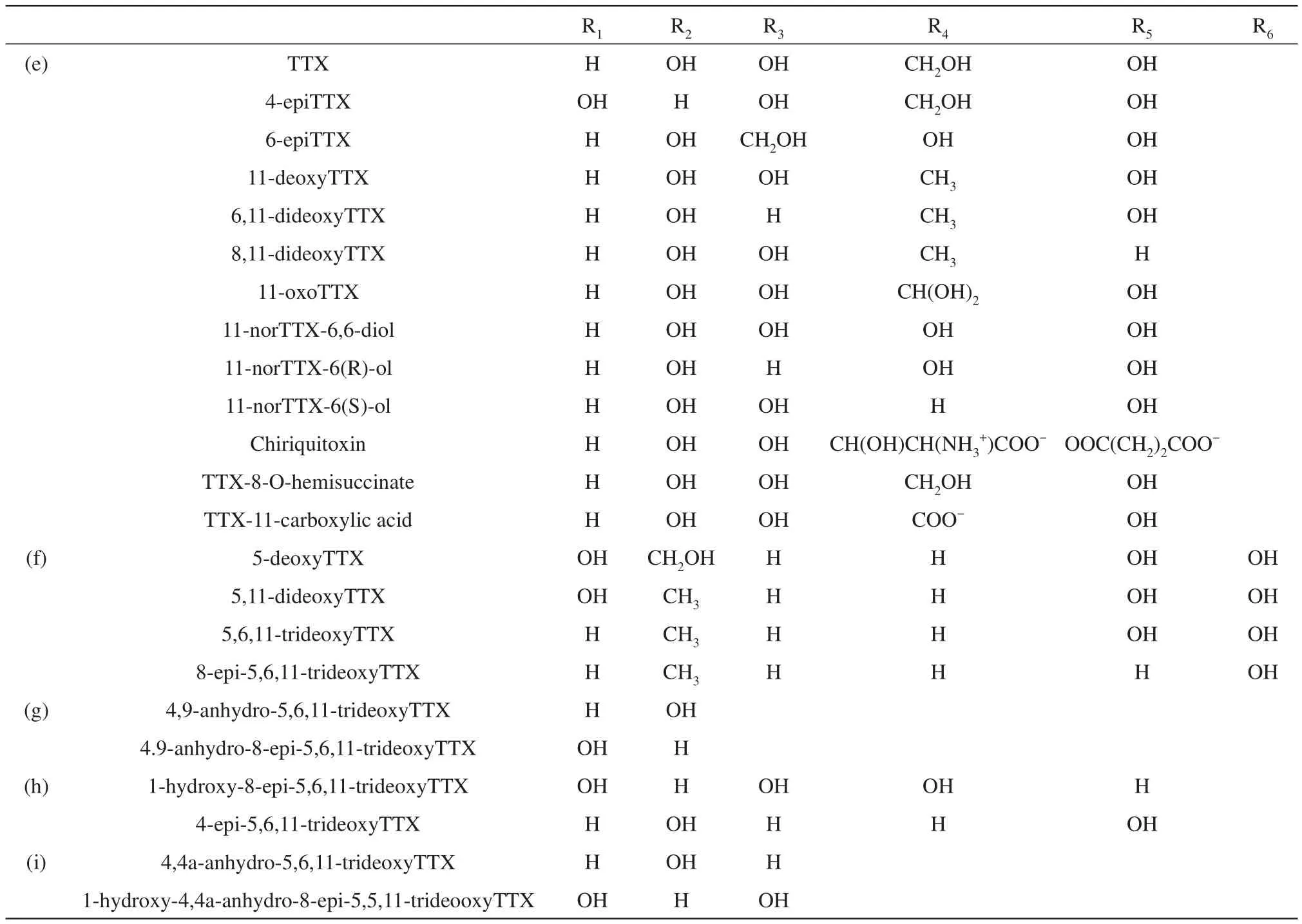
Table 1 TTX and its analogues表1 TTX及其类似物

Fig.1 The structure of TTX[7]图1 TTX的结构[7]
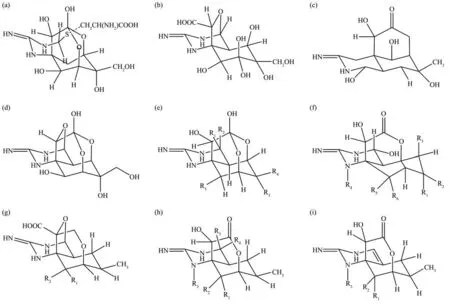
Fig.2 Analogues from TTX[8]图2 TTX衍生物[8]
1.2 致死剂量
TTX是毒性极强的麻痹性生物碱毒素,毒性是氰化物的1 000倍[9]。TTX对昆明小鼠腹腔注射、皮下注射、灌胃给药LD50值分别为:10.7、12.5、532 μg/kg,LD99值分别为:12.5、14.5、622 μg/kg,且雄性小鼠比雌性的毒性反应更敏感。TTX对大耳白家兔肌肉注射给药与静脉注射给药的最低致死剂量为5.3 μg/kg与3.1 μg/kg,全死剂量为5.8 μg/kg与3.8 μg/kg[10]。推断50 kg成人的最小致死剂量仅为2 mg[2],该毒性剂量可能会因年龄、健康状况和对毒素的敏感性等个体因素存在一些差异。
1.3 作用机制
TTX发挥毒性作用机制(图3)为带正电的胍基基团通过静电吸附作用与神经、肌肉细胞上电压门控性 Na+通道(voltage-gated Na+channel,VGSC)的氨基酸残基高效结合,从而形成空间位阻,阻碍Na+通过神经细胞的细胞膜[11],从而阻止动作电位的产生,进而引发一系列机体功能紊乱。迄今为止,已从哺乳动物中成功鉴定出10种VGSC亚型。根据α亚基的差异,分别命名为Nav1.1~Nav1.9 和 NavX。其中 Nav1.1、Nav1.2、Nav1.3、Nav1.4、Nav1.6和Nav1.7对TTX高度敏感,主要表达于骨骼肌和神经系统[12]。
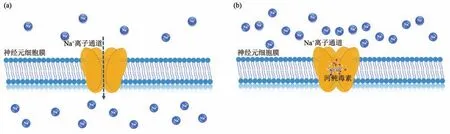
Fig.3 TTX toxicity mechanism[13]图3 TTX作用机制示意图[13]
1.4 中毒表现
TTX中毒后的临床表现见表2。

Table 2 Clinical classification of TTX poisoning[1,8,14]表2 TTX中毒的临床分级[1,8,14]
1.5 临床治疗
目前,尚无TTX特效解毒剂,对于TTX中毒患者的治疗多为对症治疗。在孟加拉国TTX中毒事件中[15],21名患者被给予新斯的明和阿托品肌松拮抗药,但未见其改善病情。泰国TTX中毒事件[16]的治疗表明,为TTX中毒患者提供呼吸支持直至TTX排出体内可降低病死率,245例患者接受气管插管和机械通气治疗,其中239例(97.5%)完全恢复,5例(2%)死亡,1例(0.4%)出现缺氧性脑损伤。在TTX中毒早期,可使用活性炭减少TTX在胃中的释放[17-18]。在中毒后60 min内,可通过洗胃来干预病情恶化,但洗胃治疗可能导致喉痉挛、鼻出血、水中毒或机械性胃损伤等并发症[19]。
2 TTX检测技术
TTX可通过食物链蓄积,在海洋生物体内传递并富集,因误食TTX而导致的中毒事件在日本[2]、澳大利亚[14]、孟加拉国[15]均有报道。中国浙江、江苏、福建近海领域螺类TTX污染较为严重,春夏季是毒素污染的高发期,辽宁与天津近海领域捕捞的河鲀鱼体内TTX水平较高[20]。鉴于TTX中毒事件给公共安全与食品安全带来了巨大挑战,TTX的检测能够起到风险预警的作用,为监管TTX提供技术保障。基于检测原理可将传统检测方法分为:生物检测法、化学检测法与免疫检测法。近年来,随着适配体技术的发展,以适配体作为新型检测元件的适配体检测技术也蓬勃发展。
2.1 检测样品制备
在实验室的实际检测中检测样品的制备方式有两种,一是直接从有毒动物组织中提取TTX,二是将无毒组织中掺入商品化TTX。提取TTX的过程涉及样品前处理方式的差异,首先是提取液的必要成分乙酸浓度的差异,提取液的种类是否含有甲醇及其他有机溶剂,其次是称取样品的重量差异,再次是具体处理流程的差异。同样,掺入商品化TTX的样品制备方法根据实验设计也有诸多方案,样品制备作为实际检测特别关键的一环,需要严格的标准化制备方式。实验室实际检测应参照最新的GB 5009.206-2016《食品安全国家标准水产品中河豚毒素的测定》,该标准不仅规定了传统的生物、化学、免疫检测的标准方法,同样规定了各种检测方法中样品提取的标准方法。
2.2 以TTX毒性特性为基础的生物检测法
小鼠生物法作为最早且使用最广泛的TTX检测方法[21],是一种针对TTX毒性的检测方法,曾被日本、美国等作为标准方法。其操作方法为选取20~22 g无特定病原体的健康雄性小鼠[22],通过腹腔注射不同浓度的TTX,观察并记录小鼠的死亡时间。根据小鼠死亡时间与剂量呈线性关系,进而实现TTX的定量检测。TTX的毒力用“鼠单位”(mouse unit,MU)表示,1 MU是指向小鼠腹腔中注射一定剂量的TTX,使小鼠在30 min内死亡的最小剂量[23]。该方法优势在于操作简单、直观,不足在于结果易受小鼠的体重与健康程度、饲养条件等个体差异影响,因此重复性差。小鼠生物法检测结果还受TTX溶液中其他溶剂的影响,难以运用于临床血样与尿液的检测,需要一定数量的小鼠才能反映TTX的毒性水平,难以实现样品中TTX的准确定量,大量使用活体小鼠在伦理上存在争议。同时,难以通过小鼠的中毒症状区分TTX与其类似物以及石房蛤毒素(saxitoxin,STX)等麻痹性贝类毒素。
1978年,《日本食品卫生检验手册》[24-25]将小鼠生物法作为官方TTX检测方法。1995年,《美国官方分析化学家协会官方分析方法》[24]也将小鼠生物法定为麻痹性贝类毒素的标准检测方法。目前,小鼠生物法被广泛应用于TTX实际检测中,Indumathi等[26]采用0.1%的乙酸溶液萃取印度泰米纳度的钦奈海岸捕获的横纹东方豚组织中TTX,并利用小鼠生物法检测其毒性。其选择了体重在18~22 g的雄性ddY小鼠,通过小鼠生物检测,确定了横纹东方豚的卵巢毒性最高(163 MU/g),其次是肝脏(143.33 MU/g)、皮肤(75.88 MU/g),肌肉组织无毒性。研究者同时采用气相色谱-质谱(GC-MS)与高效液相色谱(HPLC)法对横纹东方豚的毒性进行定性、定量检测:GC-MS定量限(limit of quantitation,LOQ)为0.05 mg,检测限(limit of detection,LOD)为0.005 mg,结果显示,10 g不同组织样品中,卵巢TTX含量最高(34.5 μg),其次是肝脏(32.5 μg)和皮肤(16.5 μg);HPLCLOQ为0.1 mg,LOD为0.01 mg,结果显示,10 g不同组织样品中,卵巢TTX含量最高(51 μg),其次是肝脏(48 μg)和皮肤(18 μg)。色谱检测法与小鼠生物法检测结果一致,验证了小鼠生物法在毒性初步判断方面准确可靠。
2.3 以TTX抗原特性为基础的免疫检测法
免疫检测法是基于抗原抗体特异结合原理,对样品中的TTX进行定性或定量检测的方法。由于TTX体积较小,缺乏免疫原性,难以作为全抗原刺激免疫动物产生抗体。1989年,Huot等[27]通过甲醛将TTX偶联于钥孔血蓝蛋白(keyhole limpet hemocyanin,KLH)上,从而使其形成全抗原,免疫6~8周龄的雌性BALB/c小鼠。当小鼠体内抗TTX抗体滴度达到最高水平时,将其脾内B淋巴细胞与NS-1小鼠骨髓瘤细胞融合以产生杂交瘤细胞,在所检测的9 329个单克隆抗体中,337个(3.6%)抗体为抗TTX阳性。最终,分离到TD2C5和TD13al高度稳定反应的单克隆抗体,IC50值分别为2×10-7mol/L与5×10-7mol/L,且不与STX产生交叉反应,具有较高的稳定性和特异性。免疫检测法优势在于其高度的灵敏度与特异性,且样品消耗量少,检测速度较快,制备成试剂盒后无需昂贵的设备与专业的操作人员,可用于TTX的现场检测。其不足在于TTX抗体获得难度较大,成本高且周期长,因此限制了其规模应用。最常用的TTX免疫检测法主要包括酶联免疫吸附实验(enzymelinked immunosorbnent assay,ELISA)与胶体金免疫层析技术。
2.3.1 酶联免疫吸附实验
在早期TTX单克隆抗体制备过程中,常采用TTX偶联于KLH作为全抗原免疫动物的方法,有研究指出这种方法难以产生高亲和力的TTX抗体。Kawatsu等[28]在初步研究中用TTX-KLH偶联物免疫的小鼠获得的抗体对游离TTX没有反应,于是改进了免疫原的制备过程:将0.1%乙酸萃取而得的TTX耦联到牛血清白蛋白(bovine serum albumin,BSA)上作为全抗原免疫BALB/c小鼠,最终得到与4,9-anhydroTTX有轻微免疫交叉反应的TTX的单克隆抗体。进一步建立了快速灵敏的竞争性酶免疫分析法(enzyme immunoassay,EIA),可在30 min左右实现TTX定量检测,且定量分析的范围为2~100 μg/L。除了TTX单克隆抗体,多克隆抗体的出现也为TTX检测提供了新思路。由于TTX有一系列类似物,为了快速检测实际样品中TTX及其类似物的成分,Sato等[29]将4,9-anhydroTTX依次与1,2-乙二硫醇、KLH反应,然后免疫家兔,获得与4,9-anhydroTTX、TTX、4-epiTTX、11-oxoTTX、5,6,11-trideoxyTTX均有免疫反应的多克隆抗体,从而建立了ELISA,对TTX、4-epiTTX、11-oxoTTX的LOD约为3 nmol/L,5,6,11-trideoxyTTX、4,9-anhydroTTX的LOD分别约为10 nmol/L、300 nmol/L,且不与阻滞Na+通道的麻痹性贝类毒素产生交叉反应,具有较好的特异性。
2.3.2 胶体金免疫层析技术
Huang等[30]成功地制备了两种胶体金免疫层析试纸条用于TTX的高效灵敏检测,其分别基于可增强信号的多支纳米金(AuNF)和大粒径乳胶微球(LM)两种报告分子。所开发的免疫层析试纸对于的检测具有良好的特异性和灵敏度:基于AuNF试纸的LOD为9.49 μg/L,基于LM试纸的LOD为5.40 μg/L。研究者试纸条检测了黄鱼、草鱼、鲈鱼和河鲀4个样品,10 min内即可得到检测结果,与ELISA试剂盒检测结果一致,在保障食品安全方面具有良好的应用前景。
免疫检测法的关键在于抗体的获得,而TTX无免疫原性,需设计偶联物制备成全抗原,抗原的设计会极大影响抗体的性能。有研究发现,TTX与KLH偶联免疫动物难以获得高亲和力的单克隆抗体,于是有学者改进了TTX的偶联方式,将TTX与BSA偶联作为全抗原,所得TTX抗体的亲和力大大提升,仅与4,9-anhydroTTX有轻微的交叉反应,特异性也有所提高。针对各种水生生物中检测TTX及其类似物,有学者将4,9-anhydroTTX的C4与KLH偶联制备了新抗原,免疫家兔得到了多克隆抗体,其对TTX及多种类似物结合而不与其他麻痹性神经毒素作用,被识别的TTX类似物的C9有一致性,因此推断C9是多克隆抗体的识别的关键部位,与之前单克隆抗体作用的关键部位为C9与C10的结论一致。TTX全抗原的制备一般会保留其活性基团胍基,在此基础上,未来应在偶联物、偶联部位的选择上探索设计新抗原,以期获得高亲和力的TTX抗体。
2.4 以TTX化学特性为基础的化学检测法
TTX的化学检测方法主要包括核磁共振(NMR)检测法、GC-MS检测法、液相色谱-荧光(LC-FLD)检测法与液相色谱-质谱(LC-MS)检测法,这几种方法不仅能够检测样品中的TTX,同时还能够分析TTX的类似物及其他毒素,从而更全面地评估风险。由于TTX及其类似物的荧光强度差异很大,如6-epTTX和11-norTTX-6(R)-ol的荧光强度分别比TTX高20倍和10倍,而5-deoxyTTX和11-deoxyTTX的荧光强度分别比TTX低1/20和1/100[31-32],此外样品基质也会干扰背景信号,故LC-FLD不适合用于实际样品的检测分析。而NMR在实际样品检测中,也因样品基质组分的强烈干扰会影响光谱的质量而受限。GC-MS虽已被用来检测样品中的TTX,但由于TTX是非挥发性的,在GC-MS分析前需要将其转化为挥发性C9碱衍生物,因此会产生重现性差的问题,同时衍生化需要大量的样品,费时费力且成本较高。因此,LC-MS特别是LC-MS/MS是测定TTX及相关化合物的最佳选择,在定量检测方面拥有不可取代的地位。但LC-MS因涉及液相色谱仪与质谱仪的使用,需要大型昂贵的仪器,样品前处理与仪器操作较为复杂,需要专业人员来操作,故限制了其应用场景,不适用于TTX的现场快速检测。
目前,不同的实验室所使用的LC-MS/MS检测方案不同(表3),导致检测限、定量限与检测范围的较大差异。加之,各验室的色谱柱、色谱仪、质谱仪一系列仪器来源于Agilent、Waters等不同厂家的不同型号,同时样品的处理方式各有不同,这就使得已报道的一些检测方法中的仪器使用参数不具有通用性,未来应该通过实验室间的协作对LC-MS/MS方案进行标准化,以进一步提高实验室LC-MS/MS法的精密度。

Table 3 Laboratory protocol for LC-MS/MS method表3 LC-MS/MS法的实验室方案
2.5 以TTX配体特性为基础的适配体检测技术
适配体是具有特异性识别功能的单链寡核苷酸分子,可折叠形成特定的三维结构从而高亲和力高特异性地结合配体分子。适配体由指数富集的配体系统进化技术(systematic evolution of ligands by exponential enrichment,SELEX)筛选得到,具体操作步骤:将靶标加入到预先设计好的随机单链寡核苷酸文库中,孵育一定时间后,分离出与靶标结合较好的寡核苷酸序列,并将其扩增后作为次级文库继续进行孵育筛选循环直至得到高亲和力的核酸适配体序列。若要提高所得核酸适配体的特异性,可向筛选文库中加入反筛靶标,移除与反筛靶标结合的单链寡核苷酸序列,便可提高所得核酸适配体序列的特异性[42]。
2012年,邵碧英等[43]首次报道了TTX核酸适配体的制备,将TTX固定于丙烯酸环氧乙烷珠子,利用SELEX技术,成功获得了亲和力吸光度值为1.343的G10适配体,开创了TTX适配体筛选的先河。2014年,邵碧英等[44]又获得了对TTX高亲和力的适配体A3,其亲和力吸光度值为1.254,并利用该适配体序列,建立了DNA适配体-荧光染料法,对TTX的检出限为10-6mol/L。自此,随着适配体技术的发展,适配体检测技术开始广泛应用于TTX的检测领域,表4列举了目前已报道的适配体作为新型的分子识别元件的TTX检测方法。

Table 4 The detection method of TTX molecular recognition element based on aptamer was established表4 以适配体作为TTX分子识别元件的检测方法建立
目前已报道的利用TTX适配体建立的检测方法主要将适配体为新型的分子识别元件与荧光、电化学、表面增强拉曼散射(surface enhanced Raman scattering,SERS)等技术联用,并应用于实际样品检测中,灵敏度高、特异性强、可靠性好。适配体的亲和力与特异性可媲美单克隆抗体,但同时又有着单克隆抗体不可比拟的优势(表5),在实际检测中将有更广阔的应用场景。
2.6 TTX检测方法的比较
4种TTX常用检测方法的优势和不足(表6)。

Table 5 List of aptamers compared with antibodies表 5 适配体与抗体比较列表
3 总结与展望
TTX毒性极强且理化性质稳定,常规烹饪手段难以使其失活,若不慎误食或处理不当,极易导致中毒事故,对生态安全、食品安全与公共安全等领域产生较大威胁。故快速、高效、灵敏、特异的检测技术是有效防范与应对TTX中毒事件的重要措施。生物检测法、免疫检测法与化学检测法是TTX传统检测方法,但仍存在抗干扰能力不强且灵敏度不足的缺点,而适配体这一新型分子识别元件的出现,开辟了TTX检测的新路径,尤其是适配体与荧光技术、SERS技术等生物传感器平台联合让TTX的快速、超灵敏、实时检测的实现成为可能。
TTX类似物较多,目前难以实现其商品化生产,故极大限制了其检测等研究的发展,LC-MS法仍是分辨其类似物的最佳方式。随着TTX多克隆抗体的出现,可以快速灵敏地检测TTX及其类似物,而适配体技术的兴起则展现出比抗体更大的优势,其易体外修饰改造的特性将为TTX类似物的识别提供巨大的优势与广阔的应用前景。
