镉胁迫下地肤根际与非根际土壤微生物群落结构及多样性
2023-10-10肖锐谭璐吴亮张皓郭佳源杨海君
肖锐, 谭璐, 吴亮, 张皓, 郭佳源, 杨海君*
(1.湖南农业大学资源环境学院,长沙 4 101281; 2.长沙经开区管委会,长沙 410100;3.核工业二三〇研究所,长沙 410007)
土壤微生物是土壤生态系统的重要组成部分,对重金属污染土壤的植物生长以及重金属的生物地球化学循环起到重要作用[1-2]。在所有土壤微生物中,根际微生物被定义为“受根周围土壤区域影响的微生物”,其与植物根系的直接接触而影响着植物根际活动[3]。实际上,每种植物在其根际都有特定的微生物群落,这在促进宿主植物生长和重金属解毒等方面均起着重要作用[4]。在重金属污染的土壤中,土壤微生物通过不断调整自身群落结构以及代谢能力以适应不同的生长环境[5],例如:土壤微生物可通过增加碳氮固定化微生物的丰度以及代谢酶的活性来增强植物对重金属毒性的抵抗能力[6],同时,一些根际细菌可以通过细胞内积累[7]、细胞外沉淀[8]、重金属离子的吸附或转化[9]来降低重金属对植物的毒性并防止其迁移。因此,土壤根际微生物群落对植物健康、养分循环和植物修复过程至关重要[10]。随着高通量测序技术在微生物多样性与功能研究方面的应用[11-13],人们利用高通量测序揭示了土壤中微生物丰度与环境参数相关,鉴定出了对重金属耐受和敏感的微生物[14]。在植物修复土壤重金属污染方面,研究者发现随着重金属毒性的增强,芒草的修复能力逐渐减弱,且重金属毒性改变了芒草土壤微生物群落的结构[15]。
地肤(Kochia scopariaL.Schrad.)为藜科地肤属一年生草本植物,极耐旱、耐盐碱、耐贫瘠、适生性强、根系发达、生长快、生物量大。目前对地肤的研究集中于其营养成分、耐盐生理特性[16-17]、栽培与园林应用等方面,也有研究报道了地肤对矿区土壤重金属的累积特性[18-20]、耐受性和富集能力[21-22],尚未见镉(Cd)胁迫对地肤根际与非根际土壤微生物群落结构及多样性影响的报道。本研究以初始土壤pH 6.1、总Cd 2.753 mg·kg-1胁迫下培植150 d的地肤盆栽土壤为供试样品,采用高通量测序技术研究Cd 胁迫下地肤根际和非根际土壤中微生物群落结构特征,明晰地肤对土壤Cd污染的耐受性与土壤微生物群落构成变化的联系,以期为地肤修复Cd污染土壤提供理论依据。
1 材料与方法
1.1 试验设计及样品采集
2021 年10 月14 日在湖南农业大学耘园基地选取初始pH 6.1、土壤总Cd 2.753 mg·kg-1胁迫下培植150 d 长势一致的盆栽地肤根际和非根际土壤为研究对象(该处理下地肤对土壤Cd的富集系数和转运系数均最大[23],分别达4.22、1.71),采集地肤根际和非根际土壤样品。根际土壤样品采用抖落法[24]采集,挖取盆中整株地肤,揉捏地肤茎秆,拍打掉大块土壤,轻抖根部,抖落土壤后,用灭菌的刷子轻刷黏附在地肤根表面的土壤,即为每株地肤的根际土壤(G),将3 盆6 株的根际土壤充分混匀则为1 个根际土壤样品。轻轻抖落大块不含根系的土壤后,用陶瓷剪刀取下附着在根系周围的土壤,作为非根际土壤(F),3 盆的非根际土壤充分混匀为1 个样本的非根际土壤样品。将根际和非根际土壤样品各分成2 份,用无菌自封袋封装,一份用于土壤理化性质、养分及总Cd测定;另一份置于冷却泡沫箱中立即带回实验室,于超净工作台上用2 mL 离心管进行分装,并立即转移到-80 ℃超低温冰箱保存,样品冰冻寄存送生工生物工程(上海)股份有限公司提取土壤微生物。每个处理设置3个重复,分别命名为G-1、G-2、G-3和F-1、F-2、F-3。
1.2 土壤理化性质、养分及Cd含量
土壤pH 值采用电位法[24]测定;土壤含水量采用烘干法[25]测定;土壤有机质含量采用直接电位滴定法[26]测定;土壤全氮(total nitrogen,TN)含量采用凯氏定氮法[27]测定;碱解氮(alkaline hydrolysis nitrogen,AN)含量利用碱解扩散法[27]测定;全磷(total phosphorus,TP)和速效磷(available phosphorus,AP)含量采用钼锑抗比色法[27]测定;土壤总Cd含量采用王水—高氯酸消解法[28]测定。
1.3 土壤总DNA提取
采用OMEGA 试剂盒E.Z.N.A™ Mag-Bind Soil DNA Kit 提取土壤微生物基因组总DNA,利用synergey HTY 酶标仪对已提取的核酸含量进行检测,并通过保守区设计引物,再在引物尾端加上测序接头,进行PCR 扩增。扩增时采用引物314F(5’-CCTACGGGNGGCWGCAG-3’)和805R(5’-GACTACHVGGGTATCTAATCC-3’)扩增细菌V3~V4区;用ITS1F(5’-CTTGGTCATTTAGAGGAAG-TAA-3’)和ITS2(5’-GCTGCGTTCTTCATCGATGC-3’)扩增真菌ITS1 区;后对扩增的细菌和真菌产物分别进行纯化、定量和均一化构建文库。已建成的文库首先采用Qubit 3.0 定量和文库检测合格后,用Illumina Miseq 平台进行测序。高通量测序所得到的原始图像数据文件,经过碱基识别分析后转换为原始序列(raw reads),然后对原始序列进行过滤、拼接、去除嵌合体等得到有效序列(effective reads)。
1.4 数据分析
采用SPSS 25.0 软件进行数据整理分析。将测序原始数据去除引物接头序列、各低质量碱基后进行拼接,舍弃长度小于200 bp 的序列,去除非特异性扩增序列及嵌合体后,得到各样本的有效序列数据。采用Usearch 软件进行OTUs(operational taxonomic units)聚类和物种信息分析。利用mothur 软件进行Alpha 多样性指数分析,包括Ace 指数、Chao 指数、Simpson 指数和Shannon指数;用R软件绘制稀释曲线,分析土壤微生物群落在各分类等级的相对丰度;利用Venn 图统计各样本中共有及特有的OTUs 数量;运用R 的gplots软件包进行UPGMA(unweighted pair-group method using arithmetic averages)聚类分析并作树状图;利用R 软件生成主成分分析(principal component analysis,PCA)。
2 结果与分析
2.1 Cd 胁迫下地肤根际与非根际土壤理化性质、养分及总Cd含量
Cd 胁迫下,地肤根际和非根际土壤的理化性质、养分及Cd 含量如表1 所示。根际和非根际土壤的pH、水分、有机质含量分别为5.01、23.26%、21.71 g·kg-1和5.56、23.76%、19.83 g·kg-1。其中根际土壤pH 及总Cd 含量显著低于非根际土壤;根际土壤速效磷含量显著高于非根际土壤;其余指标在根际和非根际土壤间差异不显著。
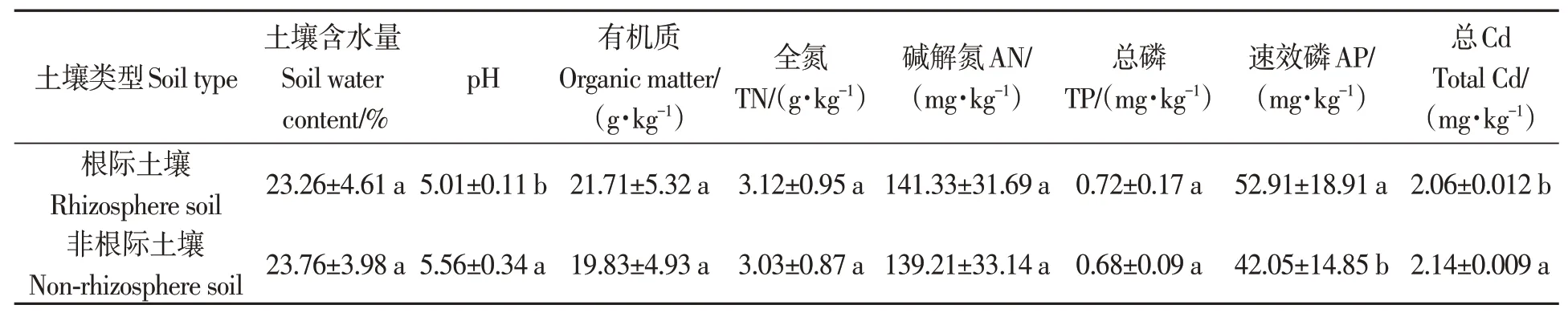
表1 镉胁迫下地肤根际与非根际土壤理化性质、养分及Cd含量Table 1 Chemical properties, nutrients and total Cd content of rhizosphere and non-rhizosphere soil of Kochia scoparia under Cd stress
2.2 土壤微生物样品测序结果
根际土壤细菌共得到原始序列351 307条,经拼接、质控过滤后得到有效序列349 700 条,平均序列长度412 bp;根际土壤真菌共得到原始序列233 024 条,经拼接、质控过滤后得到有效序列232 882 条,平均序列长度264 bp。非根际土壤细菌共得到原始序列305 198条,经拼接、质控过滤后得到有效序列303 796条,平均序列长度414 bp;非根际土壤真菌共得到原始序列248 453 条,经拼接、质控过滤后得到有效序列248 334 条,平均序列长度261 bp。稀释曲线(图1)表明,当细菌OTUs 数量达到1 500 左右,真菌OTUs 数目达到500 左右,稀释曲线趋于平稳,随着数据量增大仅产生较少的新物种,说明此时测序量已基本覆盖土壤微生物类群,试验结果科学可靠。
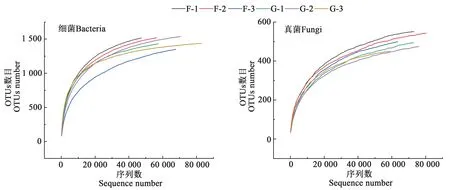
图1 土壤样品的稀释曲线Fig. 1 Dilution curves of the soil samples
2.3 镉胁迫下地肤根际与非根际土壤微生物群落多样性和丰富度
2.3.1Alpha 多样性指数 由表2 可知,地肤非根际土壤细菌的Simpson 指数大于根际土壤;而Shannon 指数小于根际土壤,因地肤非根际和根际土壤细菌的物种丰富度较接近,而均匀度差别较大,采用Simpson指数的效果更好[29],由此表明,地肤非根际土壤细菌的群落多样性高于根际土壤;非根际土壤细菌的Chao1 指数和ACE 指数均大于根际土壤,表明非根际土壤细菌的丰度高于根际土壤,但差异不显著。地肤非根际土壤真菌的Shannon 指数和Simpson 指数均大于根际土壤,表明非根际土壤真菌的群落多样性高于根际土壤,但差异不显著;非根际土壤真菌的Chao1指数和ACE指数均大于根际土壤,表明非根际土壤真菌的丰度高于根际土壤,但均差异不显著。此外,在地肤根际和非根际土壤中,除Simpson 指数外,土壤细菌的Shannon 指数、Chao1 指数、ACE 指数均高于真菌,说明地肤根际和非根际土壤中细菌的群落多样性和丰度均高于真菌。无论是细菌还是真菌,根际土壤的Simpson指数均小于非根际土壤,说明非根际土壤的生物多样性高于根际土壤。
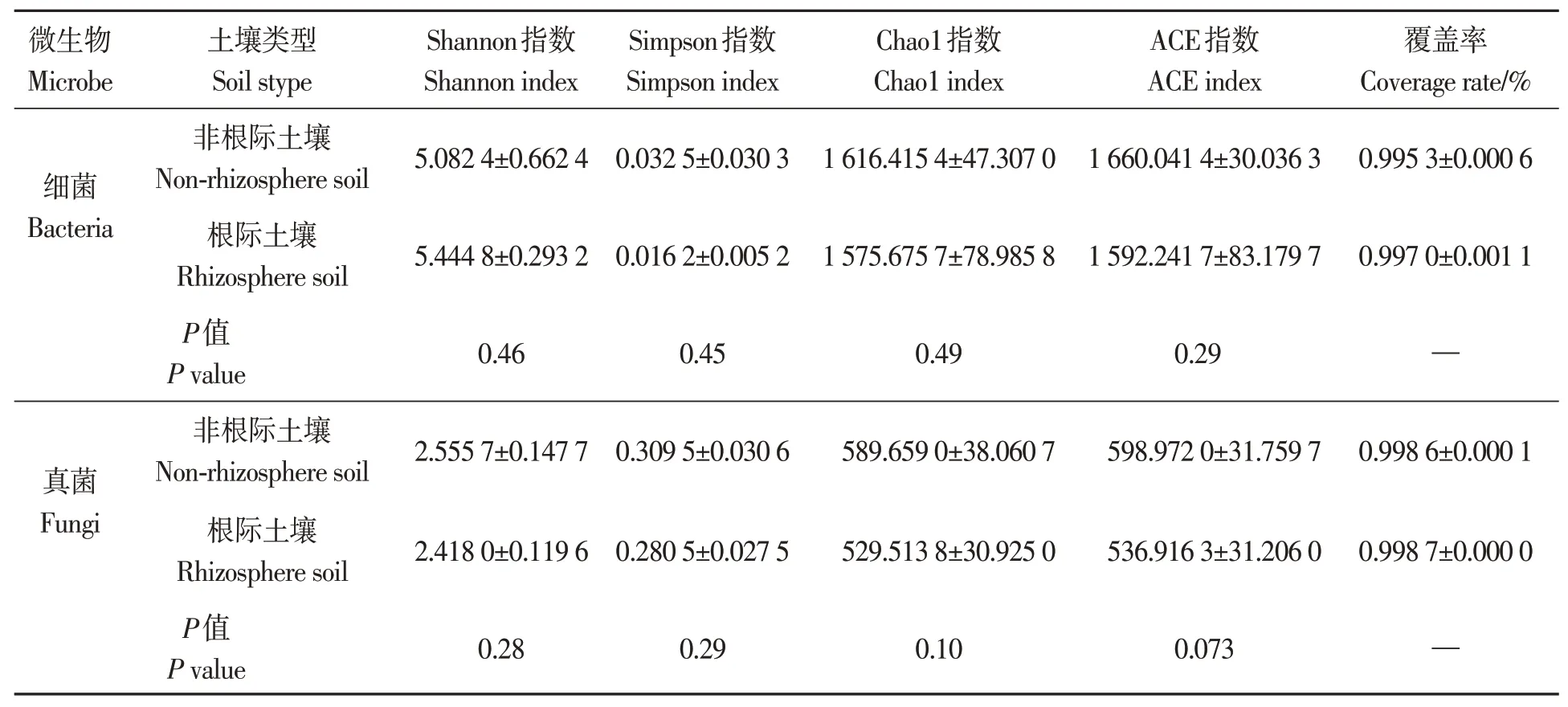
表2 Cd胁迫下地肤根际土壤与非根际土壤中细菌和真菌群落的Alpha多样性Table 2 Alpha index of the bacterial and fungal communities in Schrad.rhizosphere and non-rhizosphere soil of Kochia scopariaunder Cd stress
2.3.2OTUs丰度 从图2可知,Cd胁迫下根际与非根际土壤细菌共有OTUs 为1 727 个,其中根际土壤特有OTUs 为829 个,非根际土壤特有OTUs为253 个,分别占总OUT 数量的32%和12%。由此可见,Cd 胁迫下根际土壤细菌特有的OTUs 数目显著高于非根际土壤,这说明根际土壤的细菌种类明显较多。Cd 胁迫下,地肤根际和非根际土壤真菌共有OTUs 为593 个,其中非根际土壤特有OTUs 为215 个,根际土样特有OTUs 为148 个,即非根际土壤真菌特有的OTUs 数量高于根际土壤。综上,Cd 胁迫下地肤根际和非根际土壤细菌和真菌的共有OTUs 数量明显多于特有OTUs 数量,这说明Cd胁迫下地肤根际与非根际土壤细菌和真菌的多样性相似度均较高。
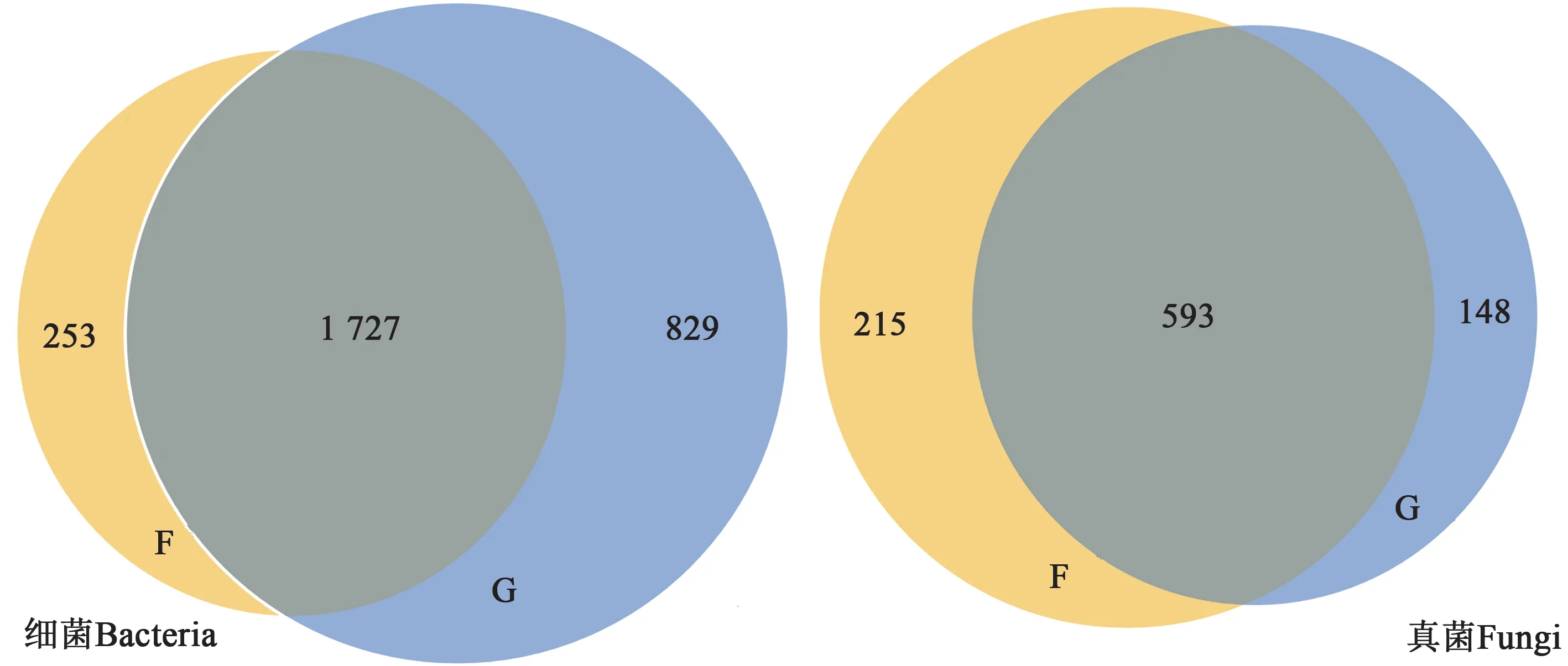
图2 Cd胁迫下地肤根际和非根际土壤中细菌和真菌的OTUs分布Fig. 2 OTUs of bacteria and fungal in rhizosphere and non-rhizosphere soil of Kochia scoparia under Cd stress
2.4 镉胁迫下地肤土壤微生物群落结构
2.4.1地肤根际和非根际土壤微生物的群落组成 由图3 可知,在细菌门水平上,地肤根际和非根际土壤的主要优势菌门均为绿弯菌门(Chloroflexi)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)及其他未知菌,分别占细菌总量的83.22%和70.01%。酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)、candidate_division_WPS-1、Candidatus_Saccharibacteria 为根际土壤特有细菌门。变形菌门、绿弯菌门在根际和非根际土壤中的相对丰度分别为42.61%、52.41%。在真菌门水平,地肤根际和非根际土壤的主要优势菌门均为子 囊 菌 门(Ascomycota) 、担 子 菌 门(Basidiomycota)、壶菌门(Chytridiomycota)、被孢霉门(Mortierellomycota),分别占真菌总量的97.91%和98.55%,其中子囊菌门(Ascomycota)的相对丰度最高,分别为88.78%和83.88%。担子菌门在根际土壤中的相对丰度高于非根际土壤6.61%。整体来说,Cd 胁迫下地肤根际土壤中的优势微生物种群的相对丰度大于非根际土壤。
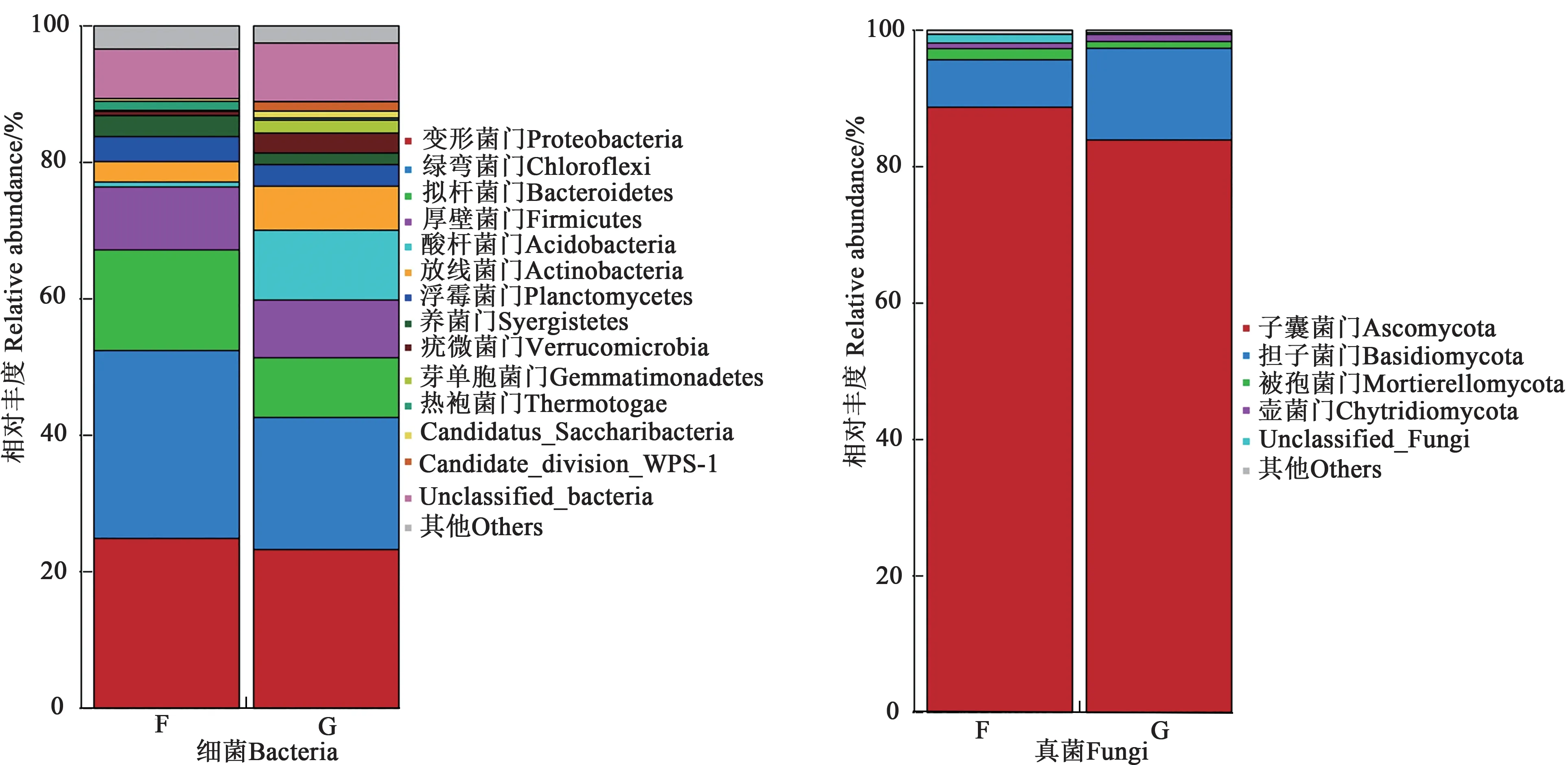
图3 地肤根际与非根际土壤在门水平上的微生物群落组成Fig. 3 Composition of soil microbial communities in rhizosphere and non-rhizosphere of Kochia scoparia at phylum level
由图4可知,Cd胁迫下,地肤非根际土壤细菌的主要优势菌属为unclassified_Anaerolineaceae、氢噬胞菌属(Hydrogenophaga)、unclassified_Bacteroidales、未分类菌属、unclassified_Planctomycetaceae;根际土壤的主要优势菌属为unclassified_Anaerolineaceae、未分类菌属、unclassified_Bacteroidetes、unclassified_Sphingomonadaceae。其中,unclassified_Anaerolineaceae在非根际和根际土壤中的相对丰度均较高,分别为23.28%和17.32%;共有的4 个优势菌属分别占非根际和根际土壤细菌总量的40.84% 和33.08%;unclassified_Sphingomonadaceae为根际土壤特有菌属。地肤非根际土壤真菌的主要优势菌属为缘刺盘菌属(Cheilymenia)、镰刀菌属(Fusarium)、念珠菌属(Candida)、unclassified_Pyronemataceae、unclassified_Sebacinaceae;根际土壤真菌主要优势菌属为缘刺盘菌属、镰刀菌属、斜盖伞属(Clitopilus)、念珠菌属、拟盘多毛孢属(Neopestalotiopsis)。其中,缘刺盘菌属在非根际和根际土壤中的相对丰度均较高,分别为54.90%和50.39%。由此说明,Cd胁迫下地肤根际和非根际土壤细菌和真菌种群和丰度在属水平上存在差距。
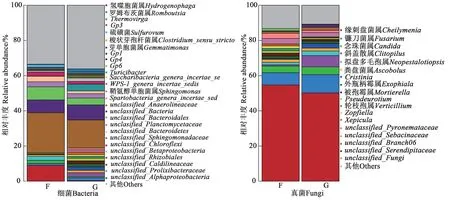
图4 地肤根际与非根际土壤在属水平上的微生物群落组成Fig. 4 Composition of soil microbial communities in rhizosphere and non-rhizosphere of Kochia scoparia at genus level
对根际和非根际土壤间进行比较,结果(图5)表明,在细菌群落中,乳酸杆菌属(Lactobacillus)和芽孢杆菌属(Bacillus)在根际土壤中的相对丰度显著高于非根际土壤;在真菌群落中,unclassified_Sordariomycetes、拟盘多毛孢属、unclassified Botryosphaeriaceae、厚垣轮枝孢菌属(Metacordyceps)在根际土壤中的相对丰度显著高于非根际土壤;柄孢壳菌属(Podospora)、Plectosphaerella、Gibellulopsis、 弯 孢 霉 属(Curvularia) 、Gongronella、Myxocephala、维希尼克氏酵母菌属(Vishniacozyma)、Pseudeurotium在非根际土壤中的相对丰度显著高于根际土壤。
由聚类分析(图6)可知,非根际土壤细菌群落中的优势菌属主要集中于unclassified_Anaerolineaceae、未分类菌属、unclassified_Bacteroidales、氢噬胞菌属(Hydrogenophaga)、硫磺属(Sulfurovum)等11个属;根际土壤细菌群落中优势菌属主要集中于芽单胞菌属(Gemmatimonas)、Gp1、Gp3、unclassified_Sphingomonadaceae、unclassified_Betaproteobacteria等16 个属。其中鞘氨醇单胞菌属(Sphingomonas)、Gp3、WPS-1_genera_incertae_sedis等在根际土壤中的相对丰度显著高于非根际土壤,说明非根际土壤与根际土壤细菌群落组成差异较大。
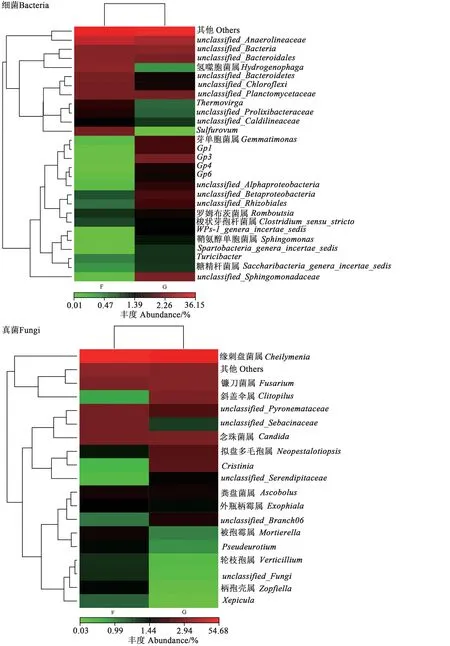
图6 地肤根际与非根际土壤微生物群落聚类热图Fig. 6 Cluster heat map of microbial communities of rhizosphere and non-rhizosphere soil of Kochia scoparia
非根际土壤真菌群落中的优势菌属主要集中于缘刺盘菌属、镰刀菌属、念珠菌属、unclassified_Pyronemataceae、unclassified_Sebacinaceae等6 个属;根际土壤真菌群落中的优势菌属主要集中于缘刺盘菌属、镰刀菌属、斜盖伞属、unclassified_Pyronemataceae、念珠菌属、拟盘多毛孢属、Cristinia等8个属(图6)。由此说明,非根际与根际土壤的真菌群落组成存在较大差异。
2.4.2PCA分析 PCA分析可对原有的复杂数据进行降维,揭示隐藏在复杂数据背后的结构[30]。通过分析不同样本的微生物群落组成可以反映样本间的差异性及相似性,如图7 所示。对于细菌群落结果,主成分1 和主成分2 的贡献率分别为62.51%和23.96%,即分别解释了细菌群落结构62.51%和23.96%的变异;地肤根际和非根际土壤的细菌群落在组内分布均较为分散,组间差异性较大,即根际和非根际土壤细菌群落的相似性较低。对于真菌群落组成,主成分1 和主成分的贡献率分别为41.81%和23.55%;地肤非根际土壤不同重复间距离较近,群落组成相似,而根际土壤不同重复间较为分散,说明群落组成差异较大。上述结果表明,地肤根际和非根际土壤微生物的群落结构有较大差异。
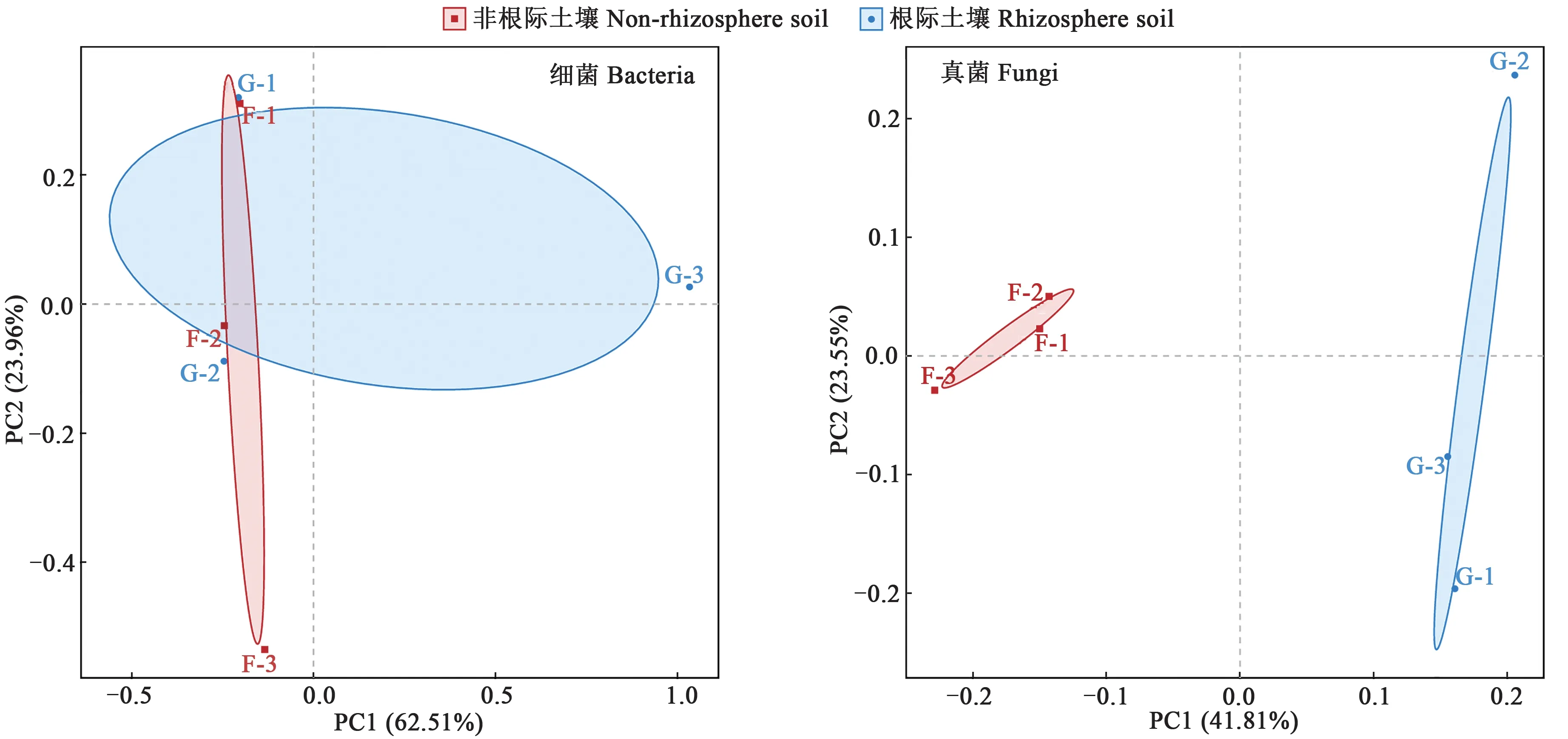
图7 地肤根际土壤与非根际土壤微生物群落结构主成分分析Fig. 7 Principal component analysis of microbial community structure in rhizosphere soil and non-rhizosphere soil of Kochia scoparia
3 讨论
根际是植物-土壤-微生物与其环境条件相互作用最为活跃的场所。根际微生物可通过促进矿物矿化、催化土壤生物化学过程等方式提高土壤中植物可利用形态营养元素的含量及植物对逆境的适应性[31]。植物根际土壤存在大量具有植物促生特性的菌群,对植物的生长、耐受逆境胁迫等方面起重要作用[32]。因此,研究植物根际土壤微生物多样性的变化有利于揭示植物的生长发育规律,对植物尤其是用作重金属污染土壤修复的植物十分有意义。目前,利用高通量测序技术研究植物根际土壤微生物多样性已有较多报道。Liu等[33]研究了三叶植物修复过程中根际土壤微生物的群落结构和组成,发现在修复后,其Shannon 指数上升,Simpson 指数下降,表明种植三叶植物提高了土壤微生物群落的丰富度和均匀性,且修复后的微生物—植株系统对重金属的抗性得到增强。金裕华等[34]研究了在重金属污染环境下木本植物根际微生物群落多样性,发现其修复区土壤细菌、放线菌及总菌群数量均显著高于对照区土壤,而对照区土壤的真菌数量显著高于木本植物修复区土壤;且木本植物修复区土壤微生物群落种类多、分布均匀,利用木本植物修复土壤可提高土壤微生物群落功能多样性。卞方圆等[35]研究了重金属复合污染下毛竹纯林、毛竹与伴矿景天间作林2 种不同种植模式对土壤微生物群落的影响,发现毛竹纯林土壤微生物的Shannon指数和Chao指数最高,表明种植修复植物有利于增加土壤细菌群落多样性。本研究通过对地肤根际和非根际土壤细菌16S rRNA V3~V4 序列和真菌 ITS1~ITS2 区进行测序,共获得4 536 个细菌OTUs、1 549 个真菌OTUs。其中,根际土壤细菌和真菌检测到2 556和741 个OTUs,非根际土壤细菌检测到1 980 和808 个OTUs;根际细菌和真菌特有的OTUs 占比分别为32.43%和19.97%,非根际细菌和真菌特有OTU 占比分别为12.78%和26.61%。由此表明,根际土壤细菌拥有较多特有的OTUs,非根际土壤真菌拥有较多独有的OTUs;且地肤根际土壤的微生物多样性高于非根际土壤,这与吴秋芳等[36]研究结果一致。
本研究中,地肤根际和非根际土壤细菌隶属于35门、83纲、131目、249科、473属。在门水平上,根际与非根际土壤细菌共有的菌门主要是绿弯菌门、变形菌门、拟杆菌门、厚壁菌门、浮霉菌门、放线菌门、养菌门、疣微菌门和降氨酸菌门。Kaplan 等[37]研究发现,上述这些细菌也存在于重金属污染的农田土壤中。其中绿弯菌门、变形菌门、拟杆菌门和厚壁菌门在地肤根际和非根际土壤中均占主导地位,表明它们是根与微生物相互作用正反馈的主要促进因素,这与Yang 等[38]的研究结果一致。这一现象可能与细菌的生命策略(富营养、贫营养或兼性贫营养)有关,因为富营养细菌比贫营养细菌在碳资源方面更具竞争力[39-40]。变形菌门是所有菌群中最为丰富的菌门,对土壤中有机质、氮、磷、硫的循环有显著促进作用[41]。变形菌门是重金属高污染环境中的主要细菌门,包括矿山沉积物、地表水和被重金属污染的土壤[42]。绿弯菌门是土壤生态循环的重要组成部分,它能通过光合作用将光能转化为化学能来适应贫瘠的环境,且在重金属污染土壤中占有优势地位[43]。放线菌门中包含许多可产抗生素、酶和有机酸等的细菌,其丰度的高低可作为土壤健康状况的评价指标[41]。本研究发现,地肤根际土壤中放线菌门的相对丰度是非根际土壤的2倍左右,这表明放线菌在重金属污染土壤修复中起重要作用。放线菌对植物生长及营养获取、重金属解毒、减轻生物和非生物胁迫起重要作用[44]。由于对重金属具有抗性,放线菌总是存在于重金属污染的土壤中,此菌群可以取代高敏感性真菌作为土壤中的主要分解者[45]。本研究表明,酸杆菌门、芽单胞菌门、candidate_division_WPS-1、Candidatus_Saccharibacteria 为根际土壤特有细菌门。Barns 等[46]研究证明,酸杆菌门、浮霉菌门、candidate_division_WPS-1 是典型的慢生长型贫营养细菌,酸杆菌门不仅具有抵抗渗透胁迫的能力,还具有抵抗重金属污染和其他极端环境的能力,且可以在土壤湿度起伏大的环境中生存。据报道,芽单胞菌属和鞘脂单胞菌属是促进植物生长的有益细菌[47-48];Gp1、Gp3和Gp6可以帮助植物吸收养分,提高植物生产力[49]。本研究表明,芽单胞菌属、Gp1、Gp3、unclassified_Sphingomonadaceae为根际土壤的优势菌属,这表明地肤根际土壤具有促进植物生长和重金属解毒的优势微生物种群,该结果为研究地肤在Cd 胁迫下健康生长的机理奠定了理论基础。
地肤根际和非根际土壤真菌隶属于13 门、47纲、116目、247科、431属。在门水平上,根际和非根际土壤中的真菌优势菌群主要是子囊菌门、担子菌门、被孢霉门和壶菌门。其中子囊菌门在非根际土壤和根际土壤中均占绝对优势,相对丰度分别为88.78%和83.88%。子囊菌是世界上最丰富和分布最广泛的土壤真菌[50],它的繁殖能力极强,能产生大量的无性孢子,且生长迅猛,使其在数量上占显著优势,这可能是子囊菌在很多植物根际中占比较大的原因[51]。子囊菌是生态系统碳氮循环的重要驱动因素,其在土壤稳定性、植物生物量分解中发挥作用,还可与植物形成共生关系[52]。Lin 等[53]研究发现,子囊菌门、担子菌门、壶菌门与重金属污染的相关性较强,可通过增强对环境压力的防御生存,即使在各种重金属环境中也是如此[54],担子菌门具有转移重金属的能力[53]。本研究发现,地肤根际土壤真菌中担子菌门的相对丰度较非根际土壤提高6.61%;而根际土壤的总Cd 含量(2.06 mg·kg-1)低于非根际土壤(2.14 mg·kg-1),由此表明,担子菌在重金属水平较低的环境中数量显著增加。这表明担子菌更适合在重金属污染水平相对较低的环境中发挥作用,与Tian 等[55]的研究结果一致。被孢霉门真菌是土壤中较为常见的真菌,具有促进植物根系吸收养分、抑制病原菌等功能[56]。在属水平上,缘刺盘菌属和镰刀菌属为地肤根际和非根际土壤真菌的2 大优势菌属,累计相对丰度均在60%以上。研究发现,重金属污染区域中镰刀菌是继青霉菌的第二大高丰度真菌,且分离出的镰刀菌属真菌对培养基中金属离子水平均十分敏感,这表明镰刀菌属真菌对重金属有一定耐受性[57],但对高水平重金属污染的抵抗力较差[58]。此外,在地肤根际与非根际土壤中,均有较大比例的未知菌群,这些未知菌群的生态学功能有待进一步研究。
本研究发现,在地肤根际土壤中促进植物生长和重金属解毒的微生物菌群占优势,且根际土壤微生物的多样性高于非根际土壤,包括放线菌门、疣微菌门、降氨酸菌门、担子菌门、壶菌门以及unclassified_Betaproteobacteria、镰刀菌属、斜盖伞属、念珠菌属、拟盘多毛孢属、unclassified_Branch06等,它们在根际土壤中的相对丰度高于非根际土壤。由此表明,种植地肤可以增加土壤微生物丰富度,进而增强土壤微生物群落结构的稳定性,减轻Cd污染土壤给农业生产带来的危害。但是,由于本研究未对空白样品(未种植地肤的Cd 污染土壤)进行分析,仅比较了地肤根际和非根际土壤微生物群落的变化情况,无法比较种植地肤对土壤微生物群落结构和多样性的影响,虽得出了地肤根际土壤较非根际土壤中促进植物生长和重金属解毒的微生物菌群更占优势,但究竟是哪种优势菌群对地肤在Cd 污染土壤中的健康生长起决定作用目前尚无法确定,有待进一步研究。
