马铃薯StCYP83基因家族鉴定及其抗晚疫病的功能分析
2023-09-27孔乐辉宗德乾史青尧殷盼盼巫文玉田鹏单卫星强晓玉
孔乐辉,宗德乾,史青尧,殷盼盼,巫文玉,田鹏,单卫星,强晓玉
马铃薯基因家族鉴定及其抗晚疫病的功能分析
孔乐辉,宗德乾,史青尧,殷盼盼,巫文玉,田鹏,单卫星,强晓玉
西北农林科技大学农学院/旱区逆境生物学国家重点实验室,陕西杨凌 712100
【目的】通过鉴定马铃薯基因家族成员,分析其响应致病疫霉()侵染的表达模式,挖掘具有抗晚疫病功能的并解析其免疫机制,为马铃薯抗晚疫病分子育种提供新型抗性基因资源。【方法】利用双向BLAST法鉴定基因家族成员,通过ExPASy Prot Param、Cell-Ploc 2.0、ESPript等软件分析StCYP83蛋白序列基本信息、亚细胞定位情况、保守基序;利用qRT-PCR技术分析响应致病疫霉侵染的表达模式;利用农杆菌介导的本氏烟瞬时表达体系和马铃薯过表达(OE)稳定转化植株分析候选基因影响寄主植物抗致病疫霉的免疫功能及作用机理。【结果】在马铃薯基因组中共鉴定到10个家族基因,分别命名为,编码蛋白长度介于387—503 aa,分子量介于44—57 kDa,亚细胞定位预测结果显示StCYP83蛋白均定位于内质网膜。qRT-PCR结果表明,家族成员在不同程度上均可响应致病疫霉侵染而诱导表达,暗示家族基因可能在马铃薯与致病疫霉互作中发挥作用。基于此,从中选取明显响应致病疫霉侵染而诱导上调表达、且与拟南芥同源性最高的用于后续的免疫功能解析。本氏烟瞬时过表达的接菌测试结果表明,具有抗致病疫霉的生物学功能;同时,过表达可显著促进PTI标记基因(、)、SA信号通路标记基因(和)和JA信号通路标记基因(和)的上调表达,并提高flg22诱发的活性氧迸发。此外,编码蛋白保守基序中的半胱氨酸位点为其抗性功能所必需。过表达(OE)株系对致病疫霉的抗性有所增强,且呈现出增强的PTI免疫反应,包括flg22诱发的活性氧水平升高以及PTI标记基因(、和)的显著诱导上调表达。此外,马铃薯SA信号通路相关基因(、、和)和JA信号通路相关基因(、和)也被诱导上调表达。【结论】共鉴定到10个家族成员,家族成员在不同程度上均可响应致病疫霉的侵染而诱导表达。通过激活PTI、SA和JA信号通路调控植物对致病疫霉的抗性;而StCYP83B1血红素结合域中的半胱氨酸位点为其抗性功能所必需。
马铃薯;基因家族;致病疫霉;植物抗病性;晚疫病
0 引言
1 材料与方法
试验于2021—2023年在西北农林科技大学旱区作物逆境生物学国家重点实验室完成。
1.1 试验材料
马铃薯品种大西洋、本氏烟、大肠杆菌菌株Turbo、根癌农杆菌菌株GV3101、致病疫霉菌株88069、融合GFP标签的35S::pART27质粒载体,均由西北农林科技大学单卫星实验室保存。
1.2 StCYP83基因家族的鉴定
(1)从EnsemblPlants数据库(http://plants.ensembl. org/info/data/ftp/index.html)下载马铃薯(SolTub_3.0)和拟南芥(TAIR10)全基因组相关文件;(2)以马铃薯全基因组蛋白序列构建本地数据库,使用AtCYP83家族蛋白作为种子序列比对出候选StCYP83蛋白(参数为E-value≤1e-10,并用query coverage≥70%过滤);(3)以拟南芥全基因组蛋白序列构建本地数据库,用候选StCYP83蛋白序列blastp拟南芥数据库,筛选最佳匹配为家族的基因;(4)使用PFAM数据库(http://pfam-legacy.xfam.org/ search#tabview=tab1)和NCBI中CD-search工具(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)对候选的蛋白序列进行保守结构域分析,确保上述候选蛋白具有CYP450结构域,最终确定马铃薯家族成员;(5)利用ExPASy Prot Param(http:// web.expasy.org/protparam/)分析StCYP83家族成员的氨基酸长度、分子量和等电点等理化性质,使用Cell-Ploc 2.0软件(http://www.csbio.sjtu.edu. cn/bioinf/Cell-PLoc-2/)预测StCYP83蛋白的亚细胞定位。
1.3 StCYP83基因家族结构和保守结构域分析
利用MEGA-X的CLUSTALW算法进行StCYP83家族蛋白多序列比对,用TBtools的TrimAL工具修剪后采用邻接法(neighbor-joining method)构建进化树,获得Newick Tree文件;利用基因组的基因结构注释文件(GFF3/GTF文件)获取的注释信息(https://ftp.ebi.ac.uk/ensemblgenomes/pub/release-55/ plants/gtf/solanum_tuberosum/),分析家族成员基因结构,使用TBtools软件的Gene Structure View(Advanced)功能对家族基因进化树和基因结构进行可视化分析。最后对StCYP83蛋白多序列比对结果用ESPript在线工具(https://espript. ibcp.fr/ESPript/cgi-bin/ESPript.cgi)进行保守基序分析。
1.4 致病疫霉接种处理
用灭菌牙签挑取致病疫霉菌丝块于黑麦培养基上,封口并于16 ℃暗培养10—15 d后,镜检孢子囊产生情况,选择孢子囊多的进行后续试验。灭菌ddH2O于4 ℃冰箱预冷,每皿加入5 mL灭菌ddH2O,用涂布器刮下菌丝层,使孢子囊从菌丝上脱落以制备无性孢子囊悬浮液。将制备好的悬浮液于4 ℃放置2 h,刺激孢子囊释放游动孢子以制备游动孢子悬液。显微镜下用无菌水将游动孢子浓度调至2.5×104个/mL左右,置于冰上备用。
1.5 StCYP83响应致病疫霉侵染的表达模式分析
将培育一个月的马铃薯组培苗经蛭石炼苗后,移入育苗基质中进行培养,待其成熟后,剪取成熟植株中上部叶片进行致病疫霉游动孢子接种处理,于接种后0、6、12、24、36、48、72 h取样,并用液氮速冻后于-80 ℃保存。使用Trizol(invitrogen)法提取叶片RNA,使用TaKara公司反转录试剂盒(PrimeScriptTMRT reagent Kit,RR047A)合成cDNA后进行qRT-PCR反应:首先将反转录合成的cDNA稀释10倍,吸取4 μL于96孔板中,依次加入7.5 μL 2×UltraSYBR Mixture、0.7 μL Forward Primer(10 μmol·L-1)、0.7 μL Reverse Primer(10 μmol·L-1)、2.1 μL ddH2O。qRT-PCR反应程序:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火延伸1 min,40—45次循环,熔解曲线程序:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s,利用2-ΔΔCT计算基因相对表达量[29]。
1.6 农杆菌介导的本氏烟叶片瞬时表达
取200 μL过表达载体菌液,加入含有Rif、Gen、Spec的LB液体培养基,置于28 ℃摇床,转速为200 r/min,至菌液OD600>1.0。室温下离心5 min(转速为3 500×)收集菌体,并重悬于含有200 μmol·L-1乙酰丁香酮的MES,稀释至OD600=0.5备用。利用1 ml一次性注射器将菌液注射于烟草叶片,并做以标记;吸去叶片表面多余的重悬菌液,并保湿避光;次日,移至正常光照条件,通过荧光显微镜检测融合有荧光标签的目标蛋白表达量,并选择合适的烟草叶片进行接菌测试。
实际试验时,采用均值滤波对边缘检测后的结果进行滤波处理。通过多次试验分析,选择3x9的内核来处理效果最好。二值化处理之后,边缘线条会有加粗的效果,利于腐蚀膨胀操作,如图3所示。
1.7 活性氧迸发检测
选择适龄的马铃薯叶片以及本氏烟瞬时表达目的基因2 d后的叶片,用打孔器在叶片两边取叶圆盘(约10—12个叶圆盘),置于ddH2O中浸泡过夜。次日,将浸泡好的叶圆盘转移至含有100 μL luminol和100 μL辣根过氧化物酶的96孔白色酶标板内,打开酶标仪,设置以下程序:化学发光,每分钟循环一次,30—50个循环,最后在每个酶标孔中加入终浓度为1 μmol·L-1的flg22,并立即检测,最后导出数据即可。
2 结果
2.1 StCYP83基因家族成员的鉴定及理化性质分析
通过双向比对,共获得11条候选StCYP83蛋白序列,剔除不包含血红素结合域(FxxGxxxCxG/A)的蛋白,最终得到10个马铃薯家族成员(表1),所有成员均含有保守的血红素结合域(PF00067)。通过ExPASy工具,对所编码的蛋白进行氨基酸长度、分子量及等电点分析,发现基因家族成员氨基酸长度在387—503 aa,分子量介于44—57 kDa,理论等电点在5.45—9.10,亚细胞定位预测结果显示StCYP83蛋白均定位于内质网膜。

表1 StCYP83基因家族的理化特性
2.2 StCYP83基因家族结构及功能结构域分析
通过对家族成员基因结构分析(图1),发现家族聚类在一起的基因其内含子与外显子的数量相同,例如和含有3个外显子、2个内含子,而其余基因均由2个外显子和1个内含子组成,结构较为保守。

图1 StCYP83基因家族结构分析
为了分析家族基因编码的蛋白所具有的保守基序,对该家族蛋白序列进行了多序列比对,结果表明StCYP83家族蛋白序列均含有CYP450蛋白的典型基序:K螺旋中的ExxR、PDR结构域中的PERF和血红素结合域中的FxxGxxxCxG/A(图2)。其中,血红素结合域是鉴定CYP450蛋白的主要特征结构,该结构域中的半胱氨酸残基(Cys)绝对保守,两个甘氨酸(Gly)和一个苯丙氨酸(Phe)通常也保守,但不绝对保守[30]。如StCYP83B9血红素结合域中的保守基序为FxxSxxxCxG/A,其第1个保守的甘氨酸(Gly)改变为丝氨酸(Ser)。
2.3 StCYP83响应致病疫霉侵染的表达模式分析
qRT-PCR分析结果表明,与0 hpi对比,和在接种致病疫霉的每个时间点均显著上调表达,其中在6 hpi的表达量上调至9.47倍,在72 hpi的表达量上调至11.63倍;在36 hpi的表达量上调至3.09倍;仅在12 hpi显著上调表达;仅在72 hpi显著上调表达;在24 hpi的表达量上调至6.32倍;在6 hpi的表达量上调至4.11倍;在36 hpi的表达量上调至2.95倍;和可能因为本底表达水平低,未检测到表达(图3)。基于上述分析结果,选取明显响应致病疫霉侵染而诱导上调表达、且与同源性最高的用于后续的免疫功能解析。
2.4 StCYP83B1能够影响植物对致病疫霉的抗性
为了探究影响植物抗致病疫霉的免疫功能,通过农杆菌介导的本氏烟瞬时表达体系在烟草叶片上分别过表达和对照,于2 d后利用免疫印迹(Western blot)确认StCYP83B1蛋白的表达(图4-A),并对烟草叶片离体接种致病疫霉游动孢子。结果显示,接菌后5 d,与对照相比,过表达的叶片表现出更小的致病疫霉侵染区域(图4-B),通过统计分析,发现过表达的叶片病斑面积约为1.7 cm2,明显小于对照叶片(2.1 cm2)的病斑面积(图4-C)。进一步提取接菌部位相同面积的烟草叶片基因组DNA,并利用qRT-PCR量化分析致病疫霉定殖于叶片组织中的生物量,结果显示,过表达叶片中的致病疫霉生物量显著低于对照组(图4-D)。该结果揭示了在植物抗致病疫霉中具有重要作用。

红色覆盖区表示严格一致的氨基酸序列The red cover regions represented sequences maintaining consistent amino acids
2.5 StCYP83B1过表达可增强植物PTI免疫
为了进一步解析参与调控植物PTI的免疫功能,首先分析了是否影响flg22激发的活性氧迸发。于本氏烟叶片中分别瞬时表达和2 d后,分析比较植物活性氧水平变化。结果显示,相比于对照组,过表达的叶片表现出更为强烈的活性氧迸发水平(图5-A)。
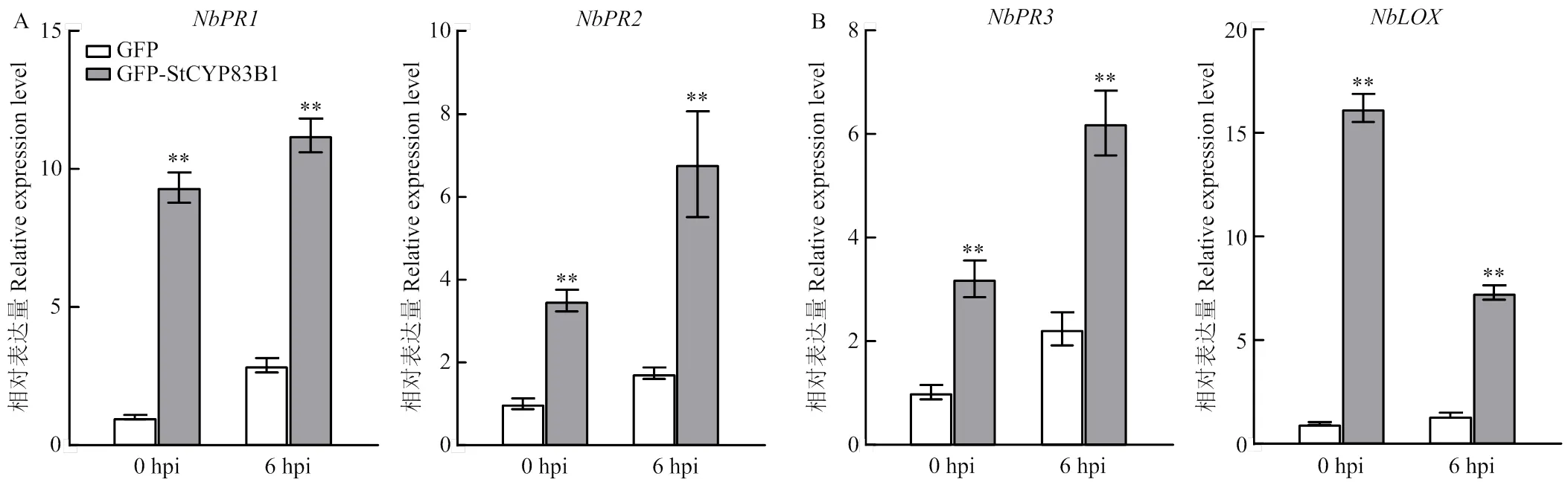
同时,接种致病疫霉于瞬时表达和的烟草叶片,利用qRT-PCR分析比较PTI标记基因(和)的表达变化。结果表明,在0和6 hpi,过表达均可促使和的表达量显著高于对照(图5-B)。以上结果揭示了在植物响应致病疫霉侵染初期可增强植物PTI免疫反应。

以马铃薯管家基因StEF1α为内参,将0 hpi的StCYP83表达水平设为1 Housekeeping gene StEF1α of potato as internal reference. The expression level of StCYP83 at 0 hpi was set to 1
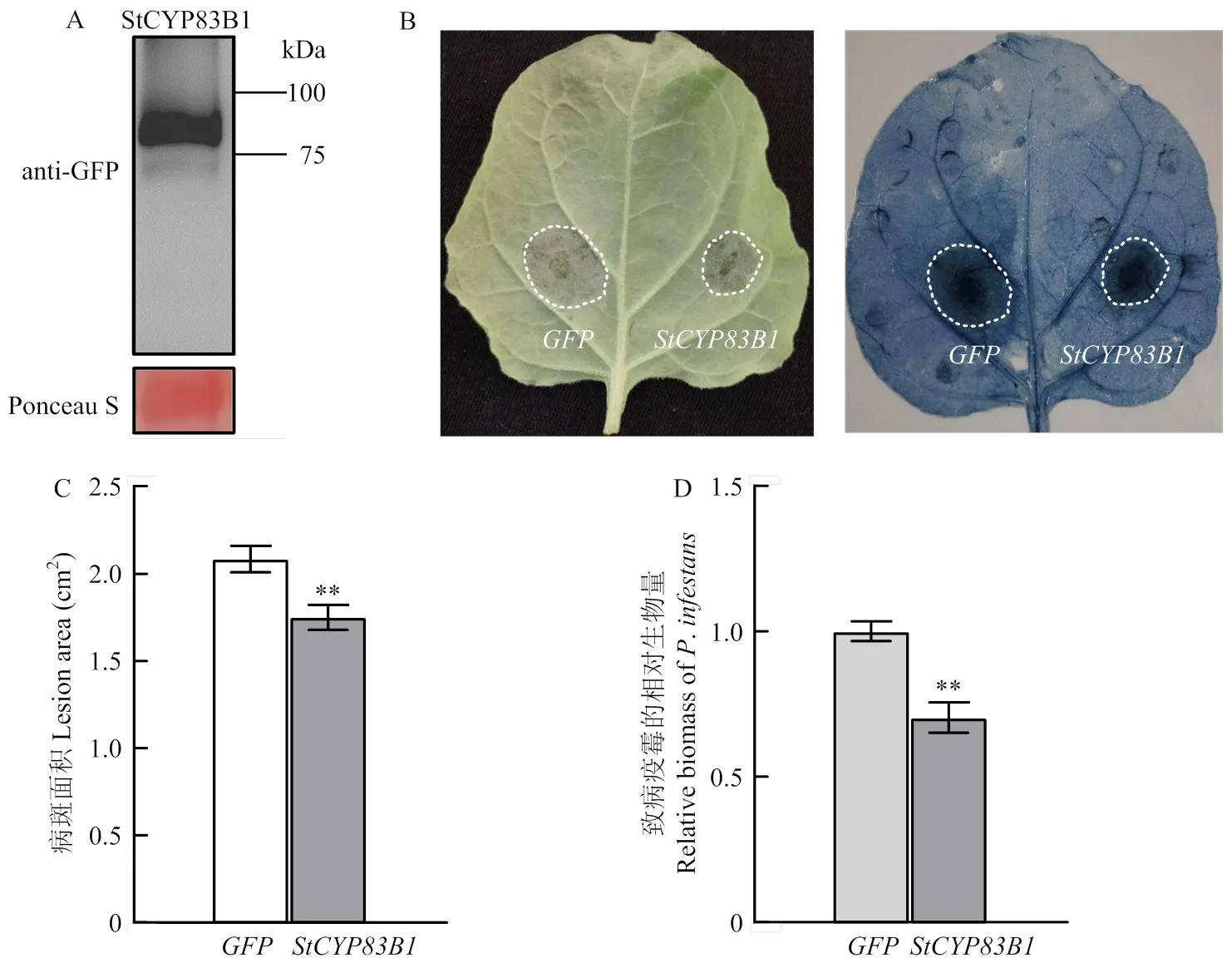
A:Western blot检测烟草叶片中StCYP83B1蛋白表达,蛋白质载量用丽春红染色表示The protein expression of StCYP83B1 in N. benthamiana leaves was examined by Western blot, and protein loading was indicated by Ponceau staining。B:农杆菌介导的本氏烟叶片瞬时转化:左侧注射GFP对照,右侧注射转有StCYP83B1的农杆菌,表达2 d后接种致病疫霉游动孢子,于5 dpi记录病斑,并进行台盼蓝染色A. tumefaciens-mediated transient transformation in N. benthamiana leaves. The left and right sides were expressed with GFP and StCYP83B1 genes, respectively. After two days, P. infestans zoospores were inoculated followed by photographing of disease symptom and trypan blue staining at 5 dpi。C:病斑面积统计。用于接菌测试的烟草叶片不少于10片(n=15)The lesion area was statistically analyzed. At least 10 N. benthamiana leaves were used for inoculation test (n=15)。D:侵染叶片中菌丝定殖量分析,以本氏烟管家基因NbF-box为内参,利用qRT-PCR检测致病疫霉管家基因PiUBC的表达,将过表达GFP叶片中的致病疫霉生物量设为1。3次独立试验均获得相似结果Quantification of P. infestans biomass in infected N. benthamiana leaves. The expression level of housekeeping genePiUBC of P. infestans was detected by qRT-PCR with housekeeping gene NbF-box of N. benthamiana as internal reference. The P. infestans biomass in leaves overexpressing GFP was set to 1. Similar results were obtained from three individual experiments

A:将过表达GFP和StCYP83B1的本氏烟叶片用1 μmol·L-1 flg22处理后,利用鲁米诺化学发光法检测活性氧迸发水平。结果表示为6个生物学重复的平均值±标准误ROS burst was measured using a luminol-based chemiluminescence assay in the overexpression of GFP and StCYP83B1 leaves treated with 1 μmol·L-1 flg22. Results were the mean±SE of 6 biological replicates。B:在致病疫霉侵染不同时期,NbWRKY7和NbWRKY8在过表达GFP和StCYP83B1的本氏烟叶片的表达量,将过表达GFP叶片中0 hpi的PTI标记基因的表达量设为1 The expression levels of NbWRKY7 and NbWRKY8 in leaves of N. benthamiana overexpressed with GFP and StCYP83B1, respectively, during P. infestation infection. The expression level of PTI marker genes at 0 hpi in GFP-expressed leaves was set to 1
2.6 StCYP83B1过表达可激活SA和JA信号通路
为进一步探究影响植物抗疫霉菌的作用机理,以为对照,于本氏烟叶片瞬时表达2 d后,进行致病疫霉接种,分别于0和6 hpi采样用以分析植物防御激素水杨酸(SA)和茉莉酸(JA)信号通路相关基因的表达变化。qRT-PCR结果表明,在0和6 hpi,与对照相比,过表达的本氏烟叶片中SA信号通路标记基因()和JA信号通路标记基因()的表达量均显著升高(图6-A、6-B)。该结果揭示了在植物响应致病疫霉侵染初期,可能通过快速激活SA和JA信号通路而影响植物免疫。
对瞬时表达2 d后的烟草叶片接种致病疫霉游动孢子,并在接菌0和6 hpi提取叶片总RNA,以本氏烟管家基因NbEF1α作为内参,将过表达GFP叶片中0 hpi的SA和JA标记基因的表达水平设为1
2.7 StCYP83B1保守基序中的半胱氨酸位点为其抗性功能所必需
为了探究CYP450酶催化活性是否影响的免疫功能,将StCYP83B1血红素结合域—— FxxGxxxCxG中的半胱氨酸(Cys)位点突变成丝氨酸(Ser),通过分段融合PCR构建p35S::P- StCYP83B1植物表达载体,并借助农杆菌介导的瞬时表达体系分别将p35S::与p35S::GFP-StCYP83B1表达载体注射于烟草叶片。免疫印迹检测确认了半胱氨酸(Cys)位点的突变不会影响蛋白正常表达(图7-A)。接种致病疫霉于瞬时表达后的烟草叶片,结果显示,相比于过表达,StCYP83B1过表达显著增加了烟草对致病疫霉的感病性,呈现出更大的病斑面积(图7-B、7-C)以及更多的病菌定殖生物量(图7-D)。该结果揭示了CYP450酶血红素结合域中的半胱氨酸位点对于发挥抗性功能必不可少。
2.8 StCYP83B1影响马铃薯抗晚疫病的功能分析
为明确影响马铃薯抗晚疫病的生物学功能,利用已构建的-OE转化植株(Line1、Line2)[31]进行接菌测试。于5周龄的大西洋和-OE转化株系(Line1、Line2)叶片背部接种致病疫霉游动孢子4 d后,对其病斑面积进行统计分析,发现-OE转化株系(Line1、Line2)叶片的病斑面积均显著小于对照株系(图8-A、8-B),且叶片中致病疫霉的定殖生物量也显著小于对照(图8-C)。该结果验证了过表达能够增强马铃薯对晚疫病的抗性。

A:Western blot检测烟草叶片中StCYP83B1(C438S)蛋白表达,蛋白质载量用丽春红染色表示The protein expression of StCYP83B1(C438S) in N. benthamiana leaves was examined by Western blot, and protein loading was indicated by Ponceau staining。B:农杆菌介导的本氏烟叶片瞬时转化,表达2 d后接种致病疫霉游动孢子,于5 dpi记录病斑,并进行台盼蓝染色The N. benthamiana leaves were transiently expressed with either StCYP83B1 or StCYP83B1(C438S) for 2 days prior to the inoculation with P. infestans zoospores, followed by photographing of disease symptom and trypan blue staining at 5 dpi。C:病斑面积统计。用于接菌测试的烟草叶片不少于10片(n=26)The lesion area was statistically analyzed. At least 10 N. benthamiana leaves were used for the pathogenicity assay (n=26)。D:侵染叶片中菌丝定殖量分析,以本氏烟管家基因NbF-box为内参,利用qRT-PCR检测致病疫霉管家基因PiUBC的表达,将过表达StCYP83B1(C438S)叶片中的致病疫霉生物量设为1。3次独立试验均获得相似结果Quantification of P. infestans biomass in infected N. benthamiana leaves. The expression level of housekeeping gene PiUBC of P. infestans was detected by qRT-PCR with housekeeping gene NbF-box of N. benthamiana as internal reference. The P. infestans biomass in leaves overexpressing StCYP83B1(C438S) was set to 1. Similar results were obtained from three individual experiments

A:接种致病疫霉4 d后马铃薯叶片病斑面积观察以及台盼蓝染色结果Lesion area of potato leaves at 4 dpi and the leaves were stained by trypan blue。B:病斑面积统计。用于接菌测试的马铃薯叶片不少于10片(n=10)The lesion area was statistically analyzed. At least 10 potato leaves were used for the pathogenicity assay (n=10)。C:侵染叶片中菌丝定殖量分析,以马铃薯管家基因StEF1α为内参,利用qRT-PCR检测致病疫霉管家基因PiUBC的表达,将大西洋中的致病疫霉生物量设为1 Quantification of P. infestans biomass in infected potato leaves. The expression level of housekeeping gene PiUBC of P. infestans was detected by qRT-PCR with housekeeping gene StEF1α of potato as internal reference. The P. infestans biomass in Atlantic was set to 1
2.9 StCYP83B1参与调控马铃薯PTI免疫反应
为了进一步验证参与调控马铃薯PTI的免疫功能,首先分析了是否影响flg22激发的活性氧迸发。结果显示,相比于对照植株大西洋,flg22触发的活性氧迸发在-OE株系(Line1、Line2)中更为强烈(图9-A)。
然后,利用qRT-PCR分析比较了PTI标记基因(、和)的表达变化。结果表明,、和在flg22处理后的对照材料(大西洋)中呈下调表达;与之相比,3个PTI标记基因在flg22处理后的-OE株系(Line1、Line2)中均呈显著诱导上调表达;在flg22处理2 h后,相比于大西洋,-OE株系(Line1、Line2)中的、、表达量均显著升高(图9-B)。以上结果表明,过表达可增强马铃薯的PTI免疫反应。
2.10 StCYP83B1激活SA和JA信号通路
为了进一步验证是否影响SA和JA信号通路,对-OE株系(Line1、Line2)和对照植株大西洋分别进行接菌处理。SA信号通路相关基因(、、和)的表达结果表明,尽管-OE株系(Line1、Line2)中、和的本底表达水平低于对照材料(大西洋),但在致病疫霉侵染后,-OE株系(Line1、Line2)中、、和的诱导上调表达幅度明显高于对照材料,其中和在24、36 hpi均显著高于对照,在24 hpi显著高于对照,在36 hpi显著高于对照(图10-A)。
JA信号通路相关基因(、和)的表达结果表明,尽管-OE株系(Line1、Line2)中的本底表达水平低于对照材料,但在24、36 hpi均显著高于对照,在24 hpi显著高于对照,在0、36 hpi显著高于对照(图10-B)。以上结果揭示了可能通过激活SA和JA信号通路而增强马铃薯对晚疫病的抗性。

A:将大西洋和StCYP83B1-OE株系的叶片用1 μmol·L-1 flg22处理后,利用鲁米诺化学发光法检测活性氧迸发水平。结果表示为6个生物学重复的平均值±标准误ROS burst was measured using a luminol-based chemiluminescence assay in the Atlantic and StCYP83B1-OE leaves treated with 1 μmol·L-1 flg22. Results were the mean±SE of 6 biological replicates。B:用40 µmol·L-1 flg22处理马铃薯叶片后提取总RNA,以马铃薯管家基因StEF1α为内参,利用qRT-PCR检测StCYP83B1-OE株系中StWRKY7、StWRKY8和StACRE31的表达量,将大西洋中0 h的PTI标记基因表达量设为1(n=3)Total RNA was extracted from 40 µmol·L-1 flg22-treated potato leaves. The expression levels of StWRKY7, StWRKY8 and StACRE31 of StCYP83B1-OE were detected by qRT-PCR with housekeeping gene StEF1α of potato as internal reference. The expression level of PTI marker genes at 0 h in Atlantic was set to 1 (n=3)
3 讨论
3.1 StCYP83基因家族可能在马铃薯与致病疫霉互作中发挥重要功能
本研究鉴定到的编码的蛋白质序列大小介于387—503 aa,分子量介于44—57 kDa,理论等电点在5.45—9.10,表明家族成员间的蛋白质大小、等电点等特征差异较大。亚细胞定位预测结果显示StCYP83蛋白均定位于内质网膜,这与WILLIAMS等[32]报道的大多数植物CYP450都与膜结合,通过其N端疏水螺旋锚定于内质网膜上的研究结果相一致。结构分析显示,家族进化树中聚类在一起的基因其内含子与外显子的数量相同(图1),符合PAQUETTE等[33]研究的家族成员间内含子保守情况与进化相关。保守结构域分析显示,每个StCYP83家族成员序列都有保守的ExxR、PERF和FxxGxxxCxG/A(图2),与已有研究相对应:所有生物CYP450分子之间都具有一定的序列保守性,即CYP450在不同物种间具有同源性,这种同源性表明它们都起源于共同的祖先[34]。家族成员在不同程度上均可响应致病疫侵染而诱导表达(图3),表明家族基因可能在马铃薯与致病疫霉的互作过程中发挥作用。在致病疫霉侵染每个时间点均显著上调表达(图3),且与同源性最高,因此,本研究选取用于后续免疫功能的分析。

以马铃薯的管家基因StEF1α为内参,将大西洋中0 hpi的SA和JA相关基因的表达水平设为1(n=3)Housekeeping gene StEF1α of potato as internal reference. The expression level of SA and JA related genes at 0 hpi in Atlantic was set to 1 (n=3)
编码蛋白含有保守的血红素结合域—— FxxGxxxCxG,其中的C(半胱氨酸)残基绝对保守,其与亚铁血红素中的铁元素形成硫醇盐离子键,在CYP450酶的催化活性中起重要作用,Hatae等[35]发现将保守的C(半胱氨酸)突变成S(丝氨酸)可以使其酶活丧失。本研究证明了编码蛋白保守基序中的半胱氨酸位点为其免疫功能所必需(图7),这意味着可以通过对该位点的基因修饰来增强酶活水平,进而提升的免疫功能,使其在抗病分子育种中发挥更大的作用。
3.2 StCYP83B1可能通过激活PTI免疫反应调控植物免疫
在烟草瞬时表达体系中,过表达可显著提升植物对致病疫霉的抗性和增强植物PTI免疫反应(图4、图5),表明可能是晚疫病正调控因子,因此将转入晚疫病易感品种大西洋中以验证其免疫功能[31]。对获得的OE转化马铃薯进行接菌测试,发现与对照相比,OE株系对致病疫霉的抗性有所增强(图8)。活性氧迸发是由分子模式识别受体FLS2识别细菌鞭毛短肽flg22而激活的植物PTI免疫反应的标志性事件之一。植物产生的高水平活性氧作为一种毒性因子可抑制病原菌的侵染,从而提高植物抗性[36]。拟南芥抗病突变体在寄生疫霉侵染后产生高水平活性氧并诱导细胞死亡以限制病原菌的侵染[37]。线粒体RNA加工蛋白RTP7通过调控线粒体活性氧迸发介导植物对多种病菌的广谱抗性[38]。OE株系在flg22处理后,活性氧水平显著高于对照(图9-A)。因此,推测OE株系可能通过维持较高水平活性氧以抵御致病疫霉的侵染。PAMP识别启动MAPK信号级联反应,是PTI最早期的信号事件之一[39],进一步激活WRKY转录因子(例如),导致抗性相关基因的上调表达[21]。PTI标记基因是一种钙结合蛋白,可被激发子快速诱导并参与植物防御信号转导[40]。在本研究中,OE株系中的PTI标记基因(、和)显著诱导上调表达(图9-B),这些结果揭示了介导的免疫功能与增强的PTI免疫反应密切相关。
而PTI作为植物先天免疫的第一道防线,在提升寄主植物对多种病原菌的广谱抗性中具有重要作用。例如,通过增强拟南芥PTI来提高对细菌和真菌的广谱抗性[41]。因此,鉴定PTI关键调控因子,并将之应用于抗病育种中被认为是行之有效的策略。本研究中的OE株系呈现出增强的PTI免疫反应(图9),揭示可能是植物PTI免疫反应的正调控因子。后续可利用OE株系测试其对多种病原菌的抗性,以探究介导的马铃薯广谱抗性功能与作用机制。
3.3 StCYP83B1可能通过影响SA和JA调控植物对致病疫霉的抗性
SA和JA作为植物体内两种主要的防御激素,在植物抵抗病原菌的过程中发挥重要作用[42]。通过SA和JA信号通路负调控水稻对稻瘟病和白叶枯病的抗性,相比于野生型水稻和-OE株系,突变体中SA相关基因(和)和JA相关基因(、、、和)明显上调,且SA和JA累积增加[43]。棉花通过激活JA和SA信号通路(沉默植株中JA相关基因(、和)、SA相关基因(和)下调且SA和JA含量下降)增强植物对黄萎病的抗性[44]。这些结果表明SA和JA可协同调控植物免疫。在本研究中,本氏烟瞬时过表达可促使植物SA信号通路标记基因(和)和JA信号通路标记基因(和)上调表达(图6)。进一步制备了OE稳定转化马铃薯[31],以进一步解析该基因抗晚疫病的免疫功能及作用机理。通过分析接种致病疫霉的-OE株系中SA和JA信号通路相关基因的表达量变化,发现-OE株系中SA和JA信号通路相关基因均明显上调表达(图10)。该结果揭示了可能通过协同调控SA和JA信号通路而影响马铃薯对晚疫病的抗性。然而,如何协同调控SA和JA信号通路的作用机制有待进一步深入研究。
值得注意的是,OE株系中SA信号通路相关基因诱导表达比JA更为显著(图10)。致病疫霉是一种半活体营养型病原菌,在其侵染寄主初期正处于活体营养型生长阶段。前期研究表明,感病因子RTP1可通过影响植物SA信号及细胞死亡以负调控拟南芥对疫霉菌的抗性[37],从而证实SA信号通路在植物抗半活体营养型病原菌中的重要作用。因此,推测可能在马铃薯响应致病疫霉侵染初期更强烈地激活SA免疫信号通路。
4 结论
共鉴定到10个家族成员,家族成员在不同程度上均可响应致病疫霉的侵染,其中在植物抗致病疫霉中具有重要功能。通过激活PTI、SA和JA信号通路调控植物免疫。此外,StCYP83B1血红素结合域中的半胱氨酸位点为其抗性功能所必需。
[1] 肖金钟. 马铃薯生产中的常见病害. 现代园艺, 2020, 43(18): 37-40.
XIAO J Z. Common diseases in potato production. Contemporary Horticulture, 2020, 43(18): 37-40. (in Chinese)
[2] 李铁锁. 马铃薯病害综合防治方法探讨. 南方农业, 2021, 15(8): 76-78.
LI T S. Discussion on integrated control methods of potato diseases. South China Agriculture, 2021, 15(8): 76-78. (in Chinese)
[3] MERILLON J M, RAMAWAT K G. Co-Evolution of Secondary Metabolites. Germany: Spring, 2020: 1-25.
[4] WERCK-REICHHART D, FEYEREISEN R. Cytochromes P450: a success story. Genome biology, 2000, 1(6): REVIEWS3003.
[5] NELSON D R. Progress in tracing the evolutionary paths of cytochrome P450. Biochimica et Biophysica Acta, 2011, 1814(1): 14-18.
[6] BARNABA C, RAMAMOORTHY A. Picturing the membrane- assisted choreography of cytochrome P450 with lipid nanodiscs. Chemphyschem, 2018, 19(20): 2603-2613.
[7] HASEMANN C A, KURUMBAIL R G, BODDUPALLI S S, PETERSON J A, DEISENHOFER J. Structure and function of cytochromes P450: a comparative analysis of three crystal structures. Structure, 1995, 3(1): 41-62.
[8] BAK S, BEISSON F, BISHOP G, HAMBERGER B, HÖFER R, PAQUETTE S, WERCK-REICHHART D. Cytochromes p450. The Arabidopsis Book, 2011, 9: e0144.
[9] 郭书巧, 束红梅, 巩元勇, 蒋璐, 朱静雯, 倪万潮. 菊科植物青蒿细胞色素P450基因家族分析. 江苏农业学报, 2015, 31(6): 1232-1241.
GUO S Q, SHU H M, GONG Y Y, JIANG L, ZHU J W, NI W C. Bioinformatics analysis of cytochrome P450 monooxygenase gene family from. Jiangsu Journal of Agricultural Sciences, 2015, 31(6): 1232-1241. (in Chinese)
[10] Zhu B, Wang Z, Yang J, Zhu Z, Wang H. Isolation and expression of glucosinolate synthesis genesandL. ssp.var.(N. Tsen & S.H. Lee) Hanelt)., 2012, 13(5): 5832-5843.
[11] 程文财, 丁聪聪, 赵云, 王茂林. 油菜BnCYP83B1基因的克隆与生长素相互作用的研究. 四川大学学报(自然科学版), 2014, 51(5): 1092-1098.
CHENG W C, DING C C, ZHAO Y, WANG M L. Cloning and mRNA expression of BnCYP83B1 gene under 2,4-D hormone in. Journal of Sichuan University (Natural Science Edition), 2014, 51(5): 1092-1098. (in Chinese)
[12] Tuo D C, Yan P, Zhao G Y, Cui H G, Zhu G P, Liu Y, Yang X K, Wang H, Li X Y, Shen W T, Zhou P. An efficient papaya leaf distortion mosaic potyvirus vector for virus-induced gene silencing in papaya. Horticulture Research, 2021, 8(1): 144.
[13] 赵桂红, 石宏, 张妮妮, 陆苗, 王晶, 李焘. 菘蓝CYP83B1基因的克隆与表达分析. 植物科学学报, 2017, 35(1): 64-72.
ZHAO G H, SHI H, ZHANG N N, LU M, WANG J, LI T. Cloning and expression analysis offromFort. Plant Science Journal, 2017, 35(1): 64-72.(in Chinese)
[14] 赵桂红, 张妮妮, 高帅帅, 陆苗, 王晶, 张天翼, 李焘. 菘蓝CYP83A1基因的克隆、表达特性及原核表达分析. 基因组学与应用生物学, 2018, 37(1): 302-312.
ZHAO G H, ZHANG N N, GAO S S, LU M, WANG J, ZHANG T Y, LI T. Cloning, expression characteristics and prokaryotic expression analysis of CYP83A1 gene fromFort. Genomics and Applied Biology, 2018, 37(1): 302-312. (in Chinese)
[15] 高灿红, 董丽丽, 关晓弯, 赵良侠, 林俊城, 徐福乐, 张水明. 青花菜萝卜硫素合成相关基因的克隆与表达分析. 西北植物学报, 2016, 36(7): 1302-1307.
GAO C H, DONG L L, GUAN X W, ZHAO L X, LIN J C, XU F L, ZHANG S M.Cloning and expression analysis of sulforaphane synthesis-related geneActa Botanica Boreali-Occidentalia Sinica, 2016, 36(7): 1302-1307. (in Chinese)
[16] Hansen C H, Du L, Naur P, Olsen C E, Axelsen K B, Hick A J, Pickett J A, Halkier B A. CYP83b1 is the oxime-metabolizing enzyme in the glucosinolate pathway in. The Journal of biological chemistry, 2001, 276(27): 24790-24796.
[17] Bak S, Tax F E, Feldmann K A, Galbraith D W, Feyereisen R. CYP83B1, a cytochrome P450 at the metabolic branch point in auxin and indole glucosinolate biosynthesis in. The Plant Cell, 2001, 13(1): 101-111.
[18] Bak S, Feyereisen R. The involvement of two p450 enzymes, CYP83B1 and CYP83A1, in auxin homeostasis and glucosinolate biosynthesis. Plant physiology, 2001, 127(1): 108-118.
[19] NGOU B P M, AHN H K, DING P, JONES J D G. Mutual potentiation of plant immunity by cell-surface and intracellular receptors. Nature, 2021, 592(7852): 110-115.
[20] WANG H, HE H, QI Y, MCLELLAN H, TIAN Z, BIRCH P R J, TIAN Z. The oomycete microbe-associated molecular pattern Pep-13 triggers SERK3/BAK1-independent plant immunity.Plant Cell Reports, 2019, 38(2): 173-182.
[21] ZHONG C, REN Y, QI Y, YU X, WU X, TIAN Z. PAMP-responsive ATL geneand its orthologuepositively regulateresistance in potato and. Plant Science, 2018, 270: 47-57.
[22] Clay N K, Adio A M, Denoux C, Jander G, Ausubel F M. Glucosinolate metabolites required for aninnate immune response. Science, 2009, 323(5910): 95-101.
[23] Smolen G, Bender J.cytochrome P450mutations activate the tryptophan biosynthetic pathway. Genetics, 2002, 160(1): 323-332.
[24] Hemm M R, Ruegger M O, Chapple C. Themutant is defective in the gene encoding CYP83A1 and shows both phenylpropanoid and glucosinolate phenotypes. The Plant Cell, 2003, 15(1): 179-194.
[25] PIETERSE C M, VAN WEES S C, VAN PELT J A, KNOESTER M, LAAN R, GERRITS H, WEISBEEK P J, VAN LOON L C. A novel signaling pathway controlling induced systemic resistance in. The Plant cell, 1998, 10(9): 1571-1580.
[26] WEIS C, HILDEBRANDT U, HOFFMANN T, HEMETSBERGER C, PFEILMEIER S, KÖNIG C, SCHWAB W, EICHMANN R, HÜCKELHOVEN R. CYP83A1 is required for metabolic compatibility ofwith the adapted powdery mildew fungus. New Phytologist, 2014, 202(4): 1310-1319.
[27] Weis C, Pfeilmeier S, Glawischnig E, Isono E, Pachl F, Hahne H, Kuster B, Eichmann R, Hückelhoven R. Co-immunoprecipitation-based identification of putative BAX INHIBITOR-1-interacting proteins involved in cell death regulation and plant-powdery mildew interactions. Molecular Plant Pathology, 2013, 14(8): 791-802.
[28] Xu R, Kong W W, Peng Y F, Zhang K X, Li R, Li J. Identification and expression pattern analysis of the glucosinolate biosynthetic genefrom broccoli. Biologia Plantarum, 2018, 62(3): 521-533.
[29] SCHMITTGEN T D, LIVAK K J. Analyzing real-time PCR data by the comparative C(T) method. Nature Protocols, 2008, 3(6): 1101-1108.
[30] SIRIM D, WIDMANN M, WAGNER F, PLEISS J. Prediction and analysis of the modular structure of cytochrome P450 monooxygenases.BMC Structural Biology, 2010, 10: 34.
[31] 孔乐辉, 宗德乾, 史青尧, 殷盼盼, 巫文玉, 单卫星, 强晓玉. 马铃薯基因过表达载体构建及遗传转化. 西北农业学报, doi: 10.7606/j.issn.1004-1389.2024.10.001.
KONG L H, ZONG D Q, SHI Q Y, YIN P P, WU W Y, SHAN W X, QIANG X Y. Construction of overexpression vector of) and development of-overexpressed transgenic potato lines. Acta Agriculturae Boreali-Occidentalis Sinica, doi: 10.7606/j.issn.1004-1389.2024.10. 001. (in Chinese)
[32] WILLIAMS P A, COSME J, SRIDHAR V, JOHNSON E F, MCREE D E. Mammalian microsomal cytochrome P450 monooxygenase: structural adaptations for membrane binding and functional diversity. Molecular Cell, 2000, 5(1): 121-131.
[33] PAQUETTE S M, BAK S, FEYEREISEN R. Intron-exon organization and phylogeny in a large superfamily, the paralogous cytochrome P450 genes of. DNA and cell biology, 2000, 19(5): 307-317.
[34] 汪思远, 蒋世翠, 王康宇, 王义, 张美萍. 植物细胞色素P450的研究进展. 吉林蔬菜, 2014(4): 41-45.
WANG S Y, JIANG S C, WANG K Y, WANG Y, ZHANG M P. Research process of cytochrome P450 in plant. Jilin Vegetable, 2014(4): 41-45. (in Chinese)
[35] HATAE T, HARA S, YOKOYAMA C, YABUKI T, INOUE H, ULLRICH V, TANABE T. Site-directed mutagenesis of human prostacyclin synthase: Alteration of Cys441of the Cys-pocket, and Glu347and Arg350of the EXXR motif. FEBS Letters, 1996, 389(3): 268-272.
[36] LAMBETH J D. NOX enzymes and the biology of reactive oxygen. Nature Reviews Immunology, 2004, 4(3): 181-189.
[37] PAN Q, CUI B, DENG F, QUAN J, LOAKE G J, SHAN W. RTP1 encodes a novel endoplasmic reticulum (ER) localized protein inand negatively regulates resistance against biotrophic pathogens. New Phytologist, 2016, 209(4): 1641-1654.
[38] YANG Y, ZHAO Y, ZHANG Y, NIU L, LI W, LU W, LI J, SCHÄFER P, MENG Y, SHAN W. A mitochondrial RNA processing protein mediates plant immunity to a broad spectrum of pathogens by modulating the mitochondrial oxidative burst. The Plant Cell, 2022, 34(6): 2343-2363.
[39] NIE P, LI X, WANG S, GUO J, ZHAO H, NIU D. Induced systemic resistance againstbyAR156 through a JA/ET- and NPR1-dependent signaling pathway and activates PAMP-triggered immunity in. Frontiers in Plant Science, 2017, 8: 238.
[40] DURRANT W E, ROWLAND O, PIEDRAS P, HAMMOND- KOSACK K E, JONES J D. cDNA-AFLP reveals a striking overlap in race-specific resistance and wound response gene expression profiles. The Plant Cell, 2000, 12(6): 963-977.
[41] LI Y, ZHANG Y, WANG Q X, WANG T T, CAO X L, ZHAO Z X, ZHAO S L, XU Y J, XIAO Z Y, LI J L, FAN J, YANG H, HUANG F, XIAO S, WANG W M. RESISTANCE TO POWDERY MILDEW8.1 boosts pattern-triggered immunity against multiple pathogens inand rice.Plant Biotechnology Journal, 2018, 16(2): 428-441.
[42] PIETERSE C M, VAN DER DOES D, ZAMIOUDIS C, LEON- REYES A, VAN WEES S C. Hormonal modulation of plant immunity. Annual Review of Cell and Developmental Biology, 2012, 28: 489-521.
[43] HONG Y, LIU Q, CAO Y, ZHANG Y, CHEN D, LOU X, CHENG S, CAO L. Thenegatively regulatesanddisease resistance via SA and JA signaling pathway in rice. Frontiers in Plant Science, 2019, 10: 752.
[44] ZHU Y, HU X, WANG P, WANG H, GE X, LI F, HOU Y. The phospholipase D geneconfers resistance toand improves tolerance to salt stress. Plant Science, 2022, 321: 111322.
Identification ofGene Family in Potato and Analysis of its Function in Resistance against Late Blight
KONG LeHui, ZONG DeQian, SHI QingYao, YIN PanPan, WU WenYu, TIAN Peng,SHAN WeiXing, QIANG XiaoYu
College of Agronomy, Northwest A & F University/State Key Laboratory of Crop Stress Biology for Arid Areas, Yangling 712100, Shaanxi
【Objective】The objective of this study is to identifygene family in potato and analyze their expression patterns in response toinfection, so as to mine thegenes with potential function in resistance to late blightand provide novel resistance gene resources for molecular resistance breeding in potato.【Method】The members ofgene family were identified by bidirectional BLASTmethod. The basic information of StCYP83 protein sequence, subcellular localization and conserved motifs were analyzed by ExPASy Prot Param, Cell-Ploc 2.0 and ESPript, etc. The qRT-PCR was used to analyze the expression pattern ofgenes in response toinfection. The immune function of candidate geneagainstwas analyzed in either-mediated transient transformation inleaves ofor stably transformed potato lines with overexpression (OE) of.【Result】A total of 10genes were identified in the potato genome, which were named,respectively, with the encoded protein lengths ranging from 387 to 503 aa and molecular weights ranging from 44 to 57 kDa. The subcellular localization of StCYP83 proteins was predicted in the endoplasmic reticulum. The qRT-PCR confirmed that members ofcould be induced in response toinfection, suggesting thatgenes might play a role in the interaction between potato and. Accordingly,with the highest homology towas selected as a candidate gene for subsequent immune functional analysis. The pathogenicity assay onleaves showed thatoverexpression ofcould enhance plant resistance against. In accordance with this, overexpression ofcould significantly promote the up-regulation expression of PTI marker genes (and), SA signaling marker genes (and), JA signalingmarker genes (and) and enhance the reactive oxygen species (ROS) burst induced by flg22. In addition, cysteine site in the conserved motif of StCYP83B1 protein was required for its immune function.overexpression (-OE) lines showed enhanced resistance to.In accordance with this,-OE could enhance PTI immune responses, including the increased level of ROS induced by flg22 and the significantly up-regulated expression of PTI marker genes (,and) as well as SA-mediated signaling marker genes (,,and) and JA-mediated signaling marker genes (,and) in response toinfection.【Conclusion】A total of 10 members offamily were identified, which could be induced byinfection in different degrees.regulates plant resistance toby activating PTI, SA and JA signaling pathways. The cysteine site in the heme binding domain of StCYP83B1 is required for its immune function.
potato ();gene family;; plant resistance; late blight

10.3864/j.issn.0578-1752.2023.16.007
2023-06-08;
2023-06-14
国家自然科学基金(31872657)、国家现代农业产业技术体系(CARS-09)、国家重点研发计划(2017YFD0200602-2)
孔乐辉,E-mail:542909995@qq.com。通信作者单卫星,E-mail:wxshan@nwafu.edu.cn。通信作者强晓玉,E-mail:qiangxiaoyu@nwafu.edu.cn
(责任编辑 岳梅)
