玉米ZCN7在调控花期抗旱性中的作用
2023-09-27李燕陶柯宇胡悦李永祥张登峰李春辉何冠华宋燕春石云素黎裕王天宇邹华文刘旭洋
李燕,陶柯宇,胡悦,李永祥,张登峰,李春辉,何冠华,宋燕春,石云素,黎裕,王天宇,邹华文,刘旭洋
玉米在调控花期抗旱性中的作用
李燕1,陶柯宇2,胡悦3,李永祥3,张登峰3,李春辉3,何冠华3,宋燕春3,石云素3,黎裕3,王天宇3,邹华文1,刘旭洋3
1长江大学农学院,湖北荆州 434000;2黑龙江大学现代农业与生态环境学院,哈尔滨 150080;3中国农业科学院作物科学研究所,北京 100081
【目的】我国玉米主产区多分布在干旱和半干旱的雨养农业地区,干旱造成的玉米减产严重威胁国家粮食安全。作为异花授粉作物,开花期是玉米对干旱最为敏感的时期,干旱引起的散粉吐丝花期不遇将导致严重的产量损失。因此,挖掘花期抗旱基因,并研究其功能,将为玉米抗旱种质改良和品种培育提供理论支撑和基因资源。【方法】采取生物信息学方法,对玉米基因组中24个ZCN基因(拟南芥的同源基因)的同源关系进行分析。利用qRT-PCR和活体GFP荧光成像试验分析的组织表达模式。选取118份玉米多样性自交系,在北京(2021和2022年)和新疆乌鲁木齐(2022年)3个环境下开展不同水分处理的玉米开花期性状调查,采用PCR扩增和Sanger测序方法对及上下游区域的遗传变异进行检测,利用混合线性模型开展散粉-吐丝间隔的候选基因关联分析获得显著关联的遗传位点,同时,取花期叶片组织进行表达量检测,分析显著位点不同单倍型自交系中散粉-吐丝间隔及表达量的差别。构建:的过表达转基因玉米植株,在大田环境开展不同水分处理下的开花期鉴定和产量及相关性状的鉴定,分析的花期抗旱功能。【结果】玉米24个ZCN基因被分为15个FT类基因、6个TFL1类基因和3个MFT类基因,编码的蛋白长度为111—193个氨基酸,其中,ZCN7与ZCN8的亲缘关系最近,二者蛋白序列的相似性为83.33%。组织表达分析结果表明,在V12期表现出表达峰值,并且的启动子在成熟的拟南芥叶片边缘高表达。候选基因关联分析发现位于起始密码子前1 001 bp的一个SNP位点具有最显著的关联信号,该位点AA和GG单倍型分别包含78和27个自交系,干旱条件下,A/A单倍型自交系的散粉-吐丝间隔显著小于G/G单倍型,并且A/A单倍型的玉米表达量显著高于G/G单倍型。对过表达转基因玉米的田间表型鉴定,表明干旱和正常水分条件下转基因玉米的散粉-吐丝间隔均小于野生型,其中,干旱条件下,OE1散粉-吐丝间隔较野生型缩小2.3 d,OE2较野生型缩小2.6 d;并且,在干旱条件下,转基因玉米的单株产量和单株籽粒数均显著高于野生型,而百粒重、粒长、粒宽等性状没有显著差异。【结论】玉米正调控玉米的抗旱性,其过表达能够缩短干旱下的散粉-吐丝间隔,并增加籽粒产量。
玉米(L.);抗旱性;开花期;ZCN
0 引言
【研究意义】玉米(L.)是重要的粮食经济作物,是世界上种植最广泛的作物之一,也是中国种植面积最大的作物之一[1]。干旱是全球范围影响玉米生产的主要胁迫因素。尤其是中国的玉米主产区大多分布在干旱和半干旱地区,干旱造成的玉米减产严重威胁我国的粮食安全。作为一种异花授粉植物,玉米在开花期受到的干旱胁迫会导致雄穗和穗发育不同步,从而延长散粉期和吐丝期间隔(anthesis-silking interval,ASI),延长的散粉期和吐丝期间隔妨碍了玉米成功授粉,造成严重的籽粒产量损失[2]。因此,解析玉米花期抗旱性的分子机制,挖掘调控干旱条件下散粉期和吐丝期间隔的基因资源,对玉米抗旱种质改良和新品种培育具有重要的理论和实际意义。【前人研究进展】植物的开花期性状是重要的环境适应相关性状,受到生育期以及光周期、温度等环境因素的共同调控。拟南芥()和()是控制花期的关键基因,这两个基因均编码磷脂酰乙醇胺结合蛋白(phosphatidylethanolamine-binding protein,PEBP),但FT和TFL1蛋白序列中一个氨基酸的差异造成了完全相反的功能,FT促进开花,而TFL1抑制开花[3]。是控制拟南芥开花的关键基因,受光信号等多种途径诱导在叶片中表达,编码的蛋白通过长距离运输到茎尖分生组织等,与编码蛋白互作进一步转录激活花分生组织识别基因()启动花的发育,过表达会使拟南芥出现早花表型,其缺失突变体表现出晚花表型[4-7]。水稻()是的同源基因,该基因与14-3-3蛋白、OsFD1蛋白互作形成复合体,激活转录因子基因的表达促进水稻开花,其过表达植株具有不依赖光周期的极早花表型[8-9]。在玉米基因组中有25个FT/TFL1基因的同源基因,命名为ZEA CENTRORADIALIS(ZCN)基因[10]。其中,是被研究最多的基因,被认为在玉米花期调控中具有中心作用。Meng等[11]发现在光周期敏感的热带玉米材料中,的表达量被诱导开花的短日照环境激活,而在光周期不敏感的温带玉米材料中,的表达量在不同日照环境下比较稳定,并且该基因的过表达能够促使玉米提早开花。Lazakis等[12]发现玉米祖先大刍草的表达量被诱导开花的短日照环境激活,的表达量受()的调控。Guo等[13]发现启动子区域的一个SNP变异位点与玉米开花期显著关联,该变异位点通过影响与启动子的结合能力控制开花期。与具有最高的基因序列相似性,Mascheretti等[14]发现/具有相似的基因表达和组蛋白表观修饰模式。然而,Danilevskaya等[10]对6个ZCN基因(—)的过表达研究发现,、和不仅控制玉米开花期,而且其过表达还显著增加了雄穗的分枝数,而和对花期没有影响但能够控制雄穗的形态。表明ZCN基因在植物的生长发育中具有多重的分子生物学功能,也表明其家族内的不同基因具有分化的功能。【本研究切入点】ZCN基因调控玉米开花期的机制已有一些报道,然而,其在玉米花期抗旱中的功能仍鲜见报道。【拟解决的关键问题】本研究以玉米为目的基因,通过qRT-PCR、组织表达分析等方法阐明的表达调控模式,采用自然群体研究的遗传变异和表达量变异与花期抗旱的相关性,利用过表达转基因植株分析控制玉米花期抗旱性的功能,为玉米抗旱种质改良和品种培育提供理论支撑和基因资源。
1 材料与方法
1.1 ZCN基因家族分析
从MaizeGDB(https://www.maizegdb.org/)网站中获取ZCN家族基因的DNA序列、编码区序列、蛋白序列和基因注释信息。使用MEGA 11中CLUSTAL W方法对ZCN基因编码蛋白序列进行多序列比对,其中,参数Gap opening penalty设为10,Gap extension penalty设为0.1,其他选用系统默认参数;采用Neighbor Joining法构建基因进化树,用500次迭代的自举分析法(bootstrap)进行分析。将ZCN家族基因蛋白序列提交至在线基因蛋白序列网站MEME Suite(https://meme-suite.org/meme/tools/meme)检测保守的蛋白结构域(motif),参数设置为选择系统默认参数。最后使用TBtools软件[15]绘图,将之前获得的ZCN进化树结果、保守motif分析结果和基因注释结果载入对应模块,选择默认参数,获得进化树+Motifs+基因结构组合图。
1.2 ZCN7和ZCN8的表达模式分析
为了明确和在玉米不同生育时期及不同组织中的表达模式,利用玉米参考基因组自交系B73在温室环境进行种植培养,在不同的叶龄中取成熟的叶片组织,在开花期取雄穗、雌穗、花丝、根系等组织,每个组织5个单株混样3个生物学重复,采用RNA Easy Fast植物组织RNA快速提取试剂盒(天根)提取组织的RNA样品,利用One-Step gDNA Removal and cDNA Synthesis SuperMix(全式金)进行反转录,利用SYBR qPCR Master Mix(诺唯赞)开展qRT-PCR分析,仪器为ABI Quantstudio3实时荧光定量PCR仪(ThermoFisher)。的qRT-PCR引物为5′-CCACTGCATGGCTACACTATA TAAT-3′和5′-CTTGGAGAATACTTTGTCTGATTAA TCA-3′,的引物为5′-GCTCAGACTGCAGCTT C-3′和5′-CTTGGCAGAAGTAGCCTATTG-3′,内参基因的引物为5′-CCCTTCATCACCACGGACT AC-3′和5′-AACCTTCTTGGCACCACCCT-3′,采用2-∆∆Ct法计算基因的表达量,每个样品3次重复,计算平均值和标准差。
1.3 ZCN7启动子表达模式分析
通过启动子表达分析进一步明确的组织表达模式,采取EⅡ、EⅠ酶切位点将克隆的2 kb启动子序列连接至pCAMBIA3301载体,构建:表达载体。利用热激法将构建好的表达载体转化至EHA105农杆菌,使用沾花侵染法转化拟南芥。T1代的拟南芥种子在4 ℃春化3 d后播种,在16 h 25 ℃/8 h 22 ℃环境的温室培养,播种后两周喷施1‰浓度的草铵膦除草剂筛选阳性植株,将阳性拟南芥植株移栽至单独的盆栽,继续培养两周后使用植物活体成像仪检测荧光信号,将滤光片调至紫外光,选择激发时长5 s,观察、拍照并保存试验结果。
1.4 玉米自然群体的田间花期抗旱性鉴定
从前期构建的大规模自然群体中挑选118份代表性玉米自交系,在北京(2021和2022年)和乌鲁木齐(2022年)开展2年多点的田间抗旱性鉴定。北京试验点在中国农业科学院作物科学研究所昌平实验基地的旱棚设施进行,其中,旱区采用滴灌系统进行灌溉,在播种后进行一次灌溉,浇水量为450 m3·hm-2,此后停止浇水至试验结束,有降雨时通过旱棚设施进行遮雨;水区按一般田间管理。新疆试验点在新疆农业科学院粮食作物研究所安宁渠试验场开展,水旱区均采用滴灌系统精确控制土壤水分含量,其中水区每两周进行一次灌溉,每次灌溉量为900 m3·hm-2;旱区同样每两周进行一次灌溉,每次灌溉量为450 m3·hm-2。各试验点均为两行区随机区组排列设计,设3重复,行长3 m,行距0.6 m,每行13株。人工记录开花期,每个小区在超过一半植株散粉当日记录为散粉期,超过一半植株吐丝当日记录为吐丝期,并计算散粉-吐丝间隔。采用R语言的lme4包计算多环境表型数据的最佳线性无偏预测(best linear unbiased prediction,BLUP)值。在V13期取每个小区的叶片组织,每个组织5个单株混样品,提取RNA并对表达量进行分析,RNA提取及qRT-PCR方法同1.2。
1.5 ZCN7候选基因的关联分析
采集118份玉米自交系的叶片样品,采用CTAB法提取样品的基因组DNA。根据序列及上游3 kb区域和下游1 kb区域的序列,设计6对引物分段PCR扩增,扩增产物采用Sanger测序法进行测序分析。6个扩增子的引物序列分别为扩增子1:5′-GACAACAAAGAACAGTTTTATCGATGC-3′和5′- ATCATTTACAAGGGGACTTGCTTC-3′,扩增子2:5′- ACATGGCCATATGTACAATCTGTT-3′和5′-CTGCA GAAAAATAACCCTATGGGAC-3′,扩增子3:5′-AGC CTTCCTCAACTCCAGTATAAAT-3′和5′-CTGATGT TGCCAACCAATTAAAGGAC-3′,扩增子4:5′-GCCG GAGTCTGGATATATTGGTATT-3′和5′-CGTACCAC TGGCATAATACTTTCAAT-3′,扩增子5:5′-ACTAC AATCAGAAGAGCACAACAC-3′和5′-GTGGGCCTA GGTTTTTTTATAGGGTG-3′,扩增子6:5′-GACAACA TTGTTGATTGTTGATCGCC-3′和5′-CTGGAGTCAA TTTACTCGTGCATG-3′。测序结果利用DNAMAN10软件进行拼接,使用MEGAX软件将拼接好的序列进行比对检测突变位点。采用TASSEL5软件的混合线性模型(mixed linear model,MLM)进行候选基因关联分析。
1.6 过表达转基因玉米的创制
从B73的cDNA中PCR扩增的编码区序列,通过In-fusion无缝连接方法连接至替换了启动子的pCAMBIA3301载体,将构建好的:载体转化至EHA105农杆菌,利用农杆菌侵染玉米幼胚的方法将过表达载体导入受体自交系B104。转化体经2代自交得到T2代种子,在每个世代通过草铵膦除草剂涂抹叶片方法检测阳性和阴性转基因植株。
1.7 过表达转基因玉米田间抗旱表型的鉴定
在新疆乌鲁木齐利用自然干旱气候环境开展转基因材料的田间抗旱性鉴定,试验在新疆农业科学院粮食作物研究所安宁渠试验场开展。试验设水区和旱区2个处理,水旱区均采用滴灌系统精确控制土壤水分含量。其中,水区每两周进行一次灌溉,每次灌溉量为900 m3·hm-2;旱区同样每两周进行一次灌溉,每次灌溉量为450 m3·hm-2。试验为四行区随机区组排列设计,行长3 m,行距0.6 m,每行13株。水旱处理均设6个重复。在玉米的开花期记录每株过表达转基因植株和野生型对照植株的散粉期和吐丝期,并计算散粉-吐丝间隔。籽粒成熟后收获四行区中间两行的果穗,人工测量小区产量、单株产量,并利用智能化考种系统测量百粒重、粒长、粒宽等性状,采用LDS-1G型谷物水分测定仪测量籽粒含水量,籽粒折合14%水分含量进行下一步统计分析。
2 结果
2.1 玉米ZCN基因家族分析
在玉米Zm-B73-REFERENCE-NAM-5.0基因组中共有24个ZCN基因,分布在除第1染色体外的其他9条染色体上,其中,第2染色体上分布最多(、、、和)。基因进化树表明,24个ZCN基因被分为三类:15个FT类基因(、、、、、、、、、、、、、和)、6个TFL1类基因(、、、、和)和3个MFT类基因(、和)(图1)。ZCN基因编码区序列长度为336—582 bp,编码的蛋白长度为111—193个氨基酸,具有较为保守的蛋白结构。其中,ZCN7与ZCN8的亲缘关系最近,其编码的蛋白序列长度分别为171和179个氨基酸,二者蛋白序列的相似性为83.33%。
2.2 ZCN7的基因表达模式分析
FT类基因主要在开花前的叶片中表达,通过长距离运输至顶端分生组织等促进植物开花[11]。通过对玉米不同叶龄的和表达量进行分析,发现在V12期表现出表达峰值,并且在V13期的表达量有所回落;而在V13期表现出表达峰值。和在雌穗、雄穗、花丝和根系中的表达量均较低(图2-a)。此外,通过GFP荧光检测对启动子的表达模式进行分析,发现启动子驱动的GFP绿色荧光蛋白在成熟的拟南芥叶片边缘呈现出较高的表达信号(图2-b)。这一结果与在玉米成熟叶片的叶尖表达结果相似。
2.3 自然群体中ZCN7的候选基因关联分析
利用118份多样性玉米自交系分析的花期抗旱性功能。针对118份玉米自交系在2年3环境开展开花期抗旱性鉴定,采用6个扩增子对及上下游区域进行PCR扩增和Sanger测序,在5 717 bp的序列上共检测到238个SNP变异和62个indel变异。基于混合线性模型对干旱下的散粉-吐丝间隔进行候选基因关联分析,发现位于起始密码子(ATG)前1 001 bp的一个SNP位点(SNP-1001)具有最显著的关联信号(图3-a)。对SNP-1001的单倍型分析结果表明,AA和GG单倍型分别包含78和27个自交系,干旱下A/A单倍型自交系的散粉-吐丝间隔显著小于G/G单倍型,而正常水分处理下的散粉-吐丝间隔没有显著差异。此外,不同水分处理下,不同单倍型间的散粉期和吐丝期也没有明显的差别。为了分析启动子前的显著SNP变异对基因表达的影响,采用qRT-PCR方法对不同水分处理下叶片中的表达量进行分析,结果表明,在干旱和正常处理下,A/A单倍型的玉米表达量均显著高于G/G单倍型(图3)。
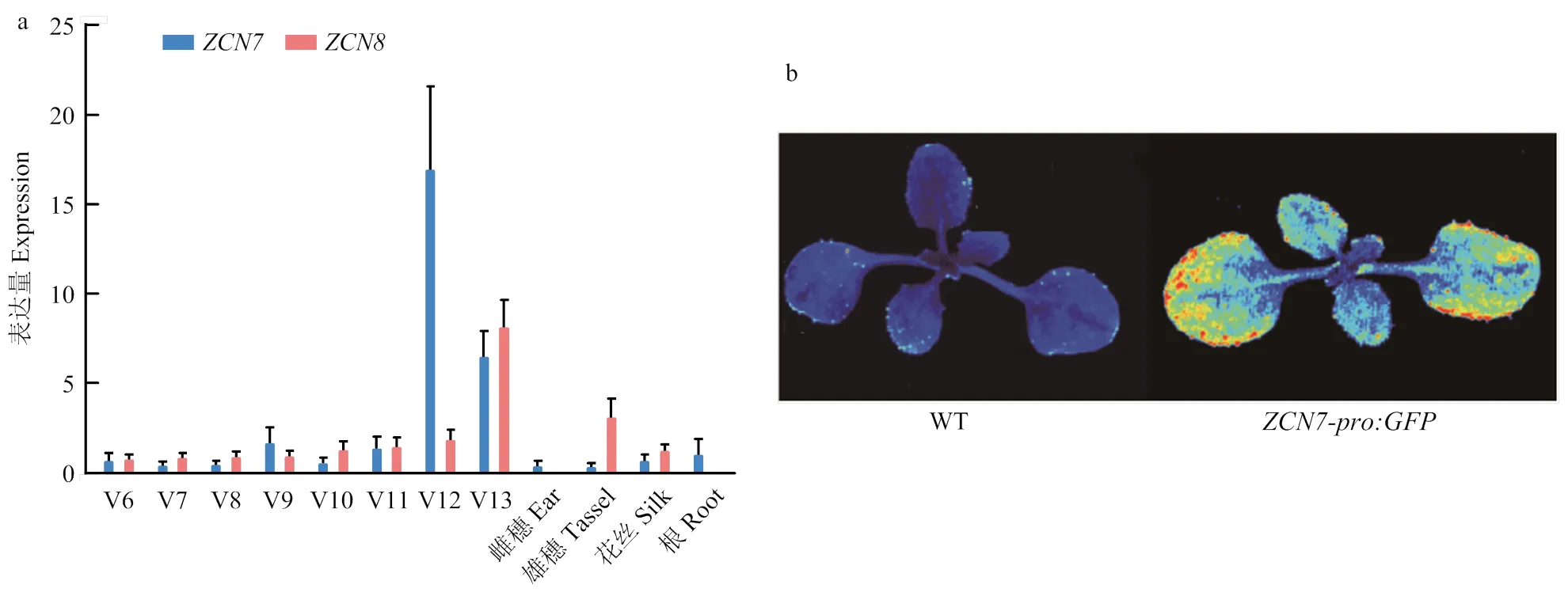
a:ZCN7和ZCN8在不同组织中的表达分析;b:GFP荧光检测
2.4 ZCN7过表达转基因玉米的抗旱性鉴定
为了验证影响玉米开花期和抗旱性的功能,构建:过表达转基因玉米植株,经过2代自交和除草剂、PCR筛选,获得2个独立的纯合阳性转化事件(OE1和OE2)。在不同水分处理下,转基因植株和野生型植株在株高、叶片数等形态特征上没有显著的差别(图4-a—b)。对开花期的性状鉴定结果表明,尽管在干旱和正常水分条件下转基因植株的散粉期和吐丝期与野生型的差异没有达到显著水平,但是转基因材料的散粉期较野生型延迟而吐丝期较野生型提前,这种相反的趋势造成转基因植株的散粉-吐丝间隔显著(<0.05)的小于野生型材料(图4-c—h)。其中,OE1在干旱下的散粉-吐丝间隔较野生型缩小2.3 d,在正常水分处理下缩小1.9 d;OE2在干旱下的散粉-吐丝间隔较野生型缩小2.6 d,在正常水分处理下缩小1.0 d。
为了验证过表达转基因玉米减小的散粉-吐丝间隔是否影响籽粒产量,对转基因和野生型玉米收获后的单株产量、百粒重、粒长、粒宽、单株籽粒数等性状进行分析。结果表明,在正常水分处理条件下,转基因植株和野生型在产量及相关性状上没有显著差异。而在干旱处理条件下,过表达转基因玉米的单株产量显著(<0.05)高于野生型,其中OE1、OE2和野生型玉米的单株产量分别为31.9、35.0和36.9 g/株;并且OE1和OE2的单株籽粒数均显著(<0.05)高于野生型WT,其单株籽粒数分别为130.4、136.8和120.6粒/株。而在百粒重、粒长、粒宽等性状上转基因玉米与野生型没有显著差异(图5)。推测在干旱条件下转基因玉米缩短的散粉-吐丝间隔增加了籽粒数从而增加了产量。
3 讨论
3.1 已克隆的玉米抗旱基因具有重要的应用潜力
我国的玉米主产区大多分布在干旱和半干旱地区,干旱造成的玉米减产严重威胁我国的粮食安全。抗旱玉米品种的培育和应用是降低干旱危害的有效手段。近年来一些玉米抗旱相关基因被成功克隆并显示出改良玉米抗旱性的应用潜力。Wang等[16]通过全基因组关联分析克隆控制玉米苗期抗旱性的基因,该基因编码一个位于液泡的质子泵-焦磷酸水解酶,的过表达玉米植株相比对照在苗期干旱下具有显著增高的存活率,在大田干旱下具有显著减小的ASI和增高的单株产量。Tian等[17]发现在抗旱玉米自交系中的3′-UTR区域缺少一个28 bp的序列导致该基因mRNA的稳定性增强,该基因的功能缺失突变体中气孔响应干旱胁迫的应答减弱,并且过表达转基因材料在干旱下的产量显著高于对照,而在正常条件下的产量不受影响。Xiang等[18]发现在玉米自然群体中的表达量与抗旱程度负相关,转基因玉米和拟南芥均证明对抗旱性起负调控作用,其功能变异位点为5′-UTR区域的一段缺失导致内质网胁迫诱导元件丧失,使丢失了干旱诱导表达的能力,从而提高了玉米的抗旱性。Mao等[19]克隆控制玉米苗期抗旱性的转录因子基因,在玉米自交系群体中该基因的表达量与抗旱性显著正相关,的过表达玉米植株在干旱下具有显著增强的存活率和水分利用效率,以及显著减小的气孔导度和蒸腾速率。Guo等[20]发现()能够控制玉米的产量和抗旱性,该基因的过表达玉米在干旱下表现显著减小的ASI、果穗突尖长度和显著增加的结实率。过表达玉米能够降低植株对乙烯信号的敏感性从而提高抗旱性[21]。经过启动子编辑的增强表达玉米植株在干旱条件下的产量显著高于对照,并且在正常水分条件下的产量与对照没有差异[22]。Xiang等[23]发现能够快速响应干旱胁迫,该基因的过表达能够显著增强玉米的抗旱性,并且ZmNAC49转录因子蛋白能够直接结合到气孔发育基因的启动子区域抑制该基因的表达。开花期是玉米抗旱性和环境适应性的重要性状,干旱引起的玉米花期不遇将造成严重的产量损失。Liu等[24]发现在花丝伸长期的雌穗中,干旱胁迫抑制了大量细胞伸长生长相关基因如扩展蛋白(expansin)、水通道蛋白(auaporin)、木葡聚糖内糖基转移酶(xyloglucan endotransglycosylase,XET)的表达,导致花丝伸长受阻;同时发现利用干旱诱导型启动子驱动一个扩展蛋白基因的表达,能够显著降低转基因植株在干旱下的散粉-吐丝间隔期。本研究克隆了玉米,该基因的过表达转基因玉米在干旱条件下较野生型对照具有显著减小的散粉-吐丝间隔,对产量相关性状的鉴定结果表明,过表达玉米较野生型具有显著提高的单株籽粒数和籽粒产量,这些结果为玉米的抗旱种质改良提供了具有应用潜力的基因资源(图4和图5)。
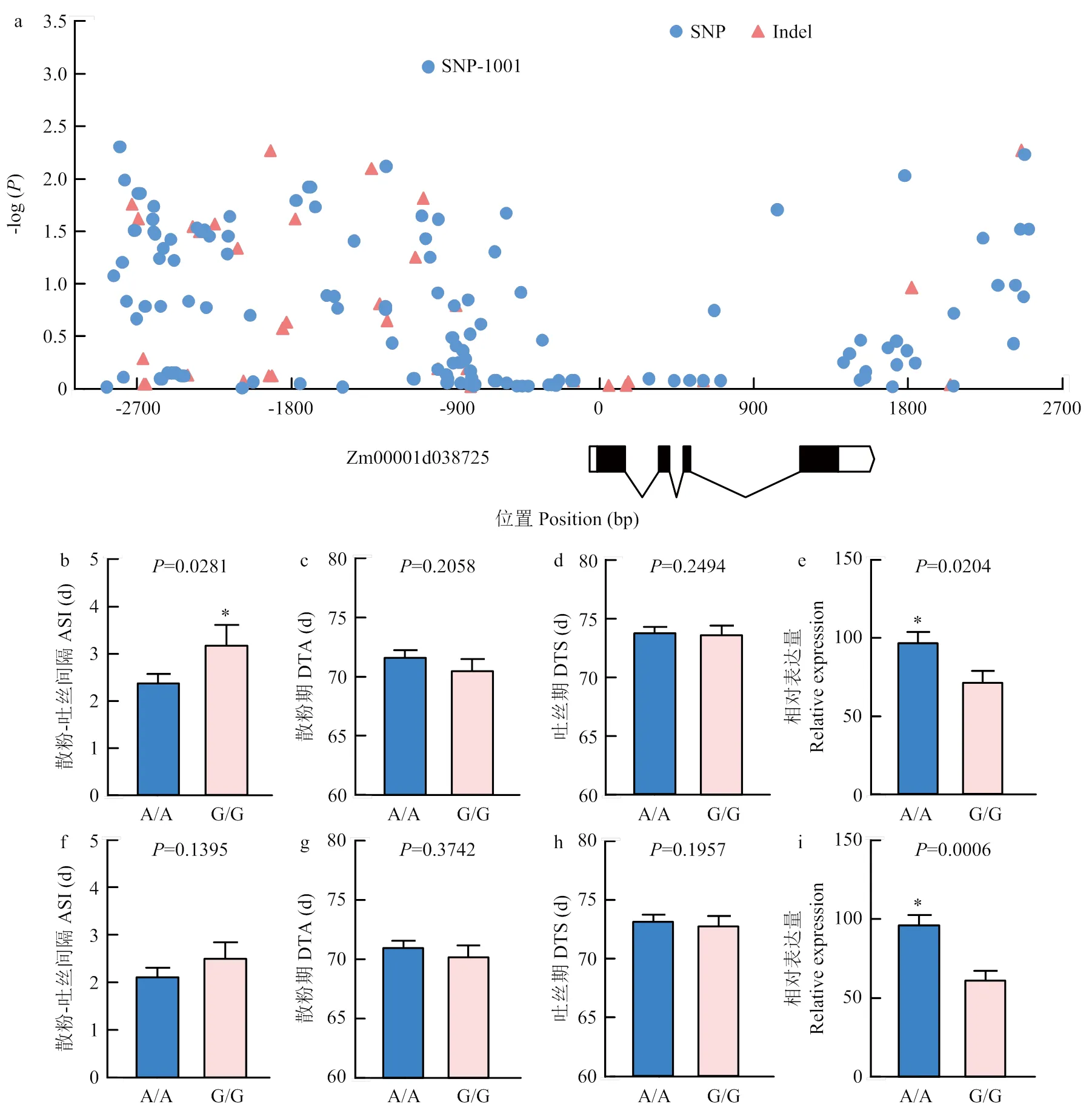
a:采用混合线性模型对干旱下的散粉-吐丝间隔进行候选基因关联分析,X坐标轴的0点为ZCN7的起始密码子(ATG),图下方为ZCN7的基因结构,白色方框代表UTR区域,黑色方框代表编码区,线条为内含子。b—e:分别为干旱下不同单倍型的散粉-吐丝间隔、散粉期、吐丝期和ZCN7的表达比较;f—i:分别为正常条件下不同单倍型的散粉-吐丝间隔、散粉期、吐丝期和ZCN7的表达比较。采用Students’t检验进行统计分析
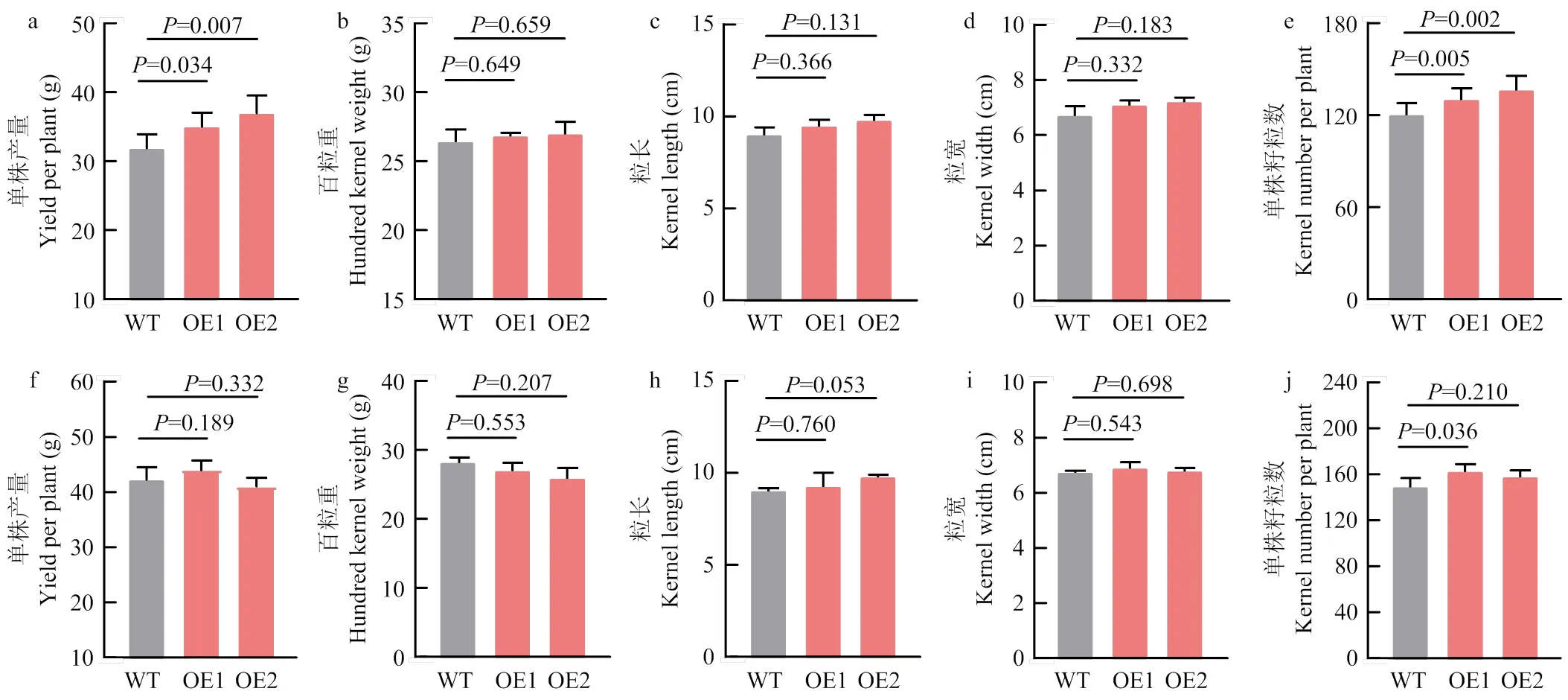
干旱处理条件下转基因(OE1和OE2)和野生型(WT)玉米的单株产量(a)、百粒重(b)、粒长(c)、粒宽(d)、单株籽粒数(e)。正常水分下转基因和野生型玉米的单株产量(f)、百粒重(g)、粒长(h)、粒宽(i)、单株籽粒数(j)。采用Students’t检验进行统计分析
3.2 一些花期相关基因在植物抗逆中发挥了重要作用
近年来,植物开花调控通路中的关键基因被发现在抗逆、抗病、营养高效等方面也发挥了重要作用。水稻()编码一个CONSTANS蛋白,Wei等[25]发现的功能缺失突变体对盐胁迫十分敏感,该基因在盐胁迫下的诱导表达会抑制质膜钠离子转运蛋白基因的表达从而减少盐离子在细胞内的积累。大麦中生物钟基因()、、和()等均能够响应高温胁迫,其表达量在高温胁迫下显著升高[26]。Wang等[27]发现是玉米抗茎腐病QTL位点的功能基因,的高表达能够增强玉米的茎腐病抗性。在拟南芥中,基因具有抗稻瘟病菌和蚜虫的功能,Yamaura等[28]发现基因和()的拟南芥双突变体表现增强的稻瘟病菌抗性。Lei等[29]发现的过表达拟南芥植株具有显著增高的吲哚硫甙含量和更强的蚜虫抗性。Wang等[30]发现大豆中光周期调控蛋白、通过地上到地下部的长距离运输,并且在根系中被根瘤菌共生信号通路关键调控因子CCaMK磷酸化修饰,促进和互作从而激活根瘤起始关键基因,调控大豆根瘤形成。本研究发现玉米具有调控花期抗旱性的作用,其减小干旱下散粉-吐丝间隔期和提高籽粒产量的功能具有育种利用的潜力。而作为玉米成花素基因,是通过花期调控途径或是其他的通路影响玉米的花期抗旱性,其分子机理还需要进一步地研究分析。
4 结论
玉米ZCN基因家族成员的在玉米V12期表达量最高,且在拟南芥成熟叶片边缘表达量较高,解析了自然群体中的等位变异和基因表达量变异,正调控玉米花期抗旱性,其优异单倍型的玉米自交系具有显著缩短的散粉-吐丝间隔,其过表达转基因玉米具有显著增加的单株籽粒数和单株产量。
[1] 戴景瑞, 鄂立柱. 我国玉米育种科技创新问题的几点思考. 玉米科学, 2010, 18(1): 1-5.
DAI J R, E L Z. Scientific and technological innovation of maize breeding in China. Journal of Maize Sciences, 2010, 18(1): 1-5. (in Chinese)
[2] LU Y L, ZHANG S H, SHAH T, XIE C X, HAO Z F, LI X H, FARKHARI M, RIBAUT J M, CAO M J, RONG T Z, XU Y B. Joint linkage-linkage disequilibrium mapping is a powerful approach to detecting quantitative trait loci underlying drought tolerance in maize. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(45): 19585-19590.
[3] KARDAILSKY I, SHUKLA V K, AHN J H, DAGENAIS N, CHRISTENSEN S K, NGUYEN J T, CHORY J, HARRISON M J, WEIGEL D. Activation tagging of the floral inducer. Science, 1999, 286(5446): 1962-1965.
[4] KOBAYASHI Y, KAYA H, GOTO K, IWABUCHI M, ARAKI T. A pair of related genes with antagonistic roles in mediating flowering signals. Science, 1999, 286(5446): 1960-1962.
[5] MORAES T S, DORNELAS M C, MARTINELLI A P./: calibrating plant architecture. Frontiers in Plant Science, 2019, 10: 97.
[6] WICKLAND D P, HANZAWA Y. The/gene family: functional evolution and molecular mechanisms. Molecular Plant, 2015, 8(7): 983-997.
[7] JAEGER K E, WIGGE P A. FT protein acts as a long-range signal in.Current Biology, 2007, 17(12): 1050-1054.
[8] TAMAKI S, MATSUO S, WONG H L, YOKOI S, SHIMAMOTO K. Hd3a protein is a mobile flowering signal in rice. Science, 2007, 316(5827): 1033-1036.
[9] TAOKA K, OHKI I, TSUJI H, FURUITA K, HAYASHI K, YANASE T, YAMAGUCHI M, NAKASHIMA C, PURWESTRI Y A, TAMAKI S, OGAKI Y, SHIMADA C, NAKAGAWA A, KOJIMA C, SHIMAMOTO K. 14-3-3 proteins act as intracellular receptors for rice Hd3a florigen. Nature, 2011, 476(7360): 332-335.
[10] DANILEVSKAYA O N, MENG X, HOU Z L, ANANIEV E V, SIMMONS C R. A genomic and expression compendium of the expandedgene family from maize.Plant Physiology, 2008, 146(1): 250-264.
[11] MENG X, MUSZYNSKI M G, DANILEVSKAYA O N. The-likegene functions as a floral activator and is involved in photoperiod sensitivity in maize. The Plant Cell, 2011, 23(3): 942-960.
[12] LAZAKIS C M, CONEVA V, COLASANTI J.encodes a potential orthologue ofFT florigen that integrates both endogenous and photoperiod flowering signals in maize.Journal of Experimental Botany, 2011, 62(14): 4833-4842.
[13] GUO L, WANG X H, ZHAO M, HUANG C, LI C, LI D, YANG C J, YORK A M, XUE W, XU G H, LIANG Y, CHEN Q, DOEBLEY J F, TIAN F. Stepwise-regulatory changes incontribute to maize flowering-time adaptation. Current Biology, 2018, 28(18): 3005- 3015.e4.
[14] MASCHERETTI I, TURNER K, BRIVIO R S, HAND A, COLASANTI J, ROSSI V. Florigen-encoding genes of day-neutral and photoperiod-sensitive maize are regulated by different chromatin modifications at the floral transition. Plant Physiology, 2015, 168(4): 1351-1363.
[15] CHEN C J, CHEN H, ZHANG Y, THOMAS H R, FRANK M H, HE Y H, XIA R. TBtools: an integrative toolkit developed for interactive analyses of big biological data. Molecular Plant, 2020, 13(8): 1194-1202.
[16] WANG X L, WANG H W, LIU S X, FERJANI A, LI J S, YAN J B, YANG X H, QIN F. Genetic variation incontributes to drought tolerance in maize seedlings. Nature Genetics, 2016, 48(10): 1233-1241.
[17] TIAN T A, WANG S H, YANG S P, YANG Z R, LIU S X, WANG Y J, GAO H J, ZHANG S S, YANG X H, JIANG C F, QIN F. Genome assembly and genetic dissection of a prominent drought-resistant maize germplasm. Nature Genetics, 2023, 55(3): 496-506.
[18] XIANG Y L, SUN X P, GAO S, QIN F, DAI M Q. Deletion of an endoplasmic reticulum stress response element in agene facilitates drought tolerance of maize seedlings. Molecular Plant, 2017, 10(3): 456-469.
[19] MAO H D, WANG H W, LIU S X, LI Z, YANG X H, YAN J B, LI J S, TRAN L S P, QIN F. A transposable element in agene is associated with drought tolerance in maize seedlings. Nature Communications, 2015, 6: 8326.
[20] GUO M, RUPE M A, WEI J, WINKLER C, GONCALVES- BUTRUILLE M, WEERS B P, CERWICK S F, DIETER J A, DUNCAN K E, HOWARD R J, HOU Z L, LOFFLER C M, COOPER M, SIMMONS C R. Maize() transgenic alleles increase hybrid maize yield. Journal of Experimental Botany, 2014, 65(1): 249-260.
[21] SHI J R, GAO H R, WANG H Y, LAFITTE H R, ARCHIBALD R L, YANG M Z, HAKIMI S M, MO H, HABBEN J E.variants generated by CRISPR-Cas9 improve maize grain yield under field drought stress conditions. Plant Biotechnology Journal, 2017, 15(2): 207-216.
[22] SHI J R, HABBEN J E, ARCHIBALD R L, DRUMMOND B J, CHAMBERLIN M A, WILLIAMS R W, LAFITTE H R, WEERS B P. Overexpression ofgenes modifies plant sensitivity to ethylene, leading to improved drought tolerance in bothand maize. Plant Physiology, 2015, 169(1): 266-282.
[23] XIANG Y, SUN X J, BIAN X L, WEI T H, HAN T, YAN J W, ZHANG A Y. The transcription factorreduces stomatal density and improves drought tolerance in maize. Journal of Experimental Botany,2021, 72(4): 1399-1410.
[24] LIU B X, ZHANG B, YANG Z R, LIU Y, YANG S P, SHI Y L, JIANG C F, QIN F. Manipulatingexpression ameliorates the drought-induced prolonged anthesis and silking interval in maize. The Plant Cell, 2021, 33(6): 2058-2071.
[25] WEI H A, WANG X L, HE Y Q, XU H, WANG L. Clock component OsPRR73 positively regulates rice salt tolerance by modulating-mediated sodium homeostasis. The EMBO Journal, 2021, 40: e105086.
[26] FORD B, DENG W W, CLAUSEN J, OLIVER S, BODEN S, HEMMING M, TREVASKIS B. Barley () circadian clock genes can respond rapidly to temperature in an-dependent manner. Journal of Experimental Botany, 2016, 67(18): 5517-5528.
[27] WANG C, YANG Q, WANG W X, LI Y P, GUO Y L, ZHANG D F, MA X N, SONG W, ZHAO J R, XU M L. A transposon-directed epigenetic change inunderlies quantitative resistance tostalk rot in maize. The New Phytologist, 2017, 215(4): 1503-1515.
[28] YAMAURA S, YAMAUCHI Y, MAKIHARA M, YAMASHINO T, ISHIKAWA A. CCA1 and LHY contribute to nonhost resistance to(syn.) in. Bioscience Biotechnology and Biochemistry, 2020, 84: 76-84.
[29] LEI J X, JAYAPRAKASHA G K, SINGH J, UCKOO R, BORREGO E J, FINLAYSON S, KOLOMIETS M, PATIL B S, BRAAM J, ZHU-SALZMAN K. CIRCADIAN CLOCK-ASSOCIATED1 controls resistance to aphids by altering indole glucosinolate production. Plant Physiology, 2019, 181(3): 1344-1359.
[30] WANG T, GUO J, PENG Y, LYU X, LIU B, SUN S, WANG X. Light-induced mobile factors from shoots regulate rhizobium- triggered soybean root nodulation. Science, 2021, 374(6563): 65-71.
Function of MaizeFlowering Stage
LI Yan1, TAO KeYu2, HU Yue3, LI YongXiang3, ZHANG DengFeng3, LI ChunHui3, HE GuanHua3, SONG YanChun3, SHI YunSu3, LI Yu3, WANG TianYu3, ZOU HuaWen1, LIU XuYang3
1College of Agriculture, Yangtze University, Jingzhou 434000, Hubei;2College of Agriculture Resources & Environment, Heilongjiang University, Harbin 150080;3Institute of Crop Sciences, Chinese Academy of Agricultural Sciences, Beijing 100081
【Objective】The main producing areas of maize is mostly located on the arid or semi-arid region that relying on the rainfed farming in China. The maize production losses caused by drought is a great threaten to food security. As a cross-pollinating crop, maize is mostly sensitive to water stress during flowering time. Drought at flowering stage will lead to asynchronous development between the male and female flower and cause massive grain yield loss. Thus, mining drought resistance related genes at flowering stage is important for maize drought resistance improvement and breeding. 【Method】In the present study, the phylogenic tree of 24 ZCN genes in maize genome, which is homologs ofgene, was build. The gene expression patterns ofwere analysis using qRT-PCR andGFP fluorescence imaging. A maize natural population consisting of 118 diverse inbred lines were planted in three environments, Beijing in 2021 and 2022 and Urumqi in 2022, to identify the flowering time related traits under different water treatments. The genomic variants aroundwere detected by PCR and Sanger sequencing. The candidate gene association analysis was performed based on mixed linear model and the significant associated variants with drought induced anthesis-silking interval was obtained. The gene expression level ofexpression were compared between different haplotypes of significant associated variant. The:overexpression transgenic maize were obtained, and the phenotypic performance was identified under different water treatments. 【Result】The 24 ZCN genes in maize genome included 15 FT like genes, 6 TFL1 like genes and 3 MFT like genes. The protein sequence of ZCN genes varied from 111 nn to 193 nn. The ZCN7 showed close relationship with ZCN8 and the protein sequence identity was 83.3% between the two genes.showed highest gene expression in the leaf blade at V12 stage. And the:vector was transformed toand the GFP showed enriched signal at the blade edge of mature leaf. The candidate gene association analysis revealed a SNP variant at 1001 bp upstream ofstart codon had highest association signal with drought induced anthesis-silking interval under drought. The A/A and G/G haplotypes of SNP-1001 included 78 and 27 inbred lines, respectively. The anthesis-silking interval of A/A haplotype lines were significantly lower than G/G lines. And thegene expression of A/A haplotype lines were significantly higher than G/G lines. In addition, theoverexpression transgenic lines showed significantly decreased anthesis-silking interval than wild type lines. Under drought, the anthesis-silking intervals of OE1 and OE2 were 2.3 and 2.6 days shorter than wild type lines. And the grain yield per plant and kernel number per plant of transgenic lines were significantly higher than wild type lines under drought, while the hundred kernel weight, kernel length and kernel width showed no significant difference. 【Conclusion】The maizeplayed positive role in drought resistance and its overexpression improved grain yield by reducing anthesis-silking interval under drought.
maize (L.); drought resistance; flowering time; ZCN

10.3864/j.issn.0578-1752.2023.16.001
2023-03-09;
2023-05-18
国家重点研发项目(2021YFD1200705)
李燕,E-mail:2863607340@qq.com。陶柯宇,E-mail:15704561709@163.com。李燕和陶柯宇为同等贡献作者。通信作者邹华文,E-mail:zouhuawen@yangtzeu.edu.cn。通信作者刘旭洋,E-mail:liuxuyang@caas.cn
(责任编辑 李莉)
