脯氨酰胺衍生的新型噻吩-叔胺手性N-氧化物的合成
2023-09-22田方丽王宇恒刘雄利邓国栋
田方丽, 王宇恒, 张 磊, 刘雄利, 邓国栋
(贵州大学 西南药食两用资源开发利用技术国家地方联合工程研究中心,贵州 贵阳 550025)
叔胺与过酸的反应很容易产生相应的N-氧化物。然而,叔胺氧化物可能会因在氮上生成了新的立体中心使其性质受到影响[1-4]。因此,合理设计手性叔胺氧化物配体是一个有趣而富有挑战性的课题。FENG课题组[5-7]在这一领域取得了重大突破,成功建立了叔胺衍生的手性N-二氧化物配体库。并且,FENG配体在各种长期具有挑战性的不对称催化反应中表现出具有较强的催化效率和立体诱导能力[5-7]。因此,在不对称催化中,开发经济可行的合成路线来制备更多结构多样性的手性N-氧化物配体具有重要的研究意义。
参考本课题组前期合成手性吡啶-氮氧配体的合成方法[8],本文以手性源L-脯氨酰胺或羟脯氨酰胺为起始原料,与噻吩-2-甲醛(2)先发生缩合环化反应,生成缩合的中间体3,然后中间体3中的氮原子在氧化剂m-CPBA(间氯过氧苯甲酸)的作用下发生N-氧化反应,室温下合成了10个未见文献报道的新型脯氨酰胺衍生的噻吩-叔胺手性N-氧化物(4a~4j),总产率41%~57%,dr值为18/1~>20/1,其结构经1H NMR,13C NMR和HR-MS(ESI-TOF)表征。该类化合物手性源L-脯氨酰胺或羟脯氨酰胺(1)为起始原料合成了手性N-氧化物,可为不对称金属催化提供新配体筛选[9-16]和生物活性测试提供新化合物筛选[17-18]。
1 实验部分
1.1 仪器与试剂
WRS-1B型数字熔点仪;Bruker-400 MHz型核磁共振仪(CD3OD为溶剂,TMS为内标);MicroTMQ-TOF型高分辨质谱仪。
所用试剂均为分析纯。
1.2 4a~4j的合成(以4a为例)
参考本课题前期合成手性吡啶-氮氧配体的方法[8],在反应管中将原料脯氨酰胺1a(1.1 eq)与噻吩-2-甲醛2a(1.0 eq, 0.3 mmol)溶于3.0 mL无水乙醇中,回流10 h,反应后处理液通过柱层析纯化,得到中间体3。将中间体3(100 mg, 1.0 eq)与m-CPBA(1.1 eq)溶于2.0 mL三氯甲烷中,在室温下反应20 min,反应后处理液通过柱层析纯化,得到N-氧化物4a:淡黄色固体,m.p.180.3~180.8 ℃, 产率57%,dr>20 ∶1;1H NMRδ: 2.09~2.22(m, 2H), 2.35~2.51(m, 2H), 3.51~3.54(m, 1H), 3.78~3.85(m, 1H), 4.26~4.29(m, 1H), 6.96~7.00(m, 2H), 7.17~7.21(m, 1H), 7.27(d,J=2.8 Hz, 1H), 7.33~7.37(m, 2H), 7.50(d,J=7.6 Hz, 2H), 7.62~7.64(m, 1H);13C NMRδ: 23.2, 24.8, 70.0, 77.6, 84.2, 123.6, 126.3, 126.8, 129.3, 130.8, 131.4, 134.5, 136.3, 168.7; HR-MS(ESI-TOF)m/z: Calcd. for C16H16N2NaO2S{[M+Na]+}323.0825, found 323.0827。
用类似的方法合成4b~4j。
4b: 淡黄色固体,m.p.172.1~172.9 ℃,产率53%,dr>20 ∶1;1H NMRδ: 2.25~2.32(m, 1H), 2.40~2.47(m, 1H), 2.51~2.64(m, 2H), 3.75~3.79(m, 1H), 3.95~4.02(m, 1H), 4.47~4.50(m, 1H), 6.94(s, 1H), 7.06~7.11(m, 3H), 7.38~7.40(m, 1H), 7.48~7.52(m, 2H), 7.63~7.65(m, 1H);13C NMRδ: 22.5, 24.1, 69.1, 76.2, 84.9, 115.5(d,JCF=23.2 Hz), 125.5(d,JCF=8.3 Hz), 130.2, 131.4(d,JCF=3.1 Hz), 132.3, 132.6, 161.0(d,JCF=245.3 Hz), 167.4; HR-MS(ESI-TOF)m/z: Calcd. for C16H15FN2NaO2S{[M+Na]+}341.0730, found 341.0734。
4c: 淡黄色固体,m.p.180.0~180.9 ℃,产率52%,dr>20∶1;1H NMRδ: 2.22~2.30(m, 1H), 2.38~2.46(m, 1H), 2.49~2.63(m, 2H), 3.74~3.80(m, 1H), 3.93~4.01(m, 1H), 4.46~4.49(m, 1H), 6.98(s, 1H), 7.06~7.08(m, 1H), 7.31~7.35(m, 2H), 7.39~7.40(m, 1H), 7.48~7.52(m, 2H), 7.62~7.64(m, 1H);13C NMRδ: 22.5, 24.2, 69.2, 76.1, 84.5, 124.3, 126.7, 128.9, 130.3, 132.0, 132.2, 132.6, 134.2, 167.3; HR-MS(ESI-TOF)m/z: Calcd. for C16H15ClN2NaO2S{[M+Na]+}357.0435, found 357.0436。
4d: 淡黄色固体,m.p.172.5~173.1 ℃,产率51%,dr=18∶1;1H NMRδ: 2.24~2.32(m, 1H), 2.40~2.48(m, 1H), 2.50~2.64(m, 2H), 3.74~3.79(m, 1H), 3.94~4.01(m, 1H), 4.45~4.49(m, 1H), 6.98(s, 1H), 7.07~7.09(m, 1H), 7.39~7.51(m, 5H), 7.64~7.65(m, 1H);13C NMRδ: 22.5, 24.1, 69.1, 76.2, 84.4, 119.7, 124.5, 126.7, 130.2, 131.9, 132.2, 132.5, 134.7, 167.3; HR-MS(ESI-TOF)m/z: Calcd. for C16H15BrN2NaO2S{[M+Na]+}400.9930, found 400.9933。
4e: 淡黄色固体,m.p.173.6~173.9 ℃,产率54%,dr>20 ∶1;1H NMRδ: 2.20~2.26(m, 4H), 2.39~2.44(m, 1H), 2.50~2.61(m, 2H), 3.74~3.79(m, 1H), 3.92~3.99(m, 1H), 4.44~4.47(m, 1H), 6.91(s, 1H), 7.03~7.06(m, 1H), 7.14(d,J=8.4 Hz, 2H), 7.33~7.37(m, 3H), 7.60~7.62(m, 1H);13C NMRδ: 19.6, 22.5, 24.1, 69.3, 76.1, 84.9, 123.0, 126.6, 129.3, 129.9, 132.0, 132.8, 133.1, 137.0, 167.3; HR-MS(ESI-TOF)m/z: Calcd. for C17H18N2NaO2S{[M+Na]+}337.0981, found 337.0980。
4f: 淡黄色固体,m.p.172.1~172.5 ℃,产率51%,dr>20∶1;1H NMRδ: 1.19(s, 3H), 1.20(s, 3H), 2.26~2.31(m, 1H), 2.41~2.49(m, 1H), 2.53~2.63(m, 2H), 2.83~2.90(m, 1H), 3.77~3.81(m, 1H), 3.95~4.02(m, 1H), 4.45~4.48(m, 1H), 6.91(s, 1H), 7.06~7.08(m, 1H), 7.21~7.24(m, 2H), 7.37~7.41(m, 3H), 7.63~7.64(m, 1H);13C NMRδ: 22.4, 22.8, 24.0, 33.6, 69.3, 76.0, 84.9, 123.0, 126.6, 126.7, 129.8, 132.0, 133.0, 133.2, 148.0, 167.3; HR-MS(ESI-TOF)m/z: Calcd. for C19H22N2NaO2S{[M+Na]+}365.1294, found 365.1294。
4g: 淡黄色固体,m.p.176.1~176.8 ℃,产率52%,dr>20 ∶1;1H NMRδ: 2.58~2.64(m, 1H), 2.74~2.81(m, 1H), 3.69(d,J=12.8 Hz, 1H), 4.21~4.26(m, 1H), 4.65~4.69(m, 1H), 4.73~4.76(m, 1H), 6.97(s, 1H), 7.02~7.05(m, 1H), 7.19~7.22(m, 1H), 7.30~7.33(m, 2H), 7.39~7.43(m, 3H), 7.61~7.62(m, 1H);13C NMRδ: 35.2, 69.9, 75.0, 76.6, 85.6, 123.6, 126.4, 126.9, 128.8,
130.8, 131.3, 132.7, 135.2, 166.9; HR-MS(ESI-TOF)m/z: Calcd. for C16H16N2NaO3S{[M+Na]+}339.0774, found 339.0773。4h: 淡黄色固体,m.p.180.1~180.8 ℃,产率52%,dr>20 ∶1;1H NMRδ: 2.59~2.65(m, 1H), 2.74~2.81(m, 1H), 3.66(d,J=12.8 Hz, 1H), 4.23~4.28(m, 1H), 4.68~4.71(m, 1H), 4.74~4.78(m, 1H), 6.95(s, 1H), 7.04~7.08(m, 3H), 7.40~7.43(m, 3H), 7.63~7.65(m, 1H);13C NMRδ: 35.1, 69.9, 74.9, 76.8, 85.9, 115.4(d,JCF=23.1 Hz), 126.2(d,JCF=7.4 Hz), 126.3, 130.7, 131.2, 133.0, 161.7(d,JCF=244.3 Hz), 167.0; HR-MS(ESI-TOF)m/z: Calcd. for C16H15FN2NaO3S{[M+Na]+}357.0680, found 357.0684。
4i: 淡黄色固体,m.p.170.9~171.2 ℃,产率53%,dr>20 ∶1;1H NMRδ: 1.15(s, 3H), 1.17(s, 3H), 2.57~2.63(m, 1H), 2.74~2.85(m, 2H), 3.72(d,J=12.8 Hz, 1H), 4.19~4.24(m, 1H), 4.63~4.66(m, 1H), 4.71~4.75(m, 1H), 6.93(s, 1H), 7.02~7.04(m, 1H), 7.18(d,J=8.4 Hz, 2H), 7.33(d,J=8.4 Hz, 2H), 7.39(d,J=3.6 Hz, 1H), 7.60(d,J=5.2 Hz, 1H);13C NMRδ: 22.8, 22.9, 33.5, 35.2, 70.0, 75.1, 76.4, 85.7, 123.6, 126.4, 126.7, 130.6, 131.6, 132.6, 132.8, 148.0, 166.9; HR-MS(ESI-TOF)m/z: Calcd. for C19H22N2NaO3S{[M+Na]+}381.1243, found 381.1241。
4j: 淡黄色固体,m.p.182.3~182.9 ℃,产率41%,dr>20∶1;1H NMRδ: 1.07~1.11(m, 6H), 1.14(d,J=6.8 Hz, 3H), 1.35(d,J=6.8 Hz, 3H), 2.55~2.70(m, 2H), 2.92~2.99(m, 1H), 3.45(d,J=15.2 Hz, 1H), 3.50~3.57(m, 1H), 4.26~4.31(m, 1H), 4.75~4.77(m, 1H), 4.87~4.91(m, 1H), 6.85~6.87(m, 1H), 6.89(s, 1H), 7.06~7.08(m, 1H), 7.12~7.14(m, 1H), 7.17~7.19(m, 1H), 7.23(d,J=7.6 Hz, 1H), 7.53~7.54(m, 1H);13C NMRδ: 22.0, 22.5, 24.2, 24.8, 27.8, 29.2, 35.1, 70.6, 74.5, 79.9, 87.5, 123.4, 124.2, 124.6, 125.8, 128.0, 129.7, 132.5, 133.7, 146.8, 149.6, 168.4; HR-MS(ESI-TOF)m/z: Calcd. for C22H28N2NaO3S{[M+Na]+}423.1713, found 423.1717。
2 结果与讨论
2.1 氧化剂的筛选和底物扩展分析
本文在对中间体3a进行N-氧化反应中发现,如果使用氧化剂H2O2,将生成难以处理的混合物。采用m-CPBA(间氯过氧苯甲酸)做氧化剂,N-氧化反应效果最好,反应20 min时,产率能达到81%,dr值>20/1(表1)。对底物通过扩展可以发现(图1),所有底物脯氨酰胺或羟脯氨酰胺(1)和噻吩-2-甲醛(2)在该合成方法中都具有较好的适应性,以良好的总产率和非对映选择性得到相应的N-氧化物4a~4j,总产率41%~57%,dr值18/1~>20/1。

表1 反应条件的优化
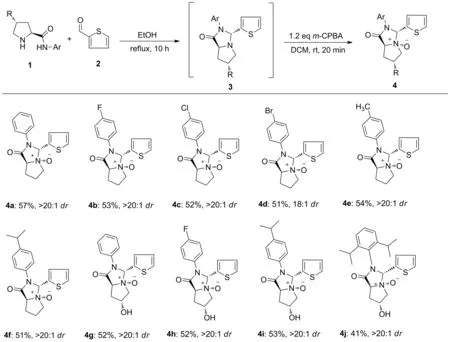
图1 脯氨酰胺衍生的噻吩-叔胺手性N-氧化物的合成路线
2.2 反应机理分析
该反应的可能机理如图2所示。在乙醇回流的条件下,先发生缩合环化反应,生成中间体3,然后中间体3中的氮原子在氧化剂m-CPBA(间氯过氧苯甲酸)的作用下发生N-氧化反应,得目标产物4。
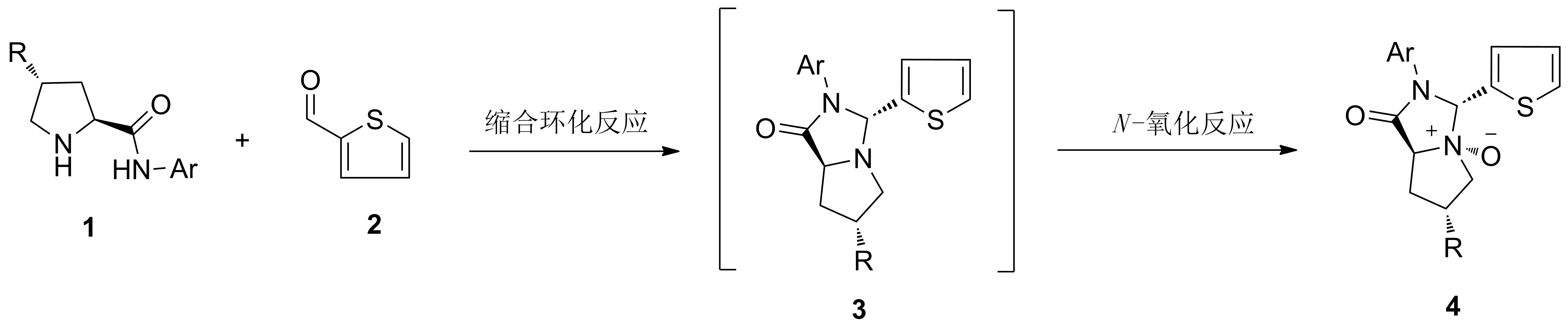
图2 可能的反应机理
本文以手性源L-脯氨酰胺或羟脯氨酰胺(1)为起始原料,与各种取代的噻吩-2-甲醛(2)先发生缩合环化反应,生成缩合的中间体3,然后中间体3中的氮原子在氧化剂m-CPBA(间氯过氧苯甲酸)的作用下发生N-氧化反应,室温下合成了10个新型脯氨酰胺衍生的噻吩-叔胺手性N-氧化物(4a~4j)。该类化合物今后可以为不对称路易斯酸催化提供新配体筛选,也可以为生物活性测试提供新化合物筛选。
