基于近红外光谱技术的脑血氧监测装置研究
2023-09-15魏梦林严荣国梅竹松
魏梦林,严荣国,梅竹松,徐 涛
(1.上海理工大学 健康科学与工程学院,上海 200093;2.海军军医大学附属第二医院(上海长征医院),上海 200003)
0 引言
大脑是人体最重要的器官,质量为总体重的2%,耗氧量占全身耗氧量的20%,婴幼儿大脑耗氧量甚至可达50%左右[1],因此人脑对缺血缺氧尤为敏感[2]。在临床治疗脑损伤患者过程中,如果缺乏脑血氧监护,一旦大脑较长时间处于缺血缺氧状态会造成不可逆的二次脑损伤且致死比例高达90%[3-4]。因此,大脑供血和供氧情况是反映脑功能正常与否的重要标准[5],实时准确地监测脑组织的血氧参数对临床治疗和术后康复非常重要,但目前国内临床上使用的脑血氧监测方法大多为有创或间接监测方式[6],无法较好地满足临床脑血氧监测需求。
近红外光谱技术(Near Infrared Spectrum,NIRS)监测局部脑组织血氧参数,具有无创、实时且连续的特点[7]。Jöbsis 首先使用NIRS 测量动物头部血氧,指出NIRS 可监测脑血流与氧合,开辟了光学技术应用于无损测量组织血氧变化的先河[8]。日本滨松光子学株式会社与英国伦敦大学合作于1987 年制作出样机,并发布了脑部组织血氧饱和度无创监测系统,但仅能监测受试者的血红蛋白相对变化量,具有一定局限性[9]。1994 年,美国Somalletics 公司推出型号为INVOS3100 脑血氧饱和度仪[10],将光源与两个探测器的距离调整为3 mm 和4 cm,通过经验计算血氧饱和度,为后续近红外探头的设计提供了更准确的标准。1995 年,日本日立公司推出ETG-4000 系列FNIRS 检测系统[11]。2003 年,英国伦敦大学Delpy 团队开发出一套针对前额叶皮层的血氧检测探头[11]。
国内利用NIRS 技术监测脑血氧的研究相较于国外较晚[12],其中最为著名的是清华大学丁海曙教授等一直致力于研究、推广NIRS 技术监测人体组织血氧参数,研发了TASH-100 近红外组织血氧参数检测仪。南开大学蔡克家、廖永国等研制了双波长NIRS 无创脑血氧饱和度监测系统。2007 年,华中科技大学生物医学光子学教育部重点实验室为解决多通道探测器件分立原理和点对点多波长集成局部探测两种检测装置的局限性,开发了一种新型多通道便携式NIRS 脑功能检测系统[13]。
综上所述,NIRS 技术在颅脑损伤监测中颇受青睐,国内外利用NIRS 技术监测颅脑损伤的研究从未中断,更多团队、资源不断投入该领域。目前,国内用于临床的脑血氧监测设备大多进口,国产近红外采集设备因体积大、易受个体差异影响,仅作为辅助监测设备使用。
为此,本文基于近红外光谱技术设计了一款双光源双探测器的便携式脑血氧监测装置。该装置拥有自主设计的脑血氧探头、模拟滤波电路、光源驱动电路和软件系统。实验结果表明,该装置可实时监测局部脑组织血氧的变化情况。
1 脑组织血氧参数检测原理
近红外光(600~1 000 nm)介于红光与红外光之间,该波长范围的光易穿透人体组织。脑组织中,例如氧合血红蛋白(HbO2)、还原血红蛋白(HbR)等发色团对该波段的光吸收率最大,其他化合物如水分子的吸收率最小。同时,氧合血红蛋白、还原血红蛋白随光的波长增加,呈现出相反吸收率[14],如图1所示。

Fig.1 Absorption spectra of HbO2 and HbR in the near-infrared region图1 HbO2和HbR在近红外段的吸收谱线
由图1 可见,本文使用了730 nm、850 nm 的光反映组织中血红蛋白和载氧情况。红外光经人体组织吸收及散射后,部分光会重新透出皮肤。出射光的衰减代表局部脑组织血氧饱和度(rSO2)与氧传递和氧消耗间的平衡信息,使近红外光谱技术对脑氧合的变化更为敏感[15]。
系统采用的散射式脑血氧饱和度定量计算方法以朗伯—比尔定理为理论基础。该定律认为透明介质吸收光子的比例与进入介质的光强度无关,在光子传输路径上,每个相同厚度的介质吸收的光子比例值相同,具体传播途径如图2所示。
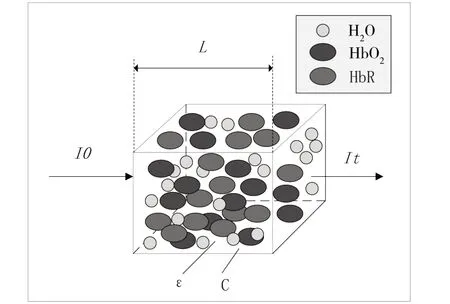
Fig.2 Lambert-Beer law图2 朗伯—比尔定律
图2 描述了光通过均一、无散射介质时入射光强与出射光强之间的关系,具体表达式如下:
式中,OD(optical density)为光衰减量,代表入射光强和出射光强比值的负对数;It代表出射光强,I0表示入射光强;C代表吸光物质的浓度,单位为mol·L-1;ε代表消光系数,单位为L·mol-1·cm-1;L代表介质厚度,单位为cm。
通过蒙特卡罗仿真分析可知[16-17],光子在脑组织中走过的实际路径较为复杂,在生物组织中的迁移规律大致为:光源在照射大脑时,一部分直接反射出去,另一部分被脑组织吸收,还有一部分经过大脑皮层、颅骨、脑组织的散射后又重新达到头皮表面被探测器检测到,如图3所示。
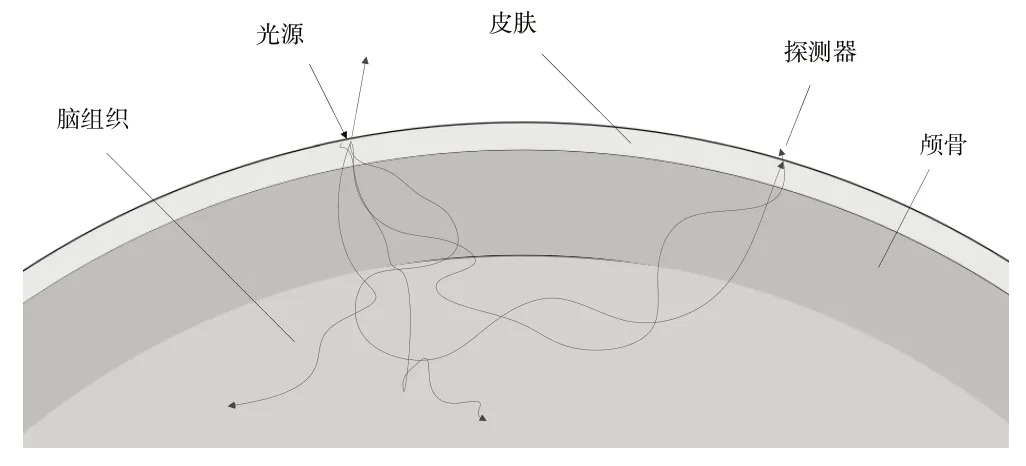
Fig.3 Migration pattern of photons in brain tissue图3 脑组织中光子的迁移规律
由图3 可见,散射效应会使光子在组织中经过的路径变长,使得更多光子被吸收,从而导致光强衰减增加,实际光路的长度远长于光源和探测器的实际距离,因此需要对光路长度L加以修正。此外,除了HbO2、HbR 会引起光强衰减外,黑色素、颅骨和脑脊液等物质也会吸收少量光子,因此需要对朗伯—比尔定律进行修正后使用。
式中,OD为光衰减量,C为吸光物质浓度,ε为消光系数,L为光源和探测器间的直线距离。相较于式(1),式(2)中DPF代表路径长度修正因子,为距离L的放大系数,DPF与L的积代表实际光程,G代表除HbO2、HbR 引起的光强衰减外其他因素造成光强衰减的总和。
由于根据式(2)求解吸光物质浓度C的绝对值较困难,但在脑损伤监测中血氧参数的相对变化值对颅脑损伤监测综合评价具有重要意义,因此本文转为求解C的相对变化值。由于颅骨、脑脊液等物质的吸收量相对稳定,假设G在实验观测时间内不变,在两个时间点t0、t1分别根据式(2)列出方程并相减,即可消除G,再利用730 nm、850 nm 双波长公式获得OD的相对变化量ΔOD与两种血红蛋白相对浓度变化的关系。
总血红蛋白的相对变化量可由任意时刻的氧合血红蛋白和还原血红蛋白的相对变化量之和所得,光衰减量OD与检测距离L相关。当存在两个探测器且距离光源足够远时,可认为同一波长下G与检测距离基本无关。
系统将730 nm、850 nm 的两个光源和探测器放置在需要探测的脑部位,实际测量时还增加了光源和探测器的分离距离以增加穿透深度,但由于光程较长、被吸收的光子更多,探测器探测到的光子会更少,将导致整体信号质量下降。由文献[17]可知,获得高质量近红外光测量的范围的发射器分离距离为2.5~5.0 cm,因此将两个传感器放置在距离光源3 cm、4 cm处的位置进行接收,此时探测深度为1.5~2 cm左右[18-19],系统的光源和探测器模型如图4所示。
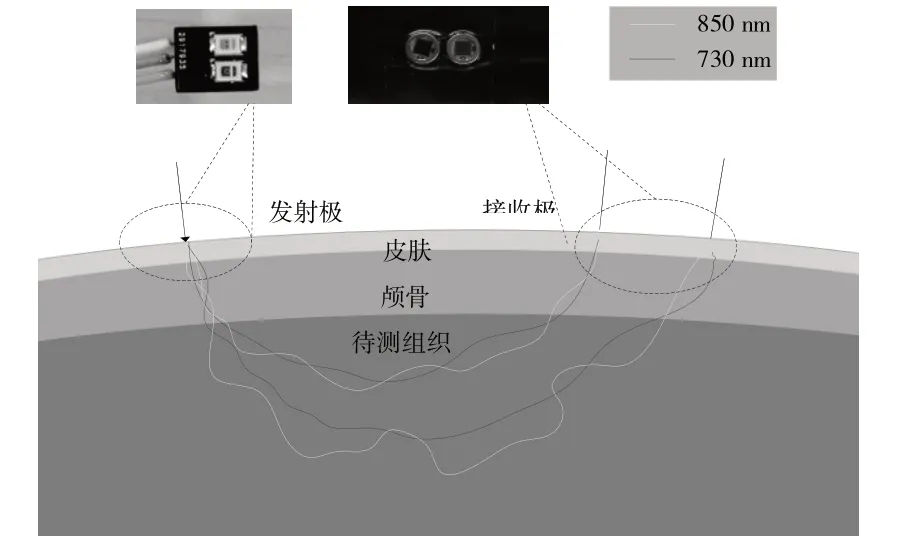
Fig.4 Dual light source and dual detector model图4 双光源和双探测器模型
结合修正版朗伯—比尔定律可得到局部脑组织血氧饱和度rSO2为:
式中,σOD为两接收极检测到的光衰减量之差,吸光系数ε、路径长度修正因子DPF可查表得到[20]。通过双波长和双探测器模型可计算局部脑组织血氧参数的变化[21]。
2 硬件系统设计
2.1 探头结构
2.1.1 光源
近红外监测血氧参数系统采用连续波法[22]。该方法通过测量近红外光照射进组织的初始光强与经过漫反射重新出现的光强,结合修正版朗伯—比尔定律分析计算组织内的氧饱和度情况,如图5所示。
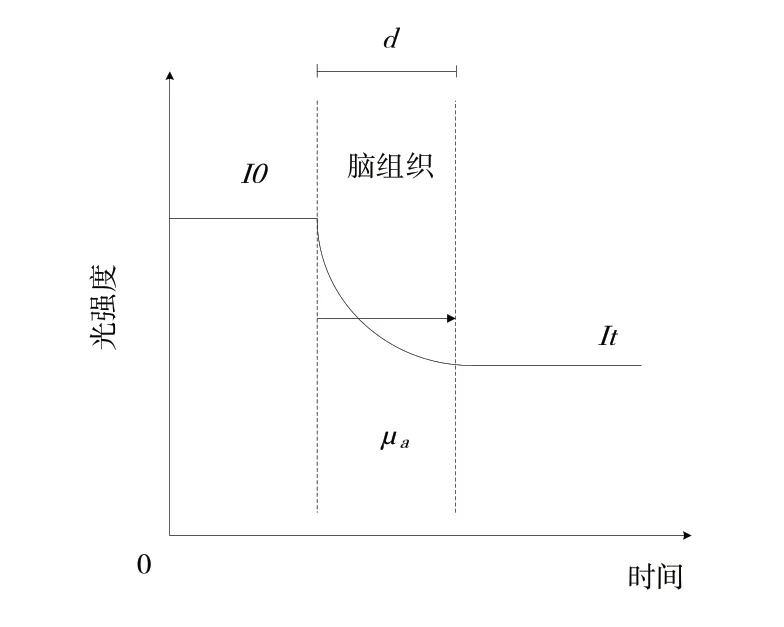
Fig.5 Continuous wave technology图5 连续波技术
由于近红外信号经大脑后会有7~9 个数量级的衰减[23],为此系统光源选择深圳荣诚微电子公司开发的封装为2835 的贴片发光二极管,该贴片发光二极管体积小、成本低,抗震和冲击性非常好。系统实际工作环境为工作电流50 mA,电压4.6 V,发光功率230 mW。据相关标准表明,平均功率为毫瓦级的光源符合实验安全标准,可应用到医疗仪器中[24]。
2.1.2 探测器
考虑到散射出脑组织后的光信号十分微弱,探测器需具备较强的灵敏度响应能力。综合考量下,系统选用日本滨松光电二极管s1223-01,该光电二极管受光面积为3.6 mm×3.6 mm,暗电流小,在730 nm、850 nm 均具有较高的灵敏度响应,光谱响应如图6所示。
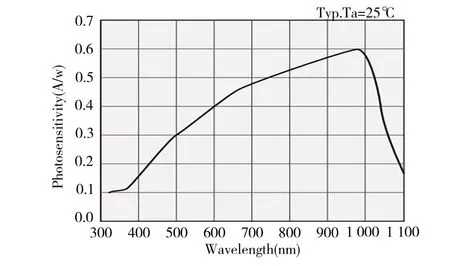
Fig.6 Spectral response图6 光谱响应
2.1.3 探头整体设计
探头在监测人脑时,表面需要与受测者的前额头部紧密贴合。由于探测器接收到的微弱光信号极易收到干扰,因此对光源和探测器周围使用黑色硅胶覆盖,如图7 所示,其中左侧部分为光源和传感器位置,右侧为探头实物。
2.2 光源驱动电路
本文系统光源驱动电路基于LT3085 稳压器所设计,其内部具有限流、限热的保护电路,可提供一个较宽的输出电压范围,再搭配其他元器件形成恒流源,可为LED 灯发光提供稳定电流,如图8所示。
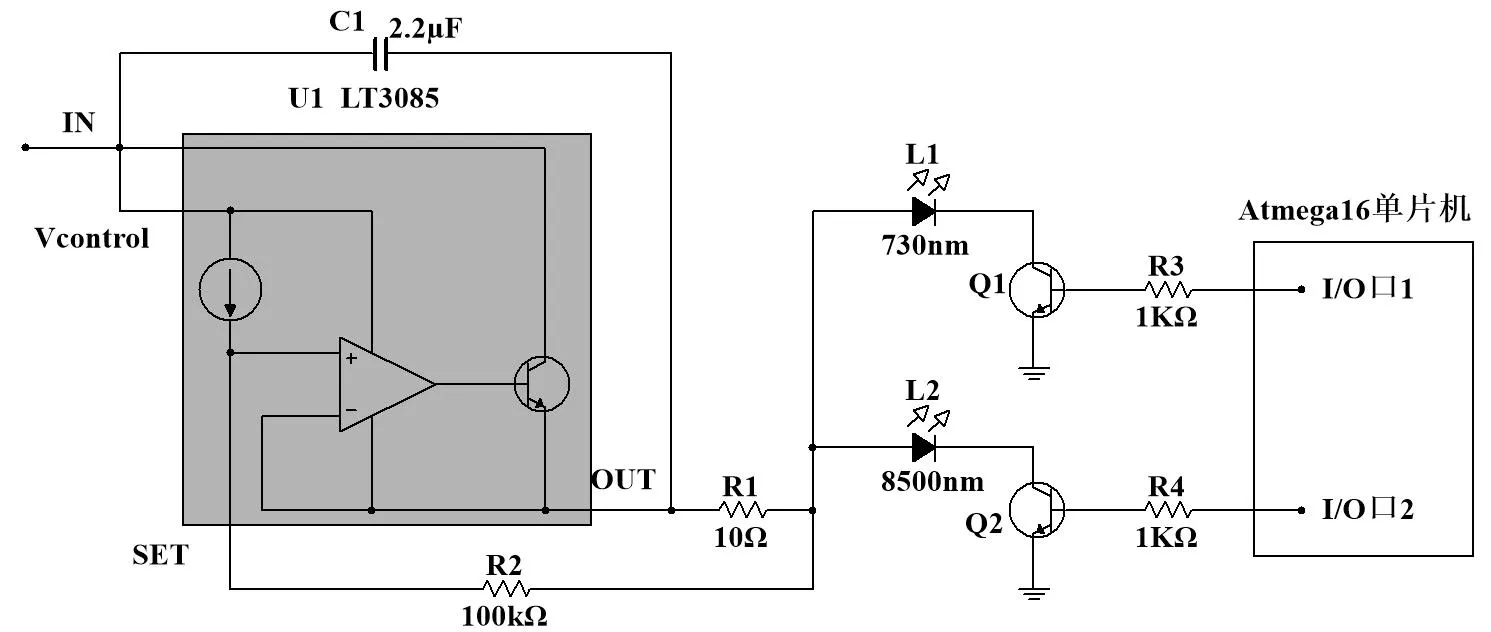
Fig.8 Driving circuit of LED light source图8 光源驱动电路
系统接入输入电压为5V,输出电压为4.5V,输出电流受控于电位器R1及LT3085 内置参考电压1V,输出端最终电流与电阻R1的关系为:
本文选用Atmega16 单片机,调用I/O 口输出高低电平对LED 灯进行交替发光,控制两个输出端口在给定时间发出+5 V 的高电平和0 V 的低电平,NPN 三极管的导通电压约为0.7 V,低电平不能导通三级管,高电平可导通。三极管集电结与发光二极管的负极相连,发射结接地,以达到给定时间控制光源交替发光的目的。
2.3 信号处理电路
为了最大限度保存脑血氧原始信号,探测器接受到的微弱信号需先进行前级放大再滤波,保证信号在Atemga16单片机AD 所能辨别的电平值内,最后通过电压抬升和可调式放大电路对信号进行放大,信号处理电路如图9所示。
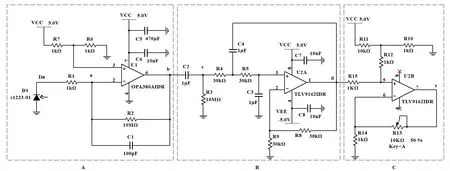
Fig.9 Signal processing circuit图9 信号处理电路
图9 中A 区为前级放大电路,由跨阻放大器构成,由于光电二极管输出的脑血氧信号十分微弱,信号值一般在nA 级别,因此运放选用TI 公司的精密高速跨组放大器OPA380AIDR 增强信号,该运放具有较小的失调电压和偏置电流,通过+5 V 单电源供电。
受人体生理噪声和光电二极管暗电流影响,光电二极管输出信号会出现在负半轴,因此需要在运放的同相输入端增加一个偏置电压以保留信号的完整性。该跨阻放大器的反馈电阻设置为10 MΩ,两端并联了一个100 pF 的反馈电容以提升信号质量,减少自激振荡,增加光电二极管应用的稳定性。
为了提升供电稳定性,在电源端、运放电源管脚端分别接入一个470 µF 的铝电解电容和一个10 nF 的陶瓷电容以滤波电源端的低频噪声和高频噪声,输出端b 点电压为:
图9 中B 区为滤波电路,由一个隔直电路与一个二阶有源低通滤波器构成。为了提升滤波电路稳定性,该级运放选用TI 公司的双通道通用滤波放大器TLV9162IDR,由+5 V 和-5 V 双电源供电。
同时,为消除环境光与其他非设定光源的影响,加入隔直电路滤除信号中的直流成分,设置隔直电容为1uF,电阻选用10 MΩ。此外,利用二阶有源低通滤波器过滤脑血氧信号中夹杂的许多高频噪声,滤波电阻为30 KΩ,滤波电阻为1 uF。其中,R4=R5=R8=R,C3=C4=C,因此该二阶有源低通滤波器的截止频率为:
滤波电路的通频带在0.016~5.3 Hz,在确保滤除高频杂波和工频干扰的情况下,可最大程度保留生理信号。
图9 中C 区为电压抬升同相可调式放大电路,为保证最后输出的信号属于AD 采样可接收的范围,在脑血氧信号中加入一个直流偏置信号,将其幅值全部保留在正半轴且最终输出端C 点的电压增益可通过调节R14与R13的比值进行调控。
3 软件系统结构
脑血氧信号经过模拟滤波后,由Atmega16单片机采样输出电压信号后进行AD 转换,整合730 nm 下近端信号、730 nm 下远端信号、850 nm 下近端信号和850 nm 下远端信号,通过串口转USB 传输给上位机,具体流程如图10所示。
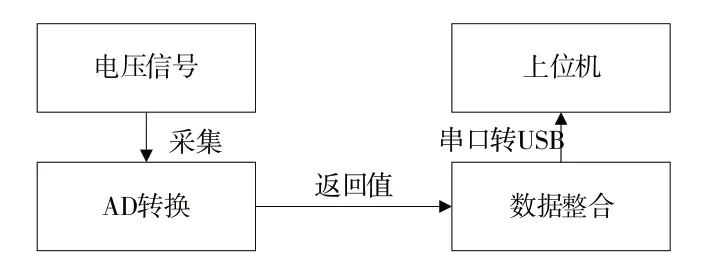
Fig.10 Data transmission process图10 数据传输流程
上位机对脑血氧信号接收后放入缓存数组,定时调用数据并筛分、计算数据,最终得到脑组织血氧饱和度值,在保存数据的同时动态更新脑血氧曲线,再构成一个完整的脑血氧波形,具体流程如图11所示。
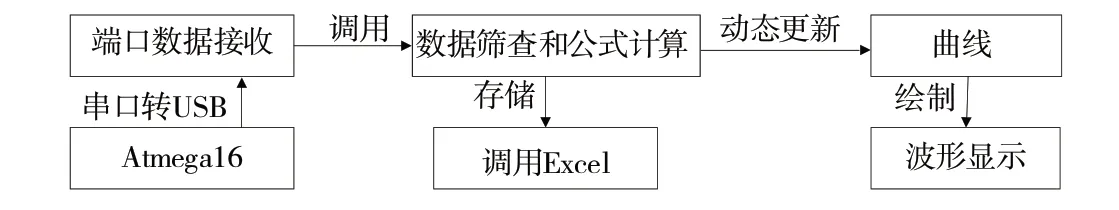
Fig.11 Upper computer workflow图11 上位机工作流程
系统的界面波形图如图12 所示,界面中左侧为波形曲线,右侧最上部是局部脑组织血氧饱和度的值,右侧中部是总血红蛋白的相对变化量,右侧下部是氧合血红蛋白和还原血红蛋白的相对变化量。
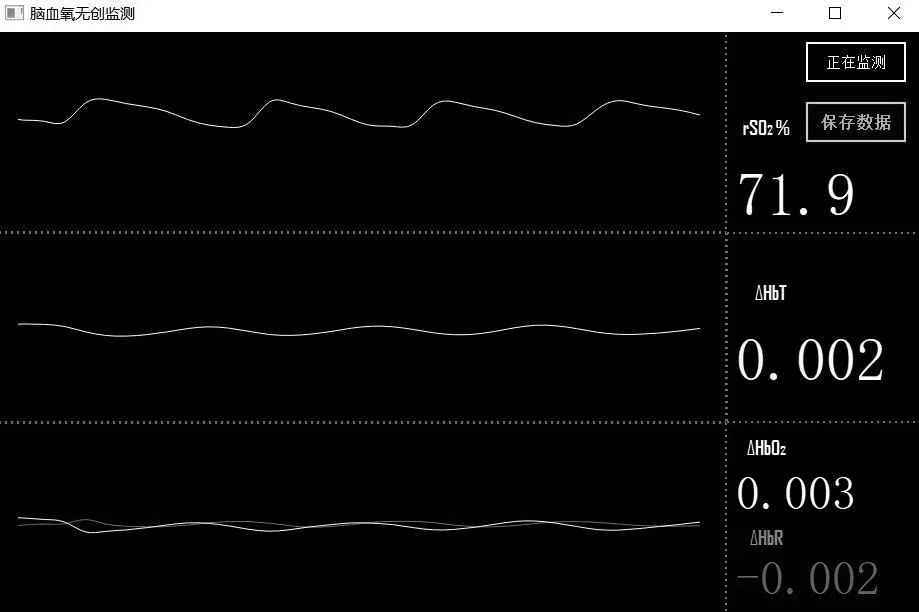
Fig.12 System QT interface图12 系统QT界面
4 实验验证
4.1 前臂阻断实验
为了验证装置有效性,设计前臂阻断实验,通过前臂阻断改变前臂组织中氧合血红蛋白和还原血红蛋白含量,从而改变前臂组织的血氧饱和度。由于脑组织血氧饱和度变化也是相同原理,因此前臂动脉阻断实验也是检验脑血氧计有效性的一种科学方法[12,22,25]。
在前臂阻断实验中,在上臂绑上袖带式血压计后将传感器紧贴于前臂里侧,用黑色袖带包裹传感器和前臂起到固定和遮光作用,然后将前臂平稳放在水平桌面上。当采集到的血氧值趋于平稳后迅速对袖带加压,保持一段时间后再迅速松开袖带,实验结果如图13所示。
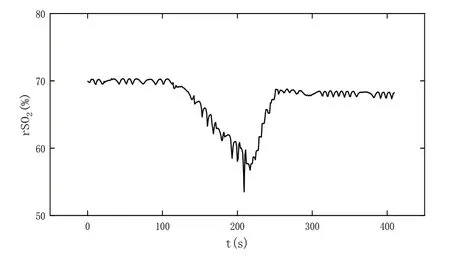
Fig.13 Forearm blocking experiment图13 前臂阻断实验
实验开始前120 s,受试者处于静息状态,此时前臂组织血氧饱和度无明显变化。在120 s 时迅速对血压计袖带加压,此后前臂处于阻断状态,无法再得到新鲜血液,随着组织新陈代谢,氧合血红蛋白含量将持续下降,还原血红蛋白含量不断上升,前臂组织血氧饱和度呈下降趋势。在230 s 时慢慢释放袖带压力,前臂供氧逐渐恢复,氧合血红蛋白的含量将持续下降,还原血红蛋白含量不断上升,前臂组织血氧饱和度又逐渐恢复至静息水平。实验结果与其他文献研究结果基本一致,证明了本文装置监测血氧的有效性。
4.2 不同体位脑血氧实测
为了探究本文装置对脑血氧监测的研究,分别对受试者进行静息坐姿和倒牵状态下的脑血氧实测。在静息坐姿下,要求受测者在静态坐姿下佩戴脑血氧探头,使探测器与光源在左(右)前额上部离眉骨上方2 cm 处。在倒牵状态下,要求受试者在平躺状态下,将头部移至与身体重心更低处,与地平面呈30°左右角度,用靠垫支撑头部,使受试者能处于较为放松的状态,一段时间后戴上脑血氧探头,在保持平稳后读取脑血氧值。
受试者处于倒牵体位时,身体中大多数容量血管处于心脏水平线以上,下肢血液转移到胸部和腹部,导致静脉回心血量增多,心脏每搏输出量增多,颈内动脉血流量增多,脑循环灌注压升高,脑部氧含量增多。此时脑血管的自身调节机制(Bayliss 效应)发挥作用,脑血管立即收缩,血管阻力增加,导致颈内动脉血流速度减慢、管径扩张,以保证脑血流量在一定范围内的相对稳定[26]。实验结果如图14所示。
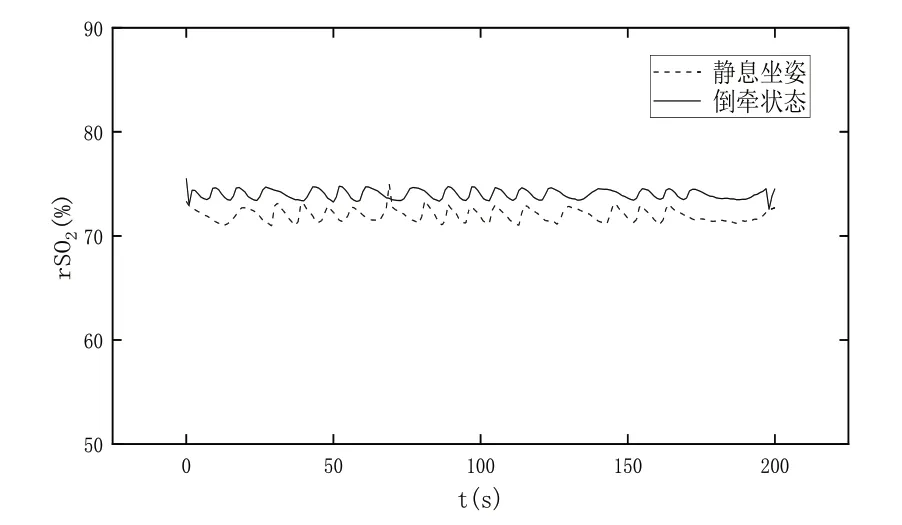
Fig.14 Measurement of cerebral blood oxygen in different postures图14 不同体位脑血氧实测
综上所述,受试者在倒牵状态下局部脑组织血氧饱相较于静息坐姿状态下显著升高。实验结果与预设结果和其他文献研究者结果基本一致,由此证明了本文装置能够实测脑血氧。
4 结语
本文基于近红外光谱技术,设计了一款双波长光源和双探测器的脑血氧监测装置。该装置包括脑血氧探头、脑血氧信号提取电路、模拟滤波电路、光源驱动电路和配套的软件系统,经前臂阻断实验和不同体位脑血氧实测验证了装置的有效性。后续,将通过该装置将对临床脑损伤患者的脑血氧变化展开研究。
