肠道菌群介导肥胖的机制及调控方法研究进展
2023-09-12徐珒昭杨晓莹马隆凯于雁松解庆刚许晓曦
于 淼,徐珒昭,杨晓莹,马隆凯,于雁松,宁 可,解庆刚,许晓曦,*
(1.东北农业大学食品学院,乳品科学教育部重点实验室,黑龙江 哈尔滨 150030;2.黑龙江飞鹤乳业有限公司,黑龙江 齐齐哈尔 164800)
肥胖是世界范围内最常见的慢性疾病之一,中国的肥胖人数位于世界首位,且罹患肥胖的人群逐渐呈现年轻化趋势[1]。2015—2019年的统计结果表明,我国6 岁以下人群肥胖患病率为6.8%;6~17 岁人群肥胖患病率为7.9%;18 岁及以上人群肥胖患病率为16.4%[2]。此外,一项关于肥胖人数的最新调查报告表明,中国罹患肥胖的人口比例正以令人震惊的速度增长[3]。肥胖可引起机体代谢紊乱,进而导致慢性疾病的发生。研究表明,肥胖是代谢类疾病(2型糖尿病等)、神经类疾病(抑郁症、阿尔茨海默症等)、心脑血管疾病(高血压、心梗、脑梗等)及结直肠癌、子宫内膜癌和乳腺癌等多种慢性和恶性疾病的主要诱因[4]。除引起慢性疾病外,Loy等[5]研究发现,代谢失调的肥胖及超重女性的生育能力也会降低。自2019年新型冠状病毒(COVID-19)疫情发生以来,多项研究表明肥胖人群感染COVID-19的风险增加,且感染COVID-19的肥胖患者病情更严重,甚至发生死亡[6-8]。肥胖诱导的慢性代谢疾病使得国家医保不堪重负[9],因此,对于肥胖的预防及控制刻不容缓。减肥手术曾被认为是治疗肥胖的有效手段,但有研究表明,手术治疗产生的副作用有时会超过其益处[10]。而市场上销售的各类减肥药物也均存在不同的副作用。肥胖是一种受多因素影响、多基因控制的慢性代谢性疾病,可由遗传因素或非遗传因素引起,此前人们主要将肥胖的原因归结于能量失衡,即摄入的能量远大于输出的能量,导致脂肪在体内积累引起肥胖,而近年来的研究证实,肥胖与肠道微生物菌群密切相关[11-12]。紊乱的肠道菌群及其代谢产物能够通过某些机制促进肥胖的发生,同时也能够诱导机体炎症反应,进而引起各种慢性疾病的发生,因此,找出肠道菌群介导肥胖的机制至关重要,饮食能够改善机体肠道菌群组成,根据肠道菌群诱导肥胖的机制制定其对应的个性化膳食调节方案进而改善肠道菌群组成被认为是极具前景的肥胖治疗手段。
1 传统医学关于肥胖的概念
体质量指数(body mass index,BMI)是体质量与身高的平方之间的比率(kg/m2)。世界卫生组织将肥胖定义为BMI≥30 kg/m2,不同国家定义肥胖的BMI值略有不同,我国将BMI≥28 kg/m2作为肥胖判定阈值[13-14]。但当体内肌肉含量增加而造成BMI值升高时,仍然依据此标准判断肥胖则有失妥当。相比于BMI值,体脂率(body fat rate,BF)则能够更准确地评估体内脂肪含量,男性不低于25%、女性不低于35%即为肥胖[15]。此外,腰围(waist circumstance,WC)也可作为肥胖判定指标,对于亚洲人来说,男性不低于90 cm,女性不低于80 cm即为肥胖[16]。研究表明,与BMI值相比,WC或结合BMI值的WC与代谢及心血管疾病的关联性更强[17]。临床上对于肥胖的诊断通常综合性考虑多个指标。肥胖人群体内肠道菌群丰度异常,近期,有人提出了一项新概念——肠道微生物组健康指数(gut microbiome health index,GMHI),它是一种基于粪便宏基因组样本的种级分类图谱,将两组样本(即良好和肥胖状态)相关微生物物种的相对丰度进行比较,用以确定患病的可能性[18]。这种方法独立于传统的临床诊断之外,有望成为判定肥胖的新概念。
2 肠道菌群介导肥胖的分子机制
肠道屏障主要由机械屏障、免疫屏障、化学屏障和生物屏障4 部分组成,能够将内脏与一些有害微生物、炎症因子等分隔开[19]。健康的肠道以营养物质、水和细菌产物的选择性渗透为特征,当肠道屏障破损时,微生物及其衍生代谢产物等即可通过屏障转移到宿主组织中,导致全身炎症的发生,进而诱发疾病[20-21](图1)。细胞间紧密连接是机械屏障的组成部分,主要由紧密连接蛋白ZO-1和Occludin组成,紧密连接蛋白大部分分布在细胞的顶端边界。肥胖会导致机体肠道屏障破坏,对小鼠饲喂高脂饮食后,肠道菌群通过激活肠表皮生长因子从而激活蛋白酶受体,导致ZO-1和Occludin蛋白的基因表达下调,使机械屏障破损,增加肠道的通透性[22-23]。肠道菌群是生物屏障的重要组成部分,肥胖人群肠道内的菌群组成发生改变,肠道菌群紊乱导致肠道微生物屏障被破坏[24]。

图1 健康与肥胖人群肠道屏障对比Fig.1 Comparison of intestinal barrier between healthy and obese people
2.1 肥胖患者的肠道菌群特征
肠道菌群的结构受饮食、体质量、精神状态和宿主代谢等诸多因素影响[25]。肠道菌群与肥胖有关的证据主要来自动物实验,将常规饲养小鼠的肠道微生物移植到无菌小鼠体内,结果发现接受移植的小鼠食物摄入量减少,但体内脂肪含量和胰岛素抵抗水平增加,这表明肠道菌群能够使宿主体内脂肪分子的产生或分泌发生变化[26]。美国华盛顿Gordon教授团队第一次提出肠道菌群是脂肪储存和肥胖的环境调节剂,并发现肥胖者肠道厚壁菌门(Firmicutes)丰度增加而拟杆菌门(Bacteroidetes)丰度降低[27],这与Ley等[28]的实验结论一致。随着BMI值的增加,厚壁菌门与拟杆菌门的比例也会增加,但这一关系与肥胖之间的相关性始终存在着争议[29-30]。有报道表明,肥胖者减肥后该比例并没有发生改变[31],因此对于这一比例与肥胖之间的关系仍需要更多的研究来探索。多项研究显示,肥胖人群体内肠道菌群结构及丰度均发生改变,肥胖个体肠道内细菌群落多样性低于正常个体[32-35]。细菌丰富度低的个体表现出明显的整体肥胖、胰岛素抵抗和血脂异常[31]。但也有日本学者认为,肥胖人群体内肠道菌群的多样性显著高于非肥胖人群,与之前的研究结果不同,可能与人种、地域及检测方法或样本量不同等诸多因素有关[36]。
肥胖人群体内的肠道菌群构成变化主要显示为与脂肪产生、促进炎症相关的菌属丰度增加,而与抑制肥胖、抗炎相关的菌属丰度降低(图2)。肥胖人群肠道厚壁菌门(如卵瘤胃球菌(Ruminococcus obeum)和长链多尔氏菌(Dorea longicatena))丰度增加,拟杆菌门丰度降低,厚壁菌门丰度高于拟杆菌门会使人体更充分地吸收食物中的热量,并且更易将热量转化为脂肪积累于皮下[37-38]。破坏肠道屏障导致炎症反应的普雷沃氏菌科(Prevotellaceae)、肠杆菌科(Enterobacteriaceae)、脱硫弧菌科(Desulfovibrionaceae)在肥胖人群体内显著富集[39-40]。肥胖人群肠道中有大量的古生菌(archaea),这类细菌能够氧化普雷沃氏菌科产生的氢气,从而加快其发酵多糖的速度,导致人体吸收更多的能量[13,41]。肥胖人群体内梭菌属丰度降低,而梭菌属部分菌株可吸收脂肪并减轻小鼠肥胖[42]。梭菌属中的粪杆菌属(Faecalibacterium)能够利用肠道内人体无法消化吸收的碳水化合物(多糖及膳食纤维类)并将其转变成SCFA[43]。阿克曼氏菌(Akkermansia muciniphila)可以减轻高脂饮食引起的代谢紊乱,改善胰岛素敏感性及脂肪沉积,并发挥抗炎作用,但其丰度在肥胖人群中显著降低[44]。减少抗炎因子生成的多形拟杆菌(Bacteroides thetaiotaomicron)在肥胖人群体内丰度降低[45]。颤螺旋菌属(Oscillibacter)可降低甘油三酯浓度以及BMI值,在肥胖人群体内该菌丰度降低[46-47]。Million等[48]发现肥胖人群体内具有抑炎作用的益生菌双歧杆菌属(Bifidobacterium)含量降低。

图2 肥胖人群的肠道菌群变化Fig.2 Changes in gut microbiota in obese people
2.2 代谢产物
肠道屏障被破坏后,肠道菌群代谢物穿过肠道屏障从而影响宿主的生理功能,目前已在代谢水平上鉴定出较多的与肥胖有关的肠道菌群代谢物,如SCFA、次级胆汁酸、谷氨酸、吲哚、TMAO等,这些代谢产物能够通过不同的机制对机体产生正反两方面的影响。
2.2.1 短链脂肪酸
肥胖人群体内产SCFA 的厌氧丁酸产生菌(Anaerobutyricum soehngenii)及粪杆菌属(Faecalibacterium)丰度降低[49]。SCFA是肠道菌群利用人体不能消化吸收的碳水化合物而产生的菌群代谢物,主要包括乙酸、丙酸、丁酸等。丙酸能够激活G蛋白偶联受体(G protein-coupled receptor,GPCRs)中的GPR41,GPR41可使体内瘦素水平升高,瘦素能够使增强食欲的神经肽Y(neuropeptide Y,NPY)含量降低[50]。GPR41还可促进抑制食欲的PYY的分泌[51]。丁酸通过激活GPR43增加血浆中GLP-1的含量来抑制肥胖。GLP-1是一种由肠道L细胞产生的激素,可通过中枢神经系统控制食欲,用减少进食量的方式降低肥胖的发生率[46]。此外,研究表明,苦味受体(taste receptor type II,TAS2R)能够通过促进GLP-1的表达来降低食欲,从而促进体质量减轻。ARD-101是一种以TAS2R为靶点的口服药物,动物实验表明,它不仅能与肠细胞表面的TAS2R结合增加小鼠体内GLP-1的含量,还能够降低其体内炎症水平,该药物在改善体内炎症水平及肥胖治疗方面具有极大潜力[52]。
SCFA通常被认为在体内产生积极作用,但有研究表明,过量的SCFA可能会对机体产生负面影响。Tirosh等[53]通过人体临床试验发现,食用含丙酸盐的膳食后,人体血浆中胰高血糖素含量增加,这可能是由于丙酸使儿茶酚胺介导的胰岛素反调节信号增加,从而导致高胰岛素血症及胰岛素抵抗,增加机体肥胖的风险。此外,肥胖人群血清中琥珀酸含量增加,这是由于机体内产琥珀酸的普雷沃氏菌科(Prevotellaceae)和韦荣氏球菌科(Veillonellaceae)相对丰度较高,而消耗琥珀酸的梭菌科(Clostridaceae)相对丰度较低导致的[37]。在2型糖尿病、高血压、缺血性心脏病患者体内均发现琥珀酸水平升高[54]。研究发现,琥珀酸水平与BMI值之间存在正相关,因此其也被视为与心血管疾病风险成正相关的潜在微生物菌群代谢物[37]。
2.2.2 次级胆汁酸
厚壁菌门中A.soehngenii的丰度在肥胖人群体内降低,此菌株具有钠胆汁酸转运蛋白和甘氨酸胆碱水解酶基因,可使代谢综合征患者次级胆汁酸浓度升高[55]。次级胆汁酸的代谢还与克里斯滕森菌科(Christensenellaceae)的丰度呈正相关[56]。次级胆汁酸由初级胆汁酸转换而来,具有促进能量代谢、增加胰岛素敏感性、减轻炎症的作用[57]。通过比较分析肥胖人群与健康人群血清及粪便代谢物发现,肥胖人群的初级胆汁酸生物合成受到干扰,从而导致无法生成次级胆汁酸,而肠道微生物可将初级胆汁酸转换成为次级胆汁酸,目前已知的与胆汁酸解偶联相关的肠道菌群有拟杆菌属、梭菌属、乳酸杆菌属、双歧杆菌属、李斯特菌属等[58]。然而,过量的胆汁酸对肝细胞具有损伤作用[59]。肠道梗阻可使胆汁酸流动中断,导致胆汁酸在肝脏中积累,引起肝细胞毒性[60]。也有研究表明,次级胆汁酸能够驱动肝癌的发生[61]。菌群代谢物能够对宿主产生正反两方面影响,若想通过调控菌群代谢物来调节机体炎症水平,应关注其浓度问题。
2.2.3 谷氨酸
肥胖人群体内富集的瘤胃球菌属(Ruminococcus)和长链多尔氏菌(D.longicatena)具有编码谷氨酰胺产生谷氨酸所需酶的基因[33]。谷氨酸在肥胖人群血清中含量增加,而其含量偏高会导致肝功能异常[62]。研究表明,灌胃带有编码谷氨酸脱羧酶基因的多形拟杆菌(B.thetaiotaomicron)能够降低血浆谷氨酸水平,并且能够下调WAT形成基因、上调脂肪分解和氧化基因的表达,抑制高脂饮食诱导的小鼠体质量增加和肥胖,而在肥胖人群中该菌种含量较低[33]。
2.2.4 吲哚
吲哚是肠道菌群衍生代谢物的一种,能够通过孕烷X受体加强肠道上皮细胞的紧密连接,增强肠上皮细胞的屏障功能,抑制促炎因子分泌,减轻宿主炎症水平[63]。吲哚还能够促进GLP-1的分泌,降低食欲[64]。大肠埃希菌(Escherichia coli)、普通变形杆菌(Proteus vulgaris)、副杆菌大肠菌群(Paracolobactrum c o l i f o r m e)、溶胶无色杆菌(A c h r o m o b a c t e r liquefaciens)、类杆菌属(Bacteroidesspp.)等均可产生吲哚[65]。但并非体内存在的所有吲哚都具有益生作用,肠道菌群通过代谢色氨酸而产生的吲哚代谢物可促进机体炎症并诱导癌症发生,如乳酸菌通过代谢色氨酸生成的吲哚-3-醛能够激活肿瘤相关巨噬细胞上的芳香烃受体,导致胰腺导管腺癌的发生,且芳香烃受体能够激活核因子κB(nuclear factor kappa-B,NF-κB),从而促进机体炎症反应的发生[66-67]。同时,若体内存在过量的吲哚,其会进入肝脏中生成吲哚氧基硫酸盐,该物质能够导致肾脏相关疾病的发生[59]。
2.2.5 氧化三甲胺
肠道菌群以红肉类、蛋类、奶类中富含的磷脂酰胆碱、胆碱和左旋肉碱等为底物生成代谢物三甲胺(trimethylamine,TMA),TMA在黄素单加氧酶3(flavin-containing monooxygenase 3,FMO3)的作用下生成TMAO。研究表明,健康人群的TMAO水平低于肥胖人群,且对同时患有肥胖及2型糖尿病的患者进行减肥手术1 年后其体内TMAO水平明显降低。对比接受Roux-en-Y胃旁路手术前后2型糖尿病肥胖患者的血清发现,双歧杆菌(Bifidobacterium)、拟杆菌门(Bacteroidetes)的丰度与TMAO水平呈负相关,而这些菌群在肥胖人群体内丰度显著降低[68]。对肥胖结肠癌患者的血清进行分析发现,TMAO水平与肠杆菌科(Enterobacteriaceae)和大肠埃希菌(E.coli)的丰度呈正相关[69]。TMAO可能通过促进炎症因子表达从而导致肥胖,小鼠实验表明,注射TMAO后IL-6、TNF-α等炎症因子水平升高[70]。此外,真细菌(Enterococcus)和大肠埃希菌(E.coli)能够产生TMA[71]。除TMAO本身对肥胖的不利影响外,其合成酶FMO3与肥胖的发生也密切相关。FMO3水平与BMI值、腰臀比呈正相关,与脂肪组织褐变水平呈负相关,对小鼠进行FMO3基因敲除,发现小鼠能够避免高脂饮食所诱导的肥胖,其原因可能是敲除FMO3基因促进了脂肪向碳水化合物的转换[72]。
2.3 免疫炎症因子
肥胖被认为是一种慢性炎症状态,因在其发生过程中,分泌抑炎因子的M2型巨噬细胞减少,而分泌促炎因子的M1型巨噬细胞、辅助性T细胞1(T helper cell,Th1)、CD8+T细胞增多[73]。肥胖患者体内检测到脂多糖(lipopolysaccharide,LPS)水平升高,而LPS是极强的炎症诱导剂[74]。LPS能够激活NF-κB信号通路,进而导致慢性炎症、内毒素血症的发生并增加脂肪积聚[75]。LPS可被脂肪细胞吸收,并且脂肪细胞越大,其活性越强[76]。同时,LPS和干扰素-γ又可激活体内M1型巨噬细胞,分泌TNF-α、IL-12、IL-6等炎症因子[77]。
肠道通透性增加导致血浆中炎症因子水平升高,使机体处于炎症状态[78]。肥胖人群体内肠杆菌科(Enterobacteriaceae)和脱硫弧菌科(Desulfovibrionaceae)丰度增加,其产生L P S 的活性极强[79]。小鼠实验表明,补充多形拟杆菌(B.thetaiotaomicron)能降低I L-6 含量,从而减轻局部炎症水平,但在肥胖人群体内多形拟杆菌丰度较低[33]。此外,研究表明,肥胖小鼠的肠道菌群胞外囊泡能够通过被破坏的肠道屏障使宿主β细胞中细菌DNA富集,导致胰岛炎症以及β细胞异常,从而导致糖尿病的发生[80]。丁酸能激活体内M2型巨噬细胞,动物实验表明,经丁酸处理后的小鼠体内IL-6、IL-12等促炎因子表达下调[81]。此外,丁酸还能够抑制转录因子NF-κB的活性,从而调节某些参与炎症反应基因的表达[44]。丁酸可通过多种方式降低肥胖发生的可能性,但肥胖人群体内产生丁酸的粪杆菌属(Faecalibacterium)丰度降低[45]。
3 肠道菌群介导调控肥胖的研究现状及趋势
肥胖人群的肠道通透性增加,一些与肥胖有关的特征性肠道菌群及其代谢产物改变了宿主肠稳态并引发炎症。肠道菌群作为肥胖预防、治疗方式中的可控因素,对其组成的调控显得极为重要。调控益生菌及饮食模式等可通过调节菌群组成并促进对机体有利的代谢作用减轻机体炎症反应,并创造健康稳定的肠道环境。通过调控肠道菌群而改善肥胖的成本低且安全性较高,有望成为今后临床肥胖治疗的一项方案。
3.1 益生菌及益生元对肠道菌群的调控作用
基于肠道微生态与肠道免疫及肥胖的关系,近年来也有一些研究探讨通过补充益生菌(和/或益生元)以调节肠道菌群组成,降低肠道通透性,以改善机体免疫功能,并由此调整脂肪代谢等从而达到减肥的目的。
3.1.1 益生菌
益生菌能够促进机体有益菌的生长,补充益生菌及益生菌补充剂能够通过使机体肠道菌群组成向有益趋势改变从而改善肥胖。Cani等[22]发现,饲喂4 周益生菌饲料的小鼠体内乳杆菌属(Lactobacillus)和双歧杆菌属(Bifidobacterium)的含量升高。对肥胖成人进行10 周益生菌干预,结果表明其肠道菌群组成发生改变且体质量明显降低[84]。此外,益生菌也可直接降低高脂喂养小鼠、健康成人、肥胖成人的肝脏、皮下等脂肪组织的质量,从而达到减轻体质量的目的[85-91]。
益生菌还能够通过使紧密连接蛋白重新连接而修复肠道屏障,并减轻体内的炎症反应从而改善肥胖。对饮食诱导的肥胖小鼠进行6 个月的植物乳杆菌(Lactobacillus plantarumMTCC5690)以及发酵乳杆菌(Lactobacillus fermentumMTCC5689)饲养,发现小鼠肠道内ZO-1和Occludin的表达量提高[92]。鼠李糖乳杆菌(Lactobacillus rhamnosusGG)菌株、乳杆菌属(Lactobacillus)和双歧杆菌属(Bifidobacterium)也能够使受细菌影响而发生变化的ZO-1和Occludin紧密连接蛋白重新分布,降低肠道通透性,从而调节免疫[93-94]。除传统的益生菌外,某些非传统益生菌的肠道细菌在无菌小鼠体内定植后也可影响宿主的新陈代谢并恢复小鼠的黏膜免疫系统。如肠道中的阿克曼氏菌(A.muciniphila)作为新一代益生菌被广泛关注[49]。其可通过刺激肠道细胞上的病原体识别受体,如Toll样受体,来促进肠上皮黏液中的黏蛋白形成,黏蛋白对维持肠道屏障的完整性起重要作用,其除了起物理屏障作用外,还能够抑制上皮细胞凋亡,维持屏障完整性[95]。
此外,益生菌能通过物质及能量代谢的途径改善肥胖。A.soehngenii可改善严重肥胖和糖尿病小鼠的胰岛素敏感性和能量代谢,增加其血浆胆汁酸浓度,并产生对宿主健康有益的代谢物质——丁酸;狄氏副拟杆菌(Parabacteroides distasonis)能增加体内次级胆汁酸的浓度,在高脂饲料喂养的小鼠中,灌胃该菌株可减轻小鼠体质量并降低机体炎症水平[51,96]。
益生菌还能直接降低促炎因子含量,从而改善肥胖[97]。Schultz等[98]证明口服鼠李糖乳杆菌(Lactobacillus rhamnosusGG)能够增加体内IL-4、IL-10等抑炎因子水平,降低IL-6、TNF-α、干扰素-γ等促炎因子水平。除鼠李糖乳杆菌外,罗伊氏乳杆菌(Lactobacillus reuteriV3401)也可通过抑制细胞因子TNF-α、IL-6和可溶性血管细胞黏附分子-1(soluble vascular cell adhesionmolecule,sVCAM-1)的产生来抑制炎症体激活和M1巨噬细胞极化,从而抑制促炎症途径的激活[99]。积累过多的TNF-α能够引起局部以及全身的炎症蔓延,这种炎症反应会导致ZO-1和Occludin蛋白的紧密连接发生改变[100]。益生菌干预还可降低小鼠体内炎症物质LPS水平,但在肠道屏障受损的情况下大剂量补充益生菌会导致免疫系统紊乱,所以应依据自身情况适量补充[21]。
补充益生菌对动物及人体影响的总结见表1。
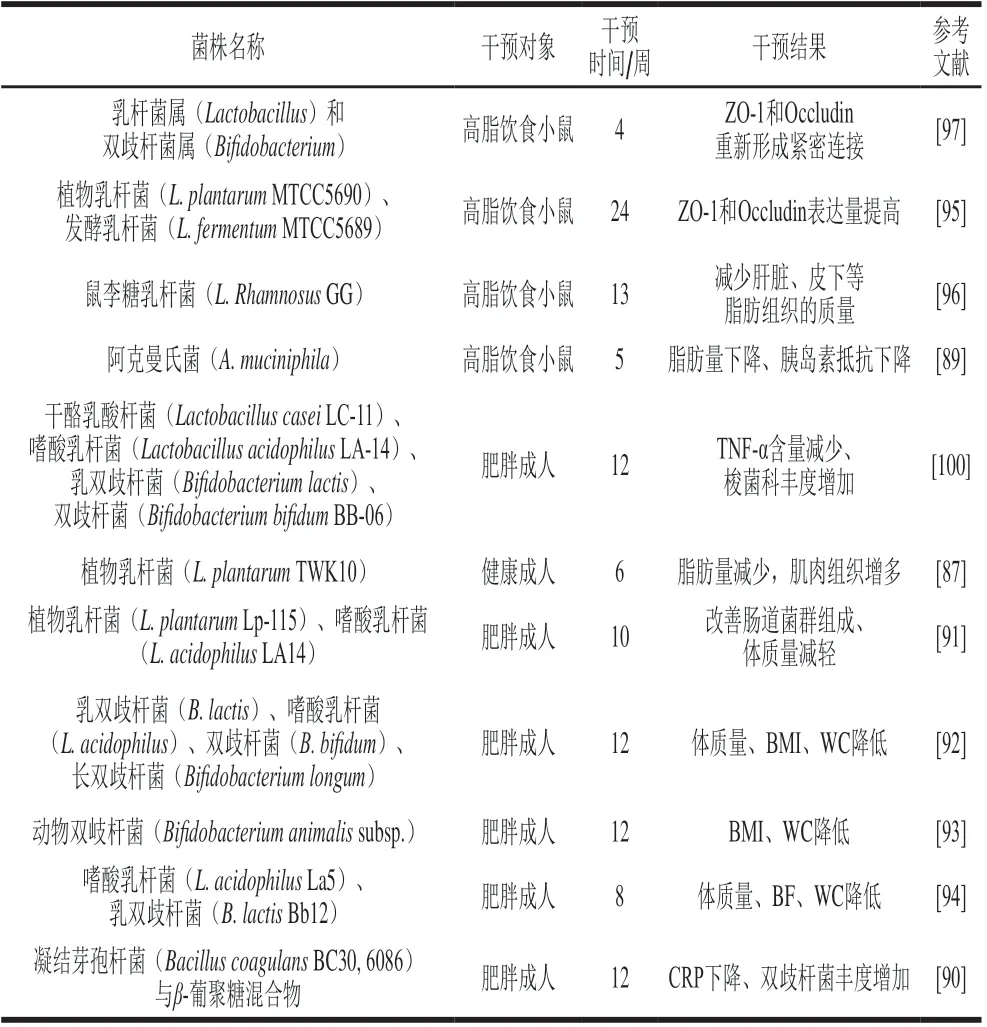
表1 补充益生菌对动物及人体的影响Table 1 Effect of probiotic supplementation on animals and human
3.1.2 益生元
益生元是指不被人体消化但能被肠道菌群发酵的物质,包括功能性低聚糖(低聚果糖、低聚半乳糖、母乳低聚糖、β-葡聚糖等)、多糖(菊粉、灵芝多糖、茯苓多糖等)、天然植物提取物黄酮及多酚类(如茶多酚、咖啡酸、花青素等)等。对高脂饮食诱导肥胖的小鼠以及肥胖人群进行益生元干预能够有效地控制其体质量的增加[101-102]。肠道菌群失调的发生机制与饮食密切相关,高脂低纤维的饮食会导致肠道菌群的组成发生紊乱[69,103]。膳食纤维进入人体后不能够被消化,但能被肠道菌群利用并生成SCFA,SCFA可以减轻炎症、增加饱腹感,因此可以通过低热量饮食来改善肥胖[104]。此外,摄入较多的膳食纤维可以增加肥胖人群体内的微生物多样性[105]。研究表明,肥胖和非肥胖者肠道菌群之间的差异与食用高膳食纤维和低膳食纤维的个体之间的差异相似[106]。
益生元可促进有益菌的生长从而改善肥胖。经低聚果糖益生元干预后,肥胖人群体内双歧杆菌属(Bifidobacterium)含量升高[107]。小鼠实验证实,经过益生元灌胃后,其肠道内的益生菌乳酸菌(Lactobacillus)、双歧杆菌属(Bifidobacterium)、阿克曼氏菌(A.muciniphila)丰度增加,脱硫弧菌科(Desulfovibrio)、乳球菌属(Lactococcus)丰度降低[108]。Jo等[109]研究发现,粪便中果糖含量与乳球菌属(Lactococcus)含量呈正相关。
益生元可通过降低体内炎症水平及上调食欲抑制激素而抑制肥胖。肥胖人群补充益生元后ZO-1和Occludin蛋白的紧密连接程度增加,肠道屏障的通透性及机体内LPS、TNF-α、IL-6水平降低[96,110-112]。在一项人体研究中,经过几周益生元治疗后,受试者体内GLP-1、PYY水平上调,食欲降低,从而减少了食物摄入量并抑制了体质量增加[113-114]。
补充益生元对动物及人体影响的总结见表2。

表2 补充益生元对动物及人体的影响Table 2 Effect of prebiotic supplementation on animals and human
3.2 生活作息及饮食方式对肠道菌群的影响
熬夜对肠道菌群具有毁灭性的影响,尤其对于夜班工作人员而言,破坏肠道生物节律的后果就是肠道微生态紊乱及出现肠道炎症,因此很多情况下肥胖均与不良睡眠习惯有关。而运动及改变饮食方式均可改善肠稳态,肠道菌群的生长依赖于机体摄入的食物,随着饮食模式的改善,肠道菌群组成也会发生一定变化,这种变化多数是对机体有益的,并且结合适当的运动会放大这种有益变化。
3.2.1 睡眠
生物钟是指机体为了适应24 h内的昼夜交替而使各种生理活动表现出的节律性变化,与人体生物钟类似,肠道菌群也具有昼夜节律。研究表明,小鼠及人体内60%左右的肠道菌群丰度在24 h内表现出节律性振荡,且菌群的昼夜节律受人体生物钟的影响[115,117]。Per1、Per2、Bmal1等是控制生物钟的核心时钟基因,在Per1和Bmal1基因敲除的小鼠体内,肠道菌群的昼夜节律也随之消失[116]。睡眠不足或熬夜使得机体原本的生物钟被打乱,从而扰乱肠道菌群昼夜节律,诱发机体疾病及生理压力[118]。轮班或长期经历时差工作增加了罹患肥胖及糖尿病的风险[119]。对两名经历了时差的受试者肠道菌群的分析发现,其菌群组成与肥胖人群的特征性菌群相同,即厚壁菌门丰度增加而拟杆菌门丰度降低;与在经历时差之前接受肠道菌群移植的无菌小鼠相比,在经历时差期间接受肠道菌群移植的无菌小鼠体质量显著增加[113]。对小鼠进行为期4 周的睡眠干扰实验发现,小鼠的食物摄入量增加,毛螺菌科(Lachnospiraceae)和瘤胃球菌科(Ruminococcaceae)丰度增加,乳杆菌科(Lactobacillaceae)、类杆菌(Bacteroides)、放线菌和双歧杆菌(Bifidobacteria)丰度降低[120]。有研究表明,睡眠时间低于5 h会使体内瘦素分泌量降低,从而增进食欲[121]。此外,睡眠不足还能诱导炎症细胞因子表达,并增加血清中皮质酮(压力标志物)水平。短时间睡眠导致儿茶酚胺和糖皮质激素的释放,这些激素会刺激肥大细胞脱颗粒,从而使肠上皮细胞紧密连接被破坏,进而使菌群及其代谢物透过肠屏障,导致全身炎症[122]。研究表明,仅几晚的睡眠缺失就会极大提高TNF-α和C反应蛋白(C-reactive protein,CRP)含量[123]。因此,保证充足的睡眠时间以维持生物钟稳定,进而维持肠道菌群稳定,就能够达到预防及改善肥胖的目的。
3.2.2 运动
按传统思维来讲,人们认为体育锻炼能减轻体质量是因为运动能够增加能量的消耗,燃烧体内储存的多余脂肪,进而达到减肥的目的。体育锻炼能有效地减少腹部脂肪含量,且坚持锻炼对减肥后的体质量保持有重要作用[124]。但有研究发现,运动还能通过改变人体内肠道菌群组成从而减轻体质量。运动可增加肠道菌群的多样性以及肠道内阿克曼氏菌(A.muciniphila)、双歧杆菌(Bifidobacteria)、粪杆菌属(Faecalibacterium)等有益菌的丰度[125-126]。对肥胖女性进行6 周有氧运动结果表明,脱硫弧菌科(Desulfovibrionaceae)及肠杆菌科(Enterobacteriaceae)含量降低[127]。此外,研究表明,运动后韦荣球菌属(Veillonella)丰度增加,该菌属能够代谢有氧运动后产生的乳酸并生成丙酸[128]。因此,锻炼对减轻体质量产生积极影响的机制可能是肠道菌群丰度的变化改善了肠屏障功能,并抑制促炎因子表达,以及提高代谢乳酸并生成SCFA的菌群丰度。除运动外,合适的饮食模式对减肥也极具效果,并且运动与减肥的饮食方式同时进行对于肠道菌群组成的改善会产生极大的协同作用[121]。
3.2.3 饮食模式
饮食是对肠道微生物菌群定向干预的基础,其有效地改变了微生物菌群组成,最重要的是,其可以创造一个促进健康微生物区系长期稳定的环境[129]。
3.2.3.1 间歇性禁食
间歇性禁食(intermittent fasting,IF)指交替地进行膳食和禁食,包括隔日禁食、限时进食(即每日进食时间限制在6~8 h内)、5∶2饮食(即每周连续禁食2 d)等。动物实验以及人体研究均表明,经过IF处理后机体总进食量不变,但体质量明显降低[130-132]。这种良好的效果依赖于肠道菌群介导的WAT褐变、肠道菌群组成的改变及体内脂肪的消耗。Li Guolin等[133]发现隔日禁食能够改变肠道菌群组成、刺激小鼠体内WAT褐变,并认为其褐变原因是由于肠道菌群的作用。研究人员将隔日禁食的无菌小鼠及接受菌群移植(隔日禁食后正常小鼠的菌群)的小鼠进行对照实验,发现后者WAT发生褐变而前者无此现象。此外,IF还能够通过增加肠道菌群的多样性、降低厚壁菌门与拟杆菌门的比值来改善肠道菌群组成,如增加了乳杆菌属(Lactobacillus)、阿克曼氏菌(A.muciniphila)、双歧杆菌科(Bifidobacteriaceae)、拟杆菌科(Bacteroidaceae ) 、粪杆菌属(Faecalibacterium)丰度,降低了普雷沃氏菌科(Prevotellaceae)丰度,从而改善肥胖状态[127,134-137]。禁食还能够促进脂肪消耗,餐后人体细胞所需能量由葡萄糖提供,脂肪则以甘油三酯的形式储存在脂肪组织中,而禁食期间,甘油三酯分解为甘油和脂肪酸,脂肪酸在肝脏中被转化为酮体,酮体为体内各组织提供能量[138]。IF由于进食时间的特殊性,不适用于低血糖人群,此外,由于禁食期间机体会处于生酮阶段,所以不适合于生酮饮食(ketogenic diet,KD)的人群亦不适合IF。
3.2.3.2 生酮饮食
KD是指摄入大量的脂肪、适量的蛋白质以及极少量碳水化合物的饮食模式。在低碳水化合物的饮食方式中,机体供能方式发生转变,且能够在1 周内实现由葡萄糖供能到酮体供能的转变,也就是说摄入的脂肪不再以甘油三酯的形式储存于体内,而是分解生成酮体后进行供能,因此,尽管通过脂肪摄入的方式来减肥,其效果仍非常显著[139]。一项关于KD数据总结的报告表明,采用KD干预12 周以上能有效降低成人的体质量、BMI、WC、BF,但这种饮食疗法对于以上指标的长期控制效果仍需进一步研究[140]。KD对于减肥的有益作用主要有以下原因:一方面,KD燃烧了大量脂肪,且许多人在KD期间不会经常感到饥饿,因此减少了总热量的摄入;另一方面,KD改善肠道菌群组成,能够对肠道环境产生有益作用,减轻体内炎症状态,从而改善肥胖。研究表明,受试者进行KD能够使体内厚壁菌门(Firmicutes)与拟杆菌门(Bacteroidetes)的比例降低[141]。此外,KD能够增加益生菌如阿克曼氏菌(A.muciniphila)和乳酸杆菌(Lactobacillus)的丰度[142],降低脱硫弧菌(Desulfovibrio)、瘤胃球菌科(Ruminococcaceae)丰度[143]。KD期间主要依靠肝脏将脂肪酸转化为酮体,因此KD不适用于患有肝病的人群,糖尿病、低血糖以及患有胃肠道疾病的人群也不适用。
3.2.3.3 地中海饮食
MedDiet摄入大量的水果、蔬菜、鱼类、谷物、豆类以及极少量的红肉,并以橄榄油作为脂肪摄入的主要来源,低脂低能量的水果蔬菜能在低热量摄入的情况下诱导产生饱腹感。MedDiet是公认的健康饮食方式,对肠道菌群有积极的影响,并能够降低罹患肥胖以及慢性疾病的风险[144-145]。MedDiet中大量的蔬菜、水果均为多酚类食物,多酚在抗炎、抗氧化、抗癌、抗糖尿病和抗脂肪等方面发挥了重要的作用,以果蔬为主的饮食相当于摄入了大量多酚,而小肠对于多酚的吸收率很低,其余多酚会干扰肠道菌群的组成,从而改善机体肥胖[146]。坚持MedDiet的受试者体内双歧杆菌属(Bifidobacterium)丰度增加、SCFA水平升高、瘤胃球菌属(Ruminococcus)丰度降低、炎症标志物CRP水平降低[147-149]。健康的饮食以蔬菜、谷物为主,MedDiet符合这一理念且饮食结构较为丰富,与其他低脂饮食模式相比,MedDiet对超重或肥胖人群的长期减肥更有效[150]。但MedDiet摄入植物性食物偏多,消化功能欠佳的人群并不适用。
4 结 语
肥胖是多种慢性疾病的诱因,手术或药物等减肥方法可能需要昂贵的费用,且这些减肥方法并不能达到长期的效果[151]。肠道菌群已被证明与肥胖的发生发展密切相关,因此通过健康的饮食及生活习惯调节肠道菌群来治疗肥胖是一种极具希望的减肥手段。通过改善饮食加运动等特定方法对肠道菌群进行干预后,可使肠道微生态发生逆转,改善肠道屏障功能、抑制炎症因子水平,从而预防并辅助治疗肥胖。而从宏观层面分析各代谢物如何调控炎症水平及各代谢物之间是否存在相互作用,可作为研究预防及治疗肥胖手段的新思路。
