兰州百合多糖与有氧运动对链脲佐菌素诱导的糖尿病大鼠肾组织的保护机制
2023-09-12李守汉高文峰崔治家
李守汉,高文峰,崔治家
(1.兰州大学体育教研部,甘肃 兰州 730000;2.甘肃中医药大学药学院,甘肃 兰州 730000)
糖尿病(diabetes mellitus,DM)是一种具有长期性的代谢紊乱疾病,并伴有多种并发症[1],其特点是血糖高,是由胰岛素(insulin,INS)分泌缺陷、INS功能下降或两者同时引起的。INS分泌不足和血液中高浓度葡萄糖的产生还可能造成一些器官衰竭,甚至功能丧失[2]。DM可通过代谢应激、组织损伤和细胞死亡的自催化循环而导致自由基产生的抑制作用及清除机制受损,从而进一步加剧氧化应激[3]。糖尿病治疗的主要目标是使血糖、血脂和脂蛋白水平接近正常水平,并清除自由基,使各组织功能得到恢复。糖尿病肾病(diabetic nephropathy,DN)是糖尿病患者最重要的并发症之一。糖尿病的微血管并发症与高血糖有关,其原因是高血糖通过代谢紊乱导致DN的发生与发展[4]。DN由多因素导致,而以高血糖、晚期糖基化终产物和氧化应激为主要因素,造成的免疫细胞浸润和肾脏慢性炎症是公认的病理机制[5]。
从植物中提取的多糖由于其低毒性和多种药理活性而受到研究人员的广泛关注[6]。多糖由单糖单元组成并通过糖苷键连接,其具有的抗糖尿病特性已成为一个重要的研究领域[7]。已有研究表明,百合多糖既可提高糖代谢酶的活性,促进葡萄糖的摄取和利用;又可增加INS分泌,调节1型糖尿病大鼠的血糖[8]。兰州百合(Lilium davidiivar.unicolor)为多年生鳞茎类草本植物,是百合科百合属川百合的一个变种,仅适宜在兰州周边二阴山区种植;研究发现,兰州百合多糖(Lanzhou lily polysaccharide,LLP)含有乙酰基葡萄糖与甘露糖结合的结构[9],具有治疗支气管扩张、抗肿瘤、抗疲劳、调节免疫、降血糖、抗氧化、抑菌等作用[10]。目前,运动疗法是一种安全、简单、有效的治疗糖尿病的方法,其有效性已在基础研究和临床应用中得到证实[11]。然而对LLP与有氧运动(aerobic exercise,AE)降血糖及对糖尿病并发症作用的研究报道较少。本研究旨在研究LLP与AE结合对糖尿病链脲佐菌素所致糖尿病大鼠空腹血糖、脂质过氧化及肾脏保护作用的影响。
1 材料与方法
1.1 动物、材料与试剂
清洁级健康成年雄性W i s t a r 大鼠,体质量200~220 g,来自甘肃中医药大学动物实验中心,合格证号:N062000800000023,生产许可证号:SYXK(甘)2020-0009。
兰州百合购自兰州市黄河药材市场。
LLP的制备方法:兰州百合废弃鳞茎→粉碎(过100 目筛)→干燥→称质量→超声波协同复合酶提取→酶灭活→抽滤、取上清液→4 000 r/min离心15 min,取上清液→减压浓缩→真空干燥至恒质量→兰州百合多糖[12]。实验前以蒸馏水为溶剂配制成一定浓度样品,4 ℃低温保存,备用。
链脲佐菌素(streptozocin,STZ) 美国Sigma公司;柠檬酸 北京华越洋生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、INS试剂盒 南京建成生物工程研究所;苏木精-伊红(hematoxylin and eosin,HE)试剂盒、Western blot二抗 北京索莱宝科技有限公司。
1.2 仪器与设备
Accu-Chek血糖测定仪 瑞士罗氏集团;血糖仪美国强生公司;7600-010全自动生化分析仪 日本日立公司;H54AR分析天平 瑞士梅特勒-托利多公司;Biofuge fresco低温离心机 德国Heraeus公司;Vanox光学显微镜 日本Olympus公司;RY-2235病理切片机徳国Leica公司。
1.3 方法
1.3.1 实验分组
选取大鼠50 只,遵循相关伦理学要求,所有动物实验均在标准笼中饲养并保持室温(24±1)℃、相对湿度(50±10)%,自然光照,自由饮食饮水。动物房及用具等定期用紫外灯消毒灭菌。适应性喂养1 周之后随机分为正常对照组(n=10)和DM模型组(n=40),前者腹腔注射一定剂量(60 mg/kgmb)0.1 mol/L pH 4.2柠檬酸缓冲液,后者腹腔内注射STZ(60 mg/kgmb)诱发糖尿病,48 h后,大鼠出现多饮、多食、多尿,尿液检验试纸检测尿糖为+++到++++,再以空腹尾静脉采血,用血糖仪测定大鼠空腹血糖浓度在16.67~26.00 mmol/L之间则确认糖尿病建模成功。之后将糖尿病组再分为糖尿病对照组(DM)、有氧运动组(DM+AE)、LLP给予组(DM+LLP)和综合治疗组(DM+LLP+AE)4 组。
1.3.2 动物运动训练与喂药
注射STZ 1 周后,DM+AE组和DM+LLP+AE组大鼠进行6 周游泳训练,水池水温在34~36 ℃左右,水深50 cm,为保证游泳期间能够持续活动,大鼠在水面活动的面积平均为250 cm2。每周游泳5 d,游泳时间为:第1~2周每日40 min,第3~4周每日60 min,第5~6周维持在90 min。这两组每日进行游泳训练结束后,用吸水纸将大鼠身体上水擦干并用电吹风机烘干大鼠毛发。
糖尿病建模成功后,DM+LLP组和DM+LLP+AE组以LLP 150 mg/kgmb灌胃,用蒸馏水将LLP配制成质量浓度为15 mg/mL溶液,灌服量为1 mL/l00 gmb,每天1 次;正常对照组、DM组、DM+AE组每天灌服蒸馏水1 mL/100 gmb。
1.3.3 样本采集
第6周训练结束后,休息24 h。然后所有组大鼠利用2.5%戊巴比妥纳注射液以50 mg/kgmb注射量腹腔注射麻醉。处死、破腹、左心室取血,离心(3 500 r/min)20 min,取上清液,-4 ℃保存备用。
血液采集后,进行腹部切口取双肾,一部分肾组织固定于4%中性甲醛溶液中,其余肾组织于-80 ℃液氮中保存,以备肾脏组织学观察。
1.3.4 生化指标测定
血糖测定仪检测空腹血糖(fasting blood glucose,F B G)浓度,全自动生化分析仪检测甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、血尿素氮(blood urea nitrogen,BUN)和血清肌酐(serum creatinine,SCr)浓度;利用试剂盒检测血清INS浓度、SOD活力和MDA浓度。
1.3.5 肾脏组织病理学观察
在室温下,肾组织在4%中性甲醛溶液中固定24 h后,从不同的组中采集小部分肾组织,通过梯度乙醇(体积分数分别为70%、80%、90%、95%、100%)系列脱水,然后在二甲苯中脱水透明,嵌入石蜡中,切成4 mm厚的切片。组织切片用HE染色,光学显微镜下观察。
1.3.6 Western blot法测定Bax/Bcl-2和Caspase-3的表达量
按照总蛋白提取试剂盒说明书裂解肾组织细胞,提取总蛋白。BCA法测定总蛋白浓度。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphatepolyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白质;经湿转将蛋白质转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上;然后将膜用TBST溶液(含质量分数5%脱脂奶粉、0.1% Tween-20)室温封闭2 h。置于稀释一抗中,4 ℃振荡过夜,用TBST溶液洗4 次,在二抗中孵育30 min后,用TBST溶液洗3 次;在暗室中将显色液ECLA和ECLB以体积比1∶1混合后覆盖在膜上,1~2 min后去尽残液,进行曝光。曝光后的胶片用显影、定影试剂进行显影和定影。依不同的发光强度调整曝光条件。用图像分析系统对Western Blot结果进行灰度扫描,以目的蛋白条带灰度值和内参蛋白条带灰度值的比值作为相应样本的蛋白表达量。
1.4 数据统计分析
采用SPSS 19软件对所有数据进行处理,结果用平均值±标准差表示,利用单因素方差分析(one-way analysis of variance,ANOVA)检验结果的差异显著性,P<0.05表示差异显著。
2 结果与分析
2.1 LLP和AE对DM大鼠FBG与INS浓度的影响
由图1可知,与正常对照组相比,STZ诱导的糖尿病大鼠FBG浓度显著升高(P<0.05),INS浓度显著降低(P<0.05)。与DM组比较,DM+AE组、DM+LLP组和DM+LLP+AE组FBG浓度显著降低(P<0.05),DM+LLP组和DM+LLP+AE组INS浓度显著升高(P<0.05)。表明LLP与有氧运动都具有降低血糖和提高INS水平的作用,而LLP与有氧运动同时干预对降低血糖的效果更明显。
2.2 LLP和AE对糖尿病大鼠的血清SCr、BUN、TC和TG浓度的影响
图2显示,注射STZ后,SCr、BUN、TC和TG浓度显著高于正常对照组大鼠(P<0.05)。与DM组相比,DM+AE组、DM+LLP组和DM+LLP+AE组血清SCr、TC和TG浓度显著降低(P<0.05),DM+LLP组和DM+LLP+AE组BUN浓度显著降低(P<0.05),DM+AE组BUN浓度变化不显著。表明服用LLP和长期进行有氧运动可降低糖尿病高血脂症,预防动脉粥样硬化的形成,减轻对肾脏组织的损伤。


图2 LLP和AE对糖尿病大鼠的血清SCr(A)、BUN(B)、TC(C)和TG(D)浓度的影响Fig.2 Effect LLP and AE on SCr (A), BUN (B), TC (C) and TG (D) in diabetic rats
2.3 LLP和AE对糖尿病大鼠肾组织SOD活力和MDA浓度的影响
图3 显示,与正常对照组比较,D M 组大鼠中SOD活力显著降低(P<0.05),MDA浓度显著升高(P<0.05)。与DM组大鼠相比,DM+LLP+AE组SOD活力显著升高(P<0.05),DM+AE组、DM+LLP组SOD活力无显著变化,DM+LLP组与DM+LLP+AE组MDA浓度显著降低(P<0.05),DM+AE组MDA浓度无显著变化。

图3 LLP和AE对糖尿病大鼠肾组织SOD活力(A)和MDA浓度(B)的影响Fig.3 Effects of LLP and AE on SOD activity (A), and MDA content(B) in kidney tissue of diabetic rats
2.4 LLP和AE对糖尿病大鼠肾组织病理学的影响
图4显示,正常对照组肾小球的结构正常,毛细血管结构完整、清晰,系膜区无增生,基底膜完整无增厚,未见炎性细胞浸润。DM组肾脏中的肾小球硬化、间质纤维化、脂质积累,出现细胞凋亡和炎症细胞浸润。与DM组相比,LLP和有氧运动治疗及二者结合治疗的糖尿病大鼠中,肾小球的结构和形态特征得到改善和恢复。表明LLP和有氧运动可改善肾小球肥大和肾小球系膜扩张。
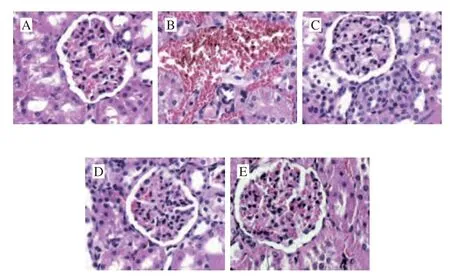
图4 LLP和AE对糖尿病大鼠肾组织病理学的影响(×400)Fig.4 Effects of LLP and AE on kidney injury in diabetic rats (× 400)
2.5 LLP和AE对糖尿病大鼠肾组织细胞Bax/Bcl-2及Caspase-3相对表达量的影响
Western blot结果显示(图5),与空白对照组比较,DM大鼠肾脏的Bax/Bcl-2及Caspase-3相对表达量均显著上调(P<0.05)。与DM组大鼠相比,DM+LLP组与DM+LLP+AE组Bax/Bcl-2相对表达量显著降低(P<0.05),DM+AE组Bax/Bcl-2相对表达量无显著变化,DM+LLP+AE组Caspase-3相对表达量显著降低(P<0.05),DM+AE组、DM+LLP组Caspase-3相对表达量无显著差异。


图5 LLP和AE对糖尿病大鼠肾组织细胞Bax/Bcl-2及Caspase-3表达量的影响Fig.5 Effects of LLP and AE on protein expression of Bax/Bcl-2 and Caspase-3 in kidney tissue of diabetic rats
3 讨 论
3.1 LLP和AE对DM大鼠FBG与INS及脂质代谢的影响
DM是一种代谢紊乱疾病,其特征是由于身体产生激素或对INS的反应能力受损而导致的高血糖症[13]。造成INS效力不足的原因包括胰导β细胞分泌INS的量不足或INS氨基酸排列异常、在血液中有INS拮抗物质存在、组织对INS有拮抗性。研究发现,有氧运动能显著降低DM大鼠FBG水平,增加INS敏感性[14]。运动能改善人类和动物的INS抵抗和葡萄糖敏感性,可能是因为促进了AMPK、PGC-1α和其他参与线粒体生物发生的基因的表达[15]。本实验中,单独给予LLP和有氧运动都能使DM大鼠FBG浓度显著下降(P<0.05),单独给予LLP及补充LLP的同时进行有氧运动均能显著增加INS的分泌量(P<0.05),这可能是由于有氧运动或LLP的生物活性改善了机体的INS敏感性。表明长期补充LLP的同时进行有氧运动能更加减轻DM大鼠的胰岛β细胞的损伤,使INS的分泌量增加,从而降低了血糖。同时服用LLP和进行有氧运动能显著降低DM大鼠血清TG、TC浓度(P<0.05),这可能是LLP和氧运动通过增加DM大鼠INS的释放使3-羟基-3-甲基戊二酸单酰辅酶A还原酶水平升高,从而达到降脂的作用。
3.2 LLP和AE对DM大鼠肾组织SOD活力及MDA含量的影响
氧化应激可促进DN发病及其并发症的发生发展[16],主要原因之一是活性氧(reactive oxygen species,ROS)会损伤细胞内DNA并最终导致细胞凋亡的发生[17]。ROS还可通过激活DM患者中的内质网应激促进肾小管细胞凋亡[18]。DM患者体内多余的血糖通过葡萄糖自动氧化、多元醇途径和蛋白质的非酶糖化诱导自由基形成从而引起氧化应激[19]。研究发现,STZ诱导的DM大鼠表现出大多数DM并发症,通过介导氧化应激产生破坏β细胞的自由基[20]。Hui Heping等从兰州百合的鳞茎中分离纯化得到一种含O-乙酰基的甘露葡聚糖(BHP-1),发现其具有明显的体外抗氧化活性和抗菌活性[21]。本实验结果显示,与正常对照组相比,DM大鼠抗氧化酶SOD活力显著下降,MDA浓度显著增加,而LLP和有氧运动均可改善这两个指标,可能是通过抑制ROS的生成降低了氧化应激水平,从而保护DM大鼠的β细胞结构和功能,抑制DN的进一步发展。
3.3 LLP和AE对DM大鼠肾组织的保护作用
在DM的进展期间,高血糖和高脂血症的代谢失调会引发DN,DN伴有白蛋白尿,其特征是肾小球滤过率降低、肾小球肥大、蛋白尿、肾小球基底膜增厚、系膜扩张、足细胞丢失、肾小球硬化和间质纤维化[22]。高脂血症可通过激活转化生长因子(transforming growth factor,TGF)-β1通路来诱导肾损伤,从而促进肾内活性氧的生成,并导致单核细胞和巨噬细胞的肾小球浸润[23]。研究表明,2型DM大鼠经黑洋葱粗多糖灌胃后,肌酐水平显著降低,肾小球形态较完整,说明多糖对DM大鼠的肾脏组织具有一定的保护和修复作用[24]。牡丹皮多糖能明显改善DN大鼠肾脏组织病理损伤及相关肾脏指标,主要通过调节氧化应激和调节炎症因子达到保护DN大鼠肾脏的作用[25]。在本研究中观察到DM大鼠肾小球损伤、慢性炎症和固有细胞坏死。在LLP与有氧运动单独治疗DM组的肾脏切片中观察到肾微结构轻微变形,肾小管结构大部分改变,在LLP联合有氧运动的情况下,大鼠肾小球的结构和形态特征得到改善和恢复;表明LLP和有氧运动可改善STZ诱导的DM大鼠肾脏肾小球肥大和肾小球系膜扩张,有效保护肾脏。
3.4 LLP和AE对DM大鼠肾脏Bax、Bcl-2及Caspase-3表达的影响
细胞凋亡是一种受调节和程序化的细胞自主死亡[26]。细胞凋亡途径主要包括线粒体途径(或称内在途径)和死亡受体途径(或称外在途径)[27]。细胞凋亡涉及多种蛋白质,包括Bcl-2和Caspase家族。线粒体介导的凋亡通路受Bcl-2家族蛋白的调控,其中Bcl-2和Bax分别是主要的抗凋亡蛋白和促凋亡蛋白[28]。研究表明,Bax/Bcl-2表达量比值在确定细胞凋亡的执行方面可能比单独的任一蛋白质的表达更重要,因为Bax/Bcl-2表达量增加会上调Caspase-3表达量,后者会激活DNA酶,导致细胞凋亡[29]。在多种病理条件下Caspase活化且最终使细胞凋亡过程完成[30]。Caspase-3被认为是细胞凋亡过程中的关键执行者,它通过切割各种蛋白质底物,包括细胞核、细胞骨架、内质网和细胞溶胶中的蛋白质,最终导致细胞凋亡[31]。由于氧化应激和炎症协同作用诱导细胞凋亡,通常认为Caspase-3是参与细胞凋亡蛋白酶级联反应的必需蛋白质,因此Caspase-3的活化是凋亡进入不可逆阶段标志[32]。黄芪多糖可促进高糖诱导的肾小管上皮细胞增殖,抑制细胞凋亡及转分化,其机制与下调Janus激酶(Janus kinase,JAK)/信号转导子和转录激活子(signal transducer and activator of transcription,STAT)信号通路有关[33]。从本实验的Western blot结果可知,与正常对照组相比,STZ诱导的DM肾脏细胞Caspase-3和Bax/Bcl-2相对表达量显著上调。LLP联合有氧运动对降低肾脏细胞Caspase-3及Bax/Bcl-2的相对表达量最有效。结果提示,LLP和有氧运动能有效地下调Bax/Bcl-2和Caspase-3的表达,明显抑制DM大鼠肾脏细胞凋亡。
综上,LLP联合有氧运动能降低DM大鼠空腹血糖,增加INS的分泌,有效降低DM大鼠血脂水平,增加肾组织抗氧化酶的活性,使肾组织的结构和形态特征得到改善和恢复,明显抑制糖尿病肾脏细胞凋亡。
