紫苏醛对杨梅主要致病菌桔青霉的抑菌活性及作用机制
2023-09-12李瑞一吴伟杰房祥军陈杭君韩延超陈慧芝郜海燕
李瑞一,吴伟杰*,房祥军,陈杭君,韩延超,牛 犇,陈慧芝,郜海燕*
(浙江省农业科学院食品科学研究所,农业农村部果品采后处理重点实验室,农业农村部蔬菜采后保鲜与加工重点实验室(部省共建),浙江省果蔬保鲜与加工技术研究重点实验室,中国轻工业果蔬保鲜与加工重点实验室,浙江 杭州 310000)
杨梅(Myrica rubraSieb.et Zucc.)多成熟于6~7月高温潮湿的梅雨季节[1],其质地柔软多汁,组织形态为柱状多肉形态,在采后运输、贮藏等环节极易受到机械损伤以及病原微生物的侵害[2],不同地区造成杨梅病害的致病菌也存在些许差异[3],桔青霉(Penicillium citrinum)侵染造成的绿霉病是杨梅采后的主要病害之一[4]。桔青霉菌落颜色主要为黄绿色,带有白色边缘,侵染杨梅果实后表面会遍布绿色霉菌[5],造成果实硬度降低等变化,失去食用价值。传统的化学保鲜剂虽然可有效抑制采后杨梅果实病害的发生,但是随着人们对健康和环境保护的意识不断增强,寻找一种绿色健康、安全无毒的抑制杨梅采后腐败变质的处理方法迫在眉睫[6-7]。
紫苏醛是从紫苏叶中提取出来的一种无色或淡黄色且具有特殊香气的油状液体[8-9],具有良好的抑菌性[10-11]。已有研究证明,紫苏醛作为天然防腐剂能有效抑制采后葡萄和樱桃番茄因病原微生物侵染造成的腐败变质问题[12-13]。GB 2760—2014《食品安全国家标准 食品添加剂使用标准》明确规定,紫苏醛能够作为食用天然香料添加剂在食品中使用,具有良好的安全性[14]。因此,紫苏醛作为一种天然的绿色安全活性成分具有广阔的应用前景。本实验基于紫苏醛优良的抑菌性和安全性能,探讨紫苏醛对桔青霉的抑菌效果及抑菌机理,为紫苏醛对桔青霉的控制提供一定的理论依据,也为杨梅采后贮藏提供参考。
1 材料与方法
1.1 菌株、材料与试剂
桔青霉(Penicillium citrinum)由浙江省农业科学院食品科学研究所食品物流保鲜与品质调控团队从采后杨梅中分离获取,经鉴定为桔青霉,在PDA斜面培养基上于4 ℃保存。
紫苏醛 上海源叶生物科技有限公司;PDA、PDB上海盛思生物科技有限公司;ATP酶试剂盒 南京建成生物工程研究所;其余试剂均为分析纯。
1.2 仪器与设备
MLS-3781L-PC型高压蒸汽灭菌器 日本松下健康医疗器械;MJX-160B-Z型霉菌培养箱 上海博迅实业有限公司医疗设备厂;无菌超净工作台 江苏苏净集团有限公司;DDS-307型电导率仪 上海精密科学仪器有限公司;UV-9000紫外-可见分光光度计 上海元析仪器有限公司;TM-3000型扫描电子显微镜、H7650透射电子显微镜 日本日立公司;FTIR-1500傅里叶变换红外光谱仪深圳市亿鑫仪器设备有限公司。
1.3 方法
1.3.1 孢子悬浮液制备
将桔青霉接种在PDA上,经28 ℃培养7 d左右后用无菌水冲洗,经4 层200 目的无菌纱布过滤,得到孢子悬浮液。用血球计数板将孢子悬浮液浓度调整至1×106CFU/mL,备用。
1.3.2 桔青霉最小抑菌浓度测定
参考Pérez-Alfonso等[15]的方法并加以修改。将紫苏醛和含体积分数5%吐温-80的无菌水按体积比1∶1进行混合,配制成500 μL/mL的紫苏醛母液,4 ℃避光保存备用。待灭菌好的PDA自然冷却至45 ℃左右时,将不同体积的紫苏醛母液加入其中,形成终浓度分别为0、30、60、90、120 μL/L的含有紫苏醛的PDA平板,备用。使用打孔器在培养5 d左右的桔青霉菌落边缘打取直径6 mm左右菌饼,置于含有不同浓度紫苏醛的PDA平板中央,于28 ℃恒温培养箱中培养6 d,每天观察并用十字交叉法测量菌落直径,以能完全抑制桔青霉菌落生长的最小浓度为最小抑菌浓度(minimal inhibitory concentration,MIC)。每个处理组3 个平行,实验重复3 次。
1.3.3 不同浓度紫苏醛处理后桔青霉孢子萌发率测定
参考Li Hua等[16]的方法并加以修改。将不同体积500 μL/mL的紫苏醛母液分别加入到灭菌且冷却后的PDB中,形成体积分数分别为0、15、30、45、60 μL/L含有紫苏醛的PDB溶液。将适量桔青霉孢子悬浮液加入PDB溶液中,调整孢子浓度为1×106CFU/mL。分别吸取50 μL含有不同浓度紫苏醛的PDB孢子悬浮液于双凹载玻片上,并放在直径为200 mm的培养皿中,28 ℃培养15 h,9、12、15 h时观察孢子萌发数量(Ng)(芽管生长长度大于孢子直径视为萌发)。每个处理组 3 个平行,每次镜检孢子数200 个,孢子萌发率按公式(1)计算。
1.3.4 不同浓度紫苏醛处理对桔青霉菌丝生长抑制影响的测定
参考袁康等[17]的方法并加以修改。按照1.3.3节方法制备含有不同浓度紫苏醛(0、30、60、90、120 μL/L)的PDB溶液。加入适量孢子悬浮液,使得孢子浓度为5×105CFU/mL,置于28 ℃、180 r/min摇床培养3 d,过滤收集菌丝体。60 ℃烘干箱干燥24 h,称质量。每个处理组3 个平行,菌丝生长抑制率按公式(2)计算。
式中:mc表示未处理组菌丝体平均质量/g;ms表示处理组菌丝平均质量/g。
1.3.5 不同浓度紫苏醛处理后桔青霉细胞膜通透性指标测定
丙二醛(malondialdehyde,MDA)含量测定:吸取适量孢子悬浮液于PDB溶液中,使得孢子浓度为5×105CFU/mL,28 ℃、180 r/min摇床培养3 d。随后分别向PDB中加入适量500 μL/mL的紫苏醛母液,使每组PDB溶液中紫苏醛的浓度分别为0、30、60、90、120 μL/L。连续培养12 h,每3 h收集培养液,使用硫代巴比妥酸法[18]测定MDA含量。实验重复3次。
相对电导率测定:吸取适量孢子悬浮液于PDB溶液中,使得孢子浓度为5×105CFU/mL,28 ℃、180 r/min摇床培养3 d,过滤收集菌丝体。取2.0 g菌丝体放入30 mL含有0、30、60、90、120 μL/L紫苏醛的无菌水中,28 ℃、180 r/min摇床培养12 h,每3 h利用电导率仪测定上清液的电导率,最后用沸水煮沸处理10 min,冷却至室温,再次测定电导率,相对电导率按公式(3)计算,实验重复3 次。
式中:e0表示0 h的电导率/(μS/cm);e1表示沸水处理后的电导率/(μS/cm)。
1.3.6 扫描电子显微镜观察不同浓度紫苏醛处理后的桔青霉
参照He Lili等[19]的方法并加以修改,在培养5 d的桔青霉菌用打孔器打取直径6 mm左右的菌饼,分别放置于含有0、60、90 μL/L紫苏醛的PDA板中央,28 ℃培养6 d后收集菌丝体,经固定、脱水、喷金处理,使用扫描电子显微镜观察拍照。
1.3.7 透射电子显微镜观察不同浓度紫苏醛处理后的桔青霉形态
参考Bonora等[20]的方法并加以修改,在培养5 d的桔青霉菌培养基中用打孔器打取直径6 mm左右的菌饼,分别放置于含有0、60、90 μL/L紫苏醛的PDA板中央,28 ℃培养6 d,经固定、脱水、切片后,使用透射电子显微镜拍照观察。
1.3.8 不同浓紫苏醛处理后桔青霉细胞内容物泄漏量的测定
参照1.3.5节相对电导率测定法收集菌丝体,取2.0 g菌丝体放入30 mL含有0、30、60、90、120 μL/L紫苏醛的无菌水中,28 ℃、180 r/min摇床培养5 h,每小时吸取上清液,参考Pei Shaopei等[21]的方法进行可溶性糖、可溶性蛋白及核酸(260 nm)泄漏量的测定。
1.3.9 不同浓度紫苏醛处理后桔青霉麦角固醇含量测定
按照1.3.4节方法得到桔青霉菌丝体,参考袁康等[17]的方法并加以修改。使用无菌蒸馏水冲洗两遍后加入5 mL 25%(质量分数)的氢氧化钾-乙醇溶液。漩涡振荡3 min,85 ℃水浴3 h,加入2 mL蒸馏水和5 mL正庚烷后振荡3 min,收集正庚烷层溶液,测定麦角固醇含量。
1.3.10 不同浓度紫苏醛处理后桔青霉线粒体ATP酶活力测定
按照1.3.4节方法得到桔青霉菌丝体,使其重悬于缓冲溶液中(含有50 mmol/L Tris(pH 7.0)、2 mmol/L乙二胺四乙酸、1 mmol/L苯基甲磺酰氟,下同),振荡3 min,10 000 r/min离心20 min,取上清液,加入2%(体积分数)葡萄糖溶液破坏细胞得到线粒体,先2 000 r/min离心5 min,接着10 000 r/min离心30 min,弃上清液后加入1 mL缓冲液重悬后使用ATP酶试剂盒检测桔青霉中的线粒体ATP酶活力。
1.3.11 不同浓度紫苏醛处理后桔青霉几丁质含量测定
几丁质含量测定参考曾辉等[22]方法并略加修改,按照1.3.4节方法得到桔青霉菌丝体,准确称取0.3 g桔青霉菌丝体,向其中加入2 mL、质量分数60% H2SO4,室温放置1 d。加入适量蒸馏水将H2SO4浓度稀释到1 mol/L,沸水浴1 h,冷却到室温后加入1 mol/L NaOH溶液中和至中性,使用磷酸盐缓冲液(0.01 mol/L,pH 7.0)定容至100 mL。取1 mL待测样液(0.25 mL蒸馏水作空白),加入0.5 mL乙酰丙酮溶液后沸水浴0.5 h,冷却至室温后加入1 mL无水乙醇和0.5 mL对二氨基苯甲醛溶液,摇匀后加入2 mL无水乙醇,60 ℃水浴1 h,使用紫外-可见分光光度计测定495 nm波长处的吸光度。
1.3.12 不同浓度紫苏醛处理后桔青霉总脂质含量测定
按照1.3.11节方法,称取0.1 g菌丝体于离心管中,加入0.8 mL蒸馏水、2 mL氯仿溶液、1 mL甲醇,漩涡振荡3 min,60 ℃水浴30 min,10 000 r/min离心20 min,吸取氯仿层到新离心管中,加入0.2 mL生理盐水,漩涡振荡,待分层后取氯仿相至玻璃管中,加入500 μL浓硫酸后沸水浴10 min,冷却至室温后加入3 mL磷酸香草醛溶液,以无菌水为对照(CK),测定520 nm波长处的吸光度,以胆固醇质量浓度(0~120 μg/mL)为横坐标,吸光度为纵坐标制作标准曲线。
1.3.13 不同浓度紫苏醛处理后桔青霉傅里叶变换红外光谱测定
按照1.3.4节方法得到桔青霉菌丝体,使用磷酸盐缓冲液(0.01 mol/L、pH 7.0)冲洗2~3 次后使用冷冻干燥机冻干备用。将冻干后的物质与光谱级溴化钾进行混合研磨,使用傅里叶变换红外光谱仪进行测定。
1.4 数据处理与分析
使用Excel软件进行数据处理,运用SPSS软件中单因素方差分析进行统计学分析,P<0.05时表示差异显著,利用Origin 2021软件作图。
2 结果与分析
2.1 不同浓度紫苏醛处理对桔青霉抑菌效果的影响
如图1A、B所示,随着紫苏醛浓度的增大,菌落直径显著减小,在培养到第6天时,120 μL/L紫苏醛处理的桔青霉菌落则完全不生长,初步确定紫苏醛抑制桔青霉生长的MIC为120 μL/L。如图1C所示,随着紫苏醛浓度的升高,孢子萌发率显著下降,在培养15 h后,对照组(0 μL/L)孢子超过85%已经萌发,15、30、45、60 μL/L紫苏醛处理组的萌发率分别为69.67%、50.50%、20.83%、9.00%,表明紫苏醛处理能够显著抑制桔青霉孢子的萌发。从图1D可以看出,随着紫苏醛浓度的升高,桔青霉菌丝质量呈现显著降低趋势,与对照组(0 μL/L)相比,30、60、90、120 μL/L紫苏醛处理组中菌丝生长抑制率为15.13%、47.70%、91.42%、99.09%,抑制桔青霉菌丝体生长的效果十分明显。综上所述,紫苏醛在直接接触桔青霉菌丝及孢子的情况下,能够有效抑制菌丝和孢子的生长,且抑制效果呈现明显的剂量-效应关系。

图1 不同浓度紫苏醛对桔青霉菌丝生长(背)(A)、菌落直径(B)、孢子萌发率(C)和菌丝质量(D)的影响Fig.1 Effects of different concentrations of perillaldehyde on mycelial growth (dorsal) (A), colony diameter (B), spore germination rate (C) and mycelial biomass(D) of P.citrinum
2.2 不同浓度紫苏醛处理对桔青霉细胞膜通透性的影响
细胞膜通透性是衡量抑菌效果的重要依据[23]。MDA是细胞膜脂质过氧化的重要产物,其含量能够间接表征细胞膜氧化受损的程度[24]。如图2A所示,随着紫苏醛浓度升高和处理时间延长,MDA含量呈现上升的趋势,,处理12 h后,30、60、90、120 μL/L紫苏醛处理组的MDA含量分别为0.74、0.85、1.04、1.24 nmol/g,对照组(0 μL/L)MDA含量显著低于各处理组(P<0.05)。从图2B可以看出,随着紫苏醛浓度增加和处理时间延长,相对电导率增加,处理6 h后,30、60、90、120 μL/L紫苏醛处理组的相对电导率分别为13.28%、19.56%、2 3.4 1%、3 1.4 4%,显著高于对照组(0 μ L/L)(P<0.05)。综上,紫苏醛处理能够加剧桔青霉细胞膜脂过氧化,增加细胞膜相对电导率,表明紫苏醛处理可能破坏了桔青霉的细胞膜结构,这和刘达照[25]的研究结果相似。

图2 不同浓度紫苏醛处理对桔青霉MDA含量(A)和相对电导率(B)的影响Fig.2 Effects of different concentrations of perillaldehyde on MDA content (A) and relative electrical conductivity (B) of P.citrinum
2.3 不同浓度紫苏醛处理对桔青霉形态的影响
对照组(0 μL/L)桔青霉菌丝呈现管状、线性的正常形态,质地均匀、光滑,顶端为扫帚状的分生孢子头(图3A1、A2);经60 μL/L紫苏醛处理后的桔青霉菌丝部分出现断裂,且顶端扫帚状分生孢子头消失(图3B1、B2);经90 μL/L紫苏醛处理后菌丝融断现象严重,且菌丝杂乱无章地聚集到一起,顶端扫帚状分生孢子头完全消失,菌丝形态完全遭到破坏(图3C1、C2)。陶能国等[26]也发现醛类物质能够破坏青霉细胞的完整性,改变膜通透性。潘旭迟等[27]研究表明植物提取物处理的菌丝会出现溶解,褶皱等现象。综上所述,紫苏醛可能通过破坏膜完整性使真菌死亡,通过破坏膜的完整性,促进胞内水解酶泄漏,导致细胞自融,从而改变桔青霉的形态。

图3 紫苏醛处理后桔青霉菌丝的扫描电子显微镜图Fig.3 Scanning electron microscopic images of P.citrinum mycelia treated with perillaldehyde
2.4 不同浓度紫苏醛处理对桔青霉超微结构的影响
从图4A1、A2可以看出,未经过紫苏醛处理的桔青霉细胞壁、质膜均具有良好的完整性,胞内拥有完整的细胞质基质和细胞器,桔青霉细胞之间有明显的质膜界限,层次感分明。经60 μL/L紫苏醛处理的桔青霉细胞细胞壁遭到破坏,细胞内容物泄漏,细胞质膜模糊,结构发生变化,部分出现轻微的质壁分离现象(图4B1、B2)。经90 μL/L紫苏醛处理的桔青霉细胞质基质降解以及大量细胞器破裂,出现不规则的囊泡,造成严重质壁分离现象(图4C1、C2)。王近近等[28]研究也发现精油处理能够破坏灰葡萄孢霉细胞壁,细胞器受损,出现质壁分离现象。综上所述,紫苏醛处理可以破坏桔青霉菌丝体细胞的超微结构,导致细胞死亡。

图4 紫苏醛处理后桔青霉菌丝的透射电子显微镜图(×20k)Fig.4 Transmission electron microscopic images of P.citrinum mycelia treated with perillaldehyde (× 20k)
2.5 不同浓度紫苏醛对桔青霉细胞内容物泄漏量的影响
细胞内容物渗漏量是判定细胞膜损伤的重要指标。从图5可以看出,随着处理时间的延长,对照组(0 μL/L)的可溶性蛋白、可溶性糖以及核酸泄漏量情况基本没有发生变化。紫苏醛处理组中随着时间的延长以及紫苏醛浓度的增加,各物质泄漏量上升。与0 h相比,处理5 h时120 μL/L紫苏醛处理组桔青霉可溶性蛋白、可溶性糖和核酸泄露量分别增加了71.20%、210.93%和117.31%,此时120 μL/L紫苏醛处理组可溶性蛋白、可溶性糖以及核酸泄漏量显著高于其他组(P<0.05)。结果表明紫苏醛能够增加桔青霉细胞的通透性,推测可能是因为紫苏醛作为脂溶性物质,能够与桔青霉细胞膜中磷脂双分子层相互作用,导致细胞膜的破损,进而导致桔青霉细胞内容物泄漏[21],细胞内外物质交换失衡,进而诱导桔青霉细胞凋亡。
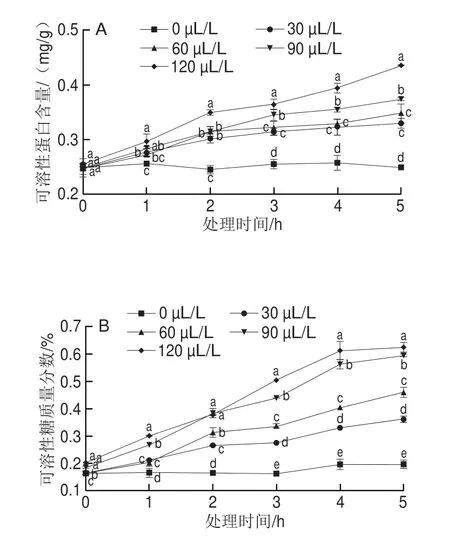

图5 不同浓度紫苏醛对桔青霉细胞内可溶性蛋白(A)、可溶性糖(B)和核酸(C)泄漏量的影响Fig.5 Effects of different concentrations of perillaldehyde on leakage of soluble carbohydrate (A), soluble protein (B) and nucleic acid (C) from the mycelia of P.citrinum
2.6 不同浓度紫苏醛对桔青霉麦角固醇、几丁质、总脂质水平和线粒体ATP酶活力的影响
几丁质和麦角固醇分别是真菌细胞壁和细胞膜中重要的组成成分,其中麦角固醇能够调节细胞膜流动性,维持细胞膜中蛋白酶的正常工作和质膜蛋白的定位功能[29],而几丁质为抗菌物质的常用靶点[30]。从图6A中可以看出,随着紫苏醛浓度的升高,桔青霉中麦角固醇含量呈现下降趋势,0、30、60、90 μL/L紫苏醛处理组中麦角固醇含量分别为1.70、1.12、0.56、0.34 mg/g,对照组(0 μL/L)麦角固醇含量显著高于其他各组(P<0.05)。由图6B可知,随着紫苏醛浓度的增加,几丁质水平呈现下降的趋势。0、30、60、90 μL/L紫苏醛处理组几丁质水平分别为94.87、68.54、56.83、33.23 μg/mL,对照组几丁质水平显著高于各处理组(P<0.05)。从图6C可以看出,随着紫苏醛浓度的增加,桔青霉总脂质含量呈现下降趋势,0、30、60、90 μL/L紫苏醛处理组中总脂质含量分别120.26、88.05、35.89、22.55 mg/g,对照组(0 μL/L)含量显著高于其他各处理组(P<0.05)。线粒体ATP酶作为细胞代谢中一种关键酶,其活力的下降会导致细胞中ATP酶生成量不足,进而引发细胞死亡[31],从图6D可以看出,随着紫苏醛浓度的上升,桔青霉的线粒体ATP酶活力呈现下降趋势。0、30、60、90 μL/L紫苏醛处理组中ATP酶活力分别为11.50、5.21、3.08、1.45 U/mg pro,对照组显著高于处理组(P<0.05)。综上,与未处理组相比,经过90 μL/L紫苏醛处理的桔青霉中麦角固醇、总脂质、几丁质水平和线粒体ATP酶活力下降了80.00%、81.25%、64.97%和87.40%,紫苏醛能够破坏桔青霉细胞壁,使细胞支架遭到破坏,此外,桔青霉可能抑制桔青霉中某些膜蛋白的功能和破坏膜的完整性,抑制麦角固醇等的生成,使总脂质含量下降,这可能会改变脂溶性和水溶性物质的运输速率[32],破坏桔青霉细胞膜的选择透过性,从而进一步抑制线粒体ATP酶活力,导致细胞消耗ATP能力降低,使桔青霉细胞死亡。
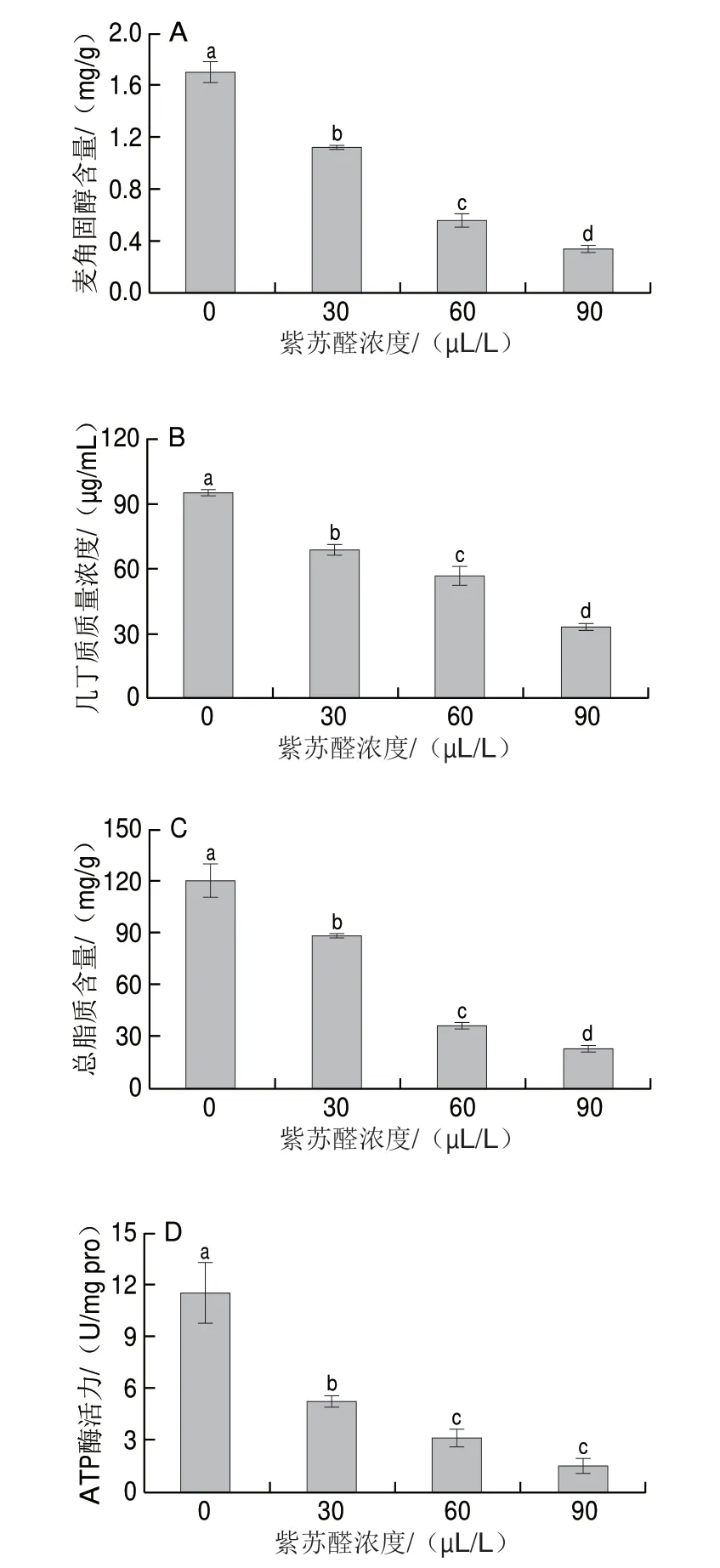
图6 不同浓度紫苏醛对桔青霉麦角固醇(A)、几丁质(B)、总脂质(C)水平和线粒体ATP酶活力(D)的影响Fig.6 Effects of different concentrations of perillaldehyde on ergosterol content (A), chitin content (B), total lipids content (C) and mitochondrial ATPase activity (D) of P.citrinum
2.7 不同浓度紫苏醛处理后桔青霉的傅里叶变换红外光谱
从图7可以看出,不同组桔青霉菌丝体傅里叶红外光谱图的特征峰出现的位置几乎相同,但峰强度有所差异。在3 380 cm-1波数附近出现羟基(—OH)的伸缩振动,在2 925 cm-1波数附近出现了甲基(—CH3)和亚甲基(—CH2—)的伸缩振动,在1 653 cm-1波数附近出现芳香族骨架振动,在1 547 cm-1波数附近出现苯环碳骨架的振动,且随紫苏醛处理浓度增加,这些峰强度减小,推测桔青霉羟基结构、甲基、亚甲基数量减少,脂肪组物质、碳水化合物、木质素等含量减少[33]。结果表明紫苏醛处理桔青霉可能使菌丝体内部物质含量发生变化。

图7 不同浓度紫苏醛处理后桔青霉的傅里叶变换红外光谱Fig.7 FTIR spectra of P.citrinum treated with different concentrations of perillaldehyde
3 讨 论
随着生活水平的升高,人们对货架果蔬的品质要求也越来越高。在果蔬保鲜过程中,化学合成的防腐剂和杀菌剂被广泛使用,但都具有一定的安全隐患。开发绿色安全的天然抑菌剂已经成为研究热点,利用植物代谢产生的挥发性物质作为高效无毒环保的抑菌剂具有极广阔的应用前景。
紫苏醛作为从紫苏叶中提取出来的绿色天然活性成分[34],具有良好的安全性、抗菌、抗氧化性等,能够通过直接接触的方式抑制杨梅主要致病菌桔青霉菌丝生长及孢子萌发。本研究结果表明,紫苏醛能够破坏桔青霉细胞壁和细胞膜的完整性,导致几丁质和麦角固醇含量下降,该结果与紫苏醛导致甘薯黑斑病菌细胞膜中麦角固醇含量降低、破坏甘薯黑斑病菌细胞膜流动性和完整性的研究结果[10]相似。本研究发现,紫苏醛处理能够加剧桔青霉细胞膜脂过氧化,提高细胞膜的相对电导率,降低总脂质含量,从而会改变细胞膜的选择通过性,进一步抑制线粒体ATP酶活力,促使细胞内ATP含量下降,干扰细胞内能量代谢过程,诱导细胞死亡,与袁康等[17]研究的紫苏精油抑制灰绿曲霉的活性和机理相似。此外,紫苏醛处理导致桔青霉蛋白质、碳水化合物和核酸等物质流失,破坏了蛋白质和遗传物质结构,从而发挥抑制桔青霉的效果[35-36],由此推测紫苏醛的抑菌机理可能与其拥有较强极性和穿透力的理化性质相关[37],紫苏醛拥有极强的亲脂性,能够和桔青霉细胞膜发生反应,导致其细胞膜的特性发生改变从而影响菌丝体生长,随后进一步穿透细胞膜,进入细胞内部,干扰细胞能量代谢等过程,从而降低桔青霉细胞整体的活性,达到抑菌效果。
本研究结果表明,紫苏醛可以破坏桔青霉的菌丝形态和超微结构、破坏细胞膜结构及其通透性、扰乱能量代谢过程、影响生物大分子合成、破坏蛋白质及遗传物质结构,从而发挥抑菌作用。因此,紫苏醛作为植物源抑菌物质具有一定的研究和开发价值,本实验可为绿色安全的天然保鲜剂研发提供理论基础。
