人参炔三醇抑制氧化低密度脂蛋白诱导泡沫细胞形成的作用机制研究
2023-09-08靳凤玉赵一慕高云阴紫钰马家乐王凌潇赵云芳郑姣
靳凤玉 赵一慕 高云 阴紫钰 马家乐 王凌潇 赵云芳 郑姣
动脉粥样硬化(atherosclerosis,As)病因复杂,是导致心脑血管疾病发生和发展的重要病因。动脉粥样硬化的形成是一个慢性炎症过程,其特征是胆固醇在动脉内膜过度沉积,从而引起不同程度的血管腔狭窄和堵塞[1, 2]。泡沫细胞的形成被认为是动脉粥样硬化过程中最重要的细胞学改变,而巨噬细胞是泡沫细胞主要来源,因此抑制巨噬细胞泡沫化是防治动脉粥样硬化的手段之一。白细胞分化抗原36(cluster of differentiation, CD36)是巨噬细胞摄取氧化脂蛋白的主要受体,促使巨噬细胞转化为富含脂质的泡沫细胞,是动脉粥样硬化治疗的重要潜在靶点。
人参为五加科人参属植物,其味甘,微苦,具有补气,固脱,安神,益智等功效。课题组前期对人参中分离得到的单体化学成分进行活性筛选,发现人参炔三醇(panaxytriol,PXT)对泡沫细胞形成具有明显的抑制活性。目前,尚未见PXT抑制泡沫细胞形成作用及机制报道,因此本论文以抑制泡沫细胞形成为切入点,探讨PXT抑制单核巨噬细胞脂质沉积的作用机制,为其治疗动脉粥样硬化诱发的心脑血管疾病提供理论依据。
1 材料与方法
1.1 药物
本研究所使用药物为课题组自制。课题组前期从人参中分离得到活性化合物,经MS、1H-NMR和13C-NMR鉴定与文献报道人参炔三醇结构一致,课题组鉴定其为人参炔三醇,纯度>98%。用二甲基亚砜溶解后,置于-20℃冰箱储存,实验时用1640培养基溶解为所需浓度。
1.2 细胞
急性单核细胞白血病细胞(THP-1)购于中国医学科学院基础医学研究所细胞资源中心(资源编号:1101HUM-PUMC000057)。
1.3 试剂与仪器
RPMI-1640培养基(Corning公司);0.25%胰蛋白酶(Corning公司);100×青霉素—链霉素混合溶液(Corning公司);胎牛血清(Corning公司);氧化低密度脂蛋白(oxidized low density lipoprotein, oxLDL)(广州奕源生物科技有限公司);DiI-oxLDL(广州奕源生物科技有限公司);二甲基亚砜(dimethyl sulfoxide, DMSO)(Sigma公司);佛波酯(PMA)(Sigma公司);甲醇(天津市致远化学试剂有限公司);脱脂奶粉(BD公司);PVDF膜(Millipore公司);ECL化学发光液(Thermo Fisher Scientific公司)。三磷酸腺苷结合盒转运体A1(ATP-binding cassette transporter A1,ABCA1)(NB400-105,Novus Biologicals);CD36(#14347,Cell Signaling Technology);GAPDH(60004-1-Ig,Proteintech);SRA1(ab183725,Abcam);SRB1(ab52629,Abcam);抗兔IgG-HRP二抗(#7074,Cell Signaling Technology);抗鼠IgG-HRP二抗(sc-2005,SantaCruz)。
1.4 细胞培养
THP-1细胞用含有10%胎牛血清,1%青霉素和链霉素的1640完全培养基,于37°C,含5% CO2体积分数的饱和湿度培养箱内培养,细胞密度达到80%~90%时需要进行传代,传代比例为1∶6,每3~4天传代一次。
1.5 PMA诱导THP-1细胞分化及细胞毒性试验
处于对数生长期的THP-1细胞以5×104个/mL的密度接种到96孔板,以100 nmol/L的PMA刺激48小时使其分化为巨噬细胞,设空白组(只含培养基)、正常组(含有细胞和培养基),给药组分别给予1 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L PXT,每组设6个复孔,边缘用PBS填充,置于培养箱中培养24小时。弃去培养基后,以PBS清洗一次,加入MTT溶液继续于培养箱培养4小时,之后加入150 μL DMSO,振荡10分钟,于490 nm波长下检测各孔的吸光度值,并计算各组细胞存活率。
细胞存活率(%)=(实验孔吸光度值-空白孔吸光度值)/(正常组孔吸光度值-空白孔吸光度值)×100%
1.6 流式细胞术、荧光显微成像检测脂质摄取
处于对数生长期的THP-1细胞以5×105个/mL的密度接种到96孔板,以100 nmol/L的PMA刺激48小时使其分化为巨噬细胞,每组设3个复孔,除正常组外,均加入50 μg/mL DiI荧光标记氧化低密度脂蛋白(DiI-oxLDL)诱导泡沫细胞形成,加入不同浓度PXT(0 μmol/L、1 μmol/L、5 μmol/L、10 μmol/L)共同孵育24小时,之后经过PBS洗涤3次,利用倒置荧光显微镜观察各组细胞内的DiI-oxLDL荧光,利用Image J软件对各组细胞内荧光强度进行定量分析。
或各孔经清洗后胰酶消化,吹打成单细胞悬液,利用流式细胞仪分析细胞中的荧光强度。
1.7 油红O染色测定细胞脂质沉积
按照1.6所述方法铺板,PMA刺激细胞分化,每组设置3个复孔,除正常组外,加入50 μg/mL oxLDL诱导泡沫细胞形成,不同浓度的PXT(0 μmol/L、1 μmol/L、5 μmol/L、10 μmol/L)共同孵育24小时。弃去孔内培养基,用PBS清洗三次后,多聚甲醛固定10分钟,再用PBS清洗3次,加入60%异丙醇进行分化,最后用油红O染色30分钟,对细胞内脂质进行染色,洗去浮色后,在光学显微镜下观察各组细胞内的红色脂滴,确认细胞内脂质沉积情况,利用Image J软件对各组细胞内脂滴面积进行定量分析。
1.8 Western blot检测蛋白表达水平
处于对数生长期的THP-1细胞以1×106个/mL的密度接种到6孔板,以100 nmol/L的PMA刺激48小时使其分化为巨噬细胞,除正常组外,加入50 μg/mL oxLDL诱导泡沫细胞形成,同时采用不同浓度的PXT(0 μmol/L、1 μmol/L、5 μmol/L、10 μmol/L)共同孵育24小时。加入细胞裂解液,使细胞完全裂解,99℃加热变性10分钟。采用恒压100 V进行电泳,电转条件为恒流400 mA,90分钟。电转结束后,用含5%脱脂奶粉的TBST低温封闭90分钟。经TBST清洗后,进行抗体孵育,一抗4℃孵育过夜,TBST洗涤条带,二抗孵育4小时,进行化学发光显影,实验重复3次。
1.9 统计方法
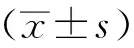
2 结果
2.1 PXT对THP-1单核巨噬细胞的毒性作用
与正常组相比,PXT低、中、高剂量组细胞活性均无明显的差异,而PXT最高剂量组细胞活性明显降低(P<0.05)(表1),因此后续实验的给药浓度均低于10 μmol/L。
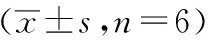
表1 人参炔三醇对THP-1巨噬细胞存活率影响
2.2 流式细胞仪检测细胞对DiI-oxLDL的摄取
利用DiI-oxLDL孵育PMA诱导后的THP-1细胞,通过检测细胞内DiI荧光强度,确定细胞内脂质含量。流式细胞荧光检测发现,与正常组相比,模型组细胞中DiI-oxLDL含量显著增加(P<0.05),与模型组比较,PXT中、高剂量组细胞内的荧光强度显著降低(P<0.05)(图1,表2),表明PXT可以剂量依赖地降低细胞中脂质含量,通过抑制巨噬细胞对脂质的吞噬,从而抑制泡沫细胞的形成。
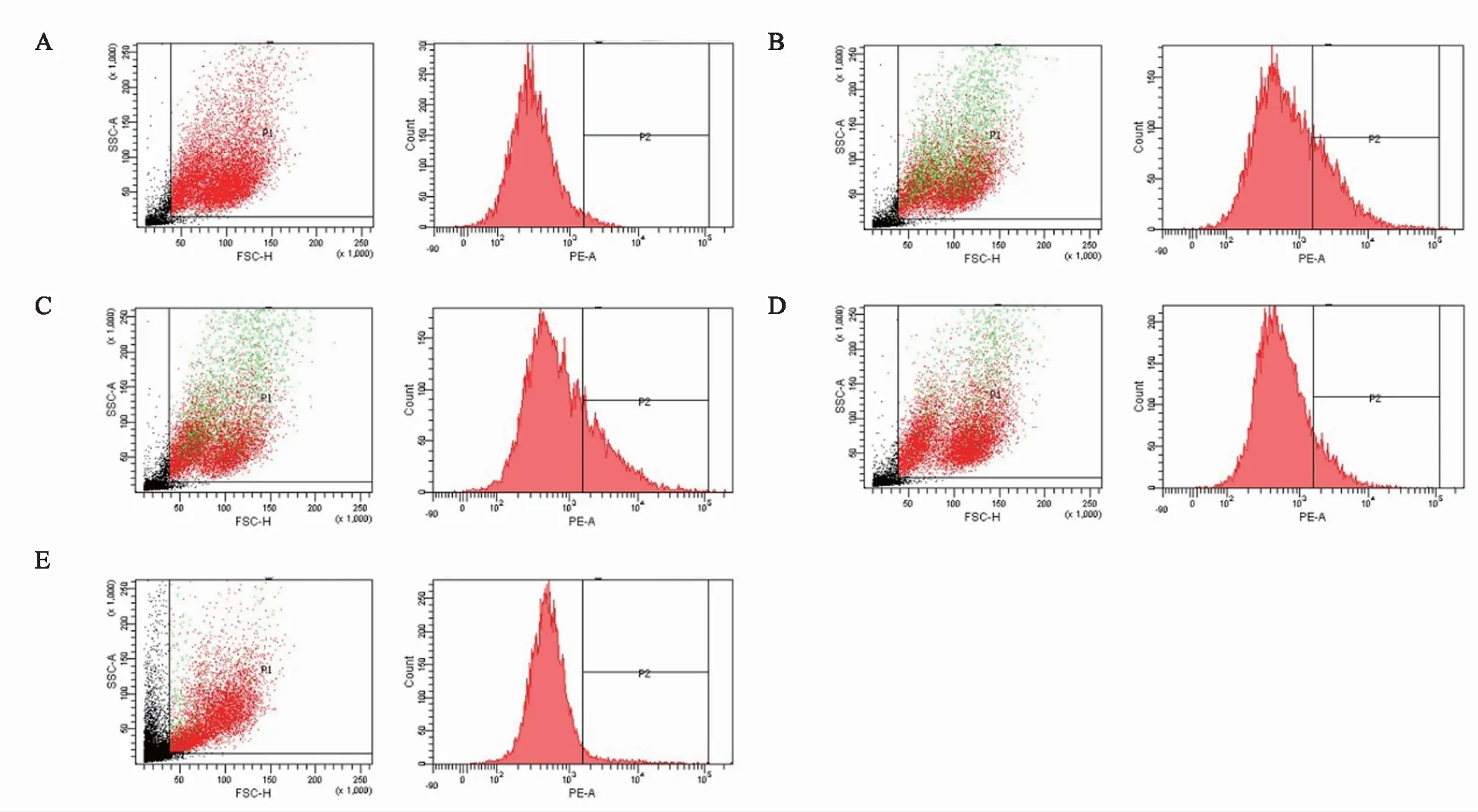
注:A 正常组;B 模型组;C PXT低剂量组;D PXT中剂量组;E PXT高剂量组。图1 人参炔三醇对巨噬细胞DiI-oxLDL沉积的影响

表2 人参炔三醇对巨噬细胞DiI-oxLDL沉积的影响
2.3 荧光显微镜观察细胞对DiI-oxLDL的摄取
利用倒置荧光显微镜观测细胞内DiI荧光强度,确定细胞内脂质含量,之后利用Image J软件进行定量分析。细胞荧光成像结果与流式细胞检测结果一致,与正常组比较,模型组细胞中DiI-oxLDL含量显著增加(P<0.05),与模型组比较,PXT中、高剂量组细胞中荧光减少且具有显著性差异(P<0.05)(图2,表3),证实PXT可以抑制泡沫细胞的形成。

图2 PXT对DiI-oxLDL诱导的巨噬细胞脂质摄取的影响

表3 PXT对DiI-oxLDL诱导的巨噬细胞脂质摄取的影响
2.4 油红O染色测定泡沫细胞脂质含量
油红O可将细胞内的脂质染成红色,利用Image J软件对红色脂滴进行定量分析,与正常组比较,模型组巨噬细胞内脂滴数量明显增加(P<0.05),而PXT能够剂量依赖性地降低oxLDL诱导的巨噬细胞内脂质蓄积(见图3,表4)。
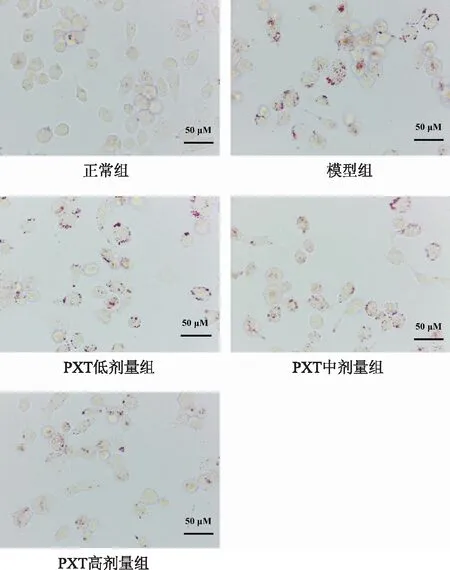
图3 油红O染色检测PXT对THP-1脂质沉积的影响
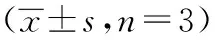
表4 油红O染色检测PXT对THP-1脂质沉积的影响
2.5 PXT对THP-1单核巨噬细胞脂质转运相关蛋白表达的影响
在泡沫细胞发生的过程中,巨噬细胞通过清道夫受体CD36、SR-A1和LOX1吞噬oxLDL[3-5],通过胆固醇逆向转运相关蛋白ABCA1、ABCG1、SR-B1促进脂质的外排[6-8]。因此我们利用Western blot对脂质吞噬和外排两方面蛋白的表达进行研究,发现PXT抑制泡沫细胞形成过程中的作用靶标。实验结果发现,与正常组相比,oxLDL可显著上调清道夫受体蛋白CD36的表达水平(P<0.05),与模型组比较,PXT高剂量显著抑制了CD36的蛋白表达水平(P<0.05)(见图4,表5),而PXT对ABCA1、SRA1、SRB1等蛋白的表达无明显影响。
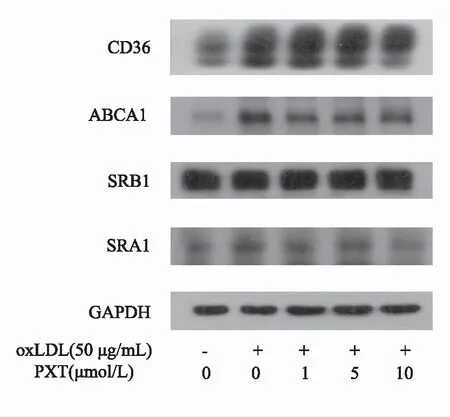
图4 PXT对巨噬细胞脂质转运蛋白表达的影响
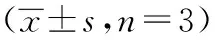
表5 PXT对巨噬细胞脂质转运蛋白表达的影响
3 讨论
近年来,动脉粥样硬化的发病率明显上升,由此引发的冠心病、脑卒中等心脑血管疾病成为死亡的首要原因。中医认为,动脉粥样硬化的发病机制与“脉痹”相吻合[9,10],故临床中多采取益气活血、化痰祛瘀为主要治法[11,12]。人参皂苷Rb1[13]、Rd[14]、Rg1[15]以及化合物K[16]均表现出良好的抗动脉粥样硬化活性,尤其在改善动脉粥样硬化的发生发展、抑制动脉粥样硬化斑块的形成、延缓心血管疾病的发病等方面具有重要作用,但是人参炔醇类成分对于动脉粥样硬化的治疗活性尚未见报道。
泡沫细胞的形成是动脉粥样硬化斑块形成和发展的重要标志,在动脉粥样硬化病变中靶向干预泡沫细胞形成可能是预防和治疗动脉粥样硬化的一种有前景的方法[17]。当巨噬细胞胆固醇流入和酯化增加而流出减少时,会导致泡沫细胞的形成[18,19],胆固醇稳态的破坏可能导致斑块坏死核心内的晶体积聚,导致机械损伤和斑块破裂。油红O染色、流式细胞术均显示oxLDL能够诱导巨噬细胞分化成为泡沫细胞,致使脂质在泡沫细胞中大量蓄积,而PXT显示出抑制泡沫细胞中的脂质蓄积的药理活性。
泡沫细胞中脂质含量的减少可能原因有两个方面,一是胆固醇摄取减少,二是通过胆固醇逆向转运,使细胞中胆固醇流出到细胞外[20]。为探讨PXT如何影响泡沫细胞脂质转运过程,于是对参与胆固醇转运的受体进行研究,研究发现PXT能够抑制CD36的表达水平,而对其他脂质转运蛋白无显著影响。CD36在巨噬细胞泡沫化过程中的发挥重要作用[21],其能介导过量的oxLDL摄取、内化,从而促进动脉粥样硬化的发生和发展。上述结果表明PXT是通过减少脂质摄取,而不是通过促进胆固醇逆向转运,抑制泡沫细胞内脂质蓄积。
以上结果提示PXT具有抑制巨噬细胞脂质蓄积的药理活性,其机制可能与通过抑制CD36的表达,抑制巨噬细胞泡沫化有关,具体的调控机制还需进一步研究。
