流速对草鱼幼鱼抗氧化性能的影响
2023-09-06朱杰胄梁骁李婧钰汤蓉李莉李大鹏张曦
朱杰胄,梁骁,李婧钰,汤蓉,李莉,李大鹏,张曦
(1.嘉兴市渔业管理服务站,浙江 嘉兴 314050;2.华中农业大学水产学院,水产养殖国家级实验教学示范中心,长江经济带大宗水生生物产业绿色发展教育部工程研究中心,池塘健康养殖湖北省工程实验室,湖北 武汉 430070;3.浙江省农业科学院水生生物研究所,浙江 杭州 310021)
近年来,随着人类合理膳食营养意识的普及,对高营养价值的蛋白需求日益增加。鱼类的主要食用部分肌肉是富含多不饱和脂肪酸(PUFA)和平衡氨基酸的优质蛋白源[1]。但在鱼类养殖过程中容易遭受氧化应激,大量产生的活性氧ROS 会导致DNA、类固醇成分以及细胞膜不饱和脂质的过氧化,损伤器官[2]。而鱼类肌肉中这种脂质氧化会损失膜功能和流动性,最终导致鱼体营养的缺失,影响鱼体的生长及品质[3]。
生物和非生物因素影响鱼类抗氧化防御反应。鱼类的行为和环境因素,例如食物种类、温度、溶解氧、环境毒素、寄生虫等,均可以增强或减弱抗氧化能力[4]。酶促抗氧化防御主要是由SOD、GSH-Px 以及CAT 完成。其中CAT 和GSH-PX 是机体酶促抗氧化系统中的重要酶类,用以清除体内过量的ROS[5,6]。SOD 通过促进O2-转变为H2O2的方式来清除体内的O2-[7]。T-AOC 用以衡量机体的抗氧化能力,反映其清除自由基的能力[8]。游泳运动是贯穿鱼类生活史的行为运动,对维持鱼类生命活动具有重要作用。研究发现,游泳训练能促进养殖鱼类的生长,通过适宜的水流速度可诱导养殖鱼类游泳运动,提高摄食及非特异性免疫等[10-13],而这均与机体抗氧化能力的提升密切相关[4]。对软骨鱼类与硬骨鱼类的研究发现,鱼类抗氧化能力取决于游泳性能的强弱,而不是其进化关系[14]。可见,游泳运动对养殖鱼类抗氧化能力有直接影响[15],因此,越来越多的研究着眼于通过游泳训练提升鱼类养殖品质。
草鱼(Ctenopharyngodon idellus)是我国重要的淡水养殖种类,2021 年淡水养殖鱼类总产量为2 586.38 万t,其中草鱼的产量为557.1 万t,占比约21.5%[16]。如何能够更好更高效地养殖高品质草鱼是水产养殖关注的重点问题之一。当前草鱼可以通过流道养殖、工厂化循环水养殖诱导其进行逆流游泳来养殖。相关研究多侧重于流速运动训练促进草鱼的长生[17],但肝脏、肌肉是草鱼易受ROS 损伤的组织,不同强度的运动训练对草鱼不同肌肉部位有何影响尚未明确报道。本试验采用封闭循环水养殖系统,探讨了不同水流刺激对草鱼幼鱼的长期运动训练,对草鱼幼鱼红肌、腹肌、尾肌、肝脏抗氧化能力的影响,旨在确定草鱼适宜流速范围,为草鱼流道养殖模式提供基础数据和理论基础。
1 材料与方法
1.1 材料
本实验用草鱼体质量(92.76±6.63)g,来源于湖北省黄冈市团凤县百容良种场,在“华中农业大学水产学院教学实习基地”完成整个实验鱼的养殖过程。
利用总蛋白、相关抗氧化能力测定试剂盒和酶标仪,测定草鱼红肌、腹肌、尾肌以及肝脏的相关抗氧化酶酶活和总抗氧化能力;利用RNA 提取试剂盒、cDNA 合成试剂盒、PCR 扩增试剂盒和实时荧光定量PCR 仪,完成草鱼红肌、腹肌、尾肌以及肝脏的相关抗氧化基因的荧光定量PCR 实验。
1.2 方法
1.2.1 实验鱼饲养
将草鱼放在直径1 m、水深78 cm 的塑料圆柱鱼缸暂养2 个月(4—6 月),期间溶氧水平保持在7 mg/L,水温大约在22 ℃~24 ℃之间。在饲养期间,每天投喂草鱼2 次。然后进行为期70 d 的养殖试验,将草鱼分别在0 bl/s(对照组)、0.5 bl/s、1 bl/s 和1.5 bl/s 流速下,每组3 个平行养殖缸,每缸14 尾鱼,实验设计参考前期研究成果[18]。
1.2.2 样品采集与测定
训练结束后,每缸随机取9 尾鱼,生长相关数据参考已发表研究结果[18]。采样鱼用MS-222(140 mg/L)麻醉,每尾草鱼采集游泳运动相关的红肌、腹肌、尾肌以及肝脏组织,置于液氮中速冻后于-80℃保存备用。
根据相关试剂盒说明书测定总蛋白质浓度、T-AOC、SOD、CAT、GSH-Px 酶活。总蛋白质浓度采用BCA 法,T-AOC 采用ABTS 法,SOD 采用羟胺法,CAT 采用钼酸铵法,GSH-Px 采用酶促反应及显色反应两步进行测定。
基因表达量测定根据已发表的文献获得引物序列[19],交由北京擎科生物科技有限公司合成,引物序列表见表1。根据试剂盒说明书指示提取RNA、cDNA 的合成和荧光定量PCR 的扩增来完成实验,使用TRIpure Reagent TRIpure Reagent 试剂盒提取RNA,使用试剂盒HifairⅢ1st Strand cDNA Synthesis SuperMix for qPCR 进行逆转录,使用PCR扩增试剂盒HieffqPCR SYBRGreen Master Mix(LowRox)进行荧光定量。
1.3 数据分析方法
采用2-ΔΔCt法来计算抗氧化基因的相对表达量,在检测实验数据的正态分布和方差齐性后,使用SPSS 21 软件对数据进行单因素方差分析(One-way ANOVA)和显著检验,用邓肯检验法(Duncan)进行多重比较分析,当差异在P<0.05 时被认为具有统计学意义,图中以不同小写英文字母表示显著性差异。
2 结果与分析
2.1 不同游泳速度对草鱼红肌抗氧化能力的影响
不同游泳速度下草鱼红肌抗氧化基因cat、gpx和sod 表达量有显著性差异(P<0.05,图1)。同0 bl/s流速组相比,0.5 bl/s 与1 bl/s 流速下草鱼红肌抗氧化基因cat 和gpx 表达量显著降低(P<0.05),但与1.5 bl/s 流速组无显著差异(P>0.05)。不同游泳速度处理下草鱼红肌的CAT、GSH-Px 和T-AOC 活性无显著性差异(P>0.05),而SOD 有显著性差异(P<0.05),1.5 bl/s 流速下草鱼红肌SOD 活性显著低于其他流速组(P<0.05,图2)。
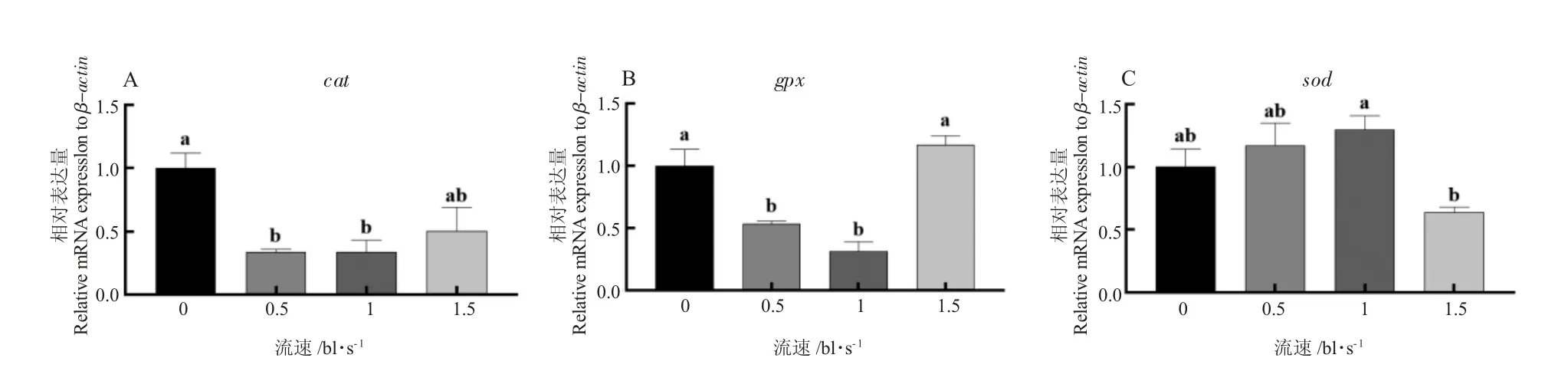
图1 草鱼红肌抗氧化基因表达量Fig.1 Relative expression levels of antioxidant gene transporters of grass carp red muscle

图2 草鱼红肌抗氧化酶活性Fig.2 Antioxidant enzyme activities of grass carp red muscle
2.2 不同游泳速度对草鱼腹肌抗氧化能力的影响
不同游泳速度下草鱼腹肌抗氧化基因cat、gpx和sod 表达量无显著性差异(P>0.05,图3)。不同游泳速度处理下草鱼腹肌的CAT 活性和T-AOC 无显著性差异(P>0.05),而GSH-Px 和SOD 有显著性差异,1 bl/s 流速下草鱼腹肌GSH-Px 活性显著高于其他流速组;1.5 bl/s 流速下草鱼腹肌SOD 活性显著高于其他流速组(P<0.05,图4)。
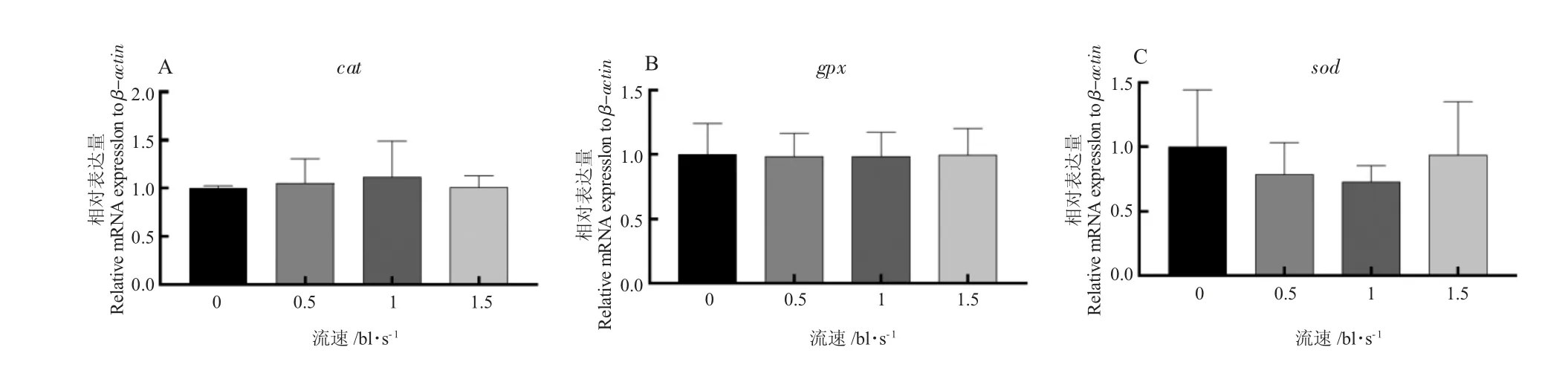
图3 草鱼腹肌抗氧化基因表达量Fig.3 Relative expression levels of antioxidant gene transporters in grass carp abdominal muscle
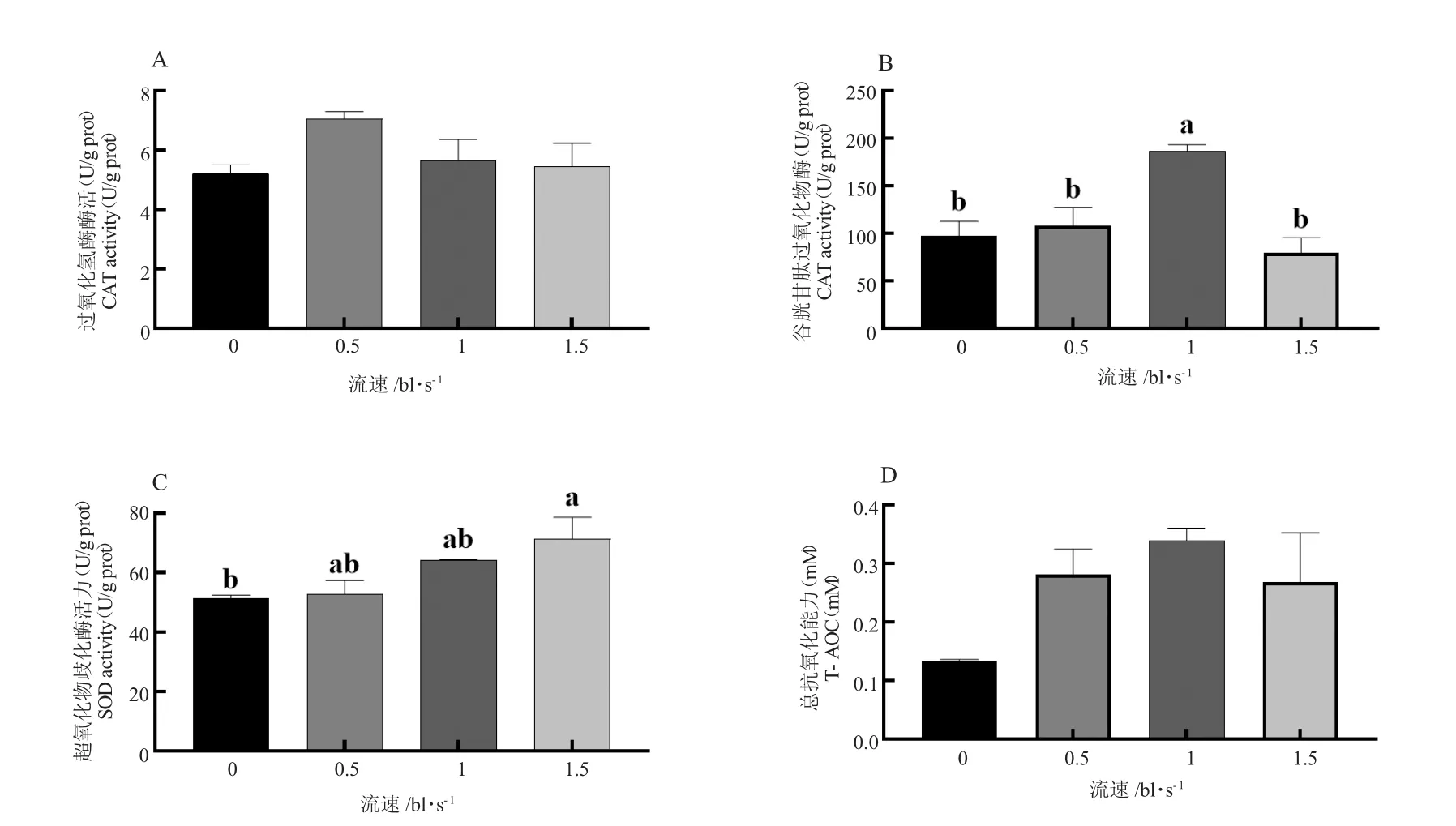
图4 草鱼腹肌抗氧化酶活性Fig.4 Antioxidant enzyme activities of grass carp abdominal muscle
2.3 不同游泳速度对草鱼尾肌抗氧化能力的影响
不同游泳速度下草鱼尾肌抗氧化基因cat、gpx和sod 表达量无显著性差异(P>0.05,图5)。不同游泳速度处理下草鱼尾肌的CAT、GSH-Px、SOD 和T-AOC 均无显著性差异(P>0.05,图6)。

图5 草鱼尾肌抗氧化基因表达量Fig.5 Relative expression levels of antioxidant gene transporters in grass carp caudal muscle
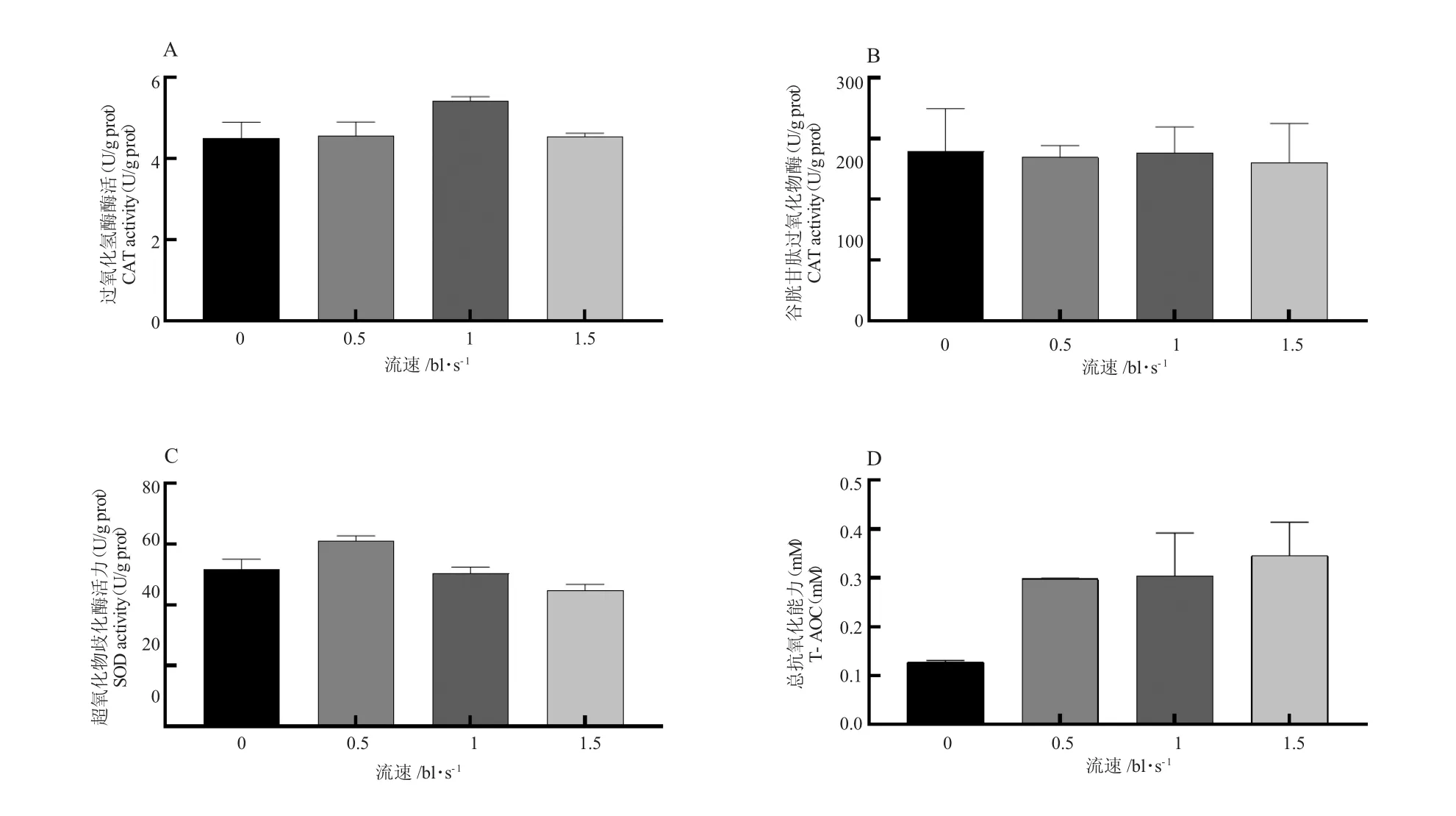
图6 草鱼尾肌抗氧化酶活性Fig.6 Antioxidant enzyme activities in grass carp caudal muscle
2.4 不同游泳速度对草鱼肝脏抗氧化能力的影响
不同游泳速度下草鱼肝脏抗氧化基因cat、gpx和sod 表达量无显著性差异(P>0.05,图7);肝脏的CAT、GSH-Px 和 SOD 活性无显著性差异(P>0.05),而T-AOC 差异显著,1.0 bl/s 和1.5 bl/s流速下肝脏T-AOC 活性显著高于0 bl/s 流速组(P<0.05,图8)。

图7 草鱼肝脏抗氧化基因表达量Fig.7 Relative expression levels of antioxidant gene transporters in grass carp liver
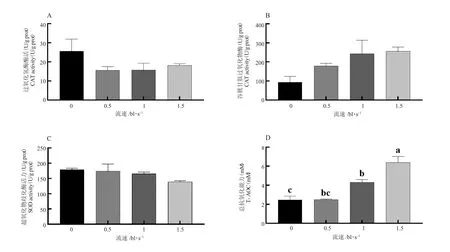
图8 草鱼肝脏抗氧化酶活性Fig.8 Antioxidant enzyme activities of grass carp liver
3 讨论
肝脏与肌肉是养殖鱼类维持正常生理代谢的关键组织,极易遭受ROS 损伤。适宜的水流速度刺激有利于鱼类的生长及生理代谢稳态,而过高的流速也会导致生长和免疫性能的下降[20-22]。基于此,本研究测定了草鱼不同游泳状态下红肌、腹肌、尾肌及肝脏的抗氧化性能,以期明确流速对养殖草鱼的影响。
早先研究以1.5 bl/s 或以下的流速对多种鱼类训练,可以提升其红肌、白肌生长与有氧代谢的能力[9,23]。游泳训练还可以通过线粒体生物合成途径影响鱼类肌纤维生理代谢过程,对红肌与白肌生理代谢的作用不尽相同[24,25],但尚未明确肌肉中抗氧化能力的变化。随着研究不断深入,越来越多的报道阐述了流速对养殖鱼类肌肉抗氧化性的影响。对虹鳟(Oncorhynchus mykiss)进行不同的运动强度的游泳训练,中等强度的游泳训练为2.0 bl/s,训练时间为每天23.5 h;高强度游泳训练为3.2 bl/s,每天训练2 h,训练10 d 后同未训练的虹鳟比较,仅高强度训练可以提升虹鳟红肌gpx-1 基因表达量,但两种运动强度对虹鳟白肌、红肌抗氧化酶活性均无影响[24]。欧洲鳗鲡(Anguilla anguilla L.)在持续游泳运动过程中通过增强有氧代谢的方式来抵消ROS 过度产生的影响,但游泳运动对红肌SOD、CAT 及GSH-Px 活性并无显著的调节效果[26]。而不同游泳能力的软、硬骨鱼尾部肌肉组织中CAT、GSH-Px 及SOD 水平具有明显差异[14]。因此,在1.5 bl/s 流速下,草鱼红肌与腹肌SOD 活性变化的显著差异表明,该流速下腹肌中清除O2-的能力提升,红肌中清除O2-的能力减弱,这可能是草鱼肌肉有氧代谢适应高流速训练的结果。而1.0 bl/s 流速显著提升了腹肌GSH-Px 活性,表明1.0 bl/s 流速下草鱼腹肌获得了更强清除体内过量的ROS 的能力。可见适当的游泳训练可以影响草鱼抗氧化途径来调控肌肉相关生理活动。
鱼类组织中肝脏通常具有较高的抗氧化酶活性[27-30],这在本研究中也有所体现,可以看到肝脏的抗氧化酶活性明显高于肌肉组织。在其他鱼类相关研究中发现,斜带石斑鱼(Epinephelus coioides)在0 bl/s、0.5 bl/s、1.0 bl/s 和2.0 bl/s 游泳速度下,肝脏T-AOC 和CAT 及SOD 的活性随游泳速度的增加先增加后降低,在1.0 bl/s 时活性最大[15]。在0 bl/s、1 bl/s、2 bl/s、4 bl/s 不同流速的训练下,随着强度的增加,黑鲷(Sparus macrocephalus)肝脏GSH-Px 含量和CAT 活性均呈现上升的趋势,而其T-AOC 没有显著性变化[31]。本研究中,随着流速增加,草鱼肝脏T-AOC 活性逐渐提升,表明清除自由基的能力增强,可见游泳训练增强了草鱼肝脏抗氧化性能。
综上所述,不同流速下鱼类的抗氧化能力的变化或许与鱼类种类相关。同时不同流速下草鱼各组织中抗氧化能力改变存在差异,这可能是草鱼机体调节能量代谢平衡,以适应不同流速的结果。整体来讲,在实际生产中可以适当改变水的流速来促进草鱼的生长。
