白藜芦醇通过上调miR-361-3p逆转卵巢癌顺铂耐药的研究*
2023-09-01汪旭珍俞一歆胡立强陈文虎
汪旭珍,刘 红,俞一歆,胡立强,陈文虎
(1.杭州市妇产科医院放射科,浙江杭州 310030;2.浙江省中医药研究院,杭州 310007;3.杭州医学院,浙江杭州 310053)
卵巢癌是妇科常见恶性肿瘤之一,其5年生存率仅为48%左右[1]。对于晚期卵巢癌,减容手术联合铂基化疗仍是主要的治疗策略[2]。虽然70%的患者最初对铂基化疗有反应,但大多数患者会出现严重的不良反应,并且不可避免地由于化疗耐药性而复发[3]。因此,提高卵巢癌对化疗的敏感性,减少相关副作用,有望延长卵巢肿瘤患者的生存期,提高其生活质量[4]。铂基化疗是晚期卵巢肿瘤的标准一线治疗方法。顺铂(cisplatin,DDP)作为最重要的铂类药物之一,在临床上得到广泛应用,但耐药性的产生是限制其疗效的重要原因[5]。因此,迫切需要寻找可以增强DDP抗肿瘤活性的其他药物。白藜芦醇(resveratrol,RES)是一种天然的多酚类化合物,来源于葡萄、花生、桑树等多种植物[6]。据报道,RES具有抗炎、抗氧化、抗衰老等多种生物学功能。基于这些生物学功能,RES在医学中得到了广泛的研究。在抗肿瘤研究中,RES与DDP联合使用可明显逆转肿瘤细胞对化疗的耐药性[7-8]。然而,RES增加DDP化学敏感性的分子机制尚不明确。
微RNA(microRNA,miR)是一类小的非编码RNA分子,包含约22个核苷酸[9]。miR对许多生理病理过程起着至关重要的作用,如细胞稳态、发育和分化、存活和死亡、肿瘤起始和进展、肿瘤化疗和耐药等[10]。miR-361-3p是一种新发现的miR,在多种恶性肿瘤中减少或丢失。既往研究报道,miR-361-3p通过抑制胰腺导管腺癌中双特异性磷酸酶2(DUSP2)的表达来调节细胞外信号调节激酶1/2(ERK1/2)信号通路,诱导上皮间质转化(EMT)[11]。虽然WANG等[12]将miR-361-3p视为抑制卵巢癌生长和侵袭的抗肿瘤miR,但其在卵巢癌对DDP耐药中的作用机制需进一步探索。本研究发现,RES可以逆转卵巢癌对DDP的耐药性,上调miR-361-3p的表达,并进一步探讨了其可能的分子机制,现报道如下。
1 材料与方法
1.1 材料
1.1.1细胞
人卵巢癌SKOV3细胞购自武汉普诺赛生命科技有限公司,在含10%胎牛血清(美国HyClone公司)和100 mg/L青霉素/链霉素(美国Gibco公司)的DMEM培养基(美国HyClone公司)中生长。
1.1.2主要试剂
RES、DDP购自北京索莱宝科技有限公司;miR-361-3p抑制剂等相关试剂购自生工生物工程(上海)股份有限公司;细胞计数试剂盒8(CCK-8)试剂和膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin-V-FITC/PI)凋亡试剂均购自日本同仁化学研究所;TRizol、miR逆转录试剂盒、TB Green荧光定量试剂盒购自日本TaKaRa公司;所有抗体均购自美国CST抗体公司。
1.2 方法
1.2.1SKOV3/DDP耐药细胞株构建
SKOV3细胞培养于含0.4 μmol/L DDP培养基中,以80%的密度传代。2周后,将细胞接种到新的6孔板中,并在含有增加DDP浓度(先前浓度的1.5倍)的培养基中培养。重复该过程,直到细胞在4 μmol/L DDP培养基中表现出稳定的生长和增殖。
1.2.2CCK-8法检测RES安全浓度
取对数生长期SKOV3/DDP细胞,以每孔4×103个接种于96孔板,置于培养箱中过夜培养,加入浓度分别为2、4、8、16、32 μmol/L的RES,0 μmol/L RES作为对照组(CON组),完全培养基作为空白组,6孔平行,继续培养48 h。每孔加入10 μL CCK-8溶液,37 ℃培养3 h,用酶标仪检测各孔450 nm波长处吸光度(A450)值,实验重复3次。按照下列公式计算药物对细胞活力的杀伤效应:细胞活力(%)=(试验组A450值-空白组A450值)/(对照组A450值-空白组A450值)×100%。
1.2.3CCK-8法检测细胞半数抑制浓度(IC50)
采用不同DDP浓度(4、8、16、32、64、128 μmol/L)作用SKOV3/DDP细胞48 h(DDP组),以及RES(浓度为4 μmol/L)与DDP联合作用细胞48 h(RES+DDP组)后进行CCK-8实验。每孔中加入10 μL CCK-8溶液,在培养箱中孵育3 h,使用酶标仪测量A450值,使用GraphPad软件计算IC50。
1.2.45-乙炔基-2′脱氧尿嘧啶核苷(EdU)技术检测细胞增殖能力
取对数生长期SKOV3/DDP细胞,以每孔1×105个接种于24孔板,置于培养箱中过夜培养,分别用DDP IC50和DDP IC50联合RES(浓度为4 μmol/L)处理48 h后加入EdU液37 ℃孵育2 h。4%多聚甲醛固定30 min,磷酸盐缓冲液(PBS)清洗3次后复染4,6-二氨基-2-苯吲哚(DAPI),荧光显微镜下观察细胞增殖情况。
1.2.5流式细胞术检测细胞凋亡
取对数生长期SKOV3/DDP细胞,以每孔1×105个接种于24孔板,置于培养箱中过夜培养,分别用DDP IC50和DDP IC50联合RES(浓度为4 μmol/L)处理细胞48 h,胰酶消化,PBS洗涤,根据Annexin V-FITC/PI试剂盒说明书,加入500 μL缓冲液重悬细胞,再分别加入5 μL Annexin V-FITC溶液与10 μL PI染色液,轻轻混匀,室温孵育15 min,转移至上样管中,用流式细胞仪检测细胞凋亡。
1.2.6实时荧光逆转录PCR(RT-qPCR)检测miR-361-3p表达水平
收集RES处理前后的SKOV3/DDP细胞,用TRIzol提取细胞总RNA,测定其纯度和浓度,按照逆转录试剂盒说明书用逆转录酶将其合成互补DNA(cDNA)。使用TB green试剂盒进行RT-qPCR检测。参数如下:95 ℃反应10 s;95 ℃反应5 s,60 ℃反应20 s,40个循环。反应结束后miR-361-3p以U6为内参对照,以2-ΔΔCt法量化相对表达水平。miR-361-3p正向引物:5′-UCC CCC AGG UGU GAU UCU GAU UU-3′,反向引物:5′-GCA AAT CAG AAT CAC ACC TG-3′。U6正向引物:5′-CTC GCT TCG GCA GCA CA-3′,反向引物:5′-AAC GCT TCA CGA ATT TGC GT-3′。
1.2.7细胞转染
NC抑制剂和miR-361-3p抑制剂按照公司提供的说明书使用。将SKOV3/DDP细胞以5×105个/孔的密度接种在6孔板中,用脂质体(LipofectamineTM2000)进行转染。转染6 h后,用PBS洗涤细胞3次,换成普通培养基,继续培养48 h。通过RT-qPCR检测转染效率。
1.2.8Western blot检测蛋白表达
收集对照组、DDP IC50、DDP IC50联合RES(浓度为4 μmol/L)处理的细胞,用二喹啉甲酸(BCA)试剂盒测定提取的蛋白水平。使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质,转移到聚偏氟乙烯(PVDF)膜上,用含有5%脱脂奶粉的Tris缓冲盐水(TBST)室温封闭2 h。加入待测一抗[ERK1/2、磷酸化ERK1/2(p-ERK1/2)、P38、磷酸化P38(p-P38)、三磷酸甘油醛脱氢酶(GAPDH)],稀释浓度为1∶1 000,在4 ℃下孵育过夜。次日,将PVDF膜与辣根过氧化物酶(HRP)标记的二抗4 ℃孵育2 h,通过电化学发光(ECL)法显色,Image J软件分析条带的灰度值。
1.3 统计学处理
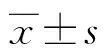
2 结 果
2.1 RES对SKOV3/DDP细胞的安全浓度检测
利用CCK-8法筛选单用RES对SKOV3/DDP细胞的最大安全浓度,结果显示:当RES终浓度为4 μmol/L时,对SKOV3/DDP细胞生长无明显抑制作用(P>0.05),见图1。因此,本实验选用4 μmol/L浓度为RES的联用剂量。

a:P<0.05,与0 μmol/L组比较。图1 单用RES对SKOV3/DDP细胞安全浓度的筛选
2.2 RES联用DDP对SKOV3/DDP细胞增殖和凋亡的影响
利用CCK-8法检测DDP组和RES+DDP组对SKOV3/DDP细胞的IC50,与DDP组相比,RES+DDP组的IC50明显降低(P<0.05),见图2。EdU增殖实验显示,RES+DDP组的细胞增殖率明显低于DDP组(P<0.05),见图3A、B。流式细胞术检测细胞凋亡,与DDP组相比,RES+DDP组的细胞凋亡率明显升高(P<0.05),见图3C、D。

a:P<0.05,与DDP组比较。图2 RES联合DDP对SKOV3/DDP细胞IC50的影响
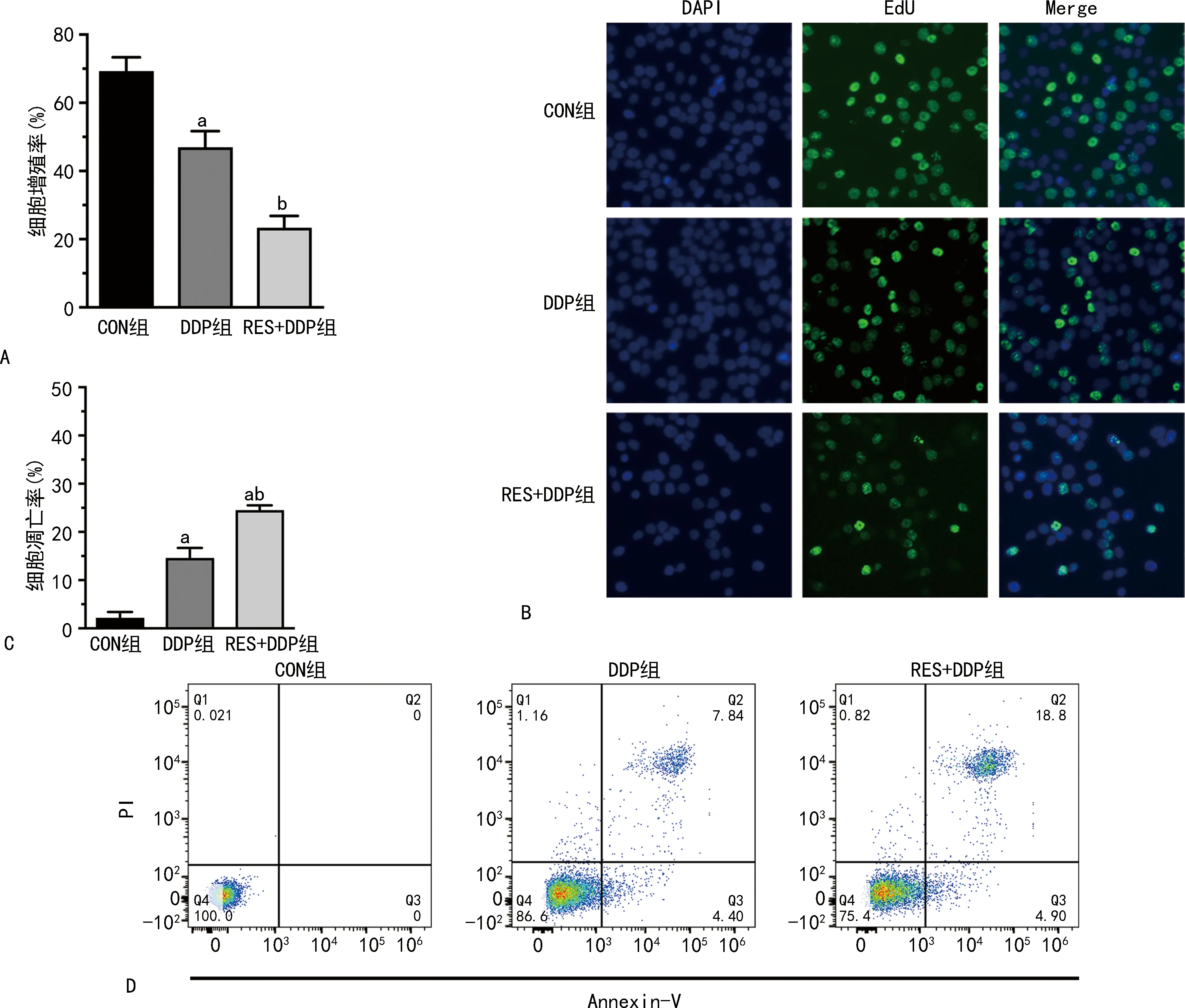
A、B:各组细胞的细胞增殖率;C、D:各组细胞的细胞凋亡率;a:P<0.05,与CON组比较;b:P<0.05,与DDP组比较。图3 RES联合DDP对SKOV3/DDP细胞增殖和凋亡的影响
2.3 RES作用后miR-361-3p的表达
采用RT-qPCR检测RES作用后SKOV3/DDP细胞中miR-361-3p的表达,与作用前(CON组)相比,RES作用后(RES组)SKOV3/DDP细胞miR-361-3p表达明显上调(P<0.05),见图4。
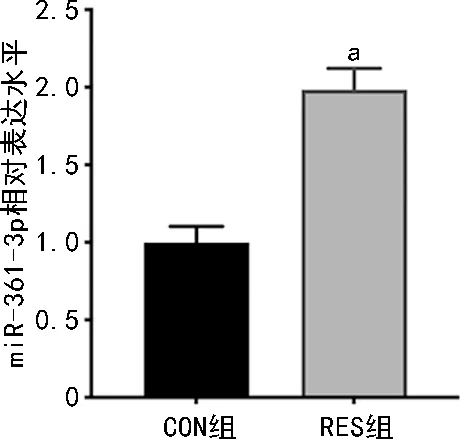
a:P<0.05,与CON组比较。图4 RES对miR-361-3p的表达调控
2.4 RES通过miR-361-3p逆转SKOV3/DDP细胞的DDP耐药性
采用RT-qPCR法检测miR-361-3p抑制剂作用后SKOV3/DDP细胞中miR-361-3p的表达,结果显示:miR-361-3p的表达明显下调(P<0.05),见图5A。与DDP组相比,NC抑制剂+RES+DDP组和miR-361-3p抑制剂+RES+DDP组可以明显降低IC50值(P<0.05),且NC抑制剂+RES+DDP组明显低于miR-361-3p抑制剂+RES+DDP组(P<0.05),见图5B。EdU增殖实验显示,NC抑制剂+RES+DDP组的细胞增殖率明显低于DDP组(P<0.05),而miR-361-3p抑制剂+RES+DDP组的细胞增殖率明显高于NC抑制剂+RES+DDP组(P<0.05),且与DDP组比较无明显差异(P>0.05),见图5C、D。流式细胞术结果显示,NC抑制剂+RES+DDP组的细胞凋亡率明显高于DDP组(P<0.05),而miR-361-3p抑制剂+RES+DDP组的细胞凋亡率明显低于NC抑制剂+RES+DDP组(P<0.05),且与DDP组比较无明显差异(P>0.05),见图5E、F。

A:RT-qPCR检测miR-361-3p在SKOV3/DDP细胞中的相对表达;B:各组DDP的IC50值;C、D:各组细胞的细胞增殖率;E、F:各组细胞的细胞凋亡率;a:P<0.05,与NC抑制剂组比较;b:P<0.05,与DDP组比较;c:P<0.05,与NC抑制剂+RES+DDP组比较。图5 RES通过miR-361-3p逆转SKOV3/DDP细胞的DDP耐药
2.5 RES通过丝裂原活化蛋白激酶(MAPK)/ERK信号通路调节DDP对SKOV3/DDP细胞的作用
采用Western blot检测ERK1/2、p-ERK1/2、P38及p-P38蛋白水平,结果发现:与CON组相比,DDP组、RES+DDP组的p-ERK1/2、p-P38蛋白水平明显下调(P<0.05),且RES+DDP组明显低于DDP组(P<0.05);而ERK1/2,P38蛋白水平无明显变化,见图6。

A:p-ERK1/2与ERK1/2蛋白的相对比值;B:p-P38与P38蛋白的相对比值;a:P<0.05,与CON组比较;b:P<0.05,与RES-DDP组比较。图6 RES和DDP对MAPK/ERK信号通路相关蛋白的调控
3 讨 论
卵巢癌是女性生殖系统恶性肿瘤,且预后较差,对女性患者的生命造成严重威胁。虽然80%的卵巢癌患者对以铂类为主的一线化疗方案敏感,但复发率高达60%以上;并且,其中大部分患者在一线化疗后会出现继发的耐药,而卵巢癌的耐药导致化疗药物无法对卵巢癌细胞进行有效的杀伤和抑制,进而导致病情恶化[13-14]。卵巢癌化疗耐药的机制研究也成为近年来研究的热点和难点[15]。
RES是重要的植物抗毒素,广泛存在于葡萄、虎杖及蓝莓等植物中,具有保护心血管系统、抗氧化、抗炎、抗过敏、抗病原微生物、保肝、抗癌等多种药理作用[16-17]。研究表明,RES通过诱导结肠癌细胞内线粒体介导的凋亡,抑制Wnt/β-连环素(β-catenin)信号通路下游蛋白的表达,对结肠癌的治疗具有积极作用[18]。RES通过丝氨酸苏氨酸激酶/核因子-κB(Akt/NF-κB)信号通路抑制了骨肉瘤干细胞标志物CD133的表达,介导信号转导及转录激活因子3(STAT3)信号通路对骨肉瘤干细胞发挥杀伤作用[19]。此外,RES协同DDP促进线粒体中细胞色素C的释放从而增加肿瘤细胞凋亡[20]。本研究通过CCK-8和EdU实验发现,RES联用DDP可以明显抑制SKOV3/DDP的增殖作用。同时,流式细胞术结果显示,RES+DDP组的细胞凋亡率明显升高。提示RES在逆转SKOV3/DDP细胞DDP耐药中的作用具有良好的应用前景。
miR是在真核生物中发现的一类内源性的具有调控功能的非编码RNA[9],主要通过参与基因的转录后调控来实现对靶基因的表达调节。目前,已有大量的研究结果表明,miR在动植物生长发育、机体疾病的发生与发展等领域中备受关注。研究报道,在乳腺癌中转染miR-34a明显抑制多柔比星耐药的MCF-7/A细胞的增殖、侵袭、迁移并诱导其凋亡[21]。而miR-214通过靶向卵巢癌中的第10号染色体同源缺失性磷酸酶-张力蛋白基因(PTEN)导致细胞存活和DDP耐药[22]。此外,研究发现miR-340在DDP耐药的肝细胞癌(HCC)细胞中明显下调,外源性miR-340表达可抑制核因子E2相关因子(Nrf2)表达,促进HepG2/DDP细胞的DDP敏感性[23]。然而,miR-361-3p在卵巢癌中与DDP敏感性之间的关系尚不明确。本研究发现,RES可上调SKOV3/DDP细胞中miR-361-3p的表达。进一步转染miR-361-3p抑制剂显示,可以明显逆转RES协同DDP的肿瘤杀伤作用。这提示miR-361-3p可能是RES逆转SKOV3/DDP细胞耐药的潜在靶标。
MAPK信号途径是细胞内重要的信号转导通路之一,参与细胞的生长、发育、分化、凋亡等一系列细胞生理活动,且与肿瘤细胞的DDP耐药性有关。有研究显示,MAPK信号通路抑制剂可抑制宫颈癌细胞增殖作用,并增强其DDP药物敏感性[24]。采用U0126抑制MAPK/ERK信号通路后,MCF-7/TAMR和T47D/TAMR细胞的增殖速度明显减缓,逆转了乳腺癌细胞对他莫昔芬的耐药性[25]。为进一步探讨RES协同DDP对SKOV3/DDP的耐药分子机制,使用Western blot检测了MAPK/ERK信号通路中ERK1/2、p-ERK1/2、P38及p-P38蛋白表达水平。结果显示,RES联用DDP明显降低ERK1/2和P38蛋白的磷酸化水平,抑制了MAPK/ERK信号通路的激活。这揭示了RES逆转DDP对SKOV3/DDP细胞耐药的潜在分子机制。
综上所述,RES能通过上调miR-361-3p水平而降低卵巢癌耐药细胞SKOV3/DDP的耐药性,从而抑制细胞增殖并诱导细胞凋亡,进一步分析RES可抑制MAPK/ERK信号通路的活化。未来的研究除了着眼于分子水平上探索细胞自噬与肿瘤的关系,还应密切关注细胞自噬的临床应用。由于细胞自噬对不同肿瘤细胞的耐药性影响不同,所以在实际应用中还需要做大量的临床前期实验,以期望做到针对不同的肿瘤细胞选用不同的治疗策略,从而避免对正常细胞及组织的损伤。RES联合DDP治疗有望应用于卵巢癌治疗研究领域,从而逆转卵巢癌细胞的耐药性,提高卵巢癌临床治疗效果。
