氨基甲酸乙酯降解菌株的分离鉴定及其在白酒中的应用
2023-08-18董乃慧薛思宇陈映羲黄治国张素芳
董乃慧,薛思宇,董 亮,陈映羲,黄治国,张素芳*
(1 大连工业大学食品学院 国家海洋食品工程技术研究中心 辽宁大连 116034 2 四川轻化工大学 酿酒生物技术及应用四川省重点实验室 四川宜宾 644000)
氨基甲酸乙酯(Ethyl carbamate,EC),又名尿烷、乌拉坦,是一种普遍存在于发酵食品和酒精饮料中的对人体存在潜在遗传毒性和较强致癌性的化学物质[1-2]。随着EC 的致癌性被不断证实[3],2007 年,国际癌症研究机构(IARC)将EC 的致癌级变更为2A 类[4]。
目前对发酵食品中EC 的控制方法主要集中在以下几个方面:1)改良发酵工艺,如精制或充分清洗原料以减少尿素(EC 主要前体物质)含量,避免酒精饮料光照的几率,减少氰化物(EC 前体物质)的生成[5];2)通过代谢工程改造酿酒酵母(Saccharomyces cerevisiae),如敲除其精氨酸酶编码基因(CAR1)[6-7]或高效表达脲基酰胺酶基因(DUR1、DUR2、DUR3)[8-9]来控制黄酒和米酒中EC 含量;3)酶法降解EC,主要分为脲酶和氨基甲酸乙酯水解酶(Ethyl carbamate hydrolase,ECH)。脲酶是酶法降解EC 最常见的酶,它可将尿素降解为CO2和氨。自1976 年Moreau 等[10]首次从乳酸杆菌中发现1 种酸性脲酶,国内外研究者在脲酶的筛选、酶学性质等方面进行了一系列研究。田亚平等[11]从雷式普罗威登斯菌(Providenciasp.)中获得1种酸性脲酶,当黄酒中加酶量达0.2 U/mL 时,EC去除率为25%。周建立等[12]发现1 种可以同时降解尿素和EC 的双功能酸性脲酶,将其应用于黄酒时,其降解EC 效果不是很理想。综上所述,目前报道的绝大多数脲酶对尿素具有高特异性,对EC没有活性,且发酵食品体系的复杂性导致其中的EC 形成途径多样,控制EC 的主要前体物质只能部分降低体系中EC 的含量,若要达到从产品中完全清除EC 是极其困难的。反观ECH,其能从源头将EC 分解成乙醇和CO2,具有巨大的潜在应用价值。应用ECH 去除发酵食品中的EC,是上述方法的一个有效补充。
白酒是世界上消费量最大的酒类(2019 年超过78 亿L[13])。加拿大、法国、巴西和日本规定[14-15]蒸馏酒中EC 含量应低于150 μg/L,然而,卓俊纳等[16]研究发现,中国白酒中EC 检出率为100%,高端浓香型白酒中EC 平均含量为201.3 μg/kg,高端酱香型白酒中EC 平均含量为195.03 μg/kg。黄松等[17]研究发现白酒基酒中EC 均有检出,最高达544.74 μg/kg,均高于上述规定,不利于我国白酒的出口。同时,白酒酒精度数多为50%vol 以上,相较于目前应用在黄酒、米酒等酒精饮料中去除EC的酶或菌株,能够耐受白酒中高浓度乙醇且具有高降解效率的几乎没有。此外,发酵食品多偏酸性,比如葡萄酒的pH 值在3.0~3.8 之间[18],黄酒的pH 值在3.5~4.6 之间[19],泡菜的pH 值在3.5~3.8之间[20]。ECH 因pH 耐受范围的原因在发酵食品中的应用会受到限制[21]。筛选能够耐受高浓度乙醇、耐偏酸性环境的EC 降解菌株是控制EC 含量的关键。
本文选择王村醋醋醅和四川成都某酒厂酒糟作为筛选来源,其中,王村醋兴于明朝,距今已有500 年左右的历史,被认定为中华老字号、省级非物质文化遗产。其发酵采用传统的常温自然发酵法,以“色淡香醇、营养健康”的风格广受民众欢迎。醋的固态发酵工艺[22]中含有酒精发酵过程,从中筛选出的能够降解EC 的菌株对乙醇和酸性环境均有较好的耐受能力。
本文对醋醅、酒糟中菌株的分离纯化,基于16S rDNA、26S rDNA 的PCR 扩增和Blastn 分析,多序列比对分析,对所分离菌株的种属进行鉴定,并将酒糟来源的1 株细菌和1 株酵母应用于商品白酒中EC 的消减。试验结果对耐酸、耐高浓度乙醇的EC 降解菌的筛选具有重要意义,并为ECH 的筛选利用提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料 样品醋醅,山东华王酿造有限公司;样品酒糟,四川省某酒厂;样品白酒(53%vol),大连当地超市。
1.1.2 试剂 氨基甲酸乙酯(≥99%)、壳聚糖、甲醇(色谱级),麦克林公司;乙酸乙酯(色谱级),斯百全化学(上海)有限公司;氯化铵、氯化钠(分析纯),国药集团化学试剂(上海)有限公司;海藻酸钠(食品级)、无水氯化钙、硼酸、氯仿、异戊醇、磷酸氢二钠、磷酸二氢钾(分析纯)、无水乙醚(色谱级),天津市大茂化学试剂厂;正己烷(色谱级),瑞典欧普森(Oceanpak)化学公司;LB 肉汤、YPD 液体培养基,高科技工业园海博生物技术(青岛)有限公司;琼脂粉、Tris、EDTA、SDS、蛋白酶K、RNase A 溶液(10 mg/mL)、Tris 饱和酚溶液、醋酸钠、TE 缓冲液,生工生物工程(上海)股份有限公司;2×Taq Master Mix(Dye Plus),南京诺唯赞生物科技股份有限公司;DL 2000 DNA Marker,宝生物工程(大连)有限公司;GoldView I 型核酸染色剂,索莱宝科技(北京)有限公司;Genview 原装琼脂糖,GEN-VIEW SCIENTIFIC INC.;50×TAE缓冲液,生工生物工程(上海)股份有限公司;Cleanert EC 氨基甲酸乙酯专用固相萃取柱,天津博纳Agela 科技有限公司。
1.1.3 培养基 富集培养基(g/L):Na2HPO4·12 H2O 6.0,KH2PO43.0,NH4Cl 1.0,NaCl 0.5,EC 5.0,pH 7.4,121 ℃灭菌15 min。
筛选培养基(g/L):Na2HPO4·12H2O 6.0,KH2PO43.0,NH4Cl 1.0,NaCl 0.5,EC 10.0,琼脂20.0,pH 7.4,121 ℃灭菌15 min。
LB 培养基(g/L):NaCl 10.0,胰蛋白胨10.0,酵母浸粉5.0,琼脂20.0(固体培养基),pH 7.0±0.1,121 ℃灭菌15 min。
YPD 培养基(g/L):蛋白胨20.0,葡萄糖20.0,酵母浸粉10.0,琼脂20.0(固体培养基),pH 6.5±0.2,121 ℃灭菌15 min。
1.2 仪器与设备
超净工作台、高压蒸汽灭菌锅,上海博迅实业有限公司;回转式恒温调速摇床,上海知楚仪器有限公司;光学显微镜,徕卡显微系统有限公司;微量台式离心机、DNA 浓度测定仪,赛默飞世尔科技公司;PCR 仪,美国伯乐公司;水平电泳仪,北京六一生物科技有限公司;凝胶成像仪,以色列DNR 公司;固相萃取仪,上海那艾精密仪器有限公司;气相色谱-质谱仪(GC-MS),安捷伦科技(中国)有限公司。
1.3 试验方法
1.3.1 菌株筛选
1.3.1.1 富集培养 以EC 为唯一碳源的培养基中,由于缺乏优势碳源(葡萄糖),菌株的生长速度较慢,故先富集培养,再筛选培养。利用灭菌水重悬醋醅和酒糟制成悬液,吸取300 μL 醋醅或酒糟重悬液于10 mL 富集培养基,28 ℃,200 r/min 培养至培养液浑浊,吸取200 μL 接种于10 mL 新鲜富集培养基,重复5 代。
1.3.1.2 筛选培养 菌体富集培养后,进行倍比稀释,分别取200 μL 不同稀释度的溶液,均匀涂布于筛选培养基平板上,置于28 ℃静置培养,每12 h 观察1 次平板上的菌株形态,选取菌落数低于300 的平板,挑取不同形态的单菌落于LB 平板划线分离纯化3 代,直至获得纯种单菌落,随后挑取单菌落接种于LB 肉汤中,200 r/min,28 ℃培养至菌液浑浊,添加体积分数20%的甘油后,冻存于-80 ℃,备用。
1.3.2 菌株基因组的提取 菌株基因组提取方法参考文献[23]的方法。
1.3.3 菌株鉴定
1.3.3.1 形态学鉴定 对筛选到的具有EC 降解能力的菌株从菌落大小、形状、边缘、光泽和颜色等方面观察并采集图像。取单菌落于40 倍物镜下,对菌体形态进行观察,做好记录并采集图像。
1.3.3.2 分子生物学鉴定 细菌16S rDNA PCR扩增采用通用引物27 F 和1492 R[24]。酵母26S rDNA PCR 扩增采用通用引物D1/D2[23]。PCR 反应体系(50 μL):2×Taq Master Mix 25 μL,上、下游引物各1 μL,基因组模板(50 ng/μL)1 μL,灭菌水22 μL。PCR 反应条件为95 ℃预变性3 min,95 ℃变性15 s,55 ℃退火15 s,72 ℃延伸1 min,30 次循环,最后72 ℃延伸5 min。
取4 μL PCR 产物进行琼脂糖凝胶电泳,剩下的45 μL PCR 产物进行测序。测序结果采用基本局部比对搜索工具(Basic local alignment search tool,BLASTn)进行比对分析。基于比对结果,构建系统发育树,采用MEGA 11.0 软件中的邻近法(Neighbor-joining method)。
1.3.4 氨基甲酸乙酯降解菌株在白酒中的应用
1.3.4.1 海藻酸钠-壳聚糖法固定化菌株 固定化菌株技术是将菌株固定在载体上,使菌株高度密集并保持其生物活性,利于菌株抵抗不利环境[25],以及实际生产后反应结束时的固液分离,提高生产效率。
挑取从酒糟中筛选得到的J29 纯种菌落接种于10 mL LB 肉汤,37 ℃,200 r/min 培养至OD600nm值为0.6。JY1 接种于YPD 液体培养基,30 ℃,200 r/min 培养至OD600nm值为0.6。菌株培养液于13 000 r/min 离心8 min,10 mL 灭菌水重悬菌体沉淀。固定化菌株方法参考文献[26]的方法。
1.3.4.2 白酒中氨基甲酸乙酯的降解能力鉴定取1.3.4.1 节制备的固定化EC 降解菌,置于10 mL 白酒样品中,20 ℃静置反应12 h。样品提取方法、标准曲线溶液配制方法参考文献[27]的方法;标准曲线绘制方法参考文献[28]的方法。样品检测方法参考文献[29]的方法,但略有不同,其中,采用HP-INNOWAX 色谱柱,长度30 m,内径0.25 mm,膜厚度0.25 μm。
2 结果与分析
2.1 菌落的形态学观察结果
以醋醅、酒糟为原材料,通过筛选培养基分离出44 株细菌和4 株酵母。采用平板划线法(LB 琼脂或YPD 琼脂)对其进行纯化,经3 次平板划线后获得纯菌落。部分菌株的平板图及镜检图见图1,具体的菌落形态学描述见表1。

表1 醋糟、酒糟中细菌的形态学特征Table 1 Morphological characteristics of bacteria in vinegar brewing mass and fermented grains of Baijiu
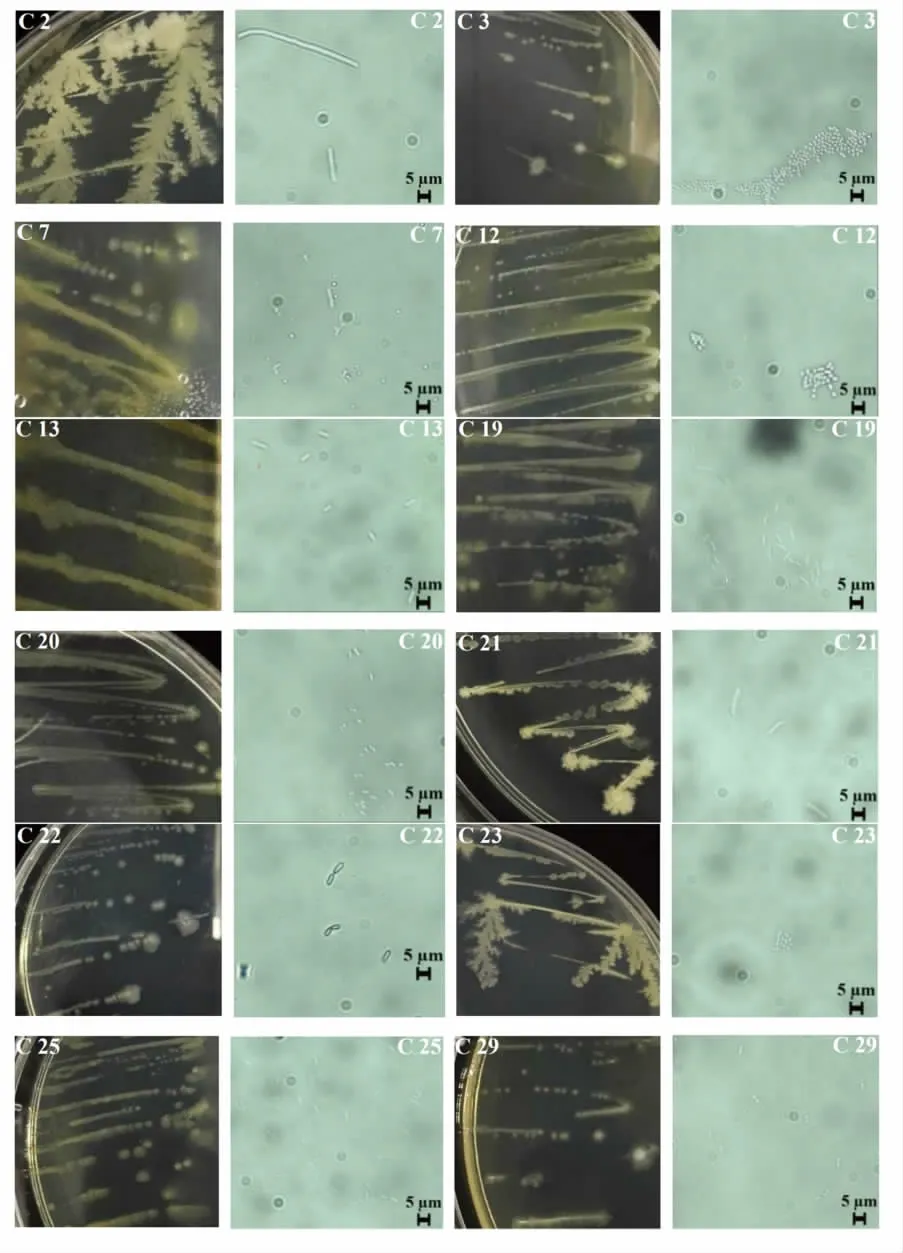
图1 醋醅、酒糟中部分菌落形态学及细菌镜检观察(40×)Fig.1 Colony morphology and microscopy of partial bacteria in vinegar brewing mass and fermented grains of Baijiu(40×)
通过形态学观察可知(图1),在颜色方面,44株细菌中有20 株呈乳白色,20 株呈浅黄色,4 株呈黄色,均不透明;在表面光滑程度方面,31 株表面光滑,4 株表面粗糙,9 株表面光滑且有同心环;在边缘形状方面,15 株呈叶状边缘,6 株呈锯齿状边缘,3 株呈根状边缘。其中,有2 株菌落形态呈雪花状,分别是C2、C22,二者表面光滑,边缘有毛边。4 株酵母在室温下均呈白色,表面光滑,边缘整齐,而CY1、CY2 菌落经4 ℃保存12 h 后呈红色。
通过镜检可知,44 株细菌共有21 株短杆菌、21 株球菌、2 株弧菌,且醋醅中筛选得到的多为球菌,而酒糟中筛选得到的多为杆菌。4 株酵母多为出芽状态,醋醅来源的酵母呈卵形,而酒糟来源的酵母呈椭圆形。
2.2 菌株的分子学鉴定
2.2.1 菌株基因组的提取及PCR 扩增结果 提取44 株细菌、4 株酵母基因组,以其为模板,细菌采用引物27F 和1492R,酵母采用引物D1 和D2,PCR 产物进行1%琼脂糖凝胶电泳分析,结果如图2 所示。可观察到所有细菌的泳道在1 500 bp 左右,所有酵母的泳道在500 bp 左右出现了1 条清晰条带。PCR 产物经测序后获得菌株基因组序列。
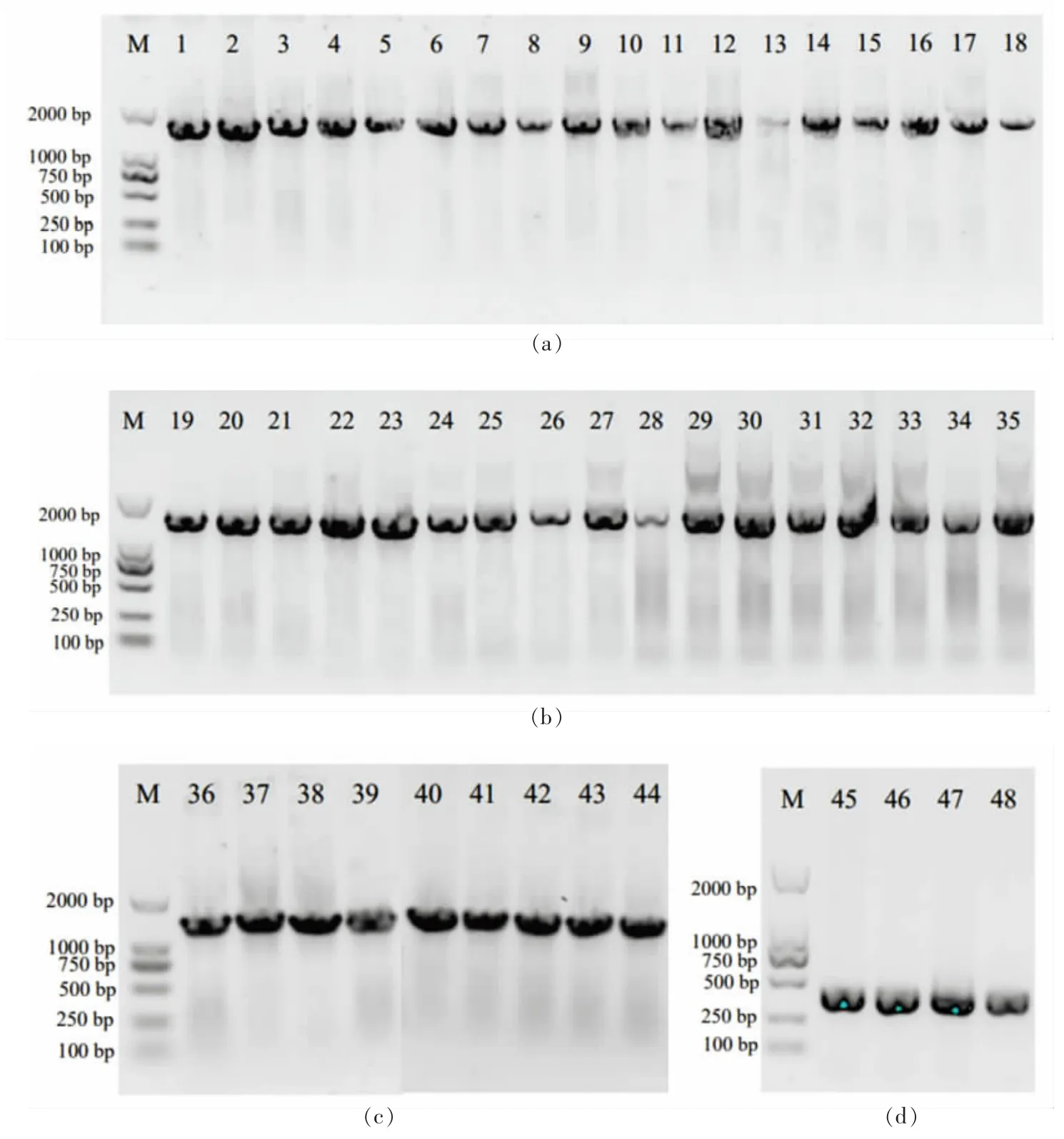
图2 PCR 产物电泳图Fig.2 Electrophoresis of PCR amplification result
2.2.2序列同源性分析 利用BLAST 分析菌株的测序结果,48 株菌分别归属于14 个种属,结果如表2 所示。
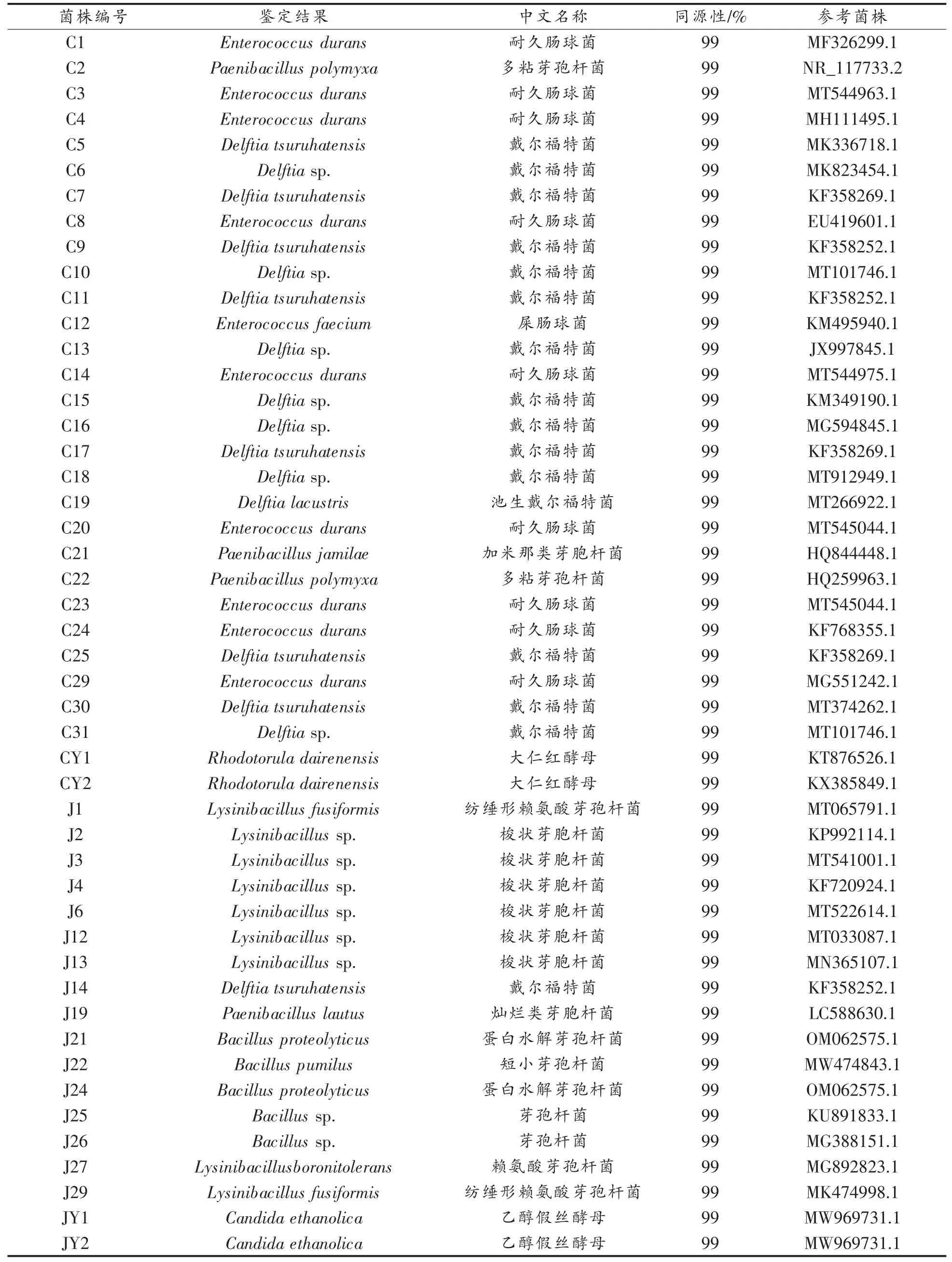
表2 细菌16S rDNA 序列、酵母26S rDNA 分析结果Table 2 Results of 16S rDNA sequence analysis for bacteria and 26S rDNA sequence analysis for yeasts
耐久肠球菌有9 株(均来自醋醅),是两种样品中分离数量最多的菌种,占总数的18.75%;戴尔福特菌(Delftia tsuruhatensis)有8 株(7 株来自醋醅,1 株来自酒糟),占总数的16.67%;戴尔福特菌属(Delftiasp.)有7 株(均来自醋醅),占总数的14.58%;赖氨酸芽孢杆菌属(Lysinibacillussp.)有6 株(均来自酒糟),占总数的12.50%。另外,还从醋醅中分离到2 株多粘类芽孢杆菌(Paenibacillus polymyxa),2 株大仁红酵母(Rhodotorula dairenensis),1 株池生戴尔福特菌(Delftia lacustris),1株屎肠球菌(Enterococcus faecium),1 株加米那类芽孢杆菌(Paenibacillus jamilae);从酒糟中分离到2 株芽孢杆菌(Bacillussp.),2 株纺锤形赖氨酸芽孢杆菌(Lysinibacillus fusiformis),2 株乙醇假丝酵母(Candida ethanolica),2 株蛋白水解芽孢杆菌(Bacillus proteolyticus),1 株短小芽孢杆菌(Bacillus pumilus),1 株耐硼赖氨酸芽孢杆菌(Lysinibacillus boronitolerans),1 株灿烂类芽孢杆菌(Paenibacillus lautus)。
Liu 等[30]从副地衣芽孢杆菌(Bacillus paralicheniformis)中筛选能够同时降解EC 和尿素的双效脲酶;Cui 等[31]通过在白酒发酵过程中接种球形赖氨酸芽孢杆菌(Lysinibacillus sphaericus)可以有效降低其中的EC 和尿素含量;Jia 等[32]从赖氨酸芽孢杆菌(Lysinibacillus fusiformis)中获得能够降解EC 的氨基甲酸乙酯水解酶,且该酶对尿素无作用;Mohapatra 等[33]从海绵微球菌(Micrococcussp.)中获得氨基甲酸乙酯水解酶。本文从发酵食品来源筛选到的菌株多为球菌和芽孢杆菌,与已报道的降解氨基甲酸乙酯菌株在属水平较为一致。
2.2.3 建立氨基甲酸乙酯降解细菌的系统发育树利用List of Prokaryotic Names with Standing in Nomenclature 网站(https://lpsn.dsmz.de/)检索不同种属细菌的模式菌株,测序结果与模式菌株使用本地软件Mega 11.0,运用N-J 法建立系统发育树,结果如图3 所示。
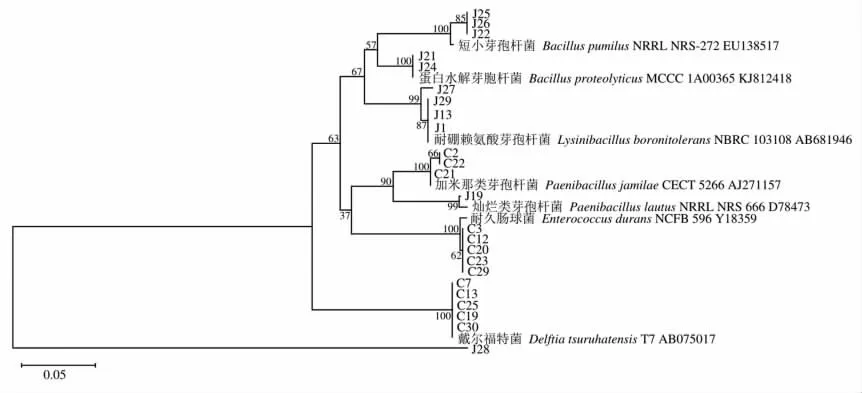
图3 醋醅、酒糟细菌分离株16S rDNA 序列系统发育树Fig.3 Phylogenetic tree of bacteria from in vinegar brewing mass and fermented grains of Baijiu based on 16S rDNA sequence
由图3 可以看出,J22、J25、J26 与短小芽孢杆菌EU138517 聚为一支,表明这3 株菌均为短小芽孢杆菌,与分子鉴定结果较为一致,形成第1 类群。J21、J24 与蜡样芽胞杆菌AJ841873 在同一分支,表明三者遗传距离较近,形成第2 类群。J1、J13、J29 与赖氨酸芽孢杆菌1031108 在同一分支,并与J27 聚为一支形成第3 类群;C2、C21、C22 与加米那类芽胞杆菌AJ271157 聚为一支,形成第4类群;J19 与灿烂类芽孢杆菌D78473 形成第5 类群;C3、C12、C20、C23、C29 与耐久肠球菌Y18359聚为一支,形成第6 类群;C7、C13、C19、C25、C30与戴尔福特菌AB075017 形成第7 类群。
2.3 氨基甲酸乙酯降解菌株在白酒中的应用
2.3.1 标准曲线的绘制 按照1.3.4.2 节中GCMS 相关条件,测定10~1 000 μg/L 的标准曲线工作液,以EC 定量离子峰面积对质量浓度构建标准曲线,结果如图4 所示。
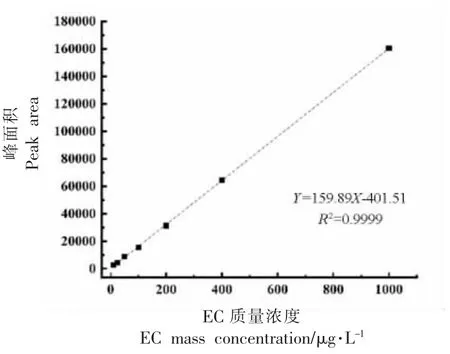
图4 氨基甲酸乙酯标准曲线Fig.4 Calibration curve of ethyl carbamate
为考察样品提取方法的准确度,进行100 μg/L 的添加回收试验,结果见表3。回收率为81.87%,在70%~110%之间,说明样品提取方法的准确度能够满足检测的需要。

表3 预处理方法的回收率Table 3 Spiked recoveries of the pretreatment methods
2.3.2 白酒中氨基甲酸乙酯的消减 目前,在白酒发酵过程中,接种是去除EC 或其前体物质的主要方法,比如孟庆达等[34]通过向固态发酵的白酒酒醅中接种高于107CFU/g 酒醅的罗伊氏乳杆菌,30 ℃发酵70 d,尿素去除率在97.3%以上。然而白酒在发酵过程中的酒精度一般在10%左右,最高达18%,本研究是将酒糟来源的J29 和JY1经固定化后添加到商品白酒中(53%vol),20 ℃处理12 h,结果如图5 所示。
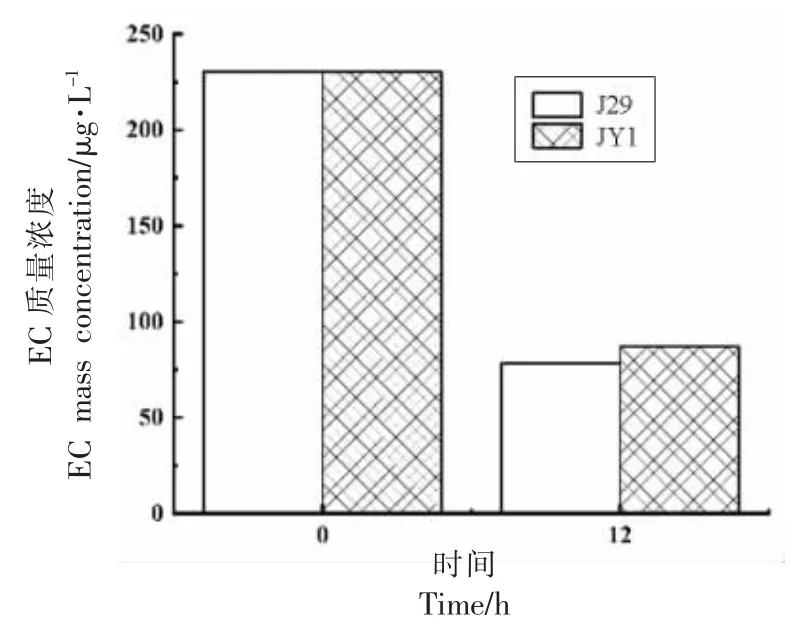
图5 固定化菌株对白酒中氨基甲酸乙酯的去除效果Fig.5 Removal effect of immobilized strains on EC in Baijiu
商品白酒中EC 质量浓度为230.37 μg/L,处理12 h 后白酒中EC 质量浓度显著降低,其中J29处理后EC 质量浓度降低至78.12 μg/L,降解率为66.09%,JY1 处理后EC 质量浓度降低至86.97 μg/L,降解率为62.25%。
3 结论
本文从醋醅、酒糟中筛选出以EC 为唯一碳源,可降解EC 的细菌44 株、酵母4 株,经分子鉴定后发现,得到戴尔福特菌(15 株)、耐久肠球菌(9 株)、梭状芽胞杆菌(6 株)、纺缍形赖氨酸芽孢杆菌(2 株)、多粘芽孢杆菌(2 株)、芽孢杆菌(2株)、大仁红酵母(2 株)、乙醇假丝酵母(2 株)、蛋白水解芽孢杆菌(2 株)、赖氨酸芽孢杆菌(1 株)、灿烂类芽孢杆菌(1 株)、加米那类芽胞杆菌(1株)、短小芽孢杆菌(1 株)、池生戴尔福特菌(1株)、屎肠球菌(1 株)。从酒糟来源的细菌、酵母中各选1 株,包埋后应用于降解商品白酒中的EC,结果表明,处理12 h 的白酒中EC 质量浓度由230.37 μg/L 降至78.12 μg/L(细菌)和86.97 μg/L(酵母),降解率均高于60%,包埋后的两株菌株不仅能够耐受高浓度乙醇(53%vol)且降解效率高。
本研究通过分离、鉴定醋醅和酒糟中氨基甲酸乙酯降解菌株,并分析了其EC 降解能力,为研究耐酸、耐乙醇的ECH 奠定了基础。后续将通过分子生物学方法克隆ECH 基因并进行表达,以期筛选出耐酸、耐乙醇的ECH,控制白酒中的EC。研究不同EC 降解菌株的特性,加速ECH 的开发,从而采取针对性措施降低发酵酒中EC 含量,对我国发酵酒的安全性提升具有重要意义。
致谢
本文受到酿酒生物技术及应用四川省重点实验室开放课题(NJ2021-01)“氨基甲酸乙酯水解酶的筛选和基因工程生产”的资助。
