破壁方法对红球菌11-3 胞内几丁质脱乙酰酶释放的影响
2023-08-18石文琪于宏伟马爱进桑亚新孙纪录
肖 宇,石文琪,于宏伟,马爱进,桑亚新,孙纪录*
(1 河北农业大学食品科技学院 河北保定 071000 2 河北科技师范学院食品科技学院 河北昌黎 066600 3 北京工商大学食品与健康学院 北京 100048)
壳聚糖(Chitosan)是一种经过乙酰基脱除处理的物质,它的优点包括易降解、耐水、耐药、易生长、抗微生物、可循环利用、安全、无毒等,因此在食品、医疗、造纸、化妆品、环境保护、农业等众多行业得到了广泛应用[1]。在食品领域,壳聚糖可以用于保鲜海鲜、水果和肉类[2-4],延缓淀粉的老化,增强面包的持水性[5],并能够澄清果汁[6]等。
目前,高温浓碱法是几丁质制备壳聚糖最为常用的方法。然而,浓碱的使用会带来严重的环境污染问题,且具有产物不稳定,耗能高等缺点[7]。采用酶分解技术降解几丁质,可以有效实现壳聚糖的绿色制备,这将成为壳聚糖制造行业的一个重要发展趋势[8]。
几丁质脱乙酰酶(Chitin deacetylase,CDA)能够催化水解几丁质中的乙酰基,使其转化为壳聚糖[9]。这种酶被认为是迄今为止发现的最能够将几丁质转变成壳聚糖的酶[9]。此外,迄今为止,已报道的CDA 大多数来源是真菌,也有少部分来源于细菌[10],并且,微生物产生的CDA 大多为胞内酶。柴金龙等[11]筛选了1 株产CDA 的海水硝酸盐还原菌(Nitratireductor aquimarinus)MCDA3-3,优化培养条件后,酶活力达到4.07 U/mL。通过多级紫外线诱变育种,魏丽蓉等[12]以海洋微紫青霉(Penicillium janthinellum)UV-0S 为原始菌株,成功获得了高产的CDA 突变株UV-3S,在最佳发酵条件下,酶活力达到11.83 U/mL。岳洪霞等[13]经筛选,发现1 株具有较强CDA 酶活性的菌株11-3,经鉴定为红球菌(Rhodococcussp.),研究发现该菌所产CDA 为胞内酶。张建旭等[14]通过优化该菌的产酶培养基,将其CDA 酶活力由58 U/mL 提高到5 890 U/mL。由此可见,红球菌是非常好的CDA 来源。然而,该菌是革兰氏阳性菌,具有多层肽聚糖细胞壁,且当细胞老化时,其细胞壁厚度还会增加,更难以破碎。因此,从红球菌细胞中获得大量CDA 的最大难题是细胞破碎[15-18]。
常见的微生物细胞破壁方法有很多,不同方法对胞内酶的提取效果的影响不尽相同。按照作用方式可分为化学法、物理法和生物法。其中,化学法有表面活性剂处理法等[19];物理法有机械法、反复冻融法、玻璃珠法、超声处理法等[19];生物法有酶解法等[20]。这些方法均有各自的局限性。机械法损耗大,且会产生过多的热量,导致酶失活[21];酶解法的价格昂贵,而且可能导致产物的降解;化学方法的效率很低,需要很长时间才能发挥作用,而且使用的试剂有很高的毒性,容易导致细胞酶失活,此外,还有可能对后续试验造成干扰;使用超声波进行冷却可能会使一些敏感的化学物质失去活性[22]。
目前,国内外对于产CDA 微生物的研究较多集中在高产菌株的选育、发酵特性、异源表达及酶学性质方面,对于CDA 高产菌株破壁处理的报道很少。本研究拟通过物理、化学和生物方法,包括超声、反复冻融、液氮研磨、球磨、均质、表面活性剂处理、氯仿处理以及溶菌酶处理等,对红球菌11-3 进行破壁处理,以提取的CDA 酶活力为主要评价指标,结合菌体扫描电镜观察,筛选出适合红球菌11-3 的单一细胞破壁方法。以此为基础,研究联合破壁方法对提取红球菌11-3 胞内CDA的效果,以期探寻出一种红球菌高效破壁提取CDA 的方法。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株 红球菌(Rhodococcussp.)11-3(以下简称红球菌),山东省食品发酵工业研究设计院刘建军教授惠赠。
1.1.2 试剂 溶菌酶(20 000 U/mg)、SDS、Twiton X-100,Biotopped 公司;EDTA,美国Solarbio 公司;氯仿,江苏普乐司生物科技有限公司;4-硝基乙酰苯胺,上海源叶生物有限公司;对硝基苯胺,天津市华东试剂厂;其它所用化学试剂均为分析纯级。
1.1.3 培养基 斜面培养基:蛋白胨10.0 g/L,牛肉膏5.0 g/L,氯化钠5.0 g/L,琼脂18.0 g/L,pH 7.0~7.2;种子培养基:葡萄糖2.5 g/L,酵母膏5.0 g/L,硫酸铵4.0 g/L,磷酸二氢钾1.5 g/L,pH 值自然;发酵培养基:蛋白胨2.5 g/L,蔗糖7.0 g/L,硫酸铵2.5 g/L,磷酸二氢钾1.5 g/L,乙酸钠2.0 g/L,玉米浆5.0 g/L,pH 值为7.5。
1.2 仪器与设备
FA1004 电子天平,上海越平科学仪器有限公司;PHS-3DW 型pH 计,安徽合肥桥斯仪器设备有限公司;WP25AB 台式电热恒温培养箱,天津市泰斯特仪器有限公司;ZWY-2102C 恒温培养振荡器,上海智城分析仪器制造有限公司;HH-4 数显恒温水浴锅,金坛市良友仪器有限公司;TGL-16MG 低温高速离心机,长沙湘锐离心机有限公司;FSH-2 可调高速匀浆机,常州国华电器有限公司;JY92-ⅡDN 超声波细胞粉碎机,宁波新芝生物科技股份有限公司;QM-100S 多功能高效球磨仪,五洲鼎创(北京)科技有限公司;721G 可见分光光度计,上海仪电分析仪器有限公司;CPD 030临界点干燥器,北京裕隆时代科技有限公司;SPIModule 溅射镀膜机,上海铂悦仪器上海有限公司;日本Hitachi s4800 场发射扫描电镜,昆山工研院新型平板显示技术中心有限公司。
1.3 方法
1.3.1 菌株活化与培养 将斜面上的红球菌菌株接种在营养肉汤(Nutrient broth,NB)固体培养基上,在30 ℃下培养24 h,然后再将其转移至NB 液体培养基上,进行3 次活化培养。将经过活化的菌株以5%的比例注入发酵培养液,于30 ℃,180 r/min 培养60 h[23]。在培养完成后,将液体培养物于4 ℃,8 000 r/min 离心20 min,弃上清,使其沉淀,接着将菌体用无菌水洗涤2~3 次,最终将其离心得到的湿菌体置于-20 ℃,以便进行后续的破壁试验。细胞破壁前,将菌体用缓冲液悬浮即可。
1.3.2 物理方法
1.3.2.1 反复冻融破壁处理 从培养60 h 的红球菌液体培养液中抽取10 mL,以8 000 r/min 的转速,在4 ℃下离心20 min,然后将菌体悬浮于10 mL 0.05 mol/L Tris-HCl 缓冲液(pH 8.0)中,并在液氮和37 ℃水浴中重复冻融10 次[24],以获得最终结果。
1.3.2.2 超声波破壁处理 将菌体悬浮于10 mL 0.05 mol/L Tris-HCl 缓冲液(pH 8.0)中,在不同处理时间(5,15,25,35,45 min)及不同功率(200,300,400,500,600 W)下分别对红球菌进行破碎处理(开5 s,关1 s),处理过程需在冰浴中进行[25]。
1.3.2.3 球磨破壁处理 将菌体悬浮于10 mL 0.05 mol/L Tris-HCl 缓冲液(pH 8.0)中,加入玻璃珠,在球磨仪最大振动频率30 Hz 的条件下研磨处理(5,10,15,20,25,30 min)。
1.3.2.4 匀浆破壁处理 将菌体悬浮于10 mL 0.05 mol/L Tris-HCl 缓冲液(pH 8.0)中,以13 000 r/min 的冰浴条件下匀浆处理(10,20,30,40,50 min)。
1.3.2.5 液氮研磨破壁处理 将取得的50 mL 菌液以8 000 r/min 的转速,在4 ℃下离心20 min,收集菌体,将其放入液氮预冷的研钵中,加入适量的液氮,充分研磨,直至菌体变成均匀的粉末状,然后将其溶解于40 mL 0.05 mol/L Tris-HCl 缓冲液中,并将其转移至干净的离心管中,最后用10 mL缓冲液洗涤研钵[26],并将其转移至离心管中。
1.3.3 化学方法
1.3.3.1 表面活性剂破壁处理 将菌体细胞重新悬浮在同体积的0.05 mol/L Tris-HCl 缓冲液(pH 8.0)中,分别添加EDTA、Triton X-100 和十二烷基硫酸钠(SDS),质量浓度均为20 g/L。悬浮液在30 ℃,180 r/min 的摇瓶中处理30 min[27]。
1.3.3.2 氯仿破壁处理 将菌体悬浮于同体积的0.05 mol/L Tris-HCl 缓冲液(pH 8.0)后,添加2.5%氯仿并在30 ℃,180 r/min 温育30 min[28]。
1.3.4 溶菌酶破壁处理 将菌体悬浮于同体积的0.05 mol/L Tris-HCl 缓冲液(pH 8.0)后,分别添加溶菌酶使其终质量浓度分为0.2,0.4,0.8,1.0,2.0 mg/mL,在37 ℃摇床中分别处理0.5,1.0,2.0,4.0,6.0 h。
1.3.5 联合破壁处理方法 处理1:从50 mL 菌液中取出湿菌体,将其放入液氮预冷的研钵内,加入适量液氮,彻底研磨,使菌体形成细腻的粉末后,加入40 mL 0.05 mol/L Tris-HCl 缓冲液(pH 8.0),使其完全溶解,然后将其转入清洁的离心管中,加入10 mL 缓冲液清洗研钵并将其转入离心管,制成重悬液,将其在13 000 r/min 的冰浴下均质30 min。
处理2:将菌体悬浮于同体积的0.05 mol/L Tris-HCl 缓冲液(pH 8.0)中,制成重悬液;重悬液以13 000 r/min 冰浴均质30 min 后,于10 000 r/min 离心5 min,留存上清液备用,并将收集到的湿菌体移入液氮预冷的研钵中,倒入适量的液氮充分研磨,直至菌体成均匀粉末状后用40 mL 留存的上清液溶解,并转入干净的离心管中,再用10 mL 上清液洗涤研钵一并转入离心管中,制成重悬液。
1.3.6 胞内CDA 的提取及酶活力测定
1.3.6.1 胞内CDA 酶的提取 将红球菌培养60 h,此时CDA 酶活力最高,取50 mL 发酵液,于8 000 r/min,4 ℃离心10 min 收集菌体,用无菌蒸馏水反复洗涤2~3 次,之后加入50 mL 0.5 mol/L Tris-HCl 缓冲液(pH 8.0)分别进行反复冻融、超声、球磨、匀浆、液氮研磨、EDTA、TritonX-100 和SDS、氯仿、溶菌酶、液氮研磨和匀浆联合进行破壁处理。将悬浮液于10 000 r/min,4 ℃离心10 min,以除去细胞残片和未破碎的细胞,上清液即为胞内酶粗酶液。
1.3.6.2 CDA 酶活力测定 对硝基苯胺标准曲线的制作:准确称取0.01 g 对硝基苯胺溶解于100 mL 蒸馏水中获得100 mg/L 的对硝基苯胺母液,然后用蒸馏水将母液稀释为0.0,2.0,4.0,6.0,8.0,10.0 mg/mL 的对硝基苯胺标液。通过蒸馏水作为参照物,测量各标准液体在波长400 nm 处的吸光度(A400)。重复3 次试验,以A400为横坐标,绘制出硝基苯胺浓度的标准曲线,如图1 所示。
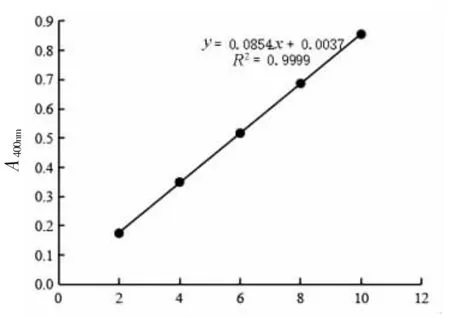
图1 对硝基苯胺标准曲线Fig.1 P-nitroaniline standard curve
CDA 酶活力测定方法参照文献[23],将1 mL 200 mg/L 的硝基乙酰苯胺水溶液、1 mL 合适浓度的酶液和3 mL 50 ℃的0.05 mol/L Tris-HCl 缓冲液(pH 8.0)混合均匀,构建反应体系,在50 ℃水浴中反应15 min,然后在沸水浴中终止反应,待反应液冷却到室温,再加入10 mL 水,搅拌均匀,以8 000 r/min 离心10 min,测定上清液的吸光度。空白对照体系为添加1 mL 相应浓度的高温灭活酶液,其余同上,测定上清液的吸光度值。设置3 个重复,取平均值,根据对硝基苯胺标准曲线计算CDA 酶活力(U/mL)。
1.3.7 扫描电子显微镜(Scanning electron microscopy,SEM)观察 按照Spiden 等[29]所述,通过SEM 对经1.3.3~1.3.6 节各方法处理后所得到的破碎上清液CDA 酶活力最高的样品进行可视化分析。具体步骤如下,在盖玻片上添加0.1%的聚乙烯亚胺溶液,并在火焰下加热干燥。将新鲜匀浆的悬浮液在盖玻片上温育1 h。然后,将盖玻片浸入2.5%戊二醛中1 h,在PBS 中冲洗3 次,每次10 min。将盖玻片转移到70%乙醇和二甲氧基甲烷(1∶1,V/V)的混合物中5 min,此后浸入纯二甲氧基甲烷中20 min。然后将盖玻片在临界点干燥器中干燥,其中溶剂逐渐被液态CO2(8 ℃,50 bar)代替。将干燥的盖玻片安装在带有双面碳片的铝片上,并使用溅射镀膜机涂金。最后,采用扫描电子显微镜观察红球菌的细胞形态,放大倍数为5 000倍。
1.4 统计学分析
破壁处理与酶活力测定试验重复3 次,运用Excel 2019 进行数据处理;使用Origin 2017 处理CDA 酶活力数据,结果用折线图呈现。
2 结果与分析
2.1 几丁质脱乙酰酶在红球菌中的定位
将已活化好的红球菌以体积分数5%的接种量接种到发酵培养基中,180 r/min,30 ℃培养,每12 h 测定培养物的OD600值,反映菌株的生长情况,以培养时间为横坐标,分别以OD600、CDA 酶活力为纵坐标,绘制其生长曲线和CDA 酶活力产生曲线,结果见图2。
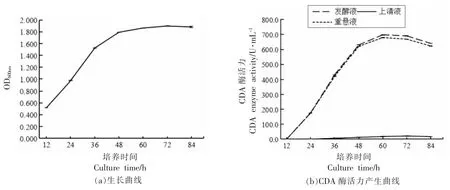
图2 红球菌细胞生长和几丁质脱乙酰酶产生曲线Fig.2 Cell growth and CDA production curves for Rhodococcus sp.11-3
由图2a 可知,随着培养时间的延长,CDA 酶活力逐渐增加,在60 h 时,达到最大。由图2b 可知,重悬液酶活力基本接近发酵液酶活力,上清液酶活力很低,初步判断原因是该酶可能存在于细胞内或细胞壁。
为避免发酵液中有其它物质影响酶活力测定的准确性,将发酵液离心收集菌体,对菌体进行反复洗涤,并用缓冲液悬浮(重悬液),分别测定上清液及重悬液的酶活力,如果上清液中CDA 酶活力较低,则该酶存在于胞内或者附着在细胞表面,可用表面活性剂洗涤菌体,离心分别测定上清液及重悬液的酶活力,若上清液中酶活力仍很低,结合图2 结果可以初步判断该酶属于胞内酶,结果如表1 所示。

表1 菌体反复洗涤后上清液和重悬液中CDA 酶活力Table 1 CDA activity in supernatant and resuspension after repeated washing
从表1 可以看出,上清液与重悬液相比CDA酶活力很低,因此,该酶不属于胞外酶。进一步在重悬液中加入表面活性剂吐温80,混匀,于室温静置20 min,离心测定上清液酶活力,以确定该酶具体位置,结果见表2。

表2 吐温80 处理后上清液和重悬液中CDA 酶活力Table 2 CDA enzyme activity in supernatant and resuspension after Tween 80 treatment
从表2 可以看出,用表面活性剂处理后,上清液中的CDA 酶活力仍很低,因此排除了该酶存在于细胞表面的可能性,可判定该酶为胞内酶,若要进一步确认此结论,应对红球菌细胞进行破壁处理。
2.2 物理破壁方法对红球菌胞内CDA 释放的影响
2.2.1 反复冻融破壁处理 采用反复冻融法对红球菌细胞进行破壁处理,观察CDA 的释放效果。离心收集沉淀和上清液,再将沉淀分散到同体积的缓冲液中,离心前、后分别测定重悬液和上清液CDA 酶活力,结果如图3 所示。
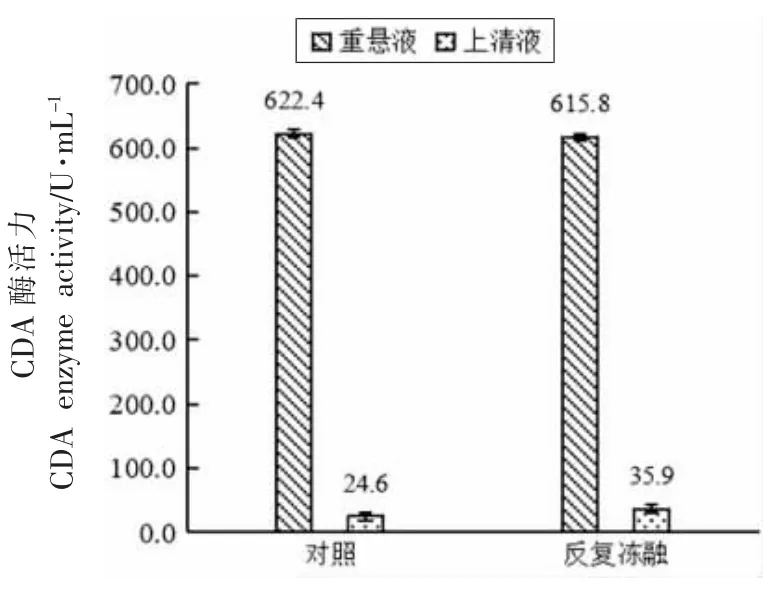
图3 反复冻融法对红球菌释放CDA 的影响Fig.3 The effect of repeated freezing and thawing on the release of CDA from Rhodococcus sp.11-3
从图3 可以看出,反复冻融法对红球菌细胞的破碎效果不明显。冻融前后重悬液、上清液酶活力相差甚微,CDA 仅释放了1.82%,说明仅采用冻融法不能显著破坏红球菌细胞壁,其胞内CDA 不能得到有效释放。
2.2.2 超声破壁处理
1)超声输出功率对细胞释放CDA 的影响超声处理已被用于释放许多重要的细胞内产物[30-32]。水浴超声处理也已成功地应用于改善各种微生物的细胞壁通透性[33-37]。超声波将电输入能量转换为高频超声波能量,这种机械能通过水浴超声波中的液体传输[38]。分别在200,300,400,500,600 W 的超声波输出功率下对红球菌细胞进行超声处理,处理总时间为25 min。测定上清液中CDA 的酶活力,结果见图4。
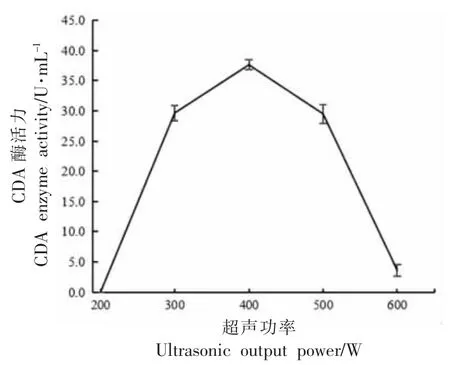
图4 超声输出功率对红球菌释放CDA 的影响Fig.4 The effect of ultrasound output power on the release of CDA from Rhodococcus sp.11-3
由图4 可知,当功率为200~400 W 时,破壁上清液中CDA 酶活力随着超声波输出功率的增加而渐强。这是由于较大的超声输出功率使液体中形成较多的空穴,进而产生更多的空化泡,使破碎作用增强。当功率为400~600 W 时,随着超声波输出功率增强,对CDA 的破坏逐渐变大,CDA 酶活力逐渐减小。因此,选择400 W 为适宜的输出功率。
2)超声处理总时间对细胞释放CDA 的影响输出功率为400 W,冰浴条件下,研究不同超声波处理总时间对细胞释放CDA 的影响,结果见图5。
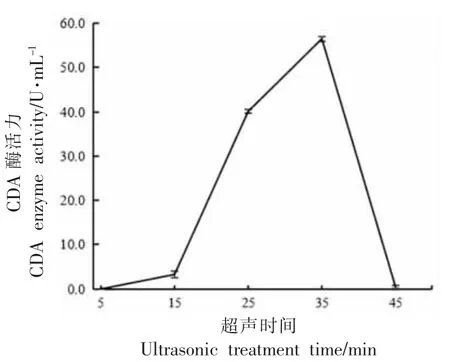
图5 超声时间对红球菌释放CDA 的影响Fig.5 The effect of total working time of ultrasonic on the release of CDA from Rhodococcus sp.11-3
超声波处理总时间为5~35 min 时,上清液中CDA 酶活力随着超声波处理总时间的延长而增大。到达35 min 时,CDA 酶活力达到最大。当超声波处理总时间超过35 min 后,CDA 酶活力骤降为0。这可能是由于超声过程中处理液局部温度骤增,导致酶失活。
3)在优化条件下超声处理对细胞释放CDA的影响 在400 W,35 min 的最优超声处理条件下,研究其对CDA 酶活力的影响,结果见图6。
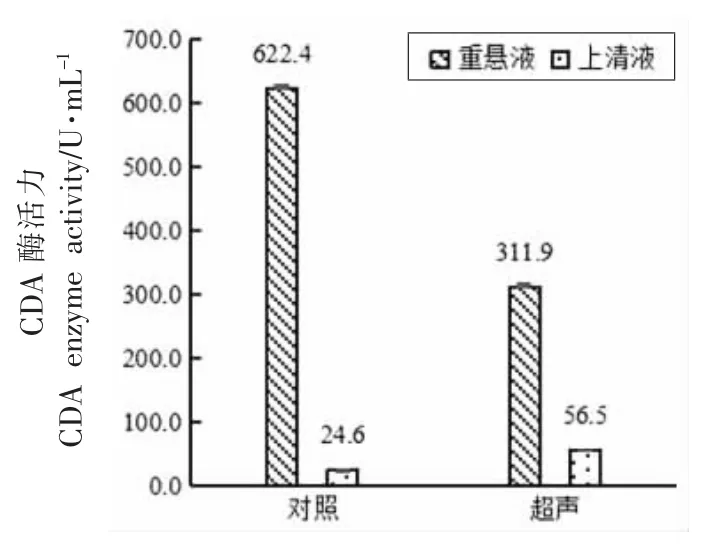
图6 超声处理对红球菌释放CDA 的影响Fig.6 The effect of ultrasonic treatment on the release of CDA from Rhodococcus sp.11-3
在400 W,35 min 的超声处理条件下,处理前、后总酶活力损失了49.89%,且CDA 仅释放了5.13%,因此超声波破壁法并不适用于红球菌。
2.2.3 球磨破壁处理 球磨是在物料研磨中是一种常用的设备,物料经球磨处理后,其表面积和孔隙率会大幅增加,其分散性、化学活性也会相应升高[39]。采用球磨法对红球菌进行破壁处理,在最大振动频率30 Hz 的条件下研磨0~30 min,分时段取样,离心收集上清液并测定其酶活力,观察CDA的释放效果,结果如图7 所示。
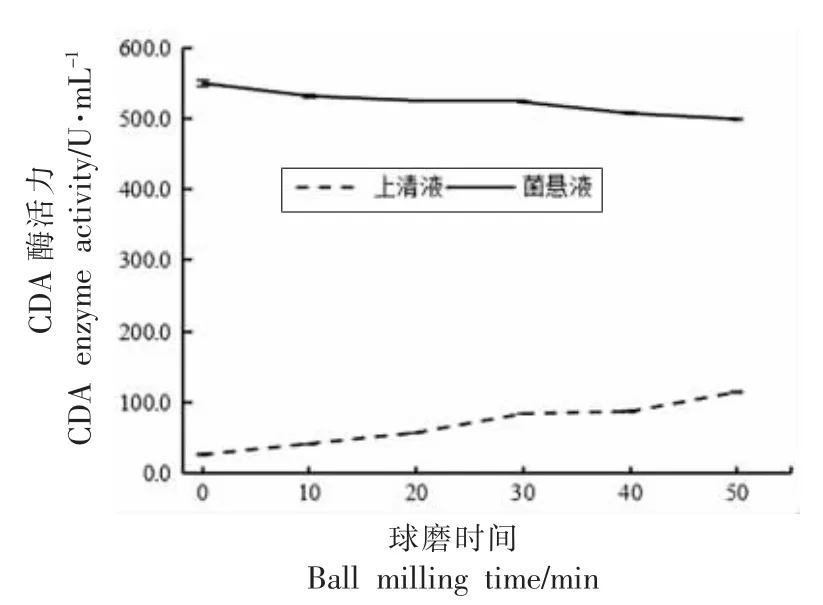
图7 球磨处理时间对红球菌释放CDA 的影响Fig.7 The effect of ball milling treatment time on the release of CDA from Rhodococcus sp.11-3
由图7 可知,球磨时间为0~30 min 时,细胞破碎液的上清液中CDA 酶活力随着球磨时间的延长而均匀增大。球磨时间为30 min 时,CDA 酶活力达到最大,为40.3 U/mL,CDA 释放率仅为6.97%。
2.2.4 匀浆破壁处理 匀浆器可以产生流体动力空化作用。在这个过程中,细胞壁被匀浆机产生的水动力裂解。在匀浆器中以最大可达到的水动力运行会产生最大数量的破碎细胞,从而使酶的释放达到最大化。据Pandi[40]报道,水动力空化对于释放位于周质空间中的酶最有效。本试验采用匀浆法对红球菌细胞进行破壁处理。在功率185 W,13 000 r/min 转速的条件下匀浆0~50 min,分时段取样,离心收集上清液并测定其酶活力,观察CDA的释放效果,结果如图8 所示。
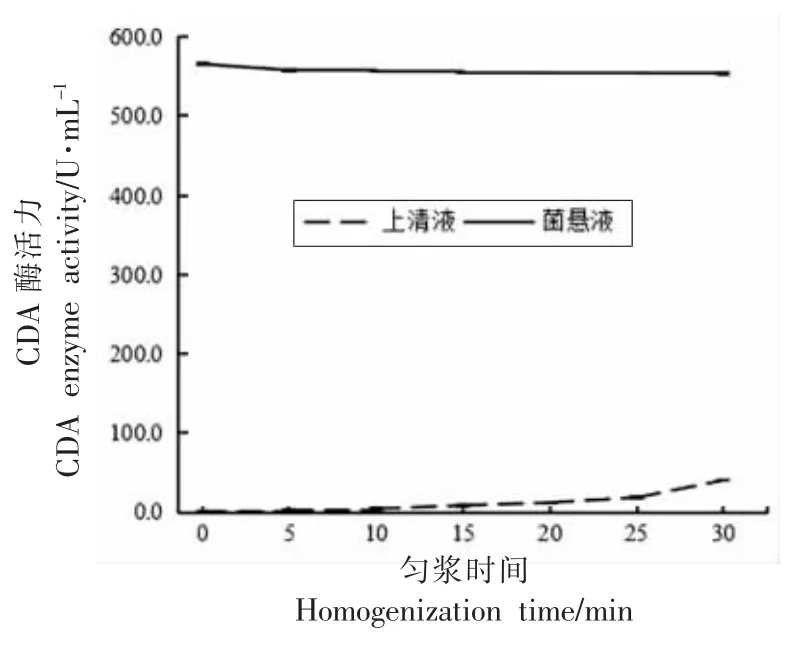
图8 匀浆时间对红球菌释放CDA 的影响Fig.8 The effect of homogenization time on the release of CDA from Rhodococcus sp.11-3
由图8 可知,匀浆时间为0~50 min 时,细胞破碎液的上清液中CDA 酶活力随着匀浆时间的延长而增大,匀浆时间为50 min 时,CDA 酶活力达到最大,为114.1 U/mL,释放率达到16%,且在匀浆过程中酶活力损失较小,为9.18%。
2.2.5 液氮研磨破壁处理 液氮研磨可以将细胞冷冻起来,质地变得很脆,这样更容易破坏细胞壁。同时,液氮的超低温可防止胞内酶被降解。另一方面,研磨细腻,能对细胞造成更大程度的破坏。本试验用液氮对红球菌进行充分研磨,将得到的细胞破碎液于10 000 r/min,4 ℃离心10 min,取上清液,测定其中的CDA 酶活力,结果见图9。
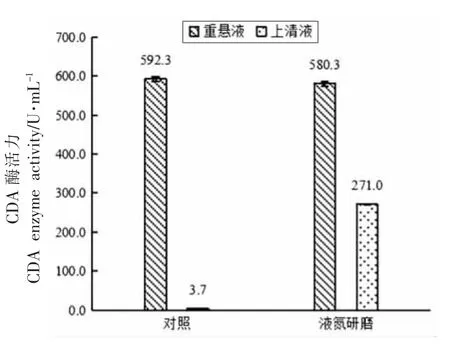
图9 液氮研磨处理对红球菌释放CDA 的影响Fig.9 The effect of liquid nitrogen grinding treatment on the release of CDA from Rhodococcus sp.11-3
由图9 可以看出,红球菌经液氮研磨后,上清液中CDA 酶活力明显提高,释放率达到45.13%,且在处理过程中重悬液中基本没有酶活力损失,仅为2.03%。因此与其它方法相比,液氮研磨提取CDA 是有效的。
2.3 化学破壁方法对红球菌胞内CDA 释放的影响
2.3.1 表面活性剂破壁处理 化学方法的选择是基于它们攻击细胞膜中特定抗性区域的能力。这些方法被用于改变细胞壁和细胞膜的通透性或弱化。本试验采用EDTA、TritonX-100、SDS 和联合方法对红球菌细胞进行破壁处理。悬浮液在30 ℃的摇瓶中培养30 min,并在4 ℃,12 000 r/min 离心5 min。离心前、后,分别测定重悬液和上清液的CDA 酶活力,观察CDA 的释放效果,结果如图10所示。
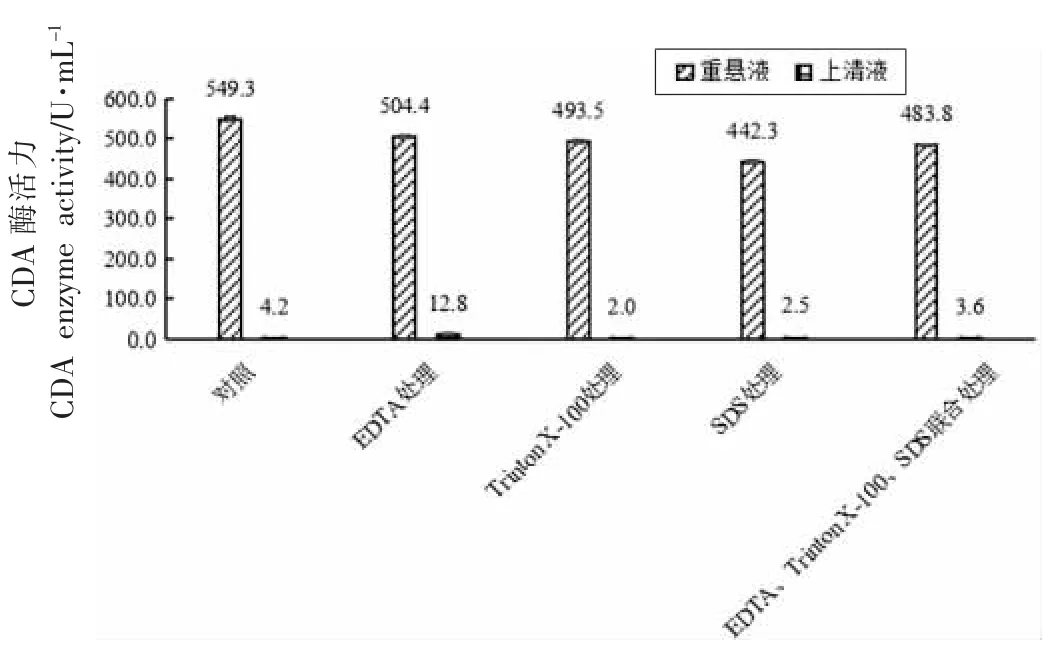
图10 EDTA、TritonX-100 和SDS 处理对红球菌细胞释放CDA 的影响Fig.10 The effect of EDTA,TritonX-100 and SDS treatment on the release of CDA from Rhodococcus sp.11-3
由图10 可知,用EDTA 处理红球菌细胞,上清液CDA 酶活力得到提高,达到12.8 U/mL;用TritonX-100 和SDS 及联合方法对红球菌细胞进行破壁处理时,上清液酶活与未处理前上清液CDA 酶活力相比并未得到提高。此外,分别用4 种方法处理后总酶活比未处理前分别降低了8.2%,10.2%,19.5%,11.9%。综上所述,在4 种化学方法中,用质量浓度为20 g/L 的EDTA 处理红球菌细胞,总酶活损失最小,且破碎后上清液CDA 酶活力最高,然而CDA 释放率仅1.57%。
2.3.2 氯仿破壁处理 经2.5%氯仿处理的重悬液以4 ℃,10 000 r/min 离心5 min。离心前、后,分别测定重悬液和上清液的CDA 酶活力,观察CDA的释放效果,结果如图11 所示。
由图11 可知,用氯仿处理红球菌细胞,总酶活仅损失了2.06%,且上清液CDA 酶活力得到提高,达到30.1 U/mL,CDA 释放率为3.70%。由此可见,该方法虽然能保持较低的总酶活损失,但破碎效果并不理想,因此该方法并不适用。
2.4 溶菌酶破壁方法对红球菌胞内CDA 释放的影响
溶菌酶可专一地作用于革兰氏阳性菌的细胞壁肽聚糖分子中的β-1,4 键,从而使其细胞壁轻易裂解,释放出细胞内含物[28]。本试验采用不同浓度的溶菌酶于37 ℃处理红球菌,观察在不同溶菌酶质量浓度下,处理时间对CDA 酶活的影响,结果如图12 所示。
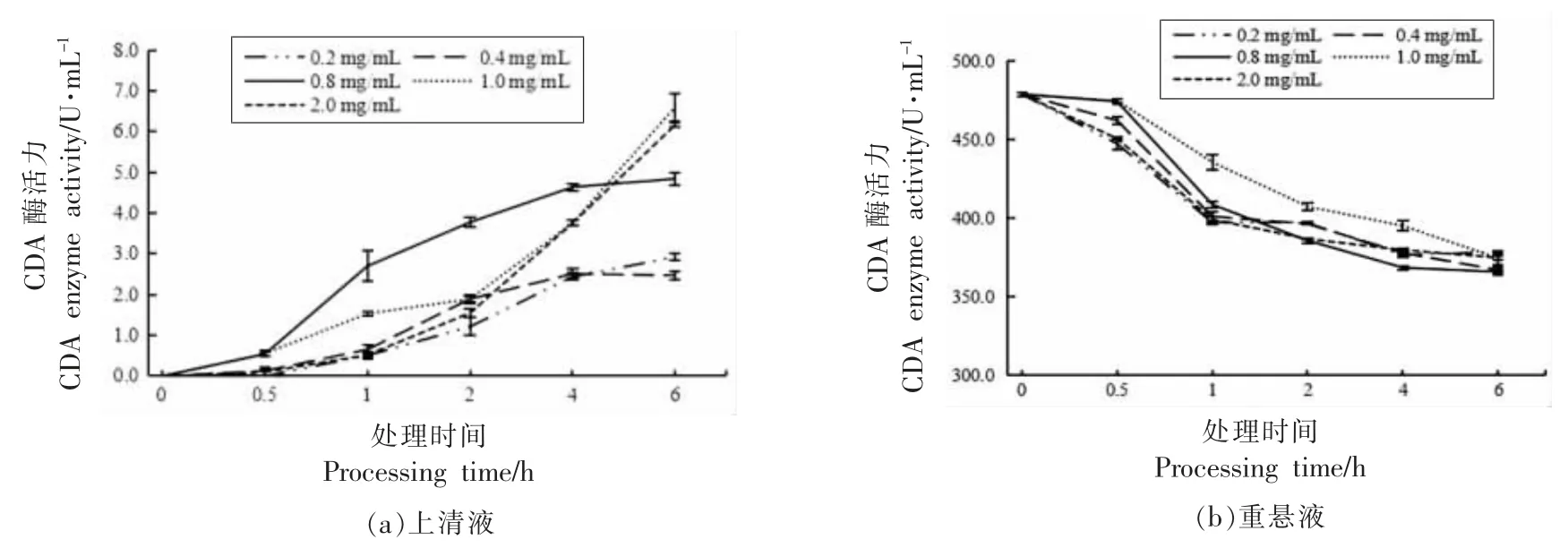
图12 不同溶菌酶浓度下处理时间对红球菌释放CDA 的影响Fig.12 The effect of treatment time under different lysozyme concentrations on the release of CDA from Rhodococcus sp.11-3
结果表明,溶菌酶质量浓度为1.0 mg/mL,处理6 h,上清液CDA 酶活力达到最大,为6.6 U/mL,释放率为1.38%。用溶菌酶处理红球菌菌体细胞,酶解后菌体残留CDA 酶活力与未处理基本没有差别。
2.5 联合破壁方法对红球菌胞内CDA 释放的影响
根据2.2~2.4 节各单一破壁方法的CDA 释放率及总酶活损失率,选择液氮研磨和匀浆两种方法联合对红球菌进行破壁处理。将处理1 和处理2 中的重悬液分别以4 ℃,10 000 r/min 离心5 min。离心前、后,分别测定重悬液和上清液的CDA 酶活力,观察CDA 的释放效果,结果如图13所示。
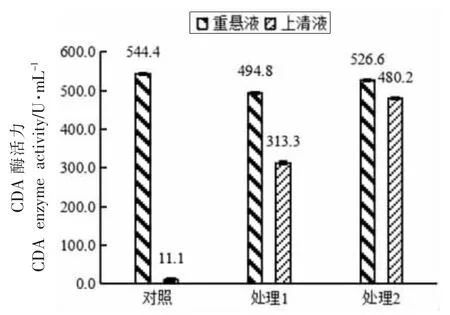
图13 液氮研磨和匀浆联合处理对红球菌释放CDA 的影响Fig.13 The effect of combined treatment of liquid nitrogen grinding and homogenization on the release of CDA from Rhodococcus sp.11-3
由图13 可知,用处理1 和处理2 两种联合方法处理红球菌细胞,上清液CDA 酶活力得到大幅度提高,分别达到313.3 U/mL 和480.2 U/mL,CDA释放率分别为55.52%和86.17%,两种处理总酶活力损失分别为9.11%和3.27%。由此可见,用处理2 破碎红球菌效果较理想。
2.6 不同破壁方法处理的红球菌细胞的SEM 观察
利用扫描电子显微镜观察经不同破壁方法处理的红球菌,包括:未处理组、反复冻融组、超声波处理组(400 W,35 min)、球磨处理组(30 Hz,50 min)、匀浆处理组(13 000 r/min,30 min)、液氮研磨组、EDTA 处理组、氯仿处理组、溶菌酶处理组(1.0 mg/mL,6 h)、处理1(液氮研磨后,匀浆处理13 000 r/min,30 min)、处理2(匀浆处理13 000 r/min,30 min 后,液氮研磨),结果见图14。
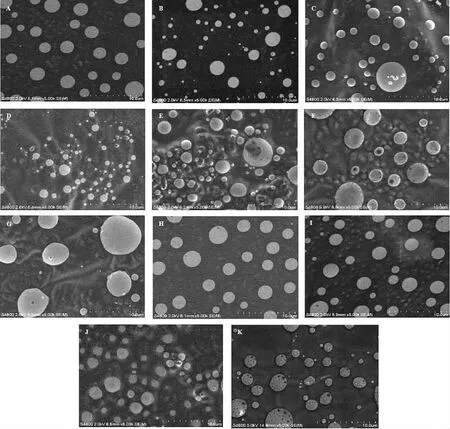
图14 不同破壁方法处理的红球菌细胞的SEM 图Fig.14 SEM images of Rhodococcus sp.11-3 cells treated by different breaking methods
由图14 可知,未经过处理的红球菌细胞表面光滑(图14A);经反复冻融、超声波、球磨、EDTA、氯仿、溶菌酶处理后的红球菌细胞表面变化很小,仅有个别细胞出现小孔洞(图14B、14C、14D、14G、14H、14I)。经匀浆处理的红球菌个别细胞表面出现较大孔洞,内容物外泄(图14E);经液氮研磨处理的红球菌细胞表面都遭到破坏,出现密密麻麻的孔洞,个别细胞表面被严重破坏,出现较大的孔洞(图14F);经液氮研磨和匀浆联合处理的红球菌细胞表面出现更多密集孔洞(图14J);经匀浆和液氮研磨联合处理的红球菌细胞表面的孔洞比图14J 的更大且密集。以上结果表明,匀浆处理和液氮研磨对红球菌细胞破壁有效果,匀浆处理和液氮研磨联合处理效果更明显。
3 结论
不同的破壁方法对红球菌菌株的胞内CDA释放效率及细胞形态变化的影响有明显差别。对于红球菌细胞,液氮研磨和匀浆是两种较优的破壁方法。破壁处理后的细胞表面出现明显孔洞,CDA 释放率分别达到45.13%和16.00%,处理过程中总酶活力损失较小。利用先匀浆后液氮研磨的联合方法处理红球菌,能够在更大程度上破坏细胞壁,产生更多、更大的密集孔洞,CDA 释放率达到86.17%。由此可见,匀浆和液氮研磨联合处理有效提高了红球菌胞内CDA 的释放程度,作为一种操作简单且高效的处理方式,为胞内CDA 的分离纯化提供了一种有效途径,同时,也为红球菌应用于壳聚糖的酶法工业化生产,提供了重要的推动作用。
