PD-1人源化小鼠构建繁殖与基因型鉴定*
2023-08-15李晓娟孙岩峰李兴杰李瑞生
李晓娟 孙岩峰 修 叶 李兴杰 李瑞生
(1.中国人民解放军总医院第五医学中心感染病医学部研究所,北京 100039)(2.中国人民解放军总医院第三医学中心儿科,北京 100039)(3.中国人民解放军总医院第五医学中心肝病医学部研究所,北京 100039)(4.福建中医药大学药学院,福州 350122)
近年来恶性肿瘤的发病率呈持续增长趋势已成为严重的社会问题[1]。随着研究的不断突破,以PD-1/PD-L1为靶点的肿瘤免疫治疗成为热点,通过抑制PD-1/PD-L1通路,从而恢复机体免疫功能并产生抗肿瘤作用[2]。众所周知,动物模型在实验研究中担负起不可取代的重要作用,研究者多通过基因修饰的技术,将小鼠体内的相关基因替换成人的相关基因从而建立人源化小鼠模型,能够更好的在动物模型中模拟人类疾病并进行研究,此类人源化小鼠广泛应用于肿瘤免疫药物研发、药物临床前评估、人基因功能研究等生物医药领域研究[3-5]。本实验拟采用CRISPR/Cas9基因组编辑技术来构建PD-1人源化小鼠,为进一步开发和应用PD-1人源化小鼠(h-PD-1)作为药物筛选及评价来提供良好的动物模型。
1 材料和方法
1.1 材料
1.1.1实验动物:本实验委托赛业模式生物研究中心(太仓)有限公司,实验动物生产许可证号【SCXK(苏)2018-0003】。采用CRISPR/Cas9基因组编辑技术,将C57BL/6J小鼠中PD-1的胞外区替换为相应的人源片段,同时完整保留小鼠PD-1的胞内部分,将构建好的受精卵通过显微注射法送回到代孕鼠输卵管中,最终获得阳性F0鼠。对F0鼠进行配繁,将性成熟的阳性F0鼠与野生型鼠配繁一代,获得F1代鼠,并经鼠尾基因组DNA的PCR检测PD-1的基因表达。因此公司提供了4只SPF级F1代小鼠,其中2只雌性和2只雄性,品系:C57BL/6J,基因型(KI/+),体质量20~24 g,8~9周龄。
1.1.2人源化小鼠的饲养与繁殖:将获得的4只F1代小鼠按照SPF级实验动物标准饲养,采用1(雄鼠)∶1(雌鼠)配比的方式进行繁殖。动物饲养在解放军总医院第五医学中心动物实验中心【SYXK(军)2017-0016】,屏障环境按国家标准进行饲养管理,饲料垫料购自斯贝福(北京)生物技术有限公司【SCXK(京)2019-0010】。本实验严格按实验动物使用的3R原则给予人道的关怀,通过了解放军总医院第五医学中心动物伦理委员会审查,伦理审批号:IACUC-2021-0020。
1.1.3主要试剂与仪器:小鼠基因型快速鉴定试剂盒(北京阳光英锐生物科技有限公司,货号:C190801);上样缓冲液&DNA染料(即用型)(北京阳光英锐生物科技有限公司,货号:C081911);50 bp DNA Ladder(北京金克隆生物技术有限公司,货号:MD0050);PCR扩增仪(PeQlab,型号:PEQSTAR 2X)。
1.2 方法
1.2.1小鼠基因组DNA提取:将获得的F1代饲养繁殖的F2代小鼠雌雄分笼后,分别剪取小鼠尾部一小段(0.2~0.5 cm)置入1.5 mL Eppendorf管中,参照小鼠基因型快速鉴定试剂盒抽提基因组DNA。
1.2.2PCR反应及琼脂糖凝胶电泳基因型鉴定:两组引物设计:(1)野生型:上游引物:5′-TTCCTTTCCGCTACAGACAACTC-3′,下游引物:5′-CTTCACAGAGAGGGACACAGAAGA-3′;(2)纯合子:上游引物:5′-GAATGGTGACCGGCATCTCTG-3′,下游引物:5′-GCTTTTGTAGTGGTCAGAGTGTGT-3′。PCR 反应:下列反应物构成20 L的反应体系。上游引物0.5 μL,下游引物0.5 μL,2×Hot Taq Mix 10 μL,DNA 模板(Diluted Template)2 μL,加H2O补足20 μL。采用基因扩增仪进行循环扩增:预变性,95 ℃ 5 min;变性,95 ℃ 30 s;退火,55 ℃ 30 s;延伸,72 ℃ 1 min,共35个循环,最后再延伸10 min。电泳鉴定:分别取PCR扩增产物10 μL,在2.0%琼脂糖凝胶中以120 V电泳30 min后于凝胶成像仪中观察拍照。小鼠尾部组织琼脂糖凝胶电泳基因型片段为:野生型:434 bp;纯合型:410 bp;杂合型:434 和410 bp,按此基因条带鉴别各个基因型小鼠。
1.2.3繁育与纯合型小鼠筛选鉴定:对F2代小鼠进行基因型鉴定,分别记录各基因型数量以及纯合型数量,计算纯合率。然后采用经典育种与PCR相结合的方法对基因敲除小鼠纯合型再次进行筛选。出生21 d后仔鼠行PCR检测,选出纯合型小鼠。成年F2代纯合型与纯合型、野生型与野生型进行交配,对繁殖的F3代仔鼠再进行基因型鉴定,确定基因型的稳定性后,继续将纯合型小鼠稳定扩群。
2 结果
2.1 人源化小鼠F2代配繁及生长情况
截至目前,F2代小鼠共繁殖5窝,每窝成活率均>95%。母鼠孕期为21 d左右,幼鼠由母鼠母乳喂养,哺乳期 21 d 左右,产后3周离乳。随着产仔窝数的增加,仔鼠的数量逐渐减少,母鼠的生育能力呈逐渐降低的状态。前4窝仔鼠雄性数量均比雌性数量多(表1)。
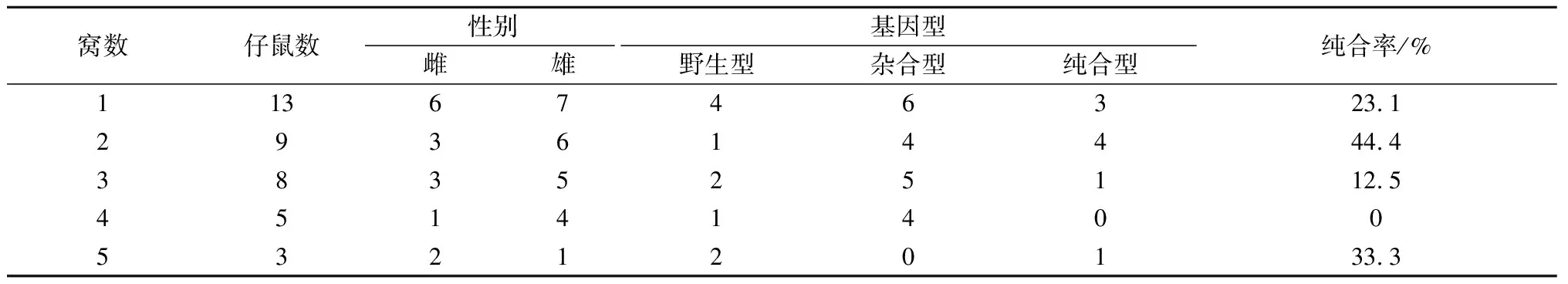
表1 F2代繁育结果统计
2.2 人源化小鼠F2代基因鉴定结果
将人源化小鼠出生21 d的F2代小鼠进行编号,部分小鼠鼠尾基因组DNA扩增产物凝胶电泳结果见图1。根据仅在410 bp左右位置可见条带为PD-1人源化小鼠纯合型,仅434 bp位置可见条带为野生型,在410和434 bp位置同时存在条带的小鼠为杂合型的判断原则,图中1号、4号、7号为纯合型小鼠;2号、5号为杂合型小鼠;3号、6号、8号为野生型小鼠。
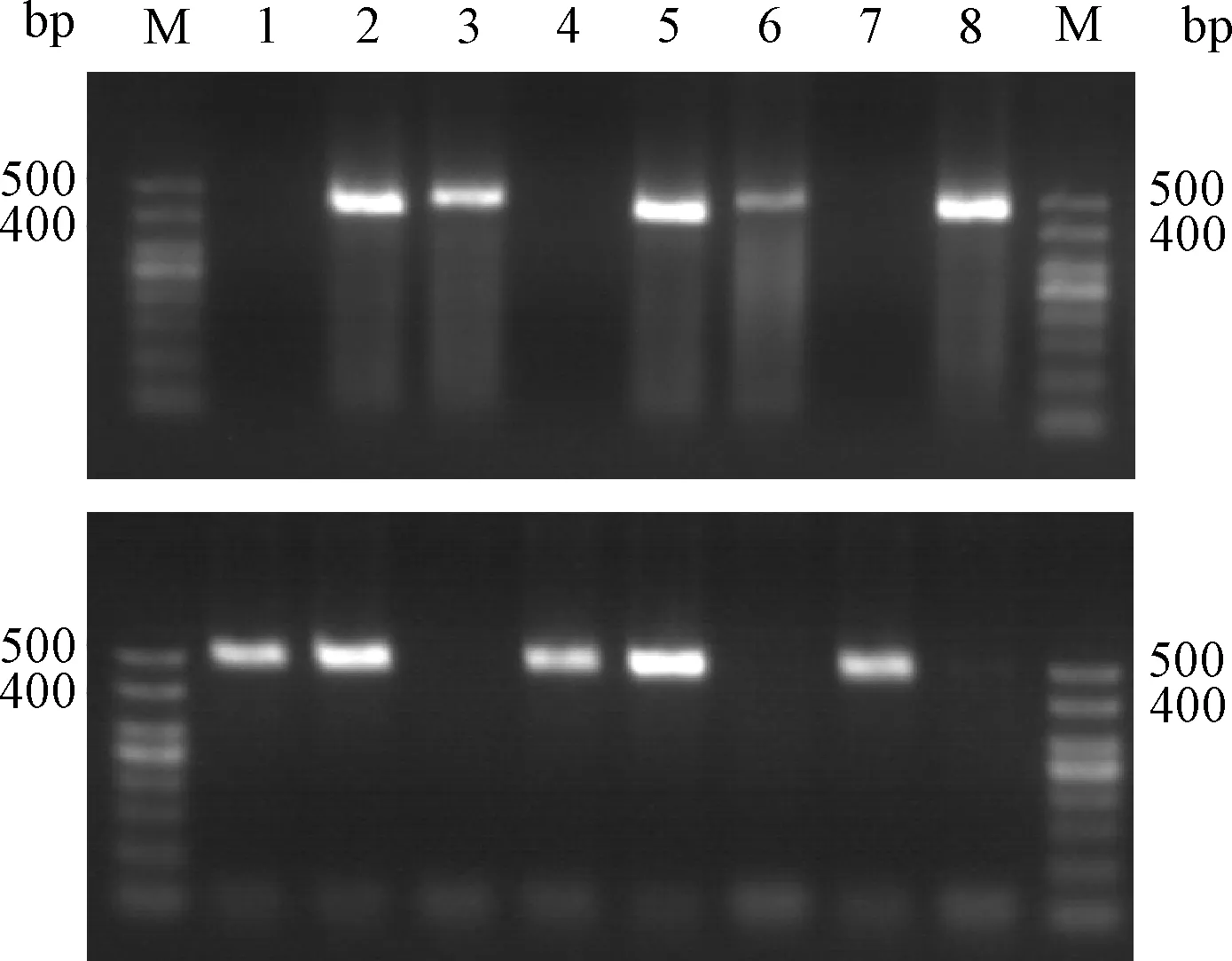
注:M.marker, 1~8分别为8只F2代小鼠
2.3 F2代交配繁育的F3代鉴定结果
根据PCR鉴定结果,将F2代中鉴定的杂合型与杂合型,纯合型与纯合型小鼠按雌雄1∶1的比例进行配繁。将纯合型交配繁殖的F3代小鼠用上述相同的方法进行鉴定,条带均为410 bp,说明均为纯合型,符合鉴定结果(图2),可继续进行繁殖扩群。纯合型与野生型小鼠外观上未见明显差异(图3)。
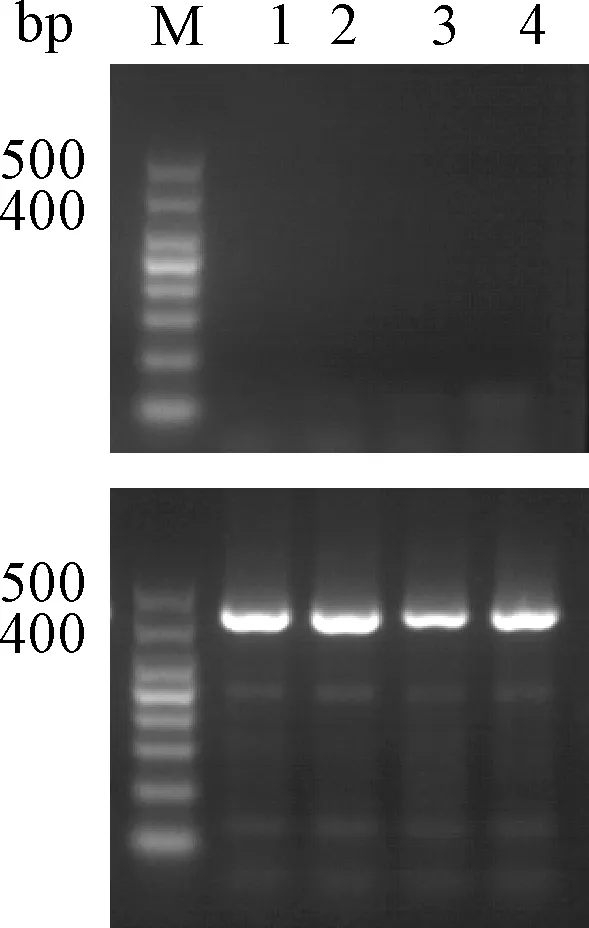
注:M.marker, 1~4分别为4只F3代纯合型小鼠
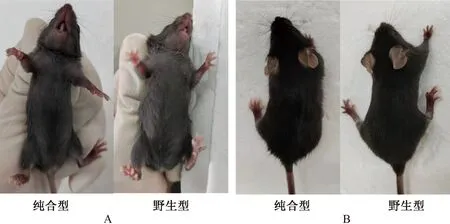
注:A.腹部对比图;B.背部对比图
3 讨论
基因工程动物模型在生物医学研究中是非常重要的研究载体,由于小鼠体型小,方便实验操作,又易于饲养繁殖,价格便宜,因此成为了基因工程动物模型的首选[6]。研究者可以对新出现的热点基因敲入各种品系的小鼠体内,以便进行不同疾病信号通路的研究。有研究[7]稳定的繁殖了AMPKα2基因敲除小鼠纯合子,为以后在糖尿病研究中提供了很好的动物平台;有研究[8]成功构建了前列腺癌免疫人源化小鼠模型,为下一步构建良好的前列腺癌免疫治疗临床前模型奠定了基础;有研究[9]构建PD-L1基因敲除小鼠品系,为 PD-L1体内基因功能研究提供了新的小鼠模型。而有关PD-1的基因工程小鼠报道甚少,人源化PD-1的基因型小鼠尚未见报道。
因此,本实验采用CRISPR/Cas9基因组编辑技术,将C57BL/6J小鼠中PD-1的胞外区替换为相应的人源片段,同时完整保留小鼠PD-1的胞内部分,将构建好的受精卵通过输卵管胚胎移植法送回代孕鼠输卵管中,获得阳性F0鼠。再将性成熟的阳性F0鼠与野生型鼠配繁一代,获得F1代鼠,并经鼠尾基因组DNA的PCR鉴定小鼠的基因型。本实验室把F1代进行交配获得F2代仔鼠,共繁殖5窝,分别记录了每窝的生仔数、基因型数以及纯合率。根据孟德尔遗传定律,采用杂合子互交,子代小鼠可能出现野生型(PD-1+/+)、杂合子(PD-1+/-)和纯合子(PD-1-/-)3种基因型,其比例接近1∶2∶1,本实验结果显示除第5窝外,前4窝均杂合型数量最多,野生型与纯合型数量较少且接近,三者比例接近1∶2∶1,因此符合孟德尔遗传定律的特征。随后实验中的杂合型小鼠可用于保种,而野生型小鼠可用于实验阴性对照组,该繁育方法同时满足了实验与保种的需求[10]。随着繁殖窝数的增多,F1代鼠的产仔数逐渐减少,说明其生育能力逐渐降低,因此实验要尽快开展,将F2代鼠鉴定完毕后,尽快繁殖下一代,确保纯合型得到稳定扩群。由于PD-1人源化小鼠的各基因型从外观上很难区分,因此从基因水平进行鉴定是实验的首要任务。众所周知,PCR法是非常成熟且广泛应用的鉴定基因型的方法,我们设计了分别针对野生型与纯合型的两对特异性引物,能够增加鉴定不同基因型的准确性和可靠性[11]。根据PCR的鉴定结果,我们严格按照SPF级动物饲养标准对小鼠进行饲养和繁殖[12],在子代中挑选几对杂合型与杂合型配繁保持种群稳定性,其余挑选纯合型与纯合型再进行繁育,结果其F3代仔鼠全部为纯合型,而且后续再生的两窝仔鼠基因型鉴定也均为纯合型,说明其基因型保存完整。同时观察发现PD-1人源化小鼠纯合型配繁后的怀孕率及生仔数均不低,我们知道在小鼠繁殖过程中噪音对繁殖也起到关键的影响作用,如果噪音过大或者来往人员过密,就会造成母鼠烦躁不哺乳,进而引起仔鼠死亡,同时多项研究结果也显示各种基因工程小鼠都存在食仔现象[13]。因此每天进行观察的时候要尽量保持安静,再给予蛋黄等营养食物,能够明显的缓解食仔现象[14],这样可明显提高母鼠的产仔率和仔鼠的成活率,为下一步实验研究提供良好的动物保障。
综上所述,本实验应用CRISPR/Cas9基因组编辑技术,所构建的PD-1人源化小鼠动物模型,在免疫检查点抑制剂研究中具有独特的研究价值,通过对其基因型鉴定并有效地进行了扩群,为今后相关小分子抑制剂体内药效评价实验提供有力的保障。
