基于实验异常现象的生成性教学实践研究
2023-08-10朱成东孙永兴徐泓孙影
朱成东 孙永兴 徐泓 孙影


摘要: 以海带中碘含量测定过程中待测液反复变蓝的实验异常现象作为课堂生成性资源,通过引导学生对其进行猜想、假设和验证组织课堂教学,从而在体验科学探究的一般过程中,发展证据推理与模型认知、科学探究与创新意识等学科核心素养。
关键词: 中学化学; 生成性教学; 异常现象; 碘含量的测定
文章编号: 10056629(2023)07003708
中图分类号: G633.8
文献标识码: B
1 问题提出
生成性教学是指教师根据课堂中的互动状态及时地调整教学思路和教学行为的教学形态[1]。生成性教学有赖于课堂中师生互动产生的生成性资源,而实验作为化学学科的基础,是化学课堂生成性资源的重要来源。“预设”与“生成”是一对矛盾统一体[2],教科书已经阐明的实验结果,抑或是由學生通过已经掌握的化学知识进行证据推理与预测得到的实验现象等均可作为课堂“预设”,而在化学实验中出现一些与预期的实验现象不相符的异常现象,如颜色变化的异常等,则是课堂中的动态“生成”。教师利用异常现象组织生成探究式课堂,对异常现象进行猜想、假设、验证的过程中,既能体验科学探究的一般过程,又可发展证据推理与模型认知、科学探究与创新意识等学科核心素养。
海带中碘含量的测定方法众多,如分光光度法[3]、气相色谱法[4],这些方法虽精确易行,但所涉及的原理和设备均超出高中教学要求和条件;我国现行行业标准《海带碘含量的测定》中所提及的碘量法虽原理简单,但过程复杂且需要用到溴水和甲酸钠等对人体不友好的化学物质,因此也不适用于高中课堂教学[5]。笔者在实际教学时拟采用双氧水做氧化剂氧化碘离子,再用硫代硫酸钠标准液进行滴定,从原理、安全等多个角度基本满足课堂小组实验的需求。但在进行预实验时,意外发现变为无色后的待测液会反复变回蓝色的异常现象(如图1所示)。查阅文献发现,造成该异常现象的原因在于过氧化氢氧化碘离子的反应慢于硫代硫酸钠还原碘分子至碘离子的反应[6]。
现有“海带提碘”“碘含量的测定”等相关教学研究[7~9]和实验研究[10],主要侧重于探究实验最佳条件以及以了解物质的提取和分离方法为教学目标的项目式教学或定量测定的STEM教学,一般忽略了双氧水氧化碘离子,再用硫代硫酸钠标准液进行滴定的实验中的“异常”现象。本研究运用该异常现象的生成性教学模型(如图2),立足于“提出猜想→设计方案→实验验证→收集证据→得出结论→交流讨论”的科学探究一般步骤,让学生经历真实的科学探究历程,培养严谨求实的科学态度,以期达成对实验中的“异常”现象能提出质疑或新的设想,并进一步付诸探究实践的素养水平[11]。
2 基于实验异常现象的生成性教学实践
2.1 教学内容分析
本课时选自鲁科版高中化学必修第二册第一章微项目“海带提碘与海水提溴”,是基于该内容设计的实验复习课[12]。“从海带中提取碘”“含碘盐的检验”是高中阶段两个重要的化学实验,多个版本的必修教材和实验选修教材均有涉及[13, 14]。此外,强酸与强碱的中和滴定是高中阶段必做的定量实验,对海带中的碘进行提取与含量测定不仅是对酸碱滴定的拓展和提升,更是需要综合运用氧化还原反应、化学反应速率与限度等核心知识。因此,从知识内容上看,该课时具有巩固化学反应原理、强化酸碱中和滴定实验技能、进一步发展学生解决问题能力的功能;从学习方法上看,基于真实情境的科学探究过程可以有效地促进知识与技能的迁移,为后续开展复杂真实的实验探究活动打下基础。其教学功能归纳如图3所示。
2.2 教学目标
(1) 通过海带中的碘含量的测定,巩固滴定实验的操作技能,认识滴定实验的重要价值。
(2) 通过实验中异常现象的发现,树立严谨求实的科学态度,形成敢于质疑、探索未知、崇尚真理的意识。
(3) 通过对实验中异常现象原因的探究,形成提出假设、设计方案、实验验证的探究思路,并运用氧化还原理论进行分析、推理,用实验加以证实或证伪,建立观点、结论和证据之间的逻辑关系。
(4) 通过对实验曲线的解释和宏观现象的分析,建立多反应复杂体系的分析思路,初步形成从热力学和动力学等角度分析化学反应的意识。
2.3 教学流程
具体教学流程如图4所示。
2.4 教学实施
环节一:发现异常——待测液反复变蓝
[提出问题]碘元素是人体必需的微量元素之一,健康成人体内的碘的总量约为30毫克,摄入过多或摄入不足均会对我们的健康造成危害,加碘盐和海带是我们日常摄入碘的主要来源。上节课我们将海带通过灼烧、浸泡、过滤等实验操作,获得了含碘离子的待测液,现在如何去测定海带中的碘含量呢?
[生]联系旧知,根据强酸与强碱的中和滴定,明确滴定法是实验室测定未知离子浓度的一般方法。
[追问1]如何选取指示剂和标准液呢?
[思考讨论]碘单质遇淀粉溶液变蓝,可以先将碘离子氧化成碘单质,选取淀粉溶液做指示剂,再选取还原剂做标准液。
[归纳总结]含碘待测液的测定原理为:
H2O2+2I-+2H+I2+2H2O①
2Na2S2O3+I22NaI+Na2S4O6②
[小组实验]根据实验原理进行小组实验(如图5所示)。
[生1]发现问题:达到滴定终点时的实验现象应为蓝色变为无色且半分钟内不变,但是在实验时,待测液变为无色后会反复变回蓝色,为什么一直达不到滴定终点?
[引导提问]待测液变回蓝色后你是如何操作的?
[生1]继续滴加硫代硫酸钠标准液,再次让待测液变回无色,但是很快又变为蓝色。
[追问]待测液反复变回蓝色,实验出现了异常现象,同学们能结合所学的化学知识,提出合理的猜想吗?
环节二:初步猜想——应用氧化还原反应模型探究异常现象
出现异常现象后,教师应充分利用该生成性资源进行教学,逐步引导学生自主讨论探究。由于造成该异常现象的原因较为复杂,学生在未熟悉科学探究的一般步骤时,很难主动地提出合理猜想,这时就需要教师充分扮演好课堂引导者的角色,从学生熟悉的易想到的原因入手,在平等的对话中进行持续探究。
[引导发问]待测液蓝色褪去,说明碘单质转化为了碘离子,那蓝色恢复呢?
[生]说明碘离子又被氧化成了碘单质。
[追问1]氧化剂是谁?
[生]锥形瓶为敞口容器,溶液接触氧气。提出猜想一:待测液反复变蓝是因为碘离子被空气中的氧气氧化。
[追问2]如何设计实验进行验证呢?
[小组讨论]可以向滴有淀粉溶液的含I-待测液中鼓入空气,观察溶液是否会变为蓝色。
[评价实验方案]方案巧妙可行,但是待测液中依然需要加入等量的酸进行酸化。
[小组实验]实验现象:打开充气泵开关,待测液始终保持为无色(如图6所示)。得出结论:空气中的氧气很难在短时间内氧化碘离子,猜想一为错误猜想。
[追问3]反应体系中是否还存在其他氧化剂呢?
[交流思考]滴定前,待测液中加入了过量的H2O2溶液,提出猜想二:待测液反复变蓝是因为碘离子被过量的H2O2氧化了。
[追问1]如何设计实验验证呢?
[交流讨论]可以向滴有H2SO4溶液和淀粉溶液的待测液中加入少量H2O2溶液再滴定,进行对比实验。
[评价实验方案]待测液中的碘离子含量未知,如何确保H2O2溶液为少量呢?
[定量实验]在试管中加入两滴管0.1mol/L KI溶液,经硫酸酸化,滴加淀粉溶液做指示剂后仅仅加入1滴0.2mol/L H2O2溶液进行氧化,从而确保过氧化氢的量为少量(如图7所示)。
[小组实验]实验现象:变为无色后的待测液会再次变蓝。得出结论:过量的H2O2不是造成该异常现象发生的主要原因。
[得出结论]猜想二为错误猜想。
环节三:深入探索——化学反应的速率和限度对异常现象的影响
利用氧化还原反应原理进行了两次猜想与假设后,学生已经熟悉了科学探究的一般步骤,这时只需从化学反应的限度入手稍加引导,学生便可自主生成新的猜想,随后再利用实验证据逐渐过渡到反应的速率角度,让探究活动与学生的思维生成始终保持一致,课堂的生成性在该环节中也得到较大程度的体现。
[引导]大家能否再提出新的猜想与假设,思考什么情况下溶液中会始终存在碘单质?
[生1]提出猜想三:有没有可能过氧化氢与碘离子的反应是一个可逆反应,即:
H2O2+2I-+2H+I2+2H2O
[生2]若为可逆反应,溶液中始终存在I2,滴加Na2S2O3,溶液不会变为无色。
[追问]如何判斷一个反应进行的程度?
[生3]可以利用平衡常数的数值来进行判断。
[提供资料]该反应的平衡常数约为1×1042。
[得出结论]猜想三为错误猜想。
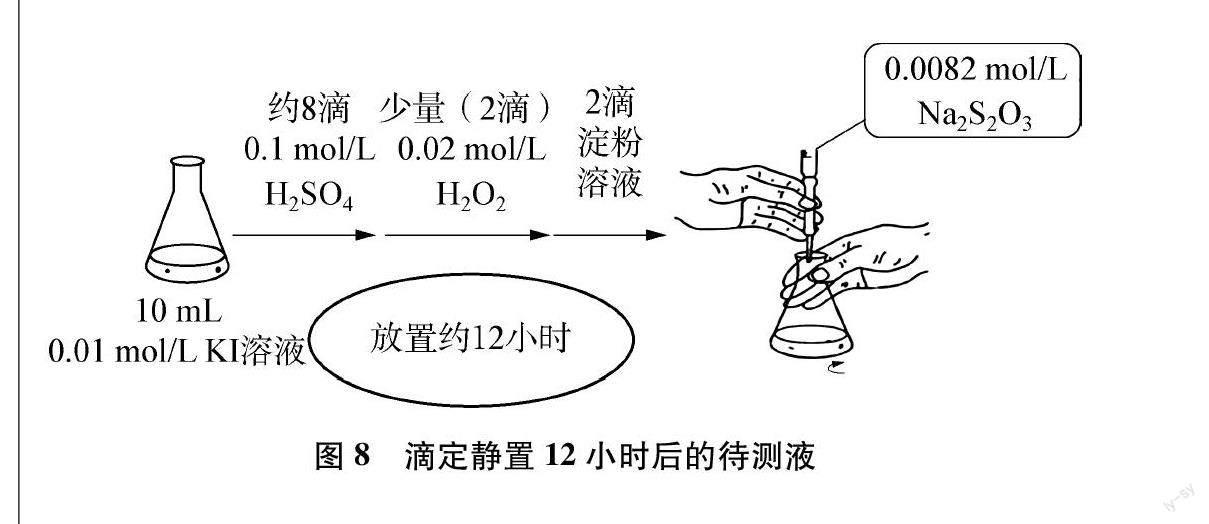
[启发思考]课前,进行了如图8所示的实验,待测液放置12小时后再进行滴定,异常现象就消失了,这是为什么呢?
[生1]说明反应①的时间长短对滴定过程有一定的影响。
[追问1]反应时间的长短又取决于什么?
[生2]化学反应速率。
[追问2]化学反应速率是否会对该异常现象造成影响呢?请大胆猜想。
[交流讨论]从化学反应速率的角度思考,提出猜想四:造成异常现象的可能原因是H2O2氧化I-的反应比Na2S2O3还原I2的反应慢,因此在滴定的过程中不断产生新的I2,故溶液会再次变蓝(如图9所示)。
[提问]如何验证反应①在滴定的过程中是持续进行的慢反应呢?
[交流讨论]很难根据宏观实验现象进行判断。
[教师引导]我们可以引入氧化还原电势传感器(ORP),去测定滴定过程中的电势变化,进而通过曲线变化趋势探寻反应的微观本质(实验装置如图10所示)。
[预测]已知氧化性物质的电势值高于还原性物质的电势值,如果猜想四为正确猜想,请预测曲线变化趋势。
[观察]预测结束后,注意观察烧杯内溶液颜色变化和曲线变化(曲线变化如图11所示)。
[解释]构建四重表征(如图12所示)。滴定前,烧杯中溶液为蓝色,打开双阀滴液管滴加硫代硫酸钠,曲
线立刻呈现下降趋势,溶液也由蓝色变为无色;恰好变为无色后,关闭双阀滴液管,曲线又呈现上升趋势,溶液也恢复为蓝色。重复实验操作可以观察到相同的宏观现象和曲线变化。
[提问]曲线在下降和上升的过程中,溶液中的离子分别发生怎样的化学变化?
[生1]碘单质具有氧化性,其电势值较高,曲线下降,说明是碘单质被还原为碘离子;相反,曲线上升则说明是具有还原性的碘离子又被氧化成碘单质。
[追问1]关闭双阀滴液管后曲线上升的趋势重复出现,说明什么?
[生2]说明H2O2与I-的反应确实在滴定的过程中持续进行着。
[追问2]为什么a点的电势值始终高于c点和之后的每一个曲线顶点呢?
[生3]因为滴加了硫代硫酸钠,相当于稀释溶液,溶液中各溶质的物质的量浓度都会降低。
[生4]因为a点为滴定起点,滴定前溶液静置的时间长,所以此时溶液中的碘单质含量高,电势值就高;而b与c之间的时间间隔短,H2O2与I-的反应速率可能较慢,因此c点溶液中的碘单质含量低,电势值就低。
[评价升华]我们需要从多个角度认识化学反应,特别是要从化学反应速率的角度对实验现象进行解释。
宏观现象曲线表征符号表征微观表征
过氧化氢在不断缓慢地氧化碘离子:H2O2+2I-+2H+I2+2H2O溶液中部分碘离子被氧化为碘单质,到达波谷前溶液中含有:I-、 I2
碘单质被还原:2Na2S2O3+I22NaI+Na2S4O6
碘单质被还原速率大于碘离子被氧化速率,所以波谷位置溶液中仅含有:I-
剩余碘离子继续被氧化:
H2O2+2I-+2H+I2+2H2O碘离子被氧化为碘单质,波峰位置溶液中含有:I-、 I2
[设问]那如何进一步验证H2O2与I-的反应速率就很慢呢?可以直接测定H2O2与I-反应过程中的电势变化,曲线如图13所示。可以发现2小时后电势还有上升的趋势,说明该反应确实很慢。
[提问]那如何设计实验表征Na2S2O3与I2的反应很快呢?
[生]依然可以测定反应过程的电势变化,观察电势曲线趋于平稳所需的时间。
[引导]大家还可以将待测液直接倒入硫代硫酸钠溶液中,观察现象。
[小组实验]如图14所示,实验现象:几乎在倒入的瞬间,蓝紫色就会消失。实验结论:说明反应②的速率远远大于反应①。
[总结]通过宏观现象和曲线斜率等多种途径,让化学反应速率可视化,最终得出结论:碘含量测定中被测液反复变蓝的异常现象是因为反应①与反应②速率相差过大导致的。同学们课下还可继续探讨造成该异常现象的其他可能原因。
环节四:拓展升华——如何精确地测定海带中的碘含量
[提问]既然H2O2做氧化剂有这么多的弊端,还是造成该异常现象的主要原因,我们能否更换氧化剂进行实验呢?
[生]交流讨论,选取其他常见的氧化剂,如KMnO4等。
[总结]如图15所示。
[课后作业]请大家课后查阅文献,找到国家制定的海带中碘含量测定的标准,思考不同氧化剂对碘含量测定的影响。
3 教学反思
我们在教学中充分挖掘过氧化氢“碘钟”实验的教学资源,以测定海带中碘含量为情境,利用学生分析多反应复杂体系的实验结果时习惯性地仅从热力学视角进行分析,使之实验现象与学生认识产生冲突,顺势引导学生转从动力学视角进行探究,并运用其生成性特点来发展学生的科学探究与创新意识素养。对本节课的生成性教学实践具体反思如下。
3.1 生成性教学需要合理的预设
精心预设可以为动态生成“保驾护航”——保证生成性资源的合情、合理和有效[15]。如果把异常实验现象的产生看作为“合情”,那么对异常实验现象的持续探究过程则需“合理和有效”,这种“合理”是建立在教师前期的实验研究之上的。本文用过氧化氢氧化碘离子,再用硫代硫酸钠标准液滴定碘,从而确定碘含量,是中学常见的碘含量测定的一种方法。在实验室重现该实验时发现该异常现象,对此进行深入的探究;再将整个探究过程浓缩成一节基于实验现象异常的生成性探究课。因而异常实验现象的生成性教学需要教师经常在实验中“备课”,才能把握住实验课中生成性教学的预设机会。
3.2 生成性教学更需关注学生的真实表现
生成性教学中学生的表现行为是个性的和未知的,学生的素养发展往往就体现在各种课堂表现之中,因此需要不断地关注学生在复杂情境中的活动表现,注重“教学评”一体化理念的落实。如用硫代硫酸钠滴定碘的实验中反复出现蓝色的异常现象,对学生的认知产生较大冲突,学生的惊讶、疑惑等真实表现都体现了学生对探索未知的渴望。对异常现象原因的探究中,教师关注学生提出的猜测、实验方案,以判断学生的思维水平;用数字化实验做出曲线后,关注学生对曲线的解释,以判断学生对问题本质的理解能力和对异常化学现象的解释能力。
3.3 生成性教学能够有助于发展学生的科学探究能力与创新意识
课堂以师生之间的平等互动为基础,生成性教学则更加关注师生在课堂中由高质量互动产生的一系列具有挑战性的任务,由师生对话引发的“设计—实验—再设计—再实验”的课堂经历使得学生的“生成”能力不断提高。如此一来,生成性教学对发展学生科学探究与创新意识等素养的价值不断得到体现。如本节课对实验异常现象原因的探究是先通过对学生提出的“空气中氧气的氧化、过量过氧化氢氧化”等猜想进行证伪探究,然后从化学反应速率视角对其进行证实探究,以此培养学生基于实验事实对猜想进行论证,在证伪中勇于创新的精神。在证伪与证实过程中不断地设计方案、运用实验进行探究,以此来培养学生坚韧不拔、持之以恒的学科素养和能力。
参考文献:
[1]罗祖兵. 生成性教学及其基本理念[J]. 课程·教材·教法, 2006, (10): 28~33.
[2]李祎, 涂荣豹. 生成性教学的基本特征与设计[J]. 教育研究, 2007, (1): 41~44.
[3]张爱梅, 王术皓, 崔慧. 阻抑动力学分光光度及荧光光度法测定微量碘[J]. 分析化学, 2001, (10): 1160~1162.
[4]单守尧. 海带碘含量的气相色谱测定[J]. 食品科学, 1991, (4): 46~48.
[5]国家水产品质量监督检验中心. 海带碘含量的测定:SC/T 3010—2001 [S]. 2001.
[6]陈肖虎, 薛安, 杨善志等. 过氧化氢硫酸氧化碘离子反应动力学研究[J]. 过程工程学报, 2009, (S1): 181~184.
[7]张琦, 卢凤琴, 陈雷等. 海产品中碘的提取与测定探究实验[J]. 化学教学, 2021, (11): 80~84.
[8]乔琦. “海带中碘的检验和提取”的教学和反思[J]. 化学教学, 2012, (2): 24~26.
[9]张金水. 浅谈碘的提取[J]. 化学教学, 2018, (10): 87~90.
[10]杨孝容, 熊俊如, 张桃. 过氧化氫提取海带中碘的实验条件优化[J]. 化学教学, 2015, (8): 48~51.
[11]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版2020年修订)[S]. 北京:人民教育出版社, 2020.
[12]王磊主编. 普通高中教科书·化学必修第二册[M]. 济南:山东科学技术出版社, 2019: 30~33.
[13]王祖浩主编. 普通高中教科书·化学必修第一册[M]. 南京: 江苏凤凰教育出版社, 2020: 81~83.
[14]宋心琦主编. 普通高中课程标准实验教科书·实验化学[M]. 北京: 人民教育出版社, 2007: 20~22.
[15]吴玲, 郭孝文. 有效教学: 让课堂生成与课前预设互动共生[J]. 中国教育学刊, 2007, (11): 52~54.
