土茯苓复方治疗口腔鳞状细胞癌的作用机制研究
2023-08-09刘淑艳王伟荣叶凌赟高金星
刘淑艳 王伟荣 叶凌赟 高金星
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是口腔恶性肿瘤中最常见的类型,患者5 年总生存率不足60%[1-2]。近年来,中药在抗肿瘤治疗中的重要性逐渐被发现。土茯苓复方由土茯苓、银花、甘草、连翘、大黄和马齿苋等中药组成,其中的土茯苓苷、茯苓醇等不仅可以抑制癌细胞的生长和扩散,还可提高机体的抗癌能力[3-6];银花提取物具有增强免疫功能的作用[7-8];甘草提取物具有抗氧化和抗肿瘤的特性[9-10];连翘、大黄和马齿苋等提取物也展现出抗氧化、抗炎的功效,并对多种癌细胞具有抑制增殖和扩散的能力[11-18]。可见土茯苓复方中的各种成分均具有一定的抗肿瘤活性,但是其作用机制尚需进一步探讨。本研究利用网络药理学对土茯苓复方的有效成分和靶点进行筛选,构建蛋白-蛋白相互作用(protein-protein interaction,PPI)网络探究土茯苓复方的OSCC 治疗靶点及其相互作用关系,对潜在疾病治疗靶点的生物学过程和途径进行富集分析,并对疾病关键靶点进行分子对接,以揭示土茯苓复方治疗OSCC 的作用机制,为寻找OSCC 新的治疗靶点提供参考依据。
1 材料和方法
1.1 土茯苓复方潜在活性成分及靶点预测 登录中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)(http://tcmspw.com/tcmsp.php),以“dahuang”“gancao”“lianqiao”“machixian”“tufulin”“yinhua”为关键词,以化合物的口服生物利用度(oral bioavailability,OB)≥30%,药物相似度(drug-likeness,DL)≥0.18 为筛选条件,筛选土茯苓复方主要活性成分及关联这些活性成分的相应靶点。通过通用蛋白质资源(universal protein resource,UniProt)数据库(https://www.uniprot.org)搜索靶点的UniProt ID,并将物种定义为“Homo sapiens”,以便后续获得治疗靶点的三维结构。
1.2 OSCC 相关靶点筛选 从癌症基因组图谱(the cancer genome atlas,TCGA)数据库中下载OSCC 的mRNA 表达谱和患者临床资料。表达谱数据的单位由每千个碱基的转录每百万映射读取的片段数(fragments per kilobase of transcript per million fragments mapped,FPKM)转化为每百万转录本(transcripts per million,TPM)[19]。利用limma R 包筛选OSCC 组织与正常组织之间的差异表达基因(differentially expressed genes,DEGs)[20]。DEGs 的筛选条件定义为P<0.05。在Online Mendelian Inheritance in Man(OMIM)数据库(https://omim.org)、GeneCards 数据库(https://www.genecards.org)中搜索关键词“口腔鳞状细胞癌”,获取疾病靶点。将DEGs 和数据中获得的疾病靶点取交集,筛选得到OSCC 相关靶点。
1.3 潜在治疗靶点与主要活性成分的获取 将1.1中潜在活性成分相应靶点与1.2 中OSCC 相关靶点取交集,绘制韦恩图,获得土茯苓复方抗OSCC 的潜在治疗靶点。随后获得这些靶向潜在治疗靶点的活性成分,即土茯苓复方抗OSCC 的主要活性成分。
1.4 PPI 网络的构建与分析 将土茯苓复方抗OSCC的潜在治疗靶点导入STRING 数据库,物种设置为“Homo sapiens”,参数设置为最高置信度0.700,去除无连接的靶蛋白,进行PPI 分析。将分析结果导入Cytoscape 软件进行可视化处理,获得“OSCC 靶点-药物活性成分”关系网络。通过拓扑学分析,即使用Cytoscape 软件中的CytoNCA 工具模块,计算PPI 网络节点的参数,包括度数、接近中心性、介数中心性、特征向量、局部平均连接系数和网络[21]。并以这6 个参数的中位数为阈值,治疗靶点的6 个参数均大于其相应中位值的靶点作为关键作用靶点。上述拓扑学分析进行两次,获得的靶点确定为土茯苓复方抗OSCC 的关键作用靶点。按照度值大小进行排序,前3 个靶点被视为最关键作用靶点。
1.5 土茯苓复方抗OSCC 关键作用靶点的功能与通路的基因本体(gene ontology,GO)及京都基因和基因组百科全书(K yo to encyclopedia of genes and genomes,KEGG)富集分析 利用Cluster Profiler R 包对土茯苓复方抗OSCC 关键作用靶点进行GO 功能富集分析和KEGG通路富集分析。利用Metascape(https://metascape.org)在线数据库对上述拓扑学首次分析的关键作用靶点进行GO 和KEGG 富集分析,物种设置为“Homo sapiens”,P<0.05 为数据有统计学意义。
1.6 TCGA-OSCC 低表达组患者和高表达组患者的生存分析 根据3 个最关键作用靶点对应基因的中位表达值将TCGA-OSCC 患者分为低表达组和高表达组,绘制Kaplan-Meier 曲线,比较两组的OS 和无进展生存期(progression-free survival,PFS)。log-rank 检验P<0.05为差异有统计学意义。HR<1 说明该基因是保护因素,HR>1 说明该基因是危险因素。
1.7 分子对接 采用Autodock Vina(http://autodock.scripps.edu/)进行分子对接。对接流程:(1)从Pub-Chem 化合物数据库中下载关键的药物活性化合物的结构文件(mol2 格式),利用ChemOffice 软件2019(Chem-Draw Professional 2019)将其转换为三维结构,利用AutoDockTools 1.5.6 软件将三维结构氢化计算并保存为PDBQT 文件。(2)从RCSB PDB 蛋白库(https://www.pdb.org/)中获取治疗疾病的最关键作用靶点晶体结构,导入PyMOL 1.7.2.1(https://pymol.org/2/)中,脱水、氢化,用于配体分离。 随后在AutoDockTools 1.5.6 中对每个目标蛋白的活性位点构建对接口袋,以PDBQT 格式保存。(3)使用AutoDock Vina 4.2 对假定的最关键作用靶点和药物活性化合物进行分子对接,并评估自由结合能。对接分数的绝对值反映了组分与目标的亲和度和构象的稳定性。绝对值>4.25 表示有一定的结合活性,>5.00表示结合活性较好,>7.00 表示结合活性较强。(4)利用PyMOL 和Discovery Studio 2022 可视化软件分析活性化合物的相互作用和结合模式。
2 结果
2.1 土茯苓复方和OSCC 交集靶点的获取 TCMSP数据库中共获得6 种中药中179 个化合物,其中大黄、甘草、连翘、马齿苋、土茯苓和银花分别包含16、92、23、10、15 和23 个化合物。核心预测靶标634 个,其中大黄70 个,甘草237 个,连翘229 个,马齿苋224个,土茯苓214 个,银花220 个。在OMIM 和GeneCards数据库中检索到与OSCC 密切相关的疾病靶点6 842个。TCGA 中共筛选到OSCC 相关的差异基因18 119个,取交集后最终得到3 079 个OSCC 相关靶点,见图1A。对土茯苓复方的靶标和OSCC 相关靶点取交集,获得潜在治疗靶点141 个,见图1B。与15 个以上靶点连接的成分有8 个,分别为槲皮素(81 个)、山奈酚(33 个)、木犀草素(33 个)、汉黄芩素(24 个)、花生四烯酸(22 个)、7 甲氧基-2 甲基异黄酮(19 个)、异鼠李素(16 个)和柚皮素(16 个)。这些成分可能在OSCC的发病机制和治疗中发挥重要作用。靶向药物种类>50 的靶点有11 个,说明土茯苓复方治疗OSCC 的机制比较复杂。

图1 土茯苓复方和OSCC交集靶点的获取(A:数据库OSCC相关基因与差异表达基因的Venn图;B:药物与疾病靶点的Venn图)
2.2 潜在治疗靶点的PPI 网络和关键作用靶点获取 将141 个潜在治疗靶点导入STRING 数据库获得PPI 网络,见图2。利用Cytoscape 3.9.1 软件绘制土茯苓复方抗OSCC 的“OSCC 靶点-药物活性成分”关系网络,见图3(插页)。CytoNCA 计算两次后得到13个关键作用靶点,分别为丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)14、表皮生长因子(epidermal growth factor,EGF)、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、窝蛋白-1(caveolin 1,CAV1)、缺氧诱导因子1α(hypoxia inducible factor 1 subunit alpha,HIF-1α)、IL-1B、MAPK8、NF-κB 抑制剂α(NF-κB inhibitor-alpha,NFκBIA)、MAPK3、丝氨酸/苏氨酸特异性蛋白激酶1(serine/threonine kinase 1,AKT1)、V-Rel 网状内皮增生病毒癌基因同源物A(RELA proto-oncogene,RELA)、半胱氨酸天冬氨酸蛋白酶3(Caspase3,CASP3)、表皮生长因子受体(epidermal growth factor receptor,EGFR)。

图2 PPI 网络图
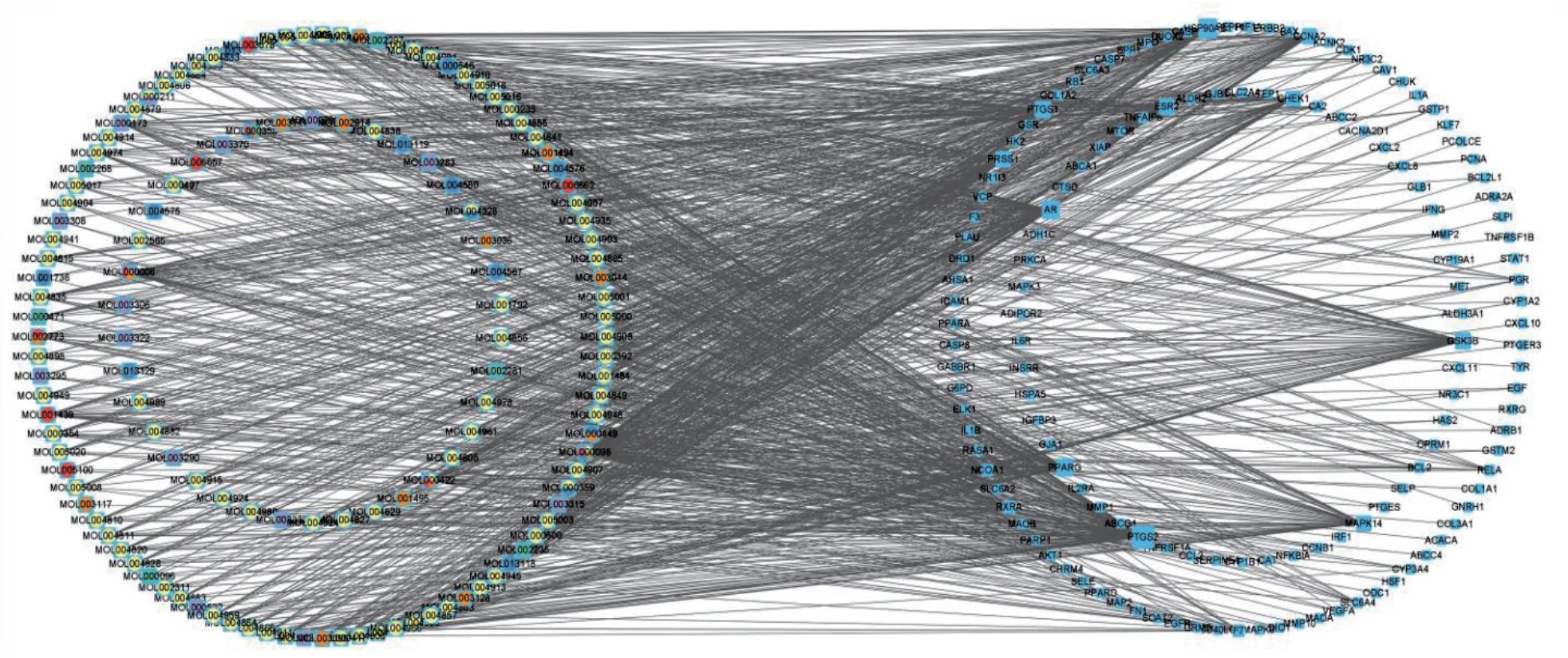
图3 “OSCC 靶点-药物活性成分”关系网络图
对141 个潜在治疗靶点的GO 分析结果显示,这些基因共参与了2 016 个生物学过程、44 个细胞成分组成、175 个分子功能。其中生物学过程包括对脂多糖、细菌源分子、外来刺激、营养水平、类固醇激素和金属离子的反应;涉及的细胞成分包括膜筏、膜微域、囊泡腔、分泌颗粒腔、细胞质囊泡腔;参与的分子功能包括DNA 结合转录因子结合、RNA 聚合酶特异性DNA 结合、转录因子结合、核受体活性、配体活化转录因子活性、抗氧化活性和类固醇激素受体活性,见图4A)。KEGG 结果显示,这些基因主要参与了162 个信号通路,包括糖基化终末产物-糖基化终末产物受体信号通路、化学致癌-受体激活、TNF 信号通路、IL-17 信号通路、Th17 细胞分化、凋亡、NF-κB 信号通路和HIF-1α 信号通路等,见图4B)。

图4 GO 分析和KEGG 通路富集分析(A:GO 分析结果;B:KEGG 通路富集分析结果)
2.3 关键作用靶点与OSCC 患者预后的关系分析单因素Cox 回归结果显示,13 个关键作用靶点中与OS 有关的共9 个,分别为AKT1、CASP3、CAV1、EGF、EGFR、MAPK8、MAPK14、RELA 和VEGFA,这些基因的高表达与较低的OS 显著相关,见图5。13个关键作用靶点中与PFS 有关的有7 个,分别为AKT1、CASP3、CAV1、EGF、HIF-1α、MAPK8 和VEGFA。除HIF-1α 外,其余基因高表达与较短的PFS 显著相关,见图6。提示上述预后相关基因是疾病的风险因素,靶向这些基因可能有助于疾病的治疗。
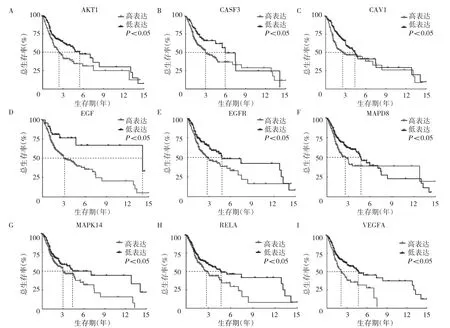
图5 基因表达量与患者总生存期的关系(A:AKT1;B:CASP3;C:CAV1;D:EGF;E:EGFR;F:MAPK8;G:MAPK14;H:RELA;I:VEGFA)
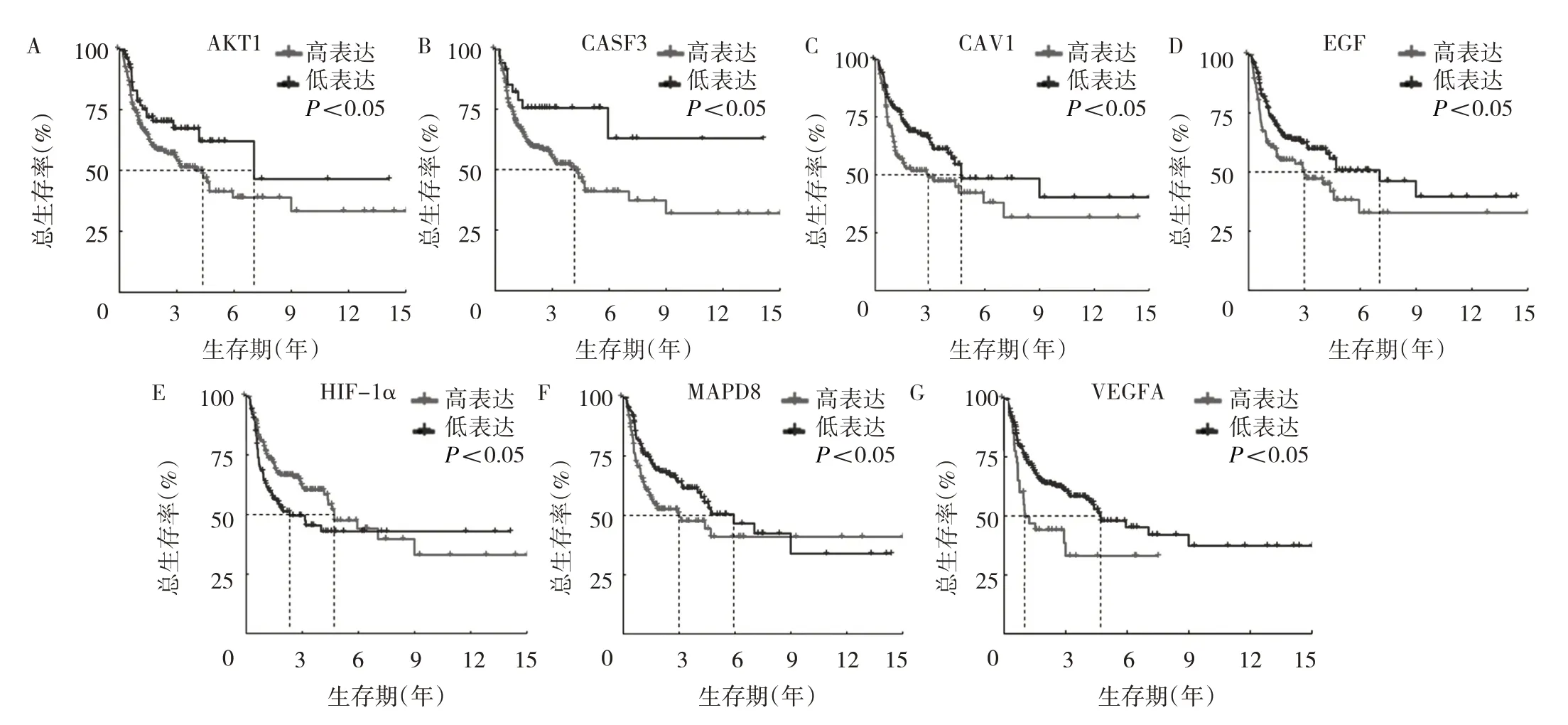
图6 基因表达量与患者无进展生存状态的关系(A:AKT1;B:CASP3;C:CAV1;D:EGF;E:HIF-1α;F:MAPK8;G:VEGFA)
2.4 最关键作用靶点和有效成分的分子对接验证 按照度值大小进行排序,被视为最关键作用靶点的前3 个靶点依次为MAPK3、AKT1 和CASP3。作用于MAPK3 的有效成分为柚皮素;作用于AKT1 的有效成分有柚皮素、汉黄芩素、薯蓣皂苷元、β-胡萝卜素、山奈酚、木犀草素和槲皮素;作用于CASP3 的有效成分有柚皮素、汉黄芩素、花生四烯酸、β-胡萝卜素、β-谷甾醇、山柰酚、木犀草素、槲皮素和芦荟大黄素。分子对接结果显示,柚皮素与MAPK3 的对接分数为-7.3,β-胡萝卜素与CASP3 的对接分数为-8.0,山奈酚与CASP3 的对接分数为-8.1,显示出较强的结合活性,见图7(插页)。

图7 最关键作用靶点与有效成分的分子对接图(A:柚皮素与MAPK3 的分子对接图;B:β-胡萝卜素与CASP3 的分子对接图;C:山奈酚与CASP3 的分子对接图)
3 讨论
最新统计数据提示,全球每年约有35 万例新的OSCC 确诊病例和17 万死亡病例[1]。寻找有效的治疗药物对于OSCC 患者至关重要。中药土茯苓复方成分复杂,可通过多靶点、多途径、多层次整合调控产生协同功效,对肿瘤治疗有效。本研究结果发现,土茯苓复方的有效成分中,与15 个以上靶点连接的成分有8 个,分别是槲皮素、山奈酚、木犀草素、汉黄芩素、花生四烯酸、7 甲氧基-2 甲基异黄酮、异鼠李素和柚皮素。其中柚皮素作用于MAPK3;柚皮素、汉黄芩素、薯蓣皂苷元、β-胡萝卜素、山奈酚、木犀草素和槲皮素作用于AKT1;柚皮素、汉黄芩素、花生四烯酸、β-胡萝卜素、β-谷甾醇、山柰酚、木犀草素、槲皮素和芦荟大黄素作用于CASP3。可见OSCC 中的MAPK3、AKT1 和CASP3 等3 个最关键作用靶点,分别被土茯苓复方中不同的有效成分靶向作用。
土茯苓复方包含土茯苓、银花、生甘草、连翘、大黄、马齿苋等6 种中药,其中土茯苓的主要活性成分槲皮素,具有调节表皮生长因子/热激蛋白27 通路的作用,通过调节肿瘤微环境的血管生成拟态进而减轻乳腺癌的恶性程度[22];此外,柚皮素和β-谷甾醇能够癌细胞停滞G0/G1期,通过调节细胞周期来抑制癌细胞的生长和扩散[23-24]。银花中的山奈酚具有抗氧化和抗肿瘤活性,能够通过干扰癌细胞的生物学行为来抑制肿瘤的生长和转移[25]。甘草中的甘草酸具有抗炎和抗肿瘤作用,可以通过调节免疫系统和抑制肿瘤细胞增殖来抑制肿瘤的发展[26]。马钱子碱是来自连翘的一种有效的抗肿瘤化合物,能够通过干扰细胞凋亡途径和抑制肿瘤细胞的生长来抑制肿瘤的发展[27-29]。大黄中的大黄素具有抗炎和抗肿瘤活性,能够通过抑制炎症反应和调节细胞凋亡途径来抑制肿瘤的生长和扩散[30-32]。马齿苋素是马齿苋的一种有效的抗肿瘤成分,能够通过抑制肿瘤细胞的增殖和迁移来抑制肿瘤的发展[33]。这些中药成分的多靶点调控作用可能是中药治疗OSCC 的有效机制之一。它们通过作用于多个关键靶点,影响肿瘤细胞的生长、增殖、迁移、凋亡等多个生物学过程,从而抑制OSCC 的发展。这种多靶点调控的特性有助于提高治疗的有效性,并减少患者对单一药物的耐药性。
本研究还存在一定的局限性。土茯苓复方的有效活性成分在体内发挥抗OSCC 中的有效性和潜在机制还尚不明确,生物活性成分治疗OSCC 的作用机制有待进一步的体外和体内研究,此外中药有效成分的浓度、剂量、剂型、作用时间等一系列问题还尚未被探究。
综上所述,本研究应用生物信息学方法,系统探索了土茯苓复方治疗OSCC 的药理学和分子作用机制,可为临床应用提供参考。
