仿制与原研阿比特龙治疗晚期前列腺癌的疗效和安全性比较研究
2023-07-31石亚飞乐凯迪闫加庆马颖林李国辉
刘 敏,石亚飞,乐凯迪,李 佳,闫加庆,李 莹,马颖林,李国辉#
(1.国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院药剂科,北京 100021; 2.国家癌症中心/国家肿瘤临床医学研究中心/河北中国医学科学院肿瘤医院药剂科,河北 廊坊 065001)
前列腺癌是全球男性发病率居第2位的恶性肿瘤,占男性癌症死因的第2位[1]。根据2018年全球恶性肿瘤统计,与西方国家相比,我国前列腺癌新发患者占全球患者的比例较低,死亡患者占全球患者的比例却超出西方国家1倍[2]。醋酸阿比特龙片(以下简称“阿比特龙”)作为新型内分泌治疗药物,是甾体17α-羟化酶/C17,20-裂解酶(CYP17)的不可逆抑制剂,可阻断雄激素的合成,与泼尼松联合治疗转移性去势抵抗性前列腺癌(mCRPC)和转移性激素敏感性前列腺癌(mHSPC)[3-6],目前已成为各大诊疗指南推荐的治疗mCRPC和mHSPC标准治疗方案[7-8]。但其高昂的医疗费用和药品的可及性却是患者治疗的很大障碍。仿制药相对于原研药而言,价格低,可及性高,成为治疗的另一个选择,但二者在有效性和安全性方面是否有差异还未有研究报道。本研究将利用中国医学科学院肿瘤医院的真实临床数据评价阿比特龙仿制与原研品种在有效性、安全性方面的差异,为临床提供参考依据。
1 资料与方法
1.1 资料来源
本研究数据来源于2017年4月至2022年6月中国医学科学院肿瘤医院的医院管理信息系统中所有使用阿比特龙(无论原研药或仿制药)的病例资料。纳入标准:经病理组织学确诊的mCRPC患者,年龄不限;预计生存期≥3个月;无论患者之前是否接受过化疗和放疗,本方案仅规定“使用阿比特龙治疗”,对联合内分泌治疗方案、剂量、剂量调整以及疗程等不进行统一规定,不干扰临床实际用法、用量(注:研究观察期内,按临床诊疗规范和治疗需要,可以联合应用其他必要治疗;本研究对临床诊疗不进行任何限制)。排除标准:患有高血压病、经抗高血压药治疗血压无法降至正常范围者[收缩压>140 mm Hg(1 mm Hg=0.133 kPa),舒张压>90 mm Hg],患有>Ⅱ级的冠心病、心律失常(包括QTc间期延长男性>450 ms)及心功能不全者;具有影响口服药物吸收的多种因素者(如无法吞咽、恶心呕吐、慢性腹泻和肠梗阻等);其他经主治医师认为不适合纳入的患者。本研究为回顾性队列研究,研究方案经中国医学科学院肿瘤医院医学伦理委员会审核,获得免患者知情同意批准(审批号:21/501-3172)。
经数据提取和评估,将114例病例数据完整且能够评效的使用仿制药的患者纳入研究。同时间段,只有极少的患者使用原研药,因此本研究使用了既往使用原研药的患者作为对照组(2017年1月至2020年4月),共纳入114例。共收集到符合纳入标准的患者228例。仿制药组患者年龄49~88岁,原研药组患者年龄57~91岁,具体基线资料见表1。
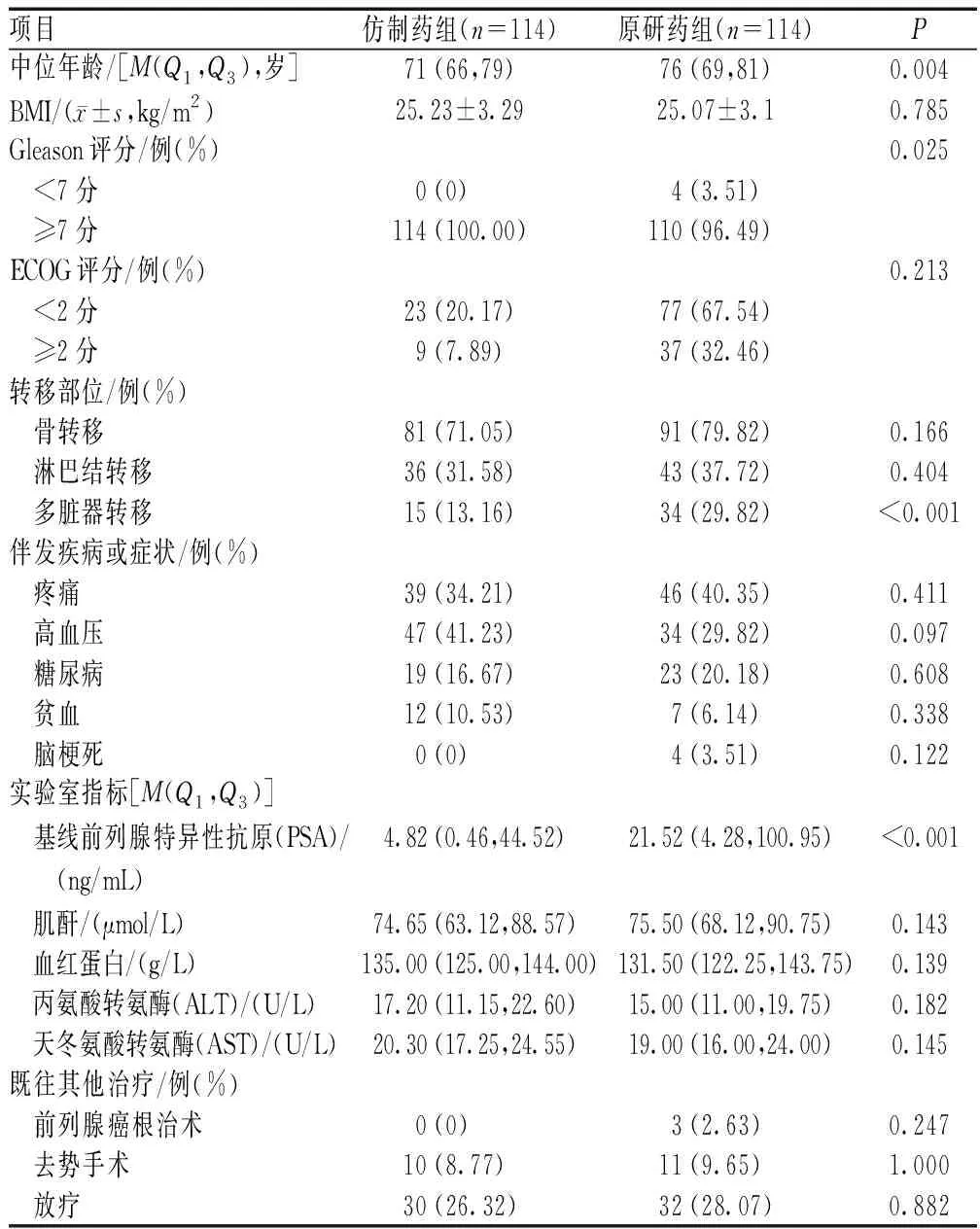
表1 两组患者基线资料比较Tab 1 Comparison of baseline information between two groups
1.2 方法
仿制药组、原研药组患者分别给予仿制、原研醋酸阿比特龙片(规格均为0.25 g),1次1 000 mg,口服,1日1次;并给予泼尼松片(规格:5 mg)5 mg,口服,1日2次。一直服用至患者无法接受不良反应或疾病进展。
1.3 数据采集内容
(1)就诊信息:患者ID号/医保卡号、医保类别、就诊时间及诊断;(2)患者人口统计学特征:性别、生日等;(3)既往病史与过敏史:既往手术史、慢性病及治疗用药情况、药物及食物过敏史;(4)现病史及治疗史:发病时间、既往就诊情况、确诊依据和时间、临床症状/体征、实验室检查及辅助检查等;(5)处方情况:处方药物名称、处方时间及用法用量(剂量/次、次数/d和用药时间等);(6)安全性信息:尽可能多地收集药品不良事件信息,包括开始时间、症状/体征、严重程度、临床处理、结局及关联性判断等;(7)其他医嘱:按照医嘱。
1.4 结局评价指标
(1)主要结局指标:①PSA50缓解。测定PSA水平从基线至基线后下降≥50%,并且由至少3周后再次评估确定。②PSA50缓解时间:PSA水平降至服用阿比特龙的基线PSA的50%所需的时间(以“月”计算)。(2)安全性指标:比较原研和仿制阿比特龙的药品不良反应发生率以及不良反应严重程度的差异。本研究采用美国国立癌症研究所通用不良事件术语标准5.0版(NCI CTC AE V5.0)[9]进行安全性评估,记录任何不良事件/不良反应、严重不良事件、病情的任何变化以及不良事件/不良反应的发生情况及其性质,包括治疗时出现的具有临床意义的疾病体征和症状、严重程度、采取的治疗措施及转归等,并进行分类和分级,计算不同类型和不同分级的不良事件发生率。
1.5 统计学方法

2 结果
2.1 倾向性评分匹配后的患者基线数据
选择年龄、转移部位、基线实验室指标和既往治疗方式等变量进行倾向性评分后,两组患者各剩余37例,各变量的差异均无统计学意义(P>0.05),见表2。
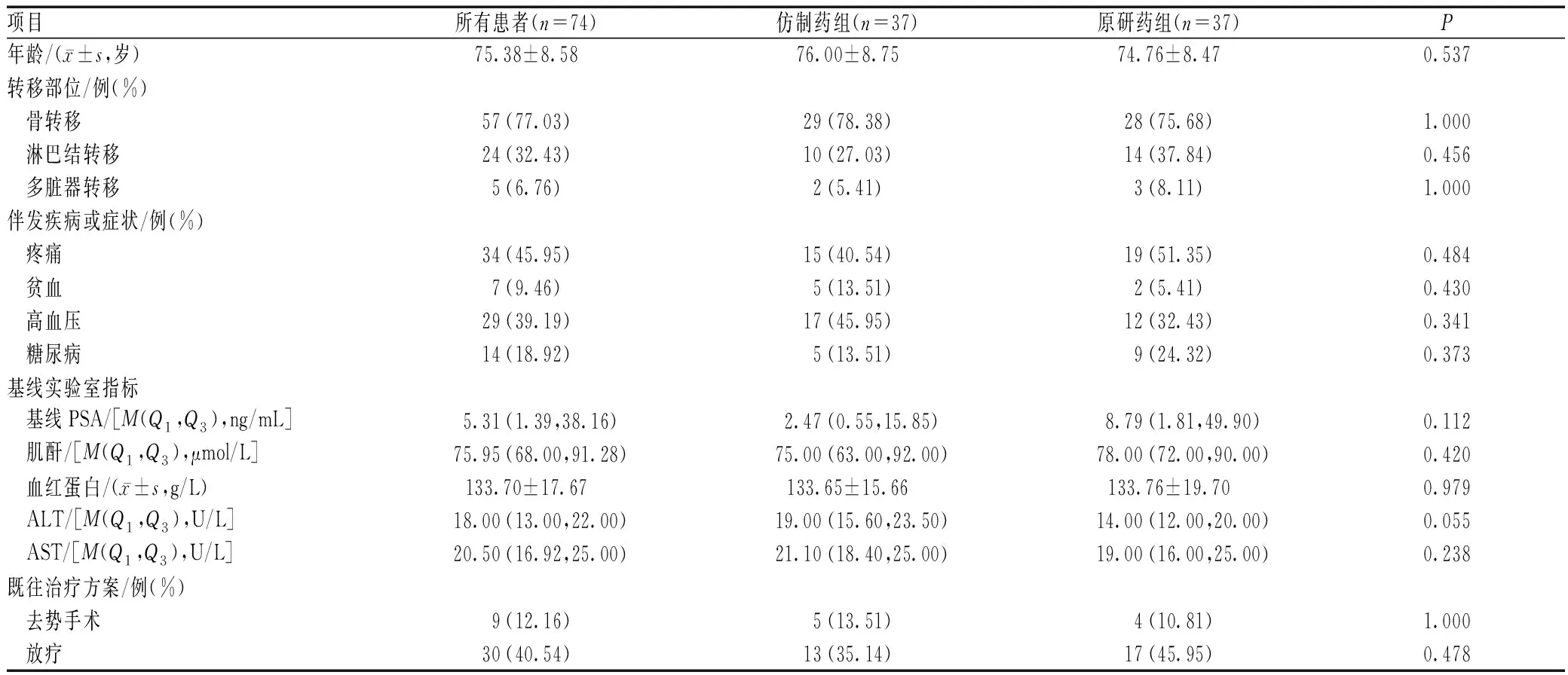
表2 倾向性评分匹配后两组前列腺癌患者基线数据比较Tab 2 Comparison of baseline data between two groups of prostate cancer patients after propensity score matching
2.2 有效性结果
达到PSA50缓解的患者,仿制药组为63例(占55.26%),低于原研药组的68例(占59.65%),但差异无统计学意义(P>0.05);仿制药组、原研药组患者的PSA50缓解中位时间分别为1.90(1.10,3.00)、2.50(1.00,4.00)个月,差异无统计学意义(P=0.12),见表3。倾向性评分匹配后,仿制药组达到PSA50缓解的患者有17例(占45.95%),低于原研药组的24例(占64.86%),但差异无统计学意义(P>0.05);仿制药组、原研药组的PSA50缓解中位时间分别为2.01(1.24,3.11)、2.00(1.00,4.00)个月,差异无统计学意义(P=0.161),见表4。

表3 仿制药组与原研药组患者疗效指标比较Tab 3 Comparison of efficacy indicators between generic drug group and original drug group

表4 倾向性评分匹配后的仿制药组与原研药组患者疗效指标比较Tab 4 Comparison of efficacy indicators between generic drug group and original drug group after propensity score matching
2.3 安全性结果
患者使用阿比特龙后最常见的药品不良反应为肝功能损害、三酰甘油水平升高、疲乏、低血钾、体液潴留和高血压等。原研药组和仿制药组患者所有级别的不良反应发生率的差异无统计学意义(P>0.05)。3—4级严重不良反应发生率并不高,原研药组3—4级不良反应中发生较多的是肝功能损害、低钾和高血压,各1例;仿制药组3—4级不良反应中发生较多的为肝功能损害1例,两组患者3—4级不良反应发生率比较,差异无统计学意义(P>0.05),见表5—6。
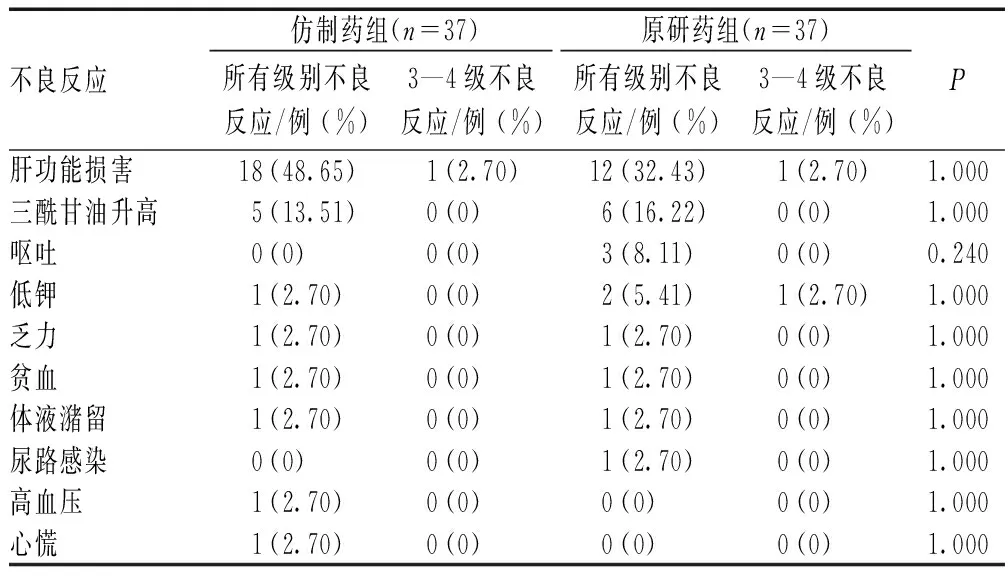
表6 倾向性评分匹配后仿制药组与原研药组患者不良反应发生情况比较Tab 6 Comparison of the incidence of adverse reactions between generic drug group and original drug group after propensity score matching
3 讨论
3.1 有效性
晚期前列腺癌的疾病进程依赖于雄激素信号通路,根据对雄激素剥夺治疗的敏感性及是否发生远处转移分为mHSPC、非转移性去势抵抗性前列腺癌及mCRPC等阶段,不同阶段患者的临床治疗目标因疾病状态的差异而有所不同[12-13]。晚期前列腺癌患者的治疗包括控制疾病进展、延长无疾病进展时间、延长生存期及提高生活质量等[14]。与一些预后较差的实体瘤相比,前列腺癌进展相对缓慢,如高转移风险的非转移性去势抵抗前列腺癌患者的中位总生存期近5年[15-16]。如果将总生存期作为该患者人群临床研究的唯一主要终点,可能会延缓患者得到有效治疗手段的时间,并且需要大量的临床样本才能得出研究结论。本研究纳入的患者均为mCRPC患者,因此,选用了PSA50缓解率和PSA50缓解中位时间作为主要终点。
基于PSA水平的终点PSA升高在临床实践中被视为前列腺癌进展的早期信号,是临床治疗决策的敏感性肿瘤标志物。PSA检测方法较为简单,可以客观和定量评估,不受后续治疗影响,可以基于更小的样本量更早地进行评估[17]。
从本研究的有效性结果可以看出,对于主要终点PSA50缓解率,2种药品都可以达到较高的缓解率,原研药稍高于仿制药[68例(59.65%)vs. 63例(55.26%)],但差异无统计学意义(P>0.05)。经倾向性评分匹配后对两组患者进行比较,差异仍无统计学意义(P>0.05)。仿制药组、原研药组患者的PSA50缓解中位时间分别为1.90(1.10,3.00)、2.5(1.00,4.00)个月,差异无统计学意义(P>0.05)。进行倾向性评分匹配后,两组患者PSA50缓解中位时间的差异仍无统计学意义(P>0.05)。阿比特龙暴露时间最长的患者在原研药组,达到57个月,暴露时间>24个月的患者达到21例。因仿制药从2020年4月才进入我院,到本研究提取数据的截止时间,仿制药组患者最长的暴露时间只有26个月,因此,该数据的差异并不表示仿制药的至首次后续治疗的时间会短于原研药,还需进一步的长期观察才可以得出确切的数据。
3.2 安全性
本研究结果显示,无论原研还是仿制阿比特龙的安全性均良好。阿比特龙所致不良反应很常见(64.91%),但通常耐受性良好,大多数不良反应为1级或2级。仿制药组发生率排序居前5位的不良反应是肝功能损害(35例,占30.70%)、三酰甘油升高(15例,占13.16%)、低钾(8例,占7.02%)、乏力(6例,占5.26%)和肌酐升高(6例,占5.26%);原研药组发生率排序居前4位的不良反应与仿制药组相同,居第5位的是体液潴留(6例,占5.26%),两组患者所有类型不良反应发生率的差异均无统计学意义(P>0.05)。 本研究中,两组患者出现3级以上肝功能损害的患者均只有1例(0.88%vs.0.88%),原研组出现1例重度低钾、1例重度高血压,仿制药组均未出现。经倾向性评分匹配后,两组患者各种类型不良反应发生率的差异仍无统计学意义(P>0.05)。
3.3 本研究的局限性
本研究主要数据来源于医院管理信息系统,可能存在数据的缺失和可能的信息偏差。虽然采用了倾向性评分匹配去除混杂因素,但由于目前仿制药在临床使用时间尚短,对于进展相对缓慢的前列腺癌来说,临床常用的疗效评价指标如影像学无进展生存期等未能进行评估,只选取了较为直观的PSA50缓解率和PSA50缓解中位时间,这是本研究的局限性。另外,本研究数据在进行倾向性评分匹配后的病例数较少,可能导致结果的偏倚,需要今后更大样本量的数据进行研究。
综上所述,在现有的研究条件下,仿制与原研阿比特龙治疗mCRPC患者在有效性和安全性方面的差异无统计学意义,两组患者的疗效和安全性数据采用倾向性评分匹配后,差异仍无统计学意义。
