不同外源激素处理对沙米种子萌发及胚根生长的影响
2023-07-31张德魁马全林魏林源陈芳唐卫东张卫星宋德伟胥宝一
张德魁,马全林,魏林源,陈芳,唐卫东,张卫星,宋德伟,胥宝一
(甘肃省治沙研究所甘肃省荒漠化与风沙灾害防治国家重点实验室培育基地,兰州 730070)
沙米(Agriophyllumsquarrosum)是藜科沙蓬属的一年生草本植物[1],具有耐干旱、耐贫瘠、适应性强的特点,是沙地植被群落演替的先锋植物[2],在沙地荒漠生态系统中起着不可或缺的作用。沙米不仅具有重要的生态价值,同时具有重要的经济开发价值,兼有药用、食用、饲用和防风固沙等多种功能,是干旱沙区的重要野生经济植物资源[3]。关于沙米种子的研究主要有生物学特性、生理生态适应特性、种子萌发、土壤种子库、化学成分及生物活性等[4-9]。沙米种子萌发存在明显的休眠特性,在自然条件下即使满足发芽的条件,沙米种子也不会全部集中发芽,这是为适应沙地特殊的环境条件而形成的[10],但这种特性对人工驯化栽培却带来一定障碍,人工栽培需要萌发速度快,出苗整齐,植株生长期和成熟期在时间上一致,保证按时脱粒收获。
通常在农业生产中施用外源植物生长调节剂是最为有效的调控手段[11]。外源激素是一类具有生理调节功能的植物生长调节剂,能控制植物生长和调节生理等,如赤霉素(GA3)、氟啶酮(FL)等可打破植物种子的休眠和提高种子的活力[12],GA3的主要生理作用有促进植物生长,特别是促进细胞伸长[13]。FL是一种脱落酸(ABA)合成抑制剂,用其处理种子,可以打破种子休眠,参与种子休眠的调控[14]。赵程等[15]对肉苁蓉种子萌发研究认为,单一GA3或FL处理均可对肉苁蓉种子发芽起促进作用,但两者的协同诱导效果更明显。有学者针对GA3和FL协同诱导植物种子萌发在巫山淫羊藿种子[16]、羊草种子[17]等也开展了一定的研究,但两者的协同诱导作用对沙米种子的萌发效果尚未见报道。农作物在种子萌发或植株生长过程中,经常受土壤、施肥、逆境等影响,导致幼苗胚根或根系生长受到抑制或损伤,影响植株生长和产量的形成,生产中促进胚根生长的技术研究和利用产品较少,沙米作为野生植物变家化栽培中,胚根的生长发育研究也十分重要。为此,通过不同浓度外源激素对沙米种子处理,研究沙米种子萌发及胚根伸长生长的变化规律,以在确定影响沙米种子萌发及胚根伸长生长的因素,探寻适宜的破除沙米种子休眠并能快速扎根生长的外源激素及浓度,为沙米的人工驯化栽培提供理论基础和数据参考。
1 材料与方法
1.1 试验材料
供试材料为2018年冬季民勤沙井子地区沙地上采集,自然风干后装种子袋中自然温度下保存,因沙米种子休眠对低温较敏感,若低温保存有打破种子休眠促进萌发的作用,因此本试验所用种子选择自然温度下保存。在保存的种子中随机选取数出1 000粒种子在分析天平上称量,5次重复,取其平均数,测得沙米种子千粒重1.036 g。
供试试剂有GA3(上海士锋生物科技有限公司),实验室专用,纯度≥90%;FL(SIGMA,CAS#59756-60-4,GC≥98%)。
试验仪器有人工气候室植物培养箱(泰斯特电热恒温培养箱DH5000(B)II)、普通型滤纸和直径为90 mm的玻璃培养皿。
1.2 试验设计
2019年4月,从保存的种子袋中取出2018年冬季收获贮藏的供试沙米种子,将种子冲洗干净,用2%次氯酸钠溶液浸泡种子5 min消毒,后用无菌蒸馏水冲洗3次,再用无菌滤纸吸干种子表面水分,备用。试验设15个处理,以蒸馏水浸泡为对照(CK),不同外源激素及浓度对沙米种子的处理如表1所示。在培养皿中平铺滤纸两层作为沙米种子萌芽的芽床,每处理20粒种子,3次重复,种子在培养皿中均匀分布开,不能让种子靠在一起,以方便观测萌发数量和胚根伸长长度观测,放置于人工气候室中,气候室温度控制在25 ℃,相对空气湿度控制在60%~80%,试验过程中适量在滤纸上添加蒸馏水,保持滤纸湿润。

表1 不同外源激素和浓度对沙米种子的处理Table 1 Treatment of Agriophyllum squarrosum seeds with different exogenous hormones and concentrations
1.3 测定指标
试验布置后以胚根突破种皮2 mm为萌发标准,种子置培养皿后每12 h观测1次,记录每次的种子萌发数量,每次观测时依据培养皿中的水分情况适量补充蒸馏水,防止种子缺水干旱死亡,并对培养皿中的沙米种子胚根伸长情况用高清照相机拍照,拍照时培养皿底部放一张标准方格纸,保存好照片备用。种子萌发试验结束后,根据记录和观测结果,分别计算种子发芽率(GR)、发芽势(GE)、发芽指数(GI)[18]、活力指数(VI)、相对胚根长等指标,计算公式分别为
(1)
式(1)中:F为正常发芽粒数;W为供试种子总数
(2)
式(2)中:Ges为发芽初期(3d)萌发种子粒数。
(3)
式(3)中:Gt为处理t日的发芽数;Dt为相应的发芽日数;GI值越大,发芽速度越快,种子的活力越高。
(4)
式(4)中:Sa为胚根平均长度。
利用AutoCAD软件的画图和测量功能对胚根长度进行测量(图1,T8处理,培养84 h照片),将前述备用的照片导入AutoCAD制图软件中,按培养皿下方的标准方格纸(或直尺)尺寸对导入的图片尺寸进行校对[图1(a)],运用CAD的描图功能对沙米种子伸长的胚根进行描画,描画每粒种子的胚根时可在电脑屏幕上尽可能放大所描画的胚根后描画,减小描画带来的误差,描画后的曲线可代表伸长的胚[图1(b)],描画每组处理时要完全对应处理号和重复编号,再利用CAD的测量功能测得曲线的长度,输入命令list回车,鼠标选择所描胚根曲线,回车确认后弹出的窗口中显示该曲线的长度[图1(c)],测得的曲线长度记为该胚根该培养时间段的伸长长度,每个培养皿中有20粒种子,记录胚根长度时每个培养皿中选择10粒最长的进行描画测量,用Excel表格分别记录每种处理(3次重复)各培养时段(24,36,48,…,108 h)的胚根长度,记录统计胚根伸长进度情况。

图1 利用AutoCAD软件测量胚根长步骤Fig.1 Step diagram of measuring radicle length with AutoCAD software
1.4 数据处理
试验数据采用SPSS19.0进行单因素ANOVA方差分析,SSR法检验差异显著性,Excel2007电子表格和SPSS19.0制图。
2 结果与分析
2.1 不同外源激素处理沙米种子萌发率的影响
不同外源激素处理后的沙米种子,除T6和T2处理外,其他处理均比对照(CK)提高了沙米种子的萌发率(图2)。其中,T11~T15处理的萌发效果最佳,处理后24 h萌发率分别达到65%、56%、78%、83%和78%,处理后48 h萌发率分别达84%、86%、89%、99%和96%,处理后72 h达到种子的萌发高峰,萌发率分别是86%、88%、92%、100%和96%;其次是T1、T10、T5、T4和T3处理,萌发率由处理后24 h的49%、49%、40%、38%和35%迅速提高到处理后48 h的89%、95%、85%、77%和72%,处理后72 h均达到种子的萌发率高峰,分别达到94%、98%、99%、94%和75%;T9、T8和T7处理开始时间种子萌发率较低,处理后24 h萌发率只有27%、15%和9%,处理后36 h也只有37%、19%和12%,但到处理后48 h种子快速萌发,萌发率上升到92%、63%和55%,已有超过一半的种子萌发。T6和T2的处理效果最差,处理后192 h种子萌发率也才只有27%和58%,而CK在处理后192 h的萌发率是65%,两个处理的萌发率低于CK,不受外源激素的干扰,沙米种子萌发率在各萌发时间段都是均匀平缓的在提升萌发率,这是由沙米生长环境经过长期演化,为适应环境生长而形成的生长适应机制。

图2 不同外源激素处理沙米种子萌发率变化图Fig.2 Variation of germination rate of Agriophyllum squarrosum seeds treated with different exogenous hormones
总体看,不同外源激素处理沙米种子的萌发率变化,在处理后24、36、48 h这3个时间段是沙米种子萌发率变化最大时期,尤其从处理后36 h到48 h这个时间段是不同外源激素处理后沙米种子迅速萌发的关键时间段,大多数沙米种子在这个时间段萌发,萌发率快速提升阶段。不同外源激素处理沙米种子,萌发率高低的排序为(192 h的萌发率)T14>T9>T5>T10>T15>T1>T4>T13>T12>T11>T8>T7>T3>CK>T2>T6。
2.2 不同外源激素处理沙米种子发芽势的影响
发芽势是指在发芽过程中日发芽种子数达到最高峰时,发芽的种子数占供测样品种子数的百分率。沙米种子用激素处理后一般3 d为发芽高峰期(图3),除T6处理的发芽势低于CK外,其他处理沙米种子的发芽势均高于CK,其中T9和T14两种处理的发芽势最高均达到100%,其次是T5、T10、T15、T1、T4和T13,发芽势分别为99%、98%、96%、94%、94%和92%,比CK组分别提高了215.22%、213.04%、208.70%、204.43%、204.35%和200.00%,各处理与对照相比均有很高的发芽势,且达到对照的2倍以上。T6处理的发芽势最低,仅为23%,只有CK组发芽势的50.00%,其次发芽势较低的是T2处理,发芽势为50%,与CK组差异不显著,其他处理组均与CK组差异显著(P<0.05),用不同外源激素处理沙米种子,可有效提高沙米种子的发芽势。各处理依据发芽势大小排序结果为T14>T9>T5>T10>T15>T1>T4>T13>T12>T11>T8>T7>T3>T2>CK>T6。

不同小写字母表示差异显著(P<0.05)图3 不同外源激素处理沙米种子的发芽势Fig.3 Germination potential of Agriophyllum squarrosum seeds treated with different exogenous hormones
2.3 不同外源激素处理沙米种子发芽指数的影响
发芽指数是种子的活力指标。发芽指数高,种子的活力就高。不同外源激素处理对沙米种子发芽指数的影响变化规律与其对发芽势的变化规律大体相似(图4),个别处理的发芽指数值大小排序与发芽势大小排序有变化,T6处理的发芽指数为4.67,低于CK的发芽指数12.89外,其他处理沙米种子的发芽指数均高于CK,且差异显著,其中,T14发芽指数值最高,其值为30.86,其次是T15和T5,发芽指数值分别为30.34和30.14,各处理发芽指数值大小排序结果为T14>T15>T5>T4>T13>T1>T10>T12>T11>T9>T3>T8>T7>T2>CK>T6。
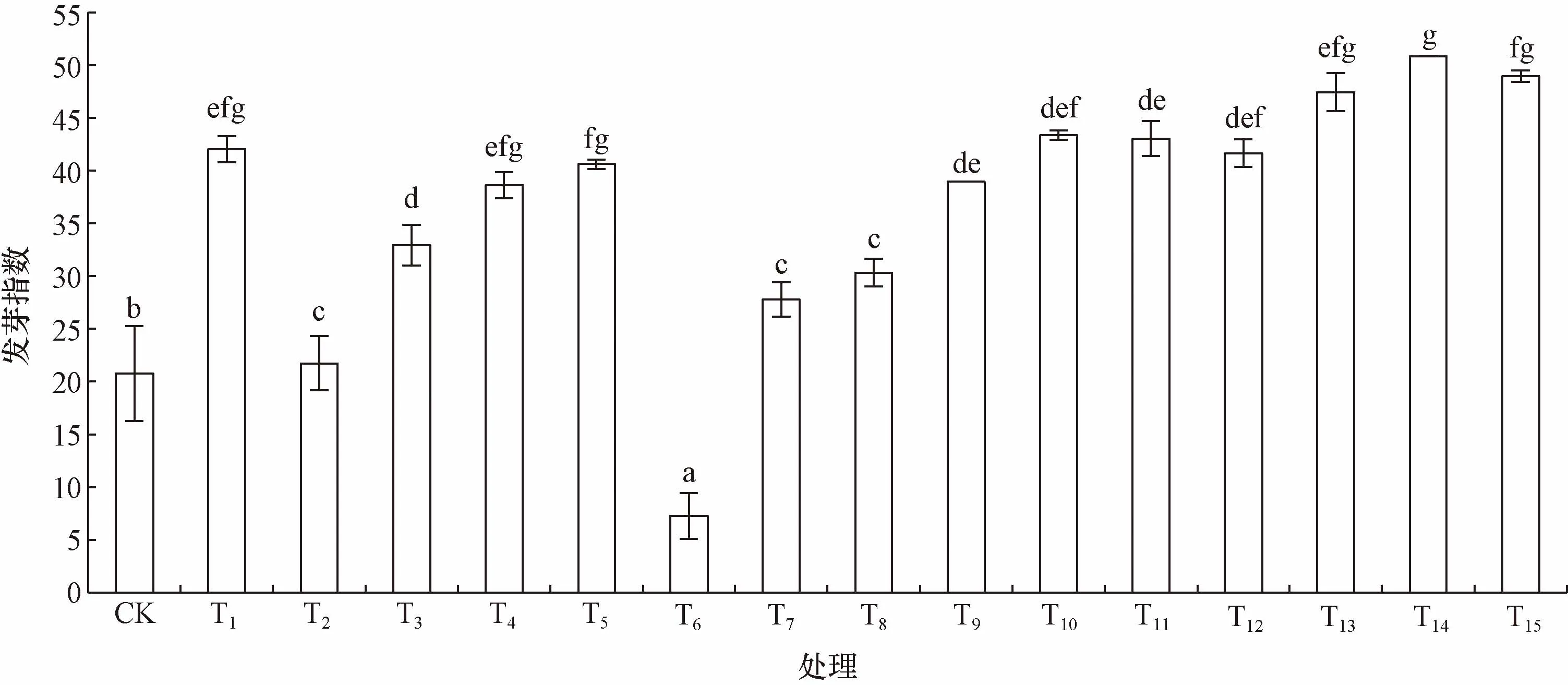
不同小写字母表示差异显著(P<0.05)图4 不同外源激素处理沙米种子的发芽指数Fig.4 Germination index of Agriophyllum squarrosum seeds treated with different exogenous hormones
2.4 不同外源激素浓度对沙米胚根长的影响
不同外源激素处理沙米种子,其胚根伸长长度有差异(图5),其中,T13、T11、T14、T9、T12、T5、T1和T15处理沙米胚根长的生长均优于对照CK,其中T13和T11处理下的沙米种子胚根伸长长度最大,处理后108 h胚根的总长度平均达到69.28 mm和54.91 mm,胚根的长度与时间呈显著的线性关系,分别可用公式y=0.688x-3.193 5(R2=0.980 4),其中,y为胚根的长度,单位:mm,x为胚根生长时间,单位:12 h,下同)和y=0.515 6x+0.673 4(R2=0.986 3)表示,其次是T14和T9处理,处理后108 h胚根的总长度平均达到43.84 mm和39.96 mm,胚根的长度与时间呈显著的线性关系,分别可用公式y=0.388 8x-0.144 9(R2=0.974 2)和y=0.395 4x+2.539 6(R2=0.957 7)表示。T12、T5、T1和T15处理108 h胚根的平均总长度分别为45.88 mm、37.65 mm、32.40 mm和32.76 mm,胚根的长度与时间呈显著的线性关系,分别可用公式y=0.353 1x+0.956 7(R2=0.661 5)、y=0.301 2x+4.820 4(R2=0.970 6)、y=0.281 1x+4.416 8(R2=0.942 6)和y=0.226 3x+3.907 5(R2=0.891 4)。不同外源激素浓度处理沙米种子12 h内只有T6处理的种子没有萌发,胚根无伸长发生,其余处理均有萌发,且胚根长度在3.84~6.59 mm生长。

图5 不同外源激素处理下沙米胚根伸长进度Fig.5 Radicle elongation progress of Agriophyllum squarrosum under different exogenous hormone treatments
3 结果
适宜浓度FL处理可有效破除沙米种子的休眠促进其萌发,FL浓度为0.1~5 mg/L,随着浓度的增加种子发芽率也在增加,浓度为10 mg/L时种子发芽率比5 mg/L时的低;0.5 mg/L浓度的FL溶液浸泡处理沙米种子,浸泡时间为3~24 h,随着浸泡时间的增加,种子的发芽率在增加,但浸泡3 h(T2)破除休眠效果差,种子的发芽率低于对照(CK),浸泡6 h以上效果明显,发芽率均高于对照。GA3+FL的混合叠加液处理沙米种子,破除休眠效果最佳,本试验5种混合叠加处理下24 h种子的发芽率均大于50%,最高发芽率达83%,36 h发芽率均≥70%,48 h发芽率已大于80%,其中T14处理效果最佳,种子的发芽率达100%,发芽势达100%,发芽指数达30.86,不同外源激素处理沙米种子发芽率高低排序结果为T14>T9>T5>T10>T15>T1>T4>T13>T12>T11>T8>T7>T3>CK>T2>T6;不同浓度外源激素处理沙米种子后24 h、36 h和48 h这3个时间段是沙米种子发芽率变化最大的时期,也是沙米种子迅速萌发胚根伸长生长的关键时期,不同外源激素浓度处理沙米种子12 h内只有T6处理的种子没有萌发,胚根无伸长发生,其余处理均有萌发,且胚根长度在3.84~6.59 mm的生长,12 h之后所有处理下的种子胚根均能快速伸长生长,且胚根的长度与萌发时间呈显著的线性相关关系,每种处理下胚根长y(单位:mm)和萌发时间x(12 h)可以用线性关系式y=ax+b表达。
4 讨论
种子休眠是长期自然选择的结果,也是植物在系统发育中形成的抵抗不良环境条件的适应性。种子休眠对处于恶劣环境中的植物保持其自身的繁衍发展具有重要的生态学意义[19]。引起植物种子休眠的原因有种壳引起的休眠、胚休眠、萌发抑制物引起的休眠、光效应引起的休眠和综合休眠等[20],针对沙米种子萌发特性的研究较多[6,21-22],但关于沙米种子休眠特性的报道不尽一致,范树高对民勤采集的沙米种子试验,适宜条件下沙米种子的发芽率在8%~15%,存在明显的休眠特性[23]。但Wang等[24]研究发现,沙米种子自然发芽率在90%以上,认为不存在休眠。魏林源等[25]对采自甘肃敦煌、民勤、宁夏沙坡头和内蒙古奈曼旗4个不同生境地的沙米种子试验,认为4生境地的沙米种子均存在休眠。沙米种子休眠的原因究竟由何引起,仍有待于进一步的研究和分析。
激素处理植物种子是目前打破种子休眠应用最广泛的措施,具有打破种子休眠和调控种子内部激素平衡[26]的作用。目前,生产上应用较为广泛的植物激素有赤霉素(GA3)、萘乙酸(NAA)、脱落酸(ABA)、吲哚丁酸(IBA)、吲哚乙酸(IAA)、乙烯利等。GA3是一种高效能的广谱植物生长调节剂,是促进植物生长发育的重要激素之一,会对种子萌发产生一定的影响,因此,在破除植物种子休眠促进萌发试验和生产中应用的较多[27-28],且GA3处理促进种子萌发过程中,普遍存在随着GA3浓度增加,种子的发芽势、发芽率呈现先增加后降低的趋势。FL对沙米种子萌发也具有很好的促进作用,通过外源施加FL,休眠的沙米种子能够快速破除休眠,且沙米种子快速完成发芽[23],但试验研究发现只用FL处理的沙米种子快速发芽后,幼苗颜色泛红色,幼苗的死亡率很高,认为单纯用FL破除沙米种子休眠不利于沙米的后期生长。GA3+FL组合作用既可有效破除沙米种子的休眠快速萌发,又可防止由FL抑制幼苗颜色泛红导致死亡的不足,因此本试验增加了GA3+FL的不同组合,试验组合来看,发芽率最佳的处理出现在T14处理,也就是0.5 mg/L GA3+10 mg/L FL组合,与汪佳维等[29]对滇重楼种子的处理和赵程等[15]对肉苁蓉种子的处理的结果基本一致,表明GA3和FL混合溶液对沙米种子休眠的破除优于单一的GA3和FL溶液。
种子萌发是一个十分复杂的生理过程[30],种子萌发时期的发芽率、发芽势、发芽指数是判断种子发芽能力的重要指标,能够直观地反映种子的发芽速率和生长的趋势,而它的生长状况(如幼苗的相对胚根胚芽长)则直接与幼苗的生长及生物量相联系[31]。种子的发芽势反映种子的发芽是否集中在一段时间和发芽是否整齐,发芽指数是种子的活力指标,如果发芽过程中种子的发芽指数高,说明种子的活力就高[32],而种子的活力指数反映了种子能否在较广范围内迅速发芽和种子生长的整齐度。不同外源激素对沙米种子萌发会产生一定的影响,可从发芽率、发芽势、发芽指数来判断。
5 结论
GA3和FL两种不同外源激素单独处理沙米种子可提高沙米种子的萌发率、发芽势和发芽指数,也可促进沙米胚根的伸长生长,本试验的数据分析结果表明,两种外源激素混合后的协同作用更能有效促进沙米种子萌发和胚根的伸长生长,先用2%次氯酸钠溶液浸泡种子消毒,后用无菌蒸馏水冲洗干净,再使用0.5 mg/L的GA3加5.0 mg/L的FL混合溶液浸泡种子24 h,在25 ℃条件下培养,是沙米种子萌发生长的最佳处理。
