大黄酸治疗腹泻的潜在机制研究
2023-07-31魏利莎沈鹏
魏利莎 沈鹏


摘要 [目的]评估大黄酸对金黄色葡萄球菌生长和猪小肠上皮细胞IPEC-J2增殖的影响。[方法]用0.3~19.2 μg/mL大黄酸处理金黄色葡萄球菌,分光光度计法检测肉汤培养法菌液在600 nm处的OD值,观察并拍照平板培养法细菌的生长情况;用1~5 μmol/L大黄酸处理加或未加脂多糖刺激的IPEC-J2细胞,CCK-8法检测细胞的增殖情况。[结果]大黄酸在低剂量(0.3 μg/mL)时对金黄色葡萄球菌的生长有显著抑制作用;大黄酸在高剂量(10 μmol/L)时对IPEC-J2细胞的增殖也有显著抑制作用,同时,大黄酸不能缓解脂多糖诱导的IPEC-J2细胞的增殖抑制。[结论]低剂量的大黄酸可通过抑制肠道致病菌的生长来缓解由致病菌引起的肠道炎症,但不能直接作用于猪小肠上皮细胞IPEC-J2。
关键词 大黄酸;脂多糖;金黄色葡萄球菌;IPEC-J2细胞
中图分类号 R285 文献标识码 A 文章编号 0517-6611(2023)13-0146-03
doi:10.3969/j.issn.0517-6611.2023.13.035
Study on the Potential Mechanism of Rhein in the Treatment of Diarrhea
WEI Li-sha1,SHEN Peng2
(1.School of Marine and Biological Engineering,Yancheng Teachers University,Yancheng,Jiangsu 224000;2.Microbiological Laboratory,Yancheng Center for Disease Control and Prevention,Yancheng,Jiangsu 224000)
Abstract [Objective]To evaluate the effect of rhein on the growth of Staphylococcus aureus and the proliferation of porcine small intestinal epithelial cell IPEC-J2.[Method]Staphylococcus aureus was treated with 0.3-19.2 μg/mL rhein.The OD value at 600 nm was detected by spectrophotometer for Staphylococcus aureus cultured in liquid medium,and the Staphylococcus aureus cultured in plate were observed and photographed.IPEC-J2 cells were treated with 1-5 μmol/L rhein with or without lipopolysaccharide (LPS) stimulation.The proliferation of IPEC-J2 cells was detected by CCK-8 kit.[Result]Rhein significantly inhibited the growth of Staphylococcus aureus at low dose (0.3 μg/mL).Rhein could significantly inhibit the proliferation of IPEC-J2 cells at high dose (10 μmol/L) as well.Meanwhile,rhein could not alleviate the proliferation inhibition of IPEC-J2 cells induced by LPS.[Conclusion]Low-dose rhein can alleviate intestinal inflammation caused by intestinal pathogens through inhibiting the growth of intestinal pathogens,but it at least cannot directly act on porcine intestinal epithelial cells IPEC-J2.
Key words Rhein;LPS;Staphylococcus aureus;IPEC-J2 cells
基金项目 国家自然科学青年基金项目(82200976)。
作者简介 魏利莎(1992—),女,江苏盐城人,讲师,博士,从事代谢性炎症与肠道疾病方面的研究。
收稿日期 2023-02-02
腹泻是全世界发病率和死亡率较高的疾病,大量证据表明,中药可有效缓解腹泻症状,特别是针对慢性腹泻疗效突出[1-3]。大黄是我国历史最悠久、知名度最高的中药之一,大黄酸(1,8- 二羟基-3-羧基蒽醌,Rhein)是富含于大黄根茎中的蒽醌类化合物,具有胃肠道保护作用[4]。有研究报道,大黄酸对多种细菌具有抑制作用[5-6]。但是对肠道致病菌金黄色葡萄球菌(Staphylococcus aureus)是否也有同样的抑制效果还不清楚。金黄色葡萄球菌是常见的引起病人腹泻的肠道致病菌[7]。因此,该研究以大黄酸为代表,分別分析其对金黄色葡萄球菌生长的作用和对脂多糖(lipopolysaccharide,LPS)诱导的猪小肠上皮细胞IPEC-J2增殖的影响,从肠道细菌和肠上皮细胞2个角度,探讨中药治疗腹泻的潜在机制。
1 材料与方法
1.1 试验材料
1.1.1 试材。IPEC-J2细胞来自美国菌种保藏中心(ATCC),由盐城师范学院药学院馈赠;金黄色葡萄球菌标准菌株(ATCC29213)由江苏省盐城市疾病预防控制中心提供。
1.1.2 试剂。营养肉汤培养基(货号022010),购自广东环凯微生物科技有限公司;营养琼脂(货号HB0109),购自海博生物技术有限公司;胎牛血清(FBS,货号FSP010),购自依科赛生物科技有限公司;DMEM高糖培养基(货号BL304A)、0.25%胰酶消化液(货号BL512A)、Hanks缓冲液(货号BL559A)、二甲基亚砜(DMSO,货号BL165B),购自兰杰柯科技有限公司;100X青霉素-链霉素溶液(货号E607011),购自上海生工生物工程技术服务有限公司;细菌试验大黄酸(货号S31389),购自上海源叶生物科技有限公司;细胞试验大黄酸(货号HY-N0105),购自MCE(MedChemExpress)公司;LPS(货号L2880),购自美国默克公司;细胞增殖及毒性检测试剂盒(CCK-8,货号C0039),购自碧云天生物技术有限公司。
1.1.3 仪器。
细菌培养箱BC-J80S,上海博讯;722S可见分光光度计,上海新茂仪器有限公司;细胞培养箱,赛默飞311;SpectraMax M2多功能酶标仪,美国Molecular Devices。
1.2 试验方法
1.2.1 营养肉汤法培养金黄色葡萄球菌。
称取0.06 g大黄酸(S31389)溶解于20 mL DMSO中配制成3 mg/mL母液,0.22 μm 滤器过滤后冻于-80 ℃备用。金黄色葡萄球菌前1 d 晚上平板划线,37 ℃培养过夜,挑取单菌落金黄色葡萄球菌于3 mL无菌营养肉汤中,37 ℃摇床培养2~3 h作为种子菌,准备32个含3 mL无菌营养肉汤的试管,每管接种20 μL種子菌,按大黄酸 0、0.3、0.6、1.2、2.4、4.8、9.6和19.2 μg/mL的工作浓度加入相应体积母液,每个浓度重复4管,于37 ℃摇床培养过夜,第2天对试管拍照并用分光光度计测菌液在600 nm处的OD值。
1.2.2 平板法培养金黄色葡萄球菌。
分别将含0、0.3、0.6、1.2、2.4、4.8、9.6和19.2 μg/mL大黄酸的琼脂培养基倒入培养皿中,凝固后每平板加入100 μL种子菌并涂布,37 ℃细菌培养箱培养过夜,第2天取出培养皿观察并进行拍照。
1.2.3 IPEC-J2细胞培养及处理。IPEC-J2细胞培养于含10% FBS和1X青霉素-链霉素的DMEM高糖培养基中,在含5% CO2的37 ℃培养箱中培养,待细胞长满至80%~90%时进行传代,吸掉废液后先用Hanks缓冲液洗3遍,再用0.25%胰酶消化液消化3 min,1 000 r/min离心5 min收集细胞,用新鲜培养基重悬细胞后按1∶3进行传代。
100 mg大黄酸(HY-N0105)粉末溶解于17 mL DMSO中配成20 mmol/L母液,经0.22 μm滤器过滤后分装冻存于-20 ℃冰箱,避免反复冻融。研究大黄酸对IPEC-J2细胞增殖影响时,共设置4组,0 μmol/L大黄酸组作为对照组(CK)、1 μmol/L大黄酸组作为处理①、10 μmol/L大黄酸组作为处理②、100 μmol/L大黄酸组作为处理③。每组重复10次。处理后细胞在37 ℃细胞培养箱中培养24 h后进行后续试验。
10 mg LPS粉末溶解于1 mL Hanks缓冲液中配成10 mg/mL母液,经0.22 μm滤器过滤后分装冻存于-20 ℃冰箱,避免反复冻融。研究大黄酸能否缓解LPS诱导引起的IPEC-J2细胞炎症时,共设置4组,0 μmol/L大黄酸 + 0 μg/mL LPS作为对照组(CK)、0 μmol/L大黄酸 + 50 μg/mL LPS组作为处理①、1 μmol/L大黄酸 + 50 μg/mL LPS组作为处理②、5 μmol/L大黄酸 + 50 μg/mL LPS组作为处理③。每组重复10次。每组细胞先加入对应浓度的大黄酸预处理1 h后,再加入对应浓度的LPS进行处理,然后在37 ℃细胞培养箱中培养24 h后进行后续试验。
1.2.4 CCK-8法检测细胞增殖。IPEC-J2细胞长满后,用Hanks缓冲液洗涤3次,0.25%胰酶消化3 min,获得细胞后进行细胞计数,按照每孔0.5×103 cells接种到96孔板中,每孔加入100 μL细胞悬液,过夜培养后先加入相应的处理,24 h后每孔加入10 μL CCK-8溶液,继续于37 ℃细胞培养箱孵育3 h,在酶标仪中检测450和650 nm处的吸光度(A),用A450-A650值表示细胞的增殖能力。
1.3 数据统计与分析
该试验所有数据用平均数±标准差(±SD)表示,选用unpaired student t test方法进行统计分析,用GraphPad Prism 9软件进行统计分析并作图。
2 结果与分析
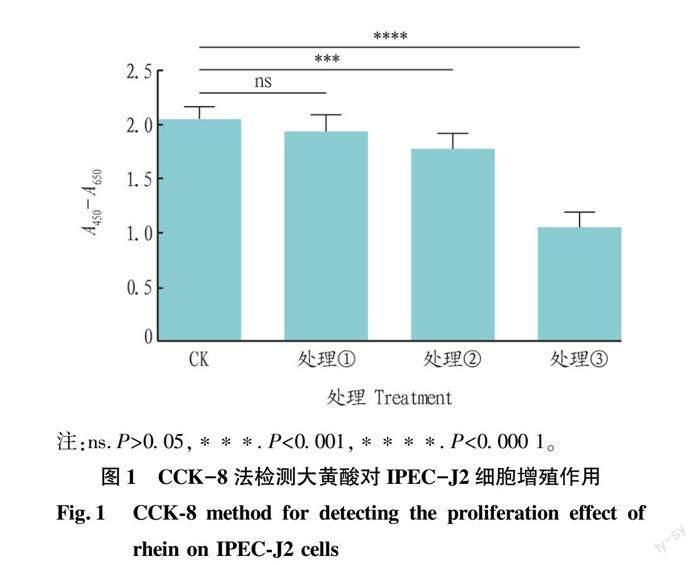
2.1 大黄酸对IPEC-J2细胞增殖的影响
该研究在验证大黄酸能否缓解LPS诱导的IPEC-J2细胞炎症前,观察不同浓度大黄酸对IPEC-J2细胞增殖的影响。如图1所示,与CK相比,IPEC-J2细胞增殖能力随着大黄酸处理浓度增加而减弱,10 μmol/L大黄酸(处理②)已能显著抑制IPEC-J2细胞的增殖(P<0.001)。这表明大黄酸对IPEC-J2细胞的增殖呈剂量依赖的抑制作用。
2.2 大黄酸对IPEC-J2细胞炎症的缓解作用 从图2可看出,与CK相比,经50 μg/mL LPS(处理①)诱导后,IPEC-J2细胞增殖能力显著下降(P<0.000 1);与LPS组相比,无论用1 μmol/L大黄酸(处理②)或5 μmol/L大黄酸(处理③)预处理LPS刺激前的IPEC-J2细胞,均不能缓解之后LPS刺激引起的IPEC-J2细胞增殖抑制(P>0.05)。上述试验结果表明,大黄酸缓解腹泻的机制不是通过直接作用于IPEC-J2细胞。
2.3 大黄酸对金黄色葡萄球菌生长的抑制作用
该研究分别用肉汤培养法和平板培养法观察0~19.2 μg/mL 大黄酸对金黄色葡萄球菌生长的影响。从图3可以看出,随着大黄酸处理浓度增加,过夜培养后菌液逐渐变得澄清。600 nm处的OD值结果(图4)表明,0.3 μg/mL大黄酸已能显著抑制金黄色葡萄球菌生长(P<0.01)。平板培养法结果也显示,随着大黄酸处理浓度增加,金黄色葡萄球菌数量越来越少(图5)。这说明大黄酸对金黄色葡萄球菌的生长有抑制作用,且呈剂量依赖作用。
3 讨论
腹泻为临床高发疾病,经漫长发展史可进展为结直肠癌,威胁人类生命安全。越来越多的证据表明,肠道菌群失调与慢性腹泻的发生发展密切相关[8]。目前,肠道致病菌引起的腹泻以抗生素治疗为主。然而,抗生素杀菌具有广谱性,杀害致病菌的同时,体内的益生菌也会受到影响,严重损害肠道功能;此外,长期不合理使用抗生素,使得大量的致病菌产生耐药性,影响治疗效果且治疗成本高[9]。最新研究表明,中药正逐渐成为治疗腹泻特别是慢性腹泻的最佳方案[10],但其作用靶点与机制尚不清晰,而该研究则以大黄块茎中的大黄酸为例,对其治病机理进行了分析。
首先,该研究发现大黄酸在低剂量(0.3 μg/mL)时对金黄色葡萄球菌的生长有抑制作用,这与之前发现的大黄酸的杀菌功能相符[11-12]。该研究发现大黄酸不能直接缓解LPS诱导引起的IPEC-J2细胞的增殖抑制,反而本身对IPEC-J2细胞的增殖呈剂量依赖的抑制作用,这与最近报道的大黄酸的潜在抗癌作用相符[13]。近年来,不同课题组利用动物试验发现,大黄酸可以改善LPS诱导引起的大鼠肠屏障损伤[14]或缓解葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导引起的小鼠结肠炎[15]。考虑到复杂的肠道内环境,并不清楚大黄酸是直接还是间接作用于肠上皮细胞。该研究提供了直接的证据,大黄酸可能通过调节肠道微生物来间接改善受损的肠上皮细胞。然而,大黄酸对肠道细菌的生长抑制作用是否具有针对性,即对肠道益生菌的生长是否也有抑制作用,以及对其他类型肠道致病菌的生长是否同样具有抑制作用等,都有待后续深入研究。
参考文献
[1] 陈影,李硕,苏萍,等.中药抗腹泻的药效作用及機制研究进展[J].中国实验方剂学杂志,2019,25(21):203-211.
[2] 杜宁,王垂杰.中医药治疗功能性腹泻作用机制研究[J].辽宁中医药大学学报,2020,22(12):213-216.
[3] 黄兰叶,唐一洲,韦维,等.中医药治疗腹泻型肠易激综合征的研究进展[J].湖南中医杂志,2021,37(11):207-210.
[4] ZHUANG S,ZHONG J,ZHOU Q L,et al.Rhein protects against barrier disruption and inhibits inflammation in intestinal epithelial cells[J].Int Immunopharmacol,2019,71:321-327.
[5] AZELMAT J,LARENTE J F,GRENIER D.The anthraquinone rhein exhibits synergistic antibacterial activity in association with metronidazole or natural compounds and attenuates virulence gene expression in Porphyromonas gingivalis[J].Arch Oral Biol,2015,60(2):342-346.
[6] CHUNG J G,TSOU M F,WANG H H,et al.Rhein affects arylamine N-acetyltransferase activity in Helicobacter pylori from peptic ulcer patients[J].J Appl Toxicol,1998,18(2):117-123.
[7] 孙建林,吕新翔.金黄色葡萄球菌的致病机制[J].医学综述,2022,28(12):2363-2367.
[8] TJALSMA H,BOLEIJ A,MARCHESI J R,et al.A bacterial driver-passenger model for colorectal cancer:Beyond the usual suspects[J].Nat Rev Microbiol,2012,10(8):575-582.
[9] WU S C,LIU F,ZHU K,et al.Natural products that target virulence factors in antibiotic-resistant Staphylococcus aureus[J].J Agric Food Chem,2019,67(48):13195-13211.
[10] MATHAN V I.Diarrhoeal diseases[J].Br Med Bull,1998,54(2):407-419.
[11] 罗曼,刘倩.食源性金黄色葡萄球菌耐药机制分析[J].中国病原生物学杂志,2022,17(6):685-688.
[12] NGUYEN A T,KIM K Y.Rhein inhibits the growth of Propionibacterium acnes by blocking NADH dehydrogenase-2 activity[J].J Med Microbiol,2020,69(5):689-696.
[13] HENAMAYEE S,BANIK K,SAILO B L,et al.Therapeutic emergence of Rhein as a potential anticancer drug: A review of its molecular targets and anticancer properties[J].Molecules,2020,25(10):1-26.
[14] ZHUANG S,ZHONG J,BIAN Y F,et al.Rhein ameliorates lipopolysaccharide-induced intestinal barrier injury via modulation of Nrf2 and MAPKs[J].Life Sci,2019,216:168-175.
[15] WU J W,WEI Z H,CHENG P,et al.Rhein modulates host purine metabolism in intestine through gut microbiota and ameliorates experimental colitis[J].Theranostics,2020,10(23):10665-10679.
