蔬菜栽培土壤中沙门菌荧光定量PCR检测方法
2023-07-29吕新刘兰英李玥仁
吕新,刘兰英,李玥仁
1.福建省农业科学院农业质量标准与检测技术研究所(福州 350003);2.福建省农产品质量安全重点实验室(福州 350003)
沙门菌是全球范围内最重要的几种食源性致病菌之一,由其引起的食物中毒占细菌性食物中毒病例的前2位[1]。据世界卫生组织不完全统计,每年至少有1 600万沙门菌感染病例,导致约60万人死亡。仅在2005—2011年间,国外发生的19件蔬菜因食源性致病菌污染而导致的食物中毒事件,其中11件的元凶是沙门菌[2]。在我国沙门菌也是最主要食源性致病菌,其中80%左右的细菌性食物中毒事件为沙门菌污染所致[3],国内已发现多种蔬菜中存在沙门菌污染风险[4-6]。农产品产地环境的质量安全是农产品质量安全的前提,蔬菜产地环境包括大气、灌溉水源和栽培土壤等因素,其中栽培土壤又是产地环境中最重要因素之一,蔬菜的沙门菌污染可能发生在从农田到餐桌的每个环节[7-8],近年来,随着对蔬菜供应链每个环节中沙门菌污染风险和来源的深入研究,研究发现蔬菜沙门菌污染主要还是发生在栽培环节中,尤以栽培土壤中沙门菌污染而导致蔬菜二次污染为甚,这也是防控蔬菜沙门菌污染重要节点[8-12]。
沙门菌检测所采用的GB 4789.4—2016《食品安全国家标准 食品微生物学检验 沙门氏菌检验》[13],主要包括沙门菌疑似菌落筛选和生化试验鉴定,整个检测过程不但步骤繁琐而且耗时费力,从样品开始检测到最终检测结果取得需要5~7个工作日,难以满足大规模样品检测需求,且最终检测结果也仅为定性分析难以定量分析。而实时荧光定量PCR(quantitative real-time PCR,qPCR)方法则可以完美解决上述问题,已被应用于沙门菌、副溶血弧菌、阴沟肠杆菌、蜡样芽孢杆菌、单核细胞增生李斯特菌等病原菌的分析检测[14-20],但国内尚未见有关蔬菜栽培土壤中沙门菌定量检测方法的研究报道。qPCR方法包括探针法和嵌合荧光法,其中嵌合荧光法以使用SYBR Green I荧光染料为主,其原理是SYBR Green I作为一种具有绿色激发波长的荧光染料,主要结合于双链DNA(dsDNA)双螺旋小沟区域,在游离状态下SYBR Green I不会散发荧光信号,但当与双链DNA结合后其荧光信号将显著增强,其荧光信号强度与双链DNA的数量呈正比,因此可利用SYBR Green I荧光信号强弱变化监测PCR体系中双链DNA的数量。试验以沙门菌特有侵袭蛋白A(invasion protein A)基因为靶基因,建立基于SYBR Green I嵌合荧光法的沙门菌实时荧光定量PCR检测方法,可满足蔬菜栽培土壤中沙门菌污染的定量检测技术需求,以期为蔬菜产地环境中沙门菌污染的防控和蔬菜质量安全的提升提供技术支撑。
1 材料与方法
1.1 材料与试剂
胰蛋白胨大豆琼脂(TSA)、蛋白胨缓冲水(BPW)、胰蛋白胨大豆肉汤(TSB)、无菌均质袋(北京陆桥技术有限责任公司);TB Green®Premix Ex TaqTM(Tli RNaseH Plus,日本宝生物公司);细菌基因组DNA提取试剂盒(北京天根公司);FastDNA®Spin Kit for Soil土壤提取试剂盒(美国MP Bio公司);NaCl(分析纯,阿拉丁公司);荧光定量PCR八联管(无锡Nest公司)。
供试土壤样品采自福州市闽清县东桥镇绿辉蔬菜种植农场,按五点采样法采集0~20 cm土壤表层样品,混合均匀后置无菌袋中放置在4 ℃冷藏箱中运回,挑出植物根系、石头等杂物,土壤理化指标测定前过2 mm筛网。具体土壤理化指标:土壤类型为黄红壤,0~20 cm土层pH 5.31,有机质含量16.61 g/kg,碱解氮含量126.54 mg/kg,速效磷含量18.25 mg/kg,速效钾含量113.79 mg/kg。
1.2 仪器与设备
实时荧光定量PCR仪(BIO-RADTMCFX96 Touch,美国伯乐公司);核酸提取仪(FastPrepTMFP120,美国MP Bio公司);拍击式均质器(easyMixTM,法国AES Chemunex公司);台式离心机(Sigma 1-14,德国希格玛公司);恒温培养箱(DHP-9082,上海一恒科学仪器有限公司);核酸蛋白定量仪(Qubit 2,美国Thermo Scientific公司);超净工作台(C2HJH-C1112B,上海智城公司)。
1.3 菌株
供试的7个菌株微生物菌株除鼠伤寒沙门菌为阳性对照菌株外,其余6个菌株均为试验的干扰菌株,菌株来源分别为中国工业微生物菌种保藏管理中心(CICC)、中国普通微生物菌种保藏管理中心(CGMCC)和美国典型培养物保存中心(ATCC)。具体菌株编号及来源等信息见表1。

表1 供试菌株
1.4 试验方法
1.4.1 引物设计
根据沙门菌侵袭蛋白A(invA)基因(Genbank Accession:M90846.1),使用Primer Premier 5.0软件设计1对qPCR引物invA-U/invA-D用于沙门菌实时荧光定量检测。检测引物交由生工生物工程(上海)股份有限公司合成。具体检测引物序列见表2。
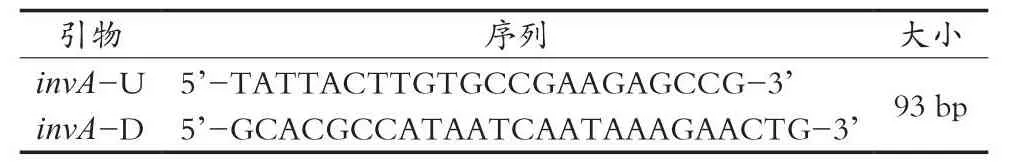
表2 qPCR扩增引物
1.4.2 沙门菌计数及基因组DNA提取
沙门菌计数。将-70 ℃保存的沙门菌菌株在TSA平板内划线后,置37 ℃培养箱倒置培养16~24 h,在5 mL TSB液体培养基中使用无菌牙签挑取TSA平板内的单个沙门菌菌落进行接种,置37 ℃、160 r/min振荡培养16~24 h后,取1 mL振荡培养的TSB液体培养基转接于新的100 mL TSB液体培养基中,在37 ℃、160 r/min振荡养至A600=0.55的对数生长期。以10倍浓度梯度将对数生长期菌液进行稀释后,吸取100 μL稀释液在TSA平板上进行涂布,置37 ℃培养18~24 h后计数。
沙门菌基因组DNA提取。吸取1 mL沙门菌培养菌液,在台式离心机上按12 000 r/min离心4 min,吸弃上清液,菌体沉淀使用细菌基因组DNA提取试剂盒按步骤进行提取。使用Qubit 2测定DNA浓度后,置于-20℃保存备用。
1.4.3 qPCR反应体系和反应条件优化
分别对qPCR反应体系和反应条件中的引物浓度、退火温度进行优化,其中:引物浓度分别为0.1,0.2,0.4,0.6,0.8和1.0 μmol/L;退火温度分别设置55,56,57,58,59,60和61 ℃。每个因子设置3个重复,同时以无菌水为模板设置阴性对照,利用Bio-Rad CFX Manager软件进行数据分析,以扩增曲线获得最小的Ct值和熔解曲线不产生非特异性扩增峰为指标,确定最佳引物浓度和退火温度。
1.4.4 qPCR反应特异性检测
以鼠伤寒沙门菌为阳性对照菌株、金黄色葡萄球菌等6个菌株为干扰菌株,使用细菌基因组DNA提取试剂盒提取各菌株DNA,对沙门菌qPCR反应进行特异性分析。采取已优化的qPCR反应体系和条件进行分析,以管内荧光信号强弱变化来判断阴阳性,阳性管内具有明显的荧光扩增曲线,阴性管内则没有明显的荧光扩增曲线。每个菌株DNA模板均设置3个重复,同时以无菌水为模板设置阴性对照。
1.4.5 qPCR反应灵敏度检测
将沙门菌DNA按10倍递减方式稀释至1×104,1×103,1×102,1×101,1,0.1和0.01 pg/μL 7个浓度,以上述DNA为模板对沙门菌qPCR反应灵敏度进行检测。反应结束后,阳性管内具有明显的荧光扩增曲线,阴性管内则没有明显的荧光扩增曲线。每个浓度的DNA模板均设置3个重复,同时以无菌水为模板设置阴性对照。
1.4.6 标准曲线的建立
取6份10 g无沙门菌污染的栽培土壤样品,加入0.5 mL不同浓度的沙门菌菌液,制备沙门菌浓度分别为2,20,200,2×103,2×104和2×105CFU/g的土壤样品,全部转移至含90 mL蛋白胨缓冲水的均质袋中,将均质袋放置在拍击式均质器中拍打1~2 min混匀,置37 ℃的恒温培养箱中增菌4 h。增菌后重新混匀样品,吸取1 mL混匀土壤样品至FastDNA®Spin Kit for Soil试剂盒中的土壤裂解管中,按12 000 r/min离心3 min,吸弃上清液,在FastPrepTMFP120核酸提取仪上按操作说明提取土壤微生物总DNA,用于栽培土壤中沙门菌的标准曲线建立。
以不同浓度沙门菌提取的DNA作为定量标准品,利用优化的qPCR方法检测各浓度标准品的Ct值,以不同浓度沙门菌对数值为横坐标,qPCR扩增Ct值为纵坐标,建立Ct值与不同浓度沙门菌对数值线性函数关系的定量标准曲线。
1.4.7 蔬菜栽培土壤中沙门菌污染对比检测
采用qPCR方法和GB 4789.4—2016《食品安全国家标准 食品微生物学检验 沙门氏菌检验》,分别对采自全省的35份栽培土壤样品中沙门菌污染情况进行检测,验证所建立的qPCR方法应用于蔬菜栽培土壤中沙门菌污染检测的准确性。
2 结果与分析
2.1 qPCR方法的建立
分别对qPCR反应体系和反应条件中引物浓度、退火温度进行优化,确定qPCR检测最佳反应体系25 μL,包括12.5 μL 2×TB GreenPremix Ex Taq(Tli RNaseH Plus),0.2 μmol/LinvA-U,0.2 μmol/LinvAD,DNA模板1 μL,灭菌水补足至25 μL体积。优化退火温度后反应条件:95 ℃/30 s,95 ℃/5 s,56 ℃/30 s和72 ℃/30 s,扩增40个循环。优化的qPCR方法反应结果如图1所示,其荧光扩增曲线实时反映PCR的指数增长期和平台期,且熔解曲线只有单一扩增峰,未见非特异性扩增峰。
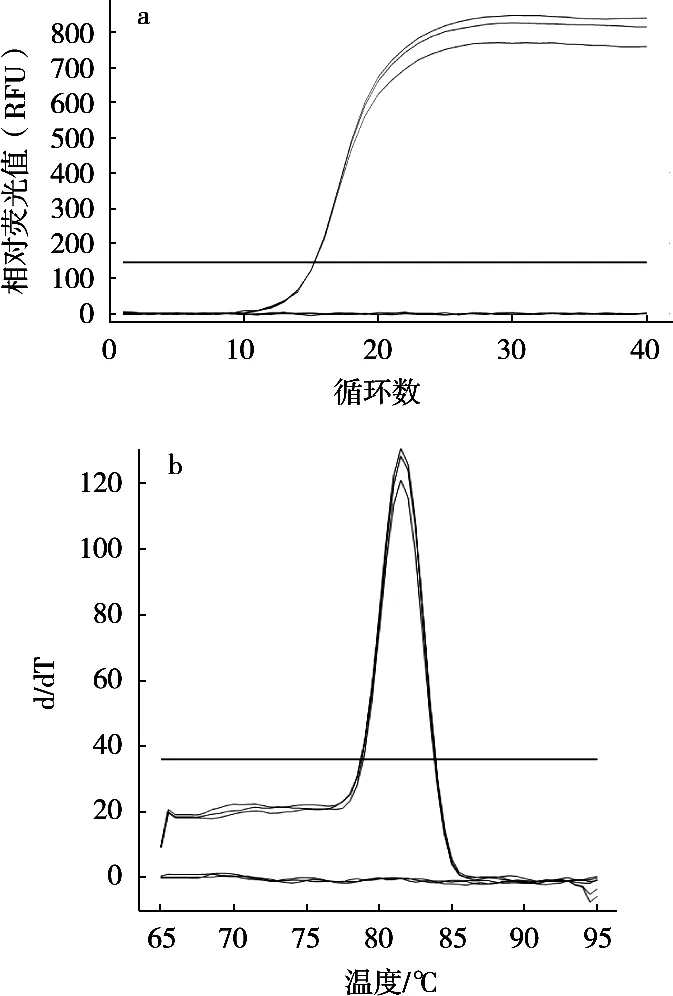
图1 qPCR方法检测沙门菌
2.2 特异性检测结果
采用优化的qPCR方法,以鼠伤寒沙门菌、大肠埃希菌O157:H7、金黄色葡萄球菌、单核细胞增生李斯特菌等7个菌株DNA为模板进行特异性分析,结果显示,除鼠伤寒沙门菌能产生明显的荧光扩增曲线,且呈现阳性结果,其余大肠埃希菌O157:H7等6个干扰菌株DNA及无菌水阴性对照均无明显荧光扩增曲线产生,均呈现阴性结果(图2)。试验表明所建立的qPCR方法具有良好的特异性。
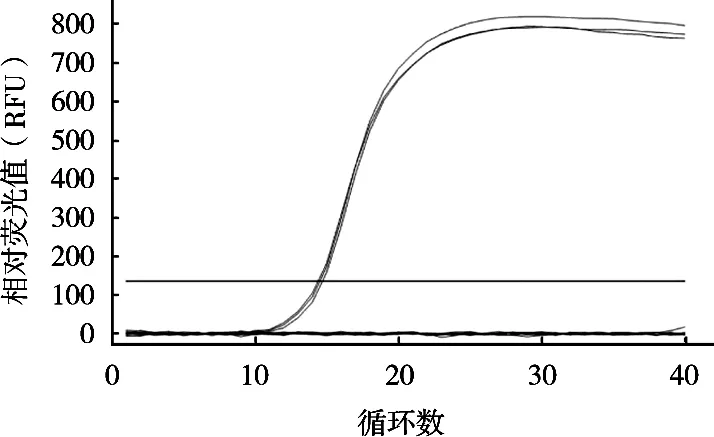
图2 qPCR方法检测沙门菌的特异性
2.3 灵敏度检测结果
使用7个不同浓度沙门菌DNA为模板进行扩增检测qPCR体系的灵敏度,检测结果显示,在每管25 μL qPCR反应体系中沙门菌DNA浓度为0.1~1×104pg/μL时均出现明显的荧光扩增曲线,3个平行样品间扩增曲线重复性好且Ct值均<35,而当沙门菌DNA浓度0.01 pg/μL时虽然也出现荧光扩增曲线,但3个平行样品间扩增曲线重复性较差且Ct值均>35(见图3)。因此,qPCR反应体系的检测灵敏度为0.1 pg/μL的沙门菌DNA。
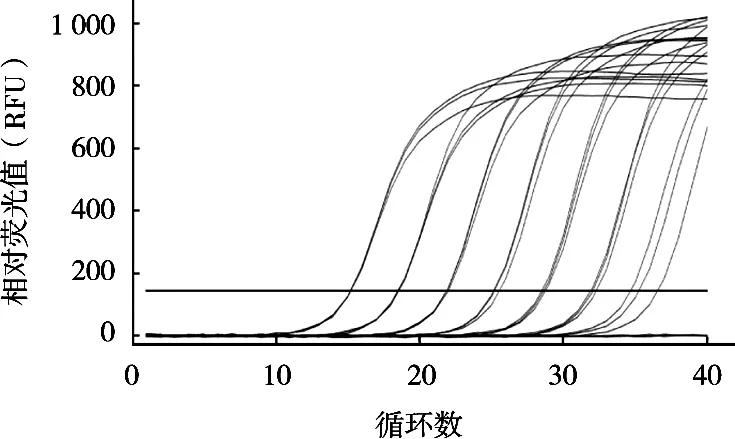
图3 qPCR方法检测沙门菌的灵敏度
2.4 标准曲线结果
将6个10倍梯度稀释的定量标准品在优化的沙门菌qPCR反应体系和条件下进行扩增,建立不同沙门菌浓度对数值与Ct值之间对应关系的定量标准曲线。结果显示,所制作的标准曲线在2~2×105CFU/g浓度之间的Ct值相差均匀,符合qPCR的Ct值与起始浓度对数值之间的线性关系(图4)。分别以Ct值为纵坐标,沙门菌浓度对数值为横坐标,得出起始浓度对数值与Ct值的线性方程:Y=-3.427 1X+32.08,斜率-3.427 1,截距32.08,相关系数R2为0.998(图5)。在对样品进行检测时,根据其Ct值和线性方程可以计算该样品沙门菌浓度。
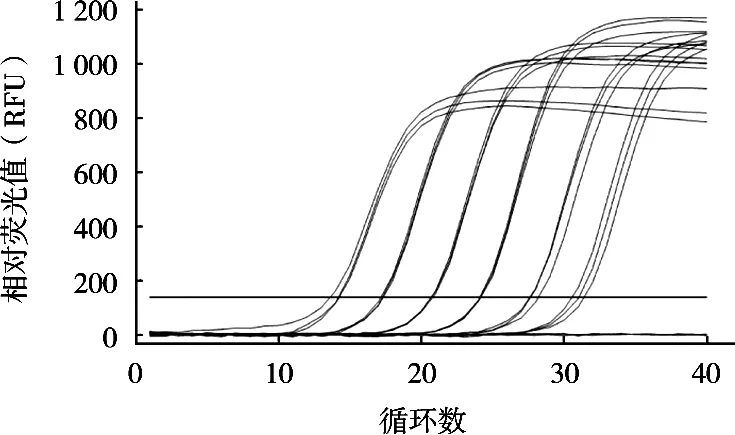
图4 不同浓度沙门菌qPCR扩增曲线
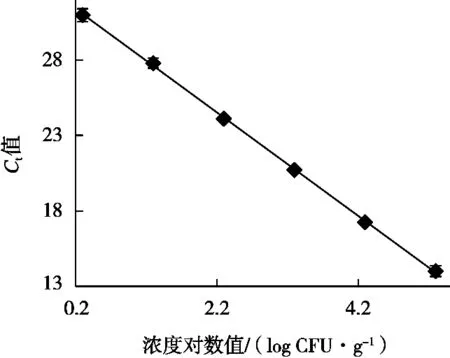
图5 沙门菌qPCR标准曲线
2.5 蔬菜栽培土壤中沙门菌污染对比检测结果
分别采用qPCR方法和GB 4789.4—2016方法对采自全省的35份栽培土壤样品中沙门菌污染情况进行分析,结果如表3所示。35份栽培土壤样品检测结果均显示为沙门菌污染阴性样品,2种方法检测结果一致,但qPCR方法在保证准确性的前提下,将检测时间缩短至6 h内,缩短了GB 4789.4—2016方法的检测时间,降低了检测强度,同时提高了检测效率,为大量栽培土壤样品中开展沙门菌污染检测提供可能。

表3 2种方法对比检测蔬菜栽培土壤沙门菌污染结果 单位:份
3 结论与讨论
蔬菜产地环境安全是防控蔬菜沙门菌污染的前提,而检测技术则是防控沙门菌污染的有力武器。采用GB 4789.4—2016《食品安全国家标准 食品微生物学检验 沙门氏菌检验》,由于检测时间长难以满足大规模检测需求且检测结果仅为定性分析,普通PCR方法虽然解决GB 4789.4—2016方法检测时间长的短板,但也不具备定量分析的能力。利用qPCR方法则兼具检测时长短和通量大的优点,更弥补GB 4789.4—2016方法和普通PCR方法不能定量检测的不足。qPCR方法包括探针法和嵌合荧光法,探针法由于探针引物设计要求高、合成费用贵等原因,导致探针法使用成本较高,而嵌合荧光法则可以使用普通PCR引物再辅以荧光染料如SYBR Green I,相对在引物设计上要求简单和使用成本上低廉,在qPCR中得到越来越多应用。
沙门菌侵袭蛋白基因是一类与沙门菌吸附和侵袭肠道上皮细胞相关的基因,包括invA~invE等多个基因,其中对invA基因的研究和应用最为广泛,以invA基因为靶基因的沙门菌qPCR方法在蛋糕、乳品、烤肉、新鲜农产品、鸡蛋和牛肉淋巴等中得到成功应用[21-23]。试验根据沙门invA基因序列设计特异性qPCR引物,建立一种基于SYBR Green I嵌合荧光法的蔬菜栽培土壤中沙门菌实时荧光定量检测方法,对沙门菌DNA的检测灵敏度可达0.1 pg/μL,所制作的qPCR扩增标准曲线在2~2×105CFU/g浓度之间有较好的线性关系,可满足对沙门菌进行准确的定量分析要求,且qPCR方法与GB 4789.4—2016方法具有相同的准确性,可应用于蔬菜栽培土壤中沙门菌的定量检测分析,对于有效防控蔬菜沙门菌污染风险保障蔬菜质量安全具有重要意义。
