香萱解郁方对血清剥夺诱导HT22细胞损伤模型的神经保护作用*
2023-07-07高圆媛沙中玮薛纯纯徐建李欧
高圆媛 沙中玮 薛纯纯 徐建 李欧
(上海中医药大学附属市中医医院,上海 200071)
海马神经元细胞在体外的存活取决于营养因子的存在和条件血清提供的去极化条件。从培养基中去除血清(Serum deprivation,SD)会导致延迟性神经元死亡,其特征是神经元凋亡[1]。目前,HT22细胞被认为是研究体外神经细胞死亡的良好模型[2]。细胞生长发育离不开生长因子等因素的影响,而血清剥夺是导致缺血缺氧的直接原因[3]。缺血缺氧所致脑组织及神经元损伤的机制复杂,因此探寻治疗脑缺血性疾病的有效疗法至关重要。香萱解郁方为上海市中医医院神志病科学科带头人徐建教授的临床经验方,常用于治疗神经退行性疾病,前期研究[4-5]发现该方能够提高大鼠外周血清中脑源性神经营养因子(BDNF)水平,改善海马突触结构及形态。本研究探讨香萱解郁方含药血清对体外缺血缺氧HT22细胞损伤模型的神经保护作用,以期为本方在临床中的应用提供实验依据。
1 材料与方法
1.1 实验动物与HT22细胞系 选取SPF级雄性SD大鼠30只,体质量190 g,购自上海杰思捷实验动物有限公司,实验动物许可证号:SCXK(沪)2018-0004,合格证号:20180004027603,饲养于上海市中医医院动物实验中心,自由饮水摄食,温度控制在24±2 ℃,相对湿度40%~50%。HT22细胞系为小鼠海马神经元细胞系,由上海圆创生物科技有限公司提供。该实验方案已通过上海市中医医院实验动物管理伦理安全委员会批准。
1.2 试验药物 香萱解郁方饮片由上海市中医医院中药房提供(组成:香附200619、萱草花DB43/1452-2018、砂仁200611、栀子20041305、合欢皮20051807、远志2020071401、肉桂 200703、广郁金 20071405、首乌藤 20200529-1、丹参 20061708、炙甘草 20200718-1)。将饮片共1310 g加入10倍的纯水中浸泡30 min,大火煮沸后继续文火煎煮40 min,过滤,倒出;药渣再加5倍纯水煮沸后文火煎煮30 min,后放入砂仁续煎10 min,过滤;将两次药液混匀,灌胃剂量按1 kg 大鼠灌胃10 mL 计算,中药量13.65 g/kg·d,浓缩至生药量浓度1.365 g/mL 的药汁,灌装灭菌,于4℃ 冰箱贮存备用,灌胃之前以温水隔加热。
1.3 主要仪器 CO2培养箱(上海敦石实业,3111);微型台式真空泵(上海凡茂生物,BGZ-70);倒置荧光显微镜(上海金甚生物,DMI3000B);干式恒温机(上海志行仪器,GL-150B);电热恒温培养箱(上海升意实业,GHP-9160);离心机(上海百翱杰生,L530R);台式高速冷冻离心机(上海力申科学仪器有限公司,Neofuge 15R);酶标仪(上海百翱杰生,Epoch 2);三恒多用电泳仪电源(上海凡茂生物,DYY-12);Mini ProGelTM蛋白制胶与电泳系统(Servicebio,BT-2);ChemiDoc XRS化学发光成像系统(上海伯乐,721BR07743);PCR仪(伯乐,CFX96)。
1.4 主要试剂 DMEM培养基(凯基生物,KGM 12800-500);胎牛血清(Servicebio,G8001-100ML);胰酶溶液-EDTA(hanks液,含酚红)(凯基生物,KGM25200);Penicillin-Streptomycin Solution,100X(生工,GA23FA0001);CCK8试剂盒(ZETA LIFE,K009-1000T);β-tubulin Ⅲ抗体(Abcam,ab18207);DAPI(博士德,AR1176);山羊抗兔IgG (Abcam,ab150077);BDNF抗体(Abcam,ab108319);抗兔IgG-HRP (CST,#7074),β-actin (CST,#4970)。引物合成(上海生工);RNA提取液 (Servicebio,G3013-100ML);逆转录试剂盒 (YEASEN, 11141ES10);PCR试剂盒(YEASEN,11198ES03)。
1.5 方法
1.5.1 含药血清制备 将SD大鼠随机分为对照组、中药组各15只。适应性喂养1周后,开始灌胃,对照组予以0.9%生理盐水,中药组予以香萱解郁方,两组均受到相同的灌胃刺激,而后提取生理盐水血清和中药血清对HT22细胞进行分组干预。灌胃前药液需水浴加热,避免刺激。灌胃前称重,按1 mL/100 g大鼠体质量灌胃,持续8 d,1次/日。灌胃结束后,禁食12 h,以减少胃内容物。第2 d腹腔注射舒泰50麻醉大鼠后腹主动脉取血后处死,冰上静置4 h,于4 ℃低温离心机3000 rpm离心15 min,将各组含药血清装于15 mL灭菌离心管,于56 ℃水浴锅中水浴30 min,0.22 μm微孔滤膜过滤除菌,分装于1.5 mL EP管,-80 ℃保存。
1.5.2 血清剥夺模型建立及分组 HT22细胞系培养在含有10%胎牛血清、80 U/mL青霉素、0.08 mg/mL链霉素的DMEM高糖完全培养基中,镜下细胞呈片状生长。首先,制备含药血清培养基,把含有10%胎牛血清完全培养基中的10%胎牛血清更换为上述制备的0.9%生理盐水血清和15%、20%浓度中药血清。其次,将体外培养的HT22细胞系随机分为:对照组、模型组和中药组,中药组又分为中药组A(含药血清15%浓度)与中药组B(含药血清20%浓度)。血清剥夺处理方法:首先,用含有10% 胎牛血清完全培养基培养细胞24 h,待细胞贴壁后,先用PBS溶液清洗2次,每次1~2 min, 充分去除血清影响,再用不含血清的DMEM高糖培养基剥夺12 h,建立血清剥夺模型。各组均血清剥夺12 h后,对照组用含0.9%生理盐水血清的DMEM高糖培养基培养,模型组继续用不含血清的DMEM高糖培养基培养,中药组A、中药组B分别使用含15%、20%浓度中药血清的DMEM高糖培养基培养,以上4组分别培养12、24、36 h后进行对照比较,通过细胞活性检测,确定后续试验中药组含药血清的最佳浓度。
1.5.3 CCK8法检测细胞活性 HT22小鼠海马神经元细胞以5×104/mL接种于96孔板,配置100 μL细胞悬液,在培养箱中(37 ℃,5%CO2条件下)培养24 h,剥夺处理12 h后,除模型组持续血清剥夺,对照组和中药组分别加入0.9%生理盐水血清、15%和20%中药含药血清后分别培养12、24、36 h,每组设6个复孔,于相应的时间点每孔中加入10 μL CCK溶液,于37℃培养箱内孵育2 h,用酶标仪测定450 nm处的吸光度(optical density,OD),并记录结果。细胞活力%=[(OD加药组)-(OD空白对照组)]/[(OD0加药物)-(OD空白对照组)]×100%。
1.5.4 免疫荧光染色法定位及鉴定 HT22小鼠海马神经元细胞以每孔1.5×105/mL铺于24孔板中,每孔接种200 μL,10%胎牛血清完全培养基培养24 h,24 h后各组改用无血清培养基饥饿12 h,除模型组,对照组、中药组每孔分别加入含生理盐水血清、15%中药含药血清200 μL,培养36 h。PBS冲洗,用4%多聚甲醛室温固定15 min后PBS冲洗5 min×2次。每孔加入500 ul 的0.5%TritonX-100 通透被膜,室温孵育10 min,PBS洗涤5 min×2次。用PBST(1% BSA、22.52 mg/mL甘氨酸)室温下封闭孵育30 min。室温下,用一抗Anti-β Ⅲ Tubulin抗体(1∶1000)4 ℃孵育过夜。PBS冲洗5 min×3次。滴加二抗(1∶1000)避光室温孵育1 h。PBS冲洗5 min×3次。DAPI(避光)孵育10 min,PBS冲洗。在荧光显微镜下观察HT22细胞核形态及β- 微管蛋白Ⅲ型定位表达,并拍照。
1.5.5 Western blot法检测BDNF蛋白表达 收集经各组细胞,加入 100 μL 含 0.01 mol /L PMSF 的 RIPA 裂解液,裂解细胞30 min,在冰上裂解,利用细胞刮收集细胞,转移至 1.5 mL EP 管中,在冰上操作,4 ℃ 条 件 12000 r/min 离心 30 min,收集上清,使用 BCA 蛋白定量试剂盒进行蛋白定量。每组取 20 μg上样,进行蛋白电泳,利用湿转移法将蛋白转移至PVDF 膜,用快速封闭液室温封闭1 h,加入Anti-BDNF antibody (1∶1000),在4 ℃冰箱孵育过夜, PBST洗涤杂交膜3次,每次8 min、8 min、8 min,加入 HRP 标记的山羊抗小鼠 IgG 二抗(1∶8000) ,HRP 标记的山羊抗兔 IgG(1:2000),室温孵育1 h, PBST 洗涤杂交膜3次,每次8 min,使用 ECL 试剂盒进行发光反应,Image J进行灰度分析,独立实验重复3次。
1.5.6 定量逆转录聚合酶链反应(RT-qPCR)检测BDNF mRNA的表达水平 使用RNA试剂盒提取各组细胞总RNA,测定RNA浓度,按照逆转录试剂盒说明书将RNA逆转录成cDNA,反转录1 μg,体系20 μL,条件为25 ℃ 5分钟,55 ℃ 15 min,85 ℃ 5 min。结束后,取出离心管,先将各引物按照说明书上的要求,使用DEPC水稀释至10 μM的浓度,配制反应体系。后进行RT-qPCR,体系20 μL,程序设置:预变性95 ℃、2 min、一个循环,变性95 ℃、10 s,退火60 ℃、30 s共40个循环。程序结束后进行数值的计算与分析。数据用2-△△CT方法进行分析[6]。引物序列,见表1。
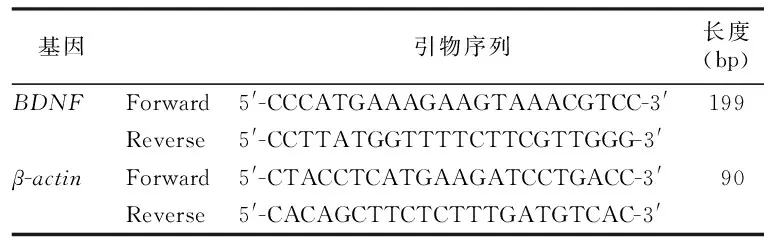
表1 各转录因子引物序列Table 1 Primer sequences of qPCR
2 结果
2.1 不同浓度香萱解郁方含药血清对HT22细胞活性的影响 经重复测量方差分析不同时间点各组细胞活力比较结果显示,在加药后12 h,对照组与模型组的细胞活力差异无统计学意义(P>0.05),中药组A、B的细胞活力明显高于对照组与模型组(P<0.001)。培养24 h,与对照组比较,模型组细胞活力明显下降(P<0.001),中药组A、B比较差异无统计学意义(P>0.05);中药组A、B均较模型组明显提高(P<0.001)。培养36 h,与对照组比较,模型组细胞活力组显著下降(P<0.001),中药组A细胞活力明显升高(P<0.05),中药组B差异无统计学意义(P>0.05);中药组A、B较模型组均明显提高(P<0.001)。当含药血清药物浓度达15%时,明显提高血清剥夺后细胞的存活率,故将该浓度作为后续实验中药组的药物浓度,见表2、图1。
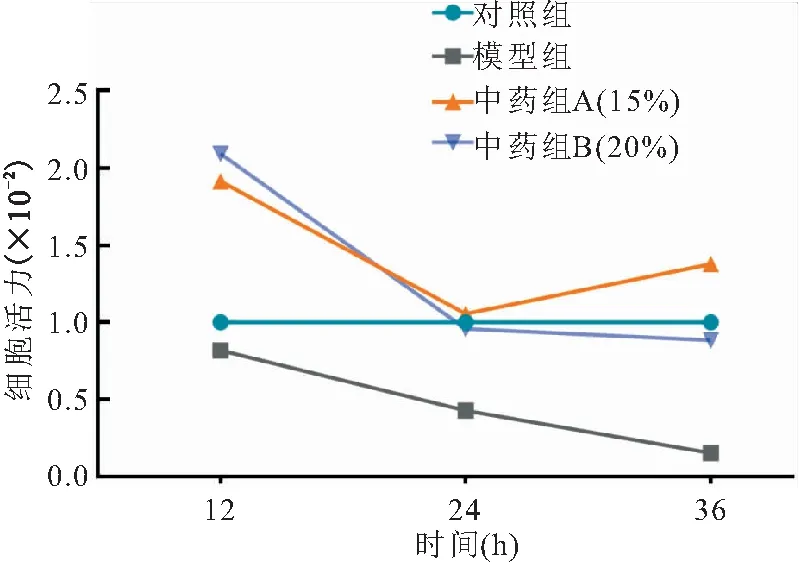
图1 不同时间点不同浓度含药血清对血清剥夺HT22细胞活力的影响Figure 1 Effects of cell viability of serum deprivation HT22 cells by serum containing different concentration of drugs at different times
表2 不同浓度含药血清对血清剥夺HT22细胞活力的影响Table 2 Effects of cell viability of serum deprivation HT22 cells by serum containing different concentration of drugs
2.2 免疫荧光染色法检测15%浓度中药含药血清作用后HT22细胞分化情况 通过DAPI和β-微管蛋白Ⅲ型的免疫染色倒置荧光显微镜下观察并定位细胞核及神经元形态。结果显示,与对照组比较,模型组少数神经元长出突起;与模型组比较,中药组HT22神经元轴突突起长度和分支增加,神经元特异性微管蛋白阳性表达明显增多。见图2。
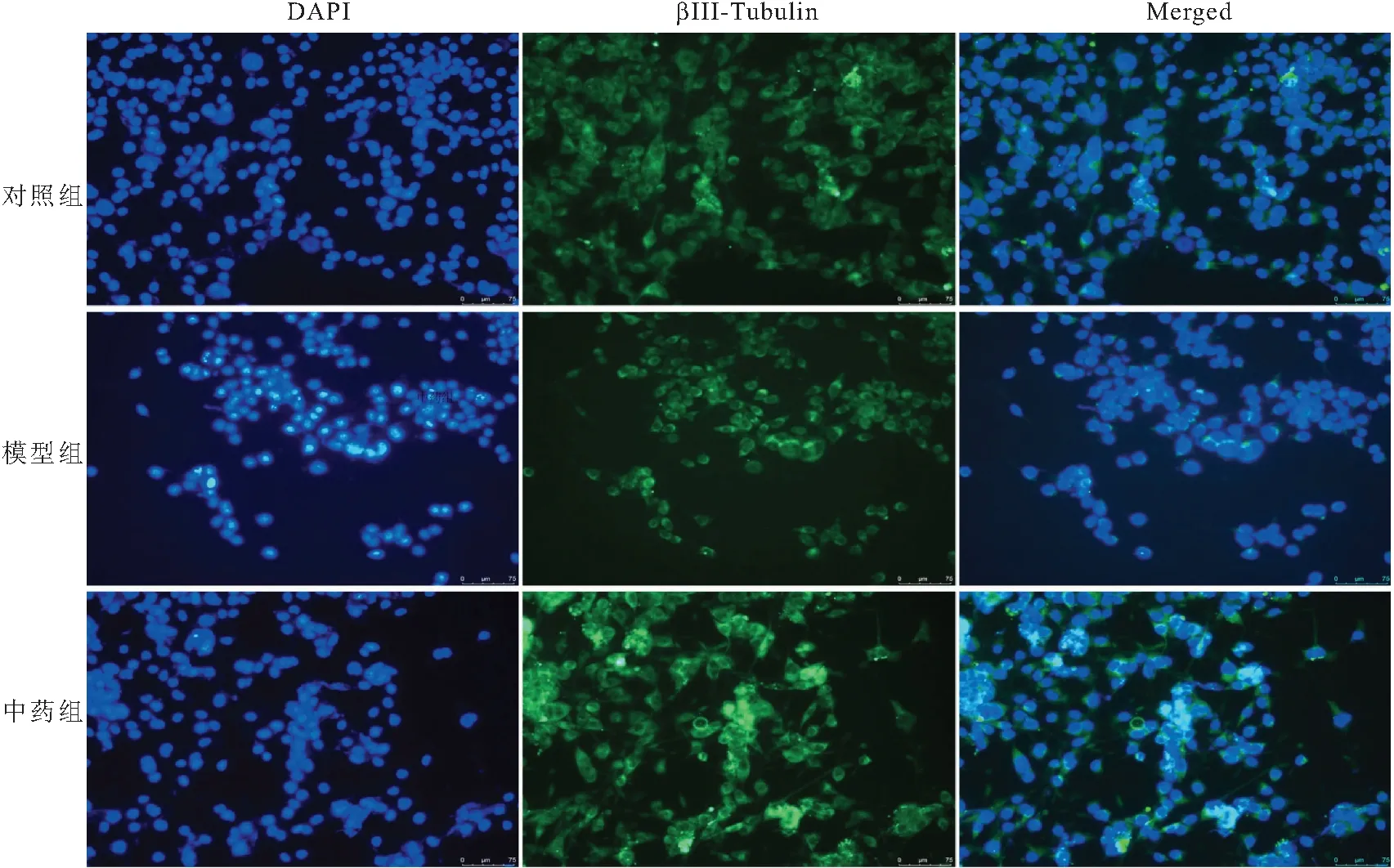
图2 各组HT22细胞血清剥夺后培养24 h后海马神经元的形态(200×)Figure 2 Cellular morphology of HT22 cells cultured in serum-containing medium for another 24 h after serum deprivation注:蓝色:DAPI染色标记细胞核;绿色:β-微管蛋白Ⅲ型标记的HT22细胞分化神经元细胞(比例尺=75 μm,见图右下角)。
2.3 15%浓度中药含药血清对HT22细胞BDNF蛋白及其mRNA表达的影响 Western blot法检测结果显示,与对照组比较,模型组BDNF表达下降(P<0.05);与模型组比较,中药组BDNF表达上升(P<0.05)。qPCR法检测结果显示,与对照组比较,模型组BDNF mRNA水平显著下调(P<0.001);与模型组比较,中药组BDNF mRNA水平显著上调(P<0.05)。见图3、表3。
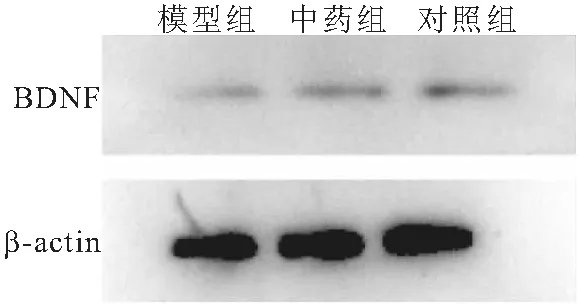
图3 各组HT22细胞中BDNF蛋白表达比较Figure 3 Comparison of BDNF protein expression in HT22 cells of each group
表3 各组HT22细胞中BDNF蛋白表达水平Table 3 Expression levels of BDNF in HT22 cells of each group
3 讨论
缺血缺氧诱导神经元细胞损伤,甚至坏死凋亡[8-9],是许多脑血管及神经退行性疾病的病理机制。神经元细胞是神经系统重要的组成部分,是高度极化的细胞,由胞体和突起组成,大脑功能依赖于大量神经元之间的相互作用[10]。神经突的丢失是神经元损伤的常见原因,是神经元疾病治疗的靶点[11]。尽量减少脑缺血后神经元树突棘和突触可塑性的损伤对维持神经元功能至关重要[12]。HT22细胞是由HT-4细胞系克隆而来的永生化小鼠海马细胞系,具有海马神经元的某些特性和易于培养的优点,目前广泛应用于神经退行性疾病的研究[13-15],在包括缺血缺氧环境下造成的神经退行性疾病或神经损伤模型中,海马神经元细胞被认为是增强神经保护、刺激神经可塑性、修复神经元丢失的关键细胞。有研究[16]表明,血清剥夺能够诱导海马HT22细胞呈凋亡和自噬特征的死亡。目前研究[17]表明中枢神经系统的神经损伤大多是不可逆转的,修复神经元细胞损伤非常困难,有效的治疗药物很少,中医药一直致力于对神经修复及保护作用的药物研究与开发。
“香萱解郁方”是上海市中医医院中医神志病学科带头人徐建教授临床治疗经验方,该方组成包括香附、萱草花、砂仁、栀子、合欢皮、远志、肉桂、广郁金、首乌藤、丹参、炙甘草。方中君药香附、萱草花、砂仁,香附主入肝经,辛香行气,善疏肝郁之结,味苦疏泄,平肝之横逆,故可以开胸中之郁结,理不顺之气,气行则郁消。明·李时珍《本草纲目》记载香附可“利三焦,解六郁;乃气病之总司,女科之主帅也”。萱草花,又名“忘忧草”,《本草纲目》云其可“宽胸膈 ,安五脏 ,安寐解郁 ,清热养心”,与香附共奏疏肝解郁之功。砂仁,气味芬芳,辛散温通,是调胃醒脾的要药。《本草纲目》中记载砂仁:“补肺醒脾,养胃益肾,理元气,通滞气,散寒饮胀痞,噎膈呕吐”。砂仁可温脾理气化湿,改善脾胃功能,调节气机升降,从而调理肝气,调节情绪。君药以花(萱草花)、果(砂仁)、根(香附)同用,合用安五脏,解诸郁,共奏疏肝醒脾,解表宣郁,疏利三焦之功。栀子、广郁金、丹参清热除烦,行气解郁,活血去瘀;远志、肉桂交通心肾,引火归元,共为臣药。佐以合欢皮、首乌藤养心安神,活血通络;炙甘草为使药,调和诸药。临床中该方加载治疗应用于睡眠障碍、血管性认知功能障碍及情绪障碍等疾病,具有一定的临床疗效。
本研究通过血清剥夺建立HT22细胞的缺血缺氧环境,应用CCK8检测血清剥夺后HT22细胞活力以及比较中药含药血清对其不同时间点的影响。结果表明,随着剥夺时间的延长,中药组和模型组细胞活力逐渐下降,剥夺24、36 h模型组细胞活力下降50%以下。不同时间点各组细胞活力比较结果显示,在加药后12 h,对照组与模型组的细胞活力无差异,中药组A、B的细胞活力明显高于对照组与模型组。培养24 h,与对照组比较,模型组细胞活力明显下降,中药组A、B无统计学意义;中药组A、B较模型组明显提高。培养36 h,与对照组比较,模型组细胞活力组显著下降,中药组A细胞活力明显升高,中药组B差异无统计学意义;中药组A、B较模型组明显提高。提示15%香萱解郁方含药血清能够明显提高血清剥夺后的细胞活力。
βⅢ-Tubulin蛋白是微管细胞骨架的一种重要蛋白,广泛应用于成熟神经元骨架细胞的标记,主要表达在神经元中,能够使神经元轴突形态可视化[13,18]。本研究通过免疫荧光染色法观察香萱解郁方对血清剥夺HT22细胞轴突及分化的影响,我们发现模型组少数神经元长出突起,中药组HT22神经元轴突突起长度和分支增加,中药含药血清对神经元突触可塑性的变化有待进一步的探究。以往研究[19-20]表明,BDNF在突触传递和神经元可塑性中起着多种作用。BDNF是一种调节突触连接、突触结构、神经递质释放和突触可塑性的神经营养素[21-22],具有神经保护作用,对于维持神经元存活和神经元结构至关重要,在促进神经突触生长和修饰细胞骨架结构方面发挥作用[23-24]。我们继续观察BDNF蛋白在HT22细胞缺血缺氧损伤中的表达发现,与对照组比较,模型组BDNF蛋白及其mRNA表达明显下降,中药组能够提高BDNF蛋白及其mRNA表达,提示香萱解郁方含药血清可能通过增加内源性BDNF含量调节神经元形态及轴突生长。
4 结论
血清剥夺能够诱导神经元损伤,初步验证香萱解郁方含药血清可能通过调节BDNF水平促进神经元轴突生长,增强神经元细胞活力,以达到对神经元损伤的保护及调节可塑性的作用,但该方的作用机制有待进一步深入研究。
