Shh-BMSCs 外泌体调控miR-133a对脂多糖诱导脊髓神经元细胞凋亡的影响*
2023-07-07贾祎佳陆廷盛陈啟鸰杨建文欧阳北平杨再松罗春山
贾祎佳 陆廷盛 陈啟鸰 杨建文 欧阳北平 杨再松 罗春山
(贵州省骨科医院脊柱科,贵州 贵阳 550014)
脊髓损伤(Spinal cord injury,SCI)是脊柱外科最常见的神经系统疾病,致残率高、破坏性强、恢复性差,极大损害患者自主生活能力,给其心理及家庭造成沉重负担[1-2]。神经元死亡及形态结构受损是引发SCI患者感觉、运动及自主神经功能障碍等的关键因素,缺血缺氧诱发的神经炎症是导致脊髓神经元形态损伤及死亡的主要病理机制,减轻神经元炎性损伤是SCI后神经功能修复的有效策略[3-4]。音猬因子(Sonic Hedgehog,Shh)是调控哺乳动物胚胎发育和器官形成的重要因子,在中枢神经系统损伤后具有神经保护作用,SCI后鞘内注射Shh可通过减轻神经炎症而促使神经功能恢复[5],骨髓间充质干细胞(Bone marrow stromal cells,BMSCs)具有潜在的神经保护特性,但直接进行移植存在难以存活、去分化、免疫排斥等风险,而其分泌的外泌体作为一种包含多种微小RNA、蛋白质、核酸等内容物的囊泡状小体,在细胞分化、存活、凋亡等过程中发挥着关键作用,BMSCs外泌体及过表达Shh的BMSCs外泌体均可减少神经元凋亡,对SCI具有保护作用,且后者作用更强[6]。miR-133a是组织细胞重要的炎性调节因子,其家族成员miR-133a-3p可靶向结合核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptor protein 3,NLRP3)阻断其控制的炎症信号,减轻对比剂肾病肾组织炎症损伤[7],过度表达miR-133a-3可减轻脂多糖(Lipopolysaccharide,LPS)诱导的小胶质细胞激活,降低促炎细胞因子表达[8],还可减少慢性缩窄性损伤大鼠炎症因子产生,抑制脊髓神经炎症,改善大鼠神经病理性疼痛[9],miR-133作为进化上保守的微小RNA,对其进行敲除时Shh表达广泛下调,激活Shh信号可挽救miR-133敲除导致的胚胎肌生成受损[10],推测miR-133a和Shh之间可能互相调控对方表达,Shh-BMSCs 外泌体可能通过调控miR-133a促使SCI后功能恢复。本文以LPS处理大鼠脊髓神经元构建SCI细胞模型,探讨Shh-BMSCs 外泌体调控miR-133a对LPS诱导脊髓神经元细胞凋亡的影响。
1 材料与方法
1.1 主要试剂与仪器 大鼠脊髓神经元细胞(货号CP-R144)、大鼠脊髓神经元细胞完全培养基(货号CM-R144)、大鼠BMSCs(货号CP-R131)、大鼠BMSCs完全培养基(货号CM-R131)-武汉普诺赛生命科技有限公司;CCK-8细胞活力检测试剂盒(货号G021-1-2)购自南京建成生物工程研究所有限公司;Shh过表达质粒、miR-133a inhibitor、miR-133a inhibitor阴性对照、miR-133a及U6、Shh、GAPDH引物、(FITC/PI双染法)Annexin V凋亡检测试剂盒(货号E606336-0100)、大鼠肿瘤坏死因子-α(TNF-α)酶联免疫吸附测定(Enzyme linked immunosorbent assay,ELISA)试剂盒(D731168)、大鼠白细胞介素-1β(IL-1β) ELISA试剂盒(货号D731007)、大鼠白细胞介素IL-10 ELISA试剂盒(货号D731011)、一步法反转录荧光定量试剂盒(货号B639277)购自上海生工生物工程股份有限公司;兔源抗大鼠Shh抗体(货号ab19897)、兔源抗大鼠ASC抗体(货号ab180799)、兔源抗大鼠caspase-1抗体(货号ab286125)、兔源抗大鼠GAPDH一抗(货号ab181602)、兔源抗大鼠β-tublin Ⅲ抗体(货号ab18207)、兔源抗大鼠NLRP3一抗(货号ab263899)购自美国Abcam公司;辣根过氧化物酶标记山羊抗兔IgG二抗(货号A0208)、免疫荧光染色试剂盒-抗兔Alexa Fluor 555(货号P0179)-购自上海碧云天生物技术有限公司等。全波长酶标仪购自杭州奥盛仪器有限公司-型号FlexA-200;流式细胞仪购自广州吉源生物科技有限公司-型号CyFlow Cube8;倒置荧光显微镜购自苏州阿尔法生物实验器材有限公司-型号MF-53N;实时荧光定量PCR仪购自美国美谷分子公司-型号ForeQuant F4/F6;基础电泳电源、小型垂直电泳槽、小型转印槽均购自广州道一科学技术有限公司-型号Basic 200、Di PES-5、Di TB-5;化学发光凝胶成像仪购自森西赛智科技有限公司-型号ChampChemi500等。
1.2 方法
1.2.1 Shh-BMSCs外泌体制备 快速解冻购买的大鼠BMSCs,以其完全培养基于含5%CO2、95%O2的37 ℃恒温培养箱中进行复苏培养,取传到第3代的BMSCs接种在培养皿中,使用脂质体2000并参照其说明书中步骤转染Shh过表达质粒,24 h后采用可去除外泌体的MEMα完全培养基(含10%胎牛血清)继续培养BMSCs,48 h后收集培养基进行超高速离心,分离得到Shh-BMSCs外泌体,将其置于镍网,于室温下干燥晾干[11]。
1.2.2 LPS和Shh-BMSCs外泌体最佳作用 浓度筛选快速解冻购买的大鼠脊髓神经元细胞,复苏培养并传代后接种在无菌96孔板中,每孔约含有1×104个细胞,培养24 h后分别以0、100、300、500、700、900 μg/mL的LPS处理[12],24 h后采用CCK-8细胞活力检测试剂盒检测各组细胞活力,公式为:细胞活力=(药物组吸光度-空白组吸光度)/(对照组吸光度-空白组吸光度)×100%,分析得出IC50值,筛选出LPS最佳作用浓度。以500 μg/mL的LPS处理传代的大鼠脊髓神经元细胞诱导建立SCI细胞模型,采用CCK-8细胞活力检测试剂盒检测经0、20、40、80、120、160 μg/mL的Shh-BMSCs外泌体处理[11]24 h后的各组细胞活力,具体方法与上相同。
1.2.3 细胞分组处理及标本收集 取传代的大鼠脊髓神经元细胞接种在无菌的24孔板中,于含5%CO2、95%O2的37 ℃恒温培养箱中培养,24 h后随机分为对照组、模型组、Shh-BMSCs外泌体组、miR-133a inhibitor组、miR-133a inhibitor阴性对照组、Shh-BMSCs外泌体+miR-133a inhibitor组,对照组不做处理,其余各组以500 μg/mL的LPS处理诱导建立SCI细胞模型,同时Shh-BMSCs外泌体组以80 μg/mL的Shh-BMSCs外泌体处理,miR-133a inhibitor组、miR-133a inhibitor阴性对照组采用脂质体2000并参照其说明书中步骤分别转染miR-133a inhibitor及其阴性对照,Shh-BMSCs外泌体+miR-133a inhibitor组以80 μg/mL的Shh-BMSCs外泌体处理同时转染miR-133a inhibitor,24 h收集各组细胞及其培养液。
1.2.4 检测各组细胞凋亡情况 取1.2.3中收集的各组细胞,以PBS清洗后重悬,混匀后计数,每组取约含5×105个细胞的细胞悬液离心,向细胞沉淀中加入Annexin V凋亡检测试剂盒中染液,避光条件下做FITC/PI双染处理,然后以PBS再次清洗细胞后通过流式细胞仪测定分析各组细胞凋亡率。
1.2.5 检测各组细胞轴突长度 取传代的大鼠脊髓神经元细胞接种在无菌的24孔板中(每孔中含有细胞载玻片),于含5%CO2、95%O2的37 ℃恒温培养箱中培养,24 h后按照1.2.3中方法进行分组处理24 h,以PBS清洗细胞后分别加入5%牛血清白蛋白、兔源抗大鼠β-tublin Ⅲ抗体溶液进行孵育,以PBS漂洗后加入Alexa Fluor 555标记的抗兔二抗孵育做免疫荧光染色,以PBS再次漂洗后,取出各组细胞爬片滴加抗荧光淬灭剂后封片,参照免疫荧光染色试剂盒说明指导于荧光显微镜下观察,神经元呈现红色,任选3个视野拍照,使用Image J软件中的Neuron J插件对图像中轴突长度进行定量分析。
1.2.6 测定各组细胞TNF-α、IL-1β、IL-10释放水平 取1.2.3中收集的各组细胞培养液,以1000 r/min的转速离心5 min,采用ELISA法检测其中TNF-α、IL-1 β和IL-10水平,具体步骤参照各自ELISA试剂盒说明书中方法进行。
1.2.7 测定各组细胞miR-133a和Shh mRNA表达 取1.2.3中收集的各组细胞,采用Trizol试剂并参照其说明指导提取出各组总RNA,然后采用一步法反转录荧光定量试剂盒中试剂分别加入各基因引物及总RNA配制反应体系,配制方法及反应条件设置参照其试剂盒说明书指导进行,miR-133a选用U6做内参,Shh选用GAPDH做内参,实验所得Ct值采用2-ΔΔCt算法做分析得出miR-133a和Shh mRNA表达,引物序列如下:miR-133a上游引物:5′-CTCGAGCT CAAGTAGGGATCCAGCATTGGTATGATAATT-3′,下游引物:5′-AGCGCTGCTCGAGGCAAGCTTT TATTTGATTATAATCAC-3′;GAPDH上游引物:5′-AGGCTGAGAACGGGAAGC-3′,下游引物:5′-CC ATGGTGGTGAAGACGC-3′;Shh上游引物:5′-AA AAGCTGACCCCTTTAGCC-3′,下游引物:5′-GAT GTCGGGGTTGTAATTGC-3′;U6上游引物:5′-GA CACGCAAATTCGTGAAGCG-3′,下游引物:5′-TC CAGTGCAGGGTCCGAG-3′。
1.2.8 检测各组细胞Shh及NLRP3炎性通路蛋白水平 取1.2.3中收集的各组细胞,采用RIPA裂解液并参照其说明指导提取出各组总蛋白,然后采用改良型BCA蛋白浓度测定试剂盒测量其浓度,具体方法参照其试剂盒说明书指导进行,根据测量结果每组取20 μg总蛋白沸水浴变性、120V恒压跑电泳、40mA稳流湿转,获得按分子量大小分离开的蛋白承载在硝酸纤维膜上,将GAPDH、Shh、NLRP3、ASC、caspase-1蛋白按照其分子量从膜上裁下,分别孵育3%牛血清白蛋白、均稀释2000倍的一抗、稀释1000倍的二抗,封闭后进行抗原抗体反应,滴加化学发光试剂显色蛋白条带,采集其图像后使用Image J软件对其灰度进行定量,最后统计后得出各蛋白相对表达。
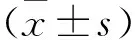
2 结果
2.1 LPS和Shh-BMSCs外泌体作用浓度确定 不同浓度LPS均可降低脊髓神经元细胞活力(见图1)。IC50值为(507.76±5.23) μg/mL,选择接近IC50的500 μg/mL LPS处理脊髓神经元细胞进行后续实验。
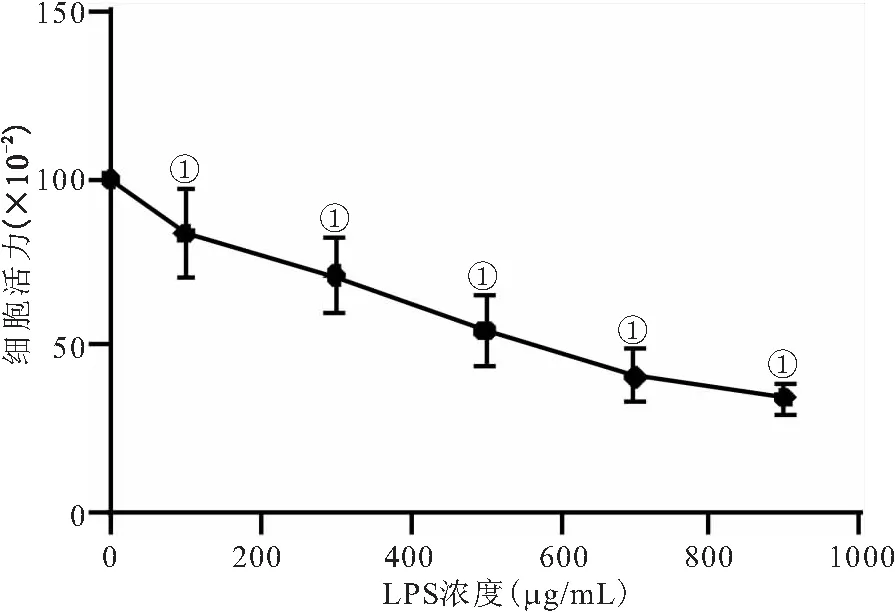
图1 不同浓度LPS对脊髓神经元细胞活力的影响Figure 1 Effect of different concentrations of LPS on the activity of spinal cord neurons注:与0 μg/mL LPS相比,①P<0.05。
不同浓度Shh-BMSCs外泌体均可提升LPS诱导脊髓神经元细胞活力,在一定浓度范围内,随Shh-BMSCs外泌体浓度升高而作用增强,在浓度为80 μg/mL时,脊髓神经元细胞活力进入平台期,Shh-BMSCs外泌体对其的提升作用不再增强,因此选择80 μg/mL Shh-BMSCs外泌体处理LPS诱导脊髓神经元细胞进行后续实验。见图2。
图2 不同浓度Shh-BMSCs外泌体对LPS诱导脊髓神经元细胞活力的影响Figure 2 Effects of different concentrations of Shh BMSCs exosomes on the activity of spinal cord neurons induced by LPS注:与0 μg/mL Shh-BMSCs外泌体相比,①P<0.05。
2.2 Shh-BMSCs外泌体对LPS诱导脊髓神经元细胞凋亡的影响 与对照组比较,模型组脊髓神经元细胞凋亡率明显升高(P<0.05)。与模型组比较,Shh-BMSCs外泌体组脊髓神经元细胞凋亡率降低(P<0.05);miR-133a inhibitor组脊髓神经元细胞凋亡率升高(P<0.05);miR-133a inhibitor阴性对照组脊髓神经元细胞凋亡率无明显变化(P>0.05)。与Shh-BMSCs外泌体组比较,Shh-BMSCs外泌体+miR-133a inhibitor组脊髓神经元细胞凋亡率升高(P<0.05)。见图3、表1。
表1 各组脊髓神经元细胞凋亡率和细胞轴突长度Table1 Apoptosis rate andLength of axons of spinal cord neurons in each group

图3 流式细胞实验检测各组脊髓神经元凋亡情况Figure 3 Detection of apoptosis of spinal cord neurons in each group by flow cytometry
2.3 Shh-BMSCs外泌体对LPS诱导脊髓神经元细胞轴突长度的影响 与对照组比较,模型组脊髓神经元细胞轴突长度明显降低(P<0.05)。与模型组比较,Shh-BMSCs外泌体组脊髓神经元细胞轴突长度升高(P<0.05);miR-133a inhibitor组脊髓神经元细胞轴突长度降低(P<0.05);miR-133a inhibitor阴性对照组脊髓神经元细胞轴突长度无明显变化(P>0.05)。与Shh-BMSCs外泌体组比较,Shh-BMSCs外泌体+miR-133a inhibitor组脊髓神经元细胞轴突长度降低(P<0.05)。见图4、表1。
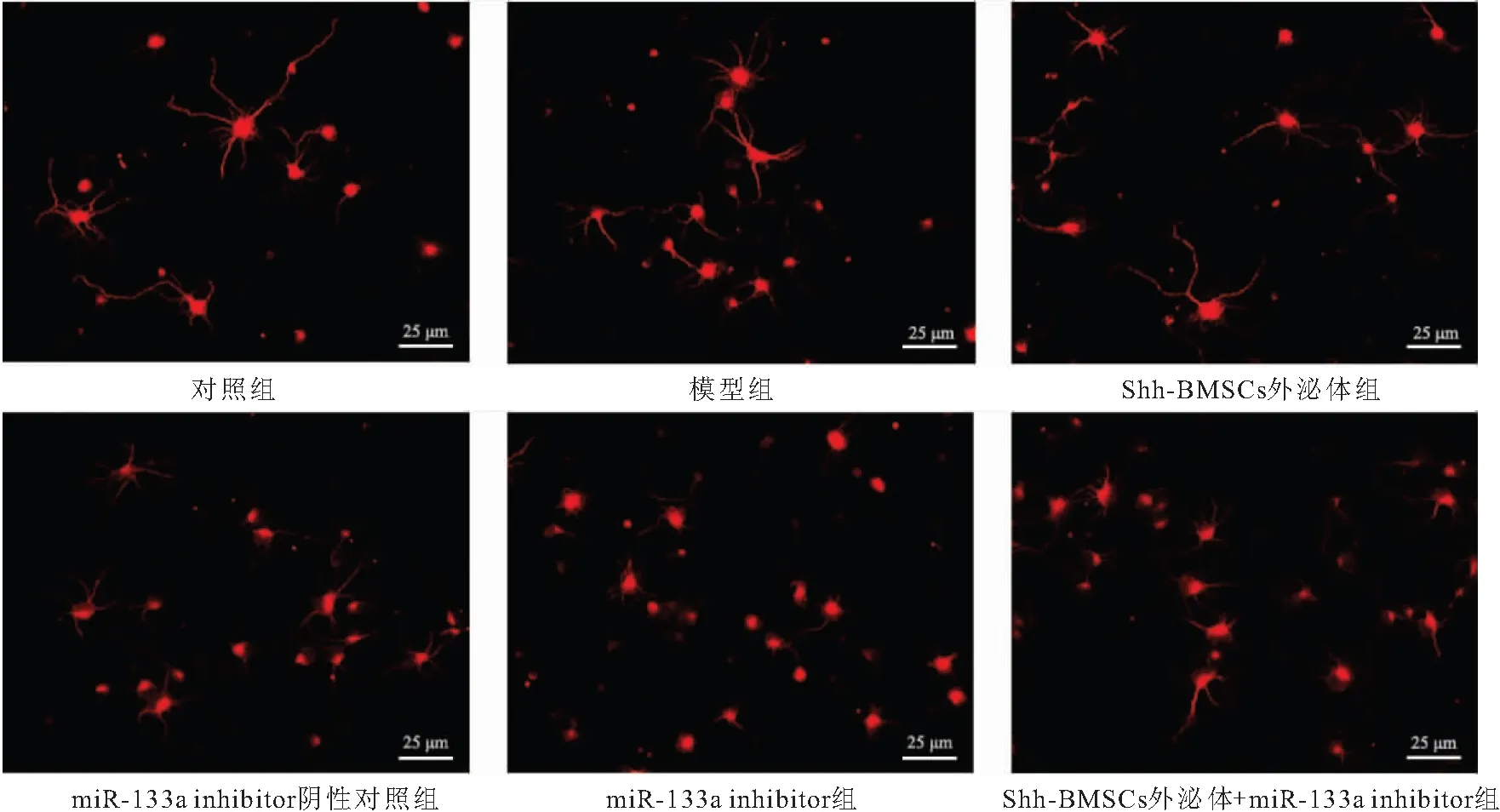
图4 免疫荧光染色β-tublin Ⅲ检测各组脊髓神经元细胞轴突(1000×)Figure 4 Immunofluorescence staining β-Tublin Ⅲ to detect axons of spinal cord neurons in each group
2.4 Shh-BMSCs外泌体对LPS诱导脊髓神经元细胞炎症因子TNF-α、IL-1 β和IL-10释放水平的影响 与对照组比较,模型组脊髓神经元细胞TNF-α、IL-1 β释放水平明显升高(均P<0.05),IL-10释放水平明显降低(P<0.05)。与模型组比较,Shh-BMSCs外泌体组脊髓神经元细胞TNF-α、IL-1 β释放水平降低(均P<0.05),IL-10释放水平升高(P<0.05);miR-133a inhibitor组脊髓神经元细胞TNF-α、IL-1 β释放水平升高(均P<0.05),IL-10释放水平降低(P<0.05);miR-133a inhibitor阴性对照组脊髓神经元细胞TNF-α、IL-1 β和IL-10释放水平均无明显变化(均P>0.05)。与Shh-BMSCs外泌体组比较,Shh-BMSCs外泌体+miR-133a inhibitor组脊髓神经元细胞TNF-α、IL-1 β释放水平升高(P<0.05),IL-10释放水平降低(均P<0.05)。见表2。
表2 脊髓神经元TNF-α、IL-1β和IL-10释放水平Table 2 TNF-α, IL-1β and IL-10 release levels of spinal cord neurons in each group
2.5 Shh-BMSCs外泌体对LPS诱导脊髓神经元细胞miR-133a和Shh mRNA表达的影响 与对照组比较,模型组脊髓神经元细胞miR-133a和Shh mRNA表达明显降低(P<0.05)。与模型组比较,Shh-BMSCs外泌体组脊髓神经元细胞miR-133a和Shh mRNA表达升高(P<0.05);miR-133a inhibitor组脊髓神经元细胞miR-133a和Shh mRNA表达降低(P<0.05);miR-133a inhibitor阴性对照组脊髓神经元细胞miR-133a和Shh mRNA表达均无明显变化(P>0.05)。与Shh-BMSCs外泌体组比较,Shh-BMSCs外泌体+miR-133a inhibitor组脊髓神经元细胞miR-133a和Shh mRNA表达降低(P<0.05)。见图5。
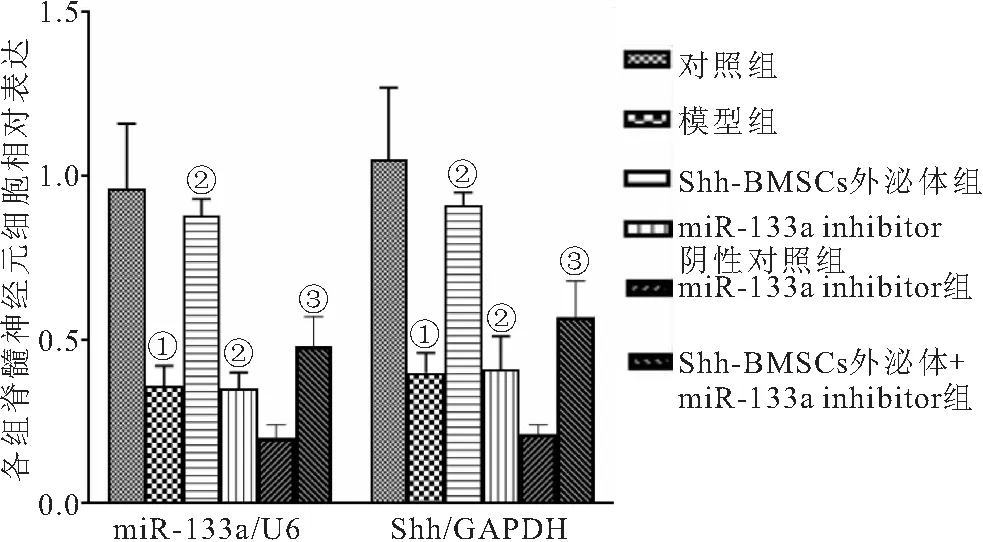
图5 各组脊髓神经元细胞miR-133a和Shh mRNA相对表达Figure 5 Relative expression of miR-133a and Shh mRNA in spinal cord neurons of each group注:与对照组相比,①P<0.05;与模型组相比,②P<0.05;与Shh-BMSCs外泌体组相比,③P<0.05。
2.6 Shh-BMSCs外泌体对LPS诱导脊髓神经元细胞Shh及NLRP3炎性信号相关蛋白表达的影响 与对照组比较,模型组脊髓神经元细胞Shh蛋白表达明显降低(P<0.05),NLRP3、ASC、caspase-1蛋白表达明显升高(P<0.05)。与模型组、Shh-BMSCs外泌体+miR-133a inhibitor组分别比较,Shh-BMSCs外泌体组脊髓神经元细胞Shh蛋白表达升高(P<0.05),NLRP3、ASC、caspase-1蛋白表达降低(P<0.05);miR-133a inhibitor组脊髓神经元细胞Shh蛋白表达降低(P<0.05),NLRP3、ASC、caspase-1蛋白表达升高(P<0.05);miR-133a inhibitor阴性对照组脊髓神经元细胞Shh、NLRP3、ASC、caspase-1蛋白表达均无明显变化(P>0.05)。与Shh-BMSCs外泌体组比较,Shh-BMSCs外泌体+miR-133a inhibitor组脊髓神经元细胞Shh蛋白表达降低(P<0.05),NLRP3、ASC、caspase-1蛋白表达升高(P<0.05)。见图6、表3。
表3 各组脊髓神经元细胞Shh及NLRP3炎性信号相关蛋白相对表达Table 3 Relative expression of Shh and NLRP3 inflammatory signal related protein in spinal cord neurons of each group
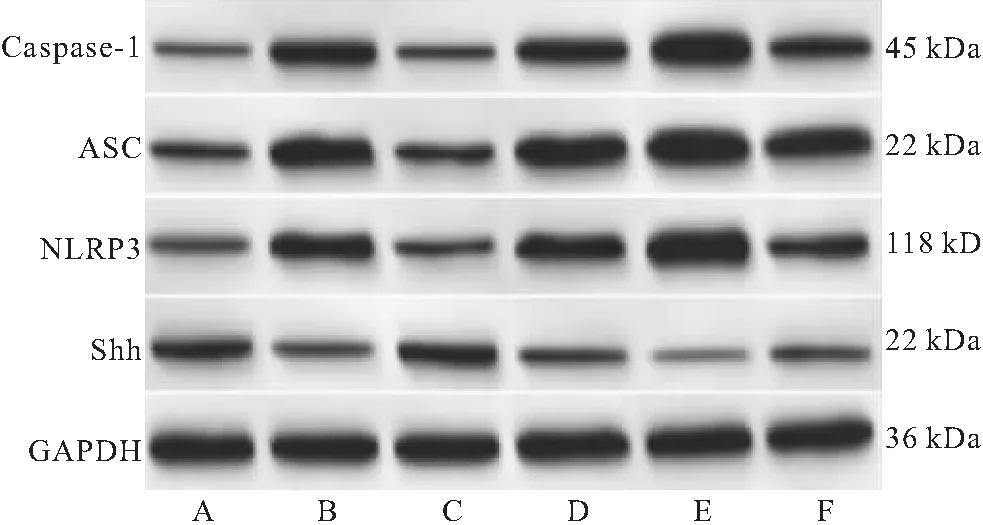
图6 免疫印迹实验检测各组脊髓神经元细胞Shh及NLRP3炎性信号相关蛋白表达Figure 6 Expression of Shh and NLRP3 inflammatory signal related protein in spinal cord neurons of each group detected by Western blot注:A.对照组;B.模型组;C.Shh-BMSCs外泌体组;D.miR-133a inhibitor阴性对照组;E.miR-133a inhibitor阴性对照组;F.Shh-BMSCs外泌体+miR-133a inhibitor组。
3 讨论
SCI其临床主要以外科手术、物理治疗、药物治疗等为主,还发展了基因治疗、细胞移植治疗等新型治疗手法,但患者神经功能的恢复并不理想,截至目前还没有公认有效的治疗手段,其最大的障碍在于神经元的死亡和受损形态难以修复,因而积极探索改善神经元凋亡和形态功能的策略对于SCI患者神经功能的修复意义重大[13-14]。炎症是造成SCI后神经元形态损伤和变性死亡的主要原因[3-4],因此本文以LPS处理大鼠脊髓神经元构建SCI细胞模型,结果显示,以LPS处理大鼠脊髓神经元细胞,可明显降低其轴突长度及IL-10释放水平,升高其凋亡率、TNF-α与IL-1 β释放水平及NLRP3、ASC、caspase-1蛋白表达,表明LPS可诱导神经元促炎因子TNF-α、IL-1 β过量表达释放,减少抗炎因子IL-10表达释放,激活NLRP3炎性信号,造成神经元炎症损伤,导致其轴突受损变短,细胞大量凋亡,揭示SCI细胞模型构建成功。
研究[15]显示进行抗炎治疗可增加SCI后神经元的数量并改善其形态,修复SCI大鼠运动功能,Shh可调控炎症介导的中枢神经系统损伤过程,Shh可抑制炎症,显著减少SCI大鼠神经元凋亡,进而修复SCI后神经功能[5,16]。BMSCs分泌的外泌体可显著增加SCI模型大鼠脊髓中Shh表达,修复脊髓神经损伤,且BMSCs外泌体过表达Shh时对SCI修复效果更好[6],而在Shh沉默的大鼠中,BMSCs外泌体在SCI修复中基本完全无效[17]。本文研究结果表明,Shh-BMSCs外泌体可上调脊髓神经元中Shh表达,促进抗炎因子表达,减少促炎因子产生,抑制NLRP3炎性信号激活,减轻神经元炎症损伤,修复神经元轴突形态,缓解LPS诱导的脊髓神经元细胞凋亡,揭示Shh-BMSCs外泌体具有明显的神经保护作用。
miR-133a作为重要的炎性调节因子,可通过靶向下调NLRP3表达,抑制其炎性小体生成及其介导的促炎反应和细胞热下垂,降低炎性因子表达,减轻炎症性细胞死亡,缓解肾组织、主动脉及心肌炎症损伤[7,18-19]。研究[10]表明miR-133敲除时Shh表达广泛下调,激活Shh信号可逆转敲除miR-133导致的细胞增殖、外基质沉积和上皮化受损,由此可知miR-133a和Shh之间可能对对方表达有互相调控作用,但Shh-BMSCs 外泌体是否可调控miR-133a的表达,进而介导LPS诱导的大鼠脊髓神经元凋亡,目前还不清楚。本研究结果显示,Shh-BMSCs外泌体处理LPS诱导的大鼠脊髓神经元后,神经元中miR-133a表达升高,以miR-133a inhibitor处理LPS诱导的大鼠脊髓神经元可加重神经元炎性损伤,进一步增强其凋亡,表明miR-133a介导Shh-BMSCs外泌体对LPS诱导的脊髓神经元细胞凋亡的抑制过程;以Shh-BMSCs外泌体和miR-133a inhibitor联合处理LPS诱导的脊髓神经元细胞,相比Shh-BMSCs外泌体单独处理,可降低神经元细胞轴突长度、IL-10释放水平、Shh mRNA及蛋白表达,升高其凋亡率及NLRP3、ASC、caspase-1蛋白表达,表明下调miR-133a表达可减弱Shh-BMSCs外泌体对NLRP3炎性信号的下调及炎症反应的抑制,拮抗其对神经元形态的改善及凋亡的减轻作用,最终逆转Shh-BMSCs外泌体对LPS诱导大鼠脊髓神经元的保护作用,揭示Shh-BMSCs 外泌体减轻LPS诱导脊髓神经元细胞凋亡是通过上调miR-133a实现的。
4 结论
Shh-BMSCs外泌体可通过促进miR-133a表达而阻断NLRP3炎性途径传导,进而降低LPS诱导的促炎因子表达释放,减轻脊髓神经元细胞炎症,阻止其发生凋亡,改善其轴突结构损伤,最终起到明显神经保护作用。实验结果为SCI后神经元损伤修复提供了新的手法选择,有利于SCI患者神经功能恢复方法的改进与发展。
