植物激素对茶树春季新梢生长发育的调控作用研究
2023-07-03李聪聪王浩乾叶玙璠陈瑶任恒泽李宇腾郝心愿王新超曹红利岳川
李聪聪,王浩乾,叶玙璠,陈瑶,任恒泽,李宇腾,郝心愿*,王新超,曹红利,岳川*
1. 中国农业科学院茶叶研究所/国家茶树改良中心/农业农村部特种经济动植物生物学与遗传育种重点实验室,浙江 杭州 310008;2. 福建农林大学园艺学院,福建 福州 350002;3. 西南大学食品科学学院,重庆 400715
茶树(Camellia sinensis)是一种叶用经济作物,春季萌发的新梢内含物丰富,是名优茶最主要的加工原料。新梢发育过程受植株的内外因素影响,既关乎茶叶的产量和品质,也关乎茶叶的采收周期。目前有关茶叶新梢发育调控机理研究鲜有报道,植物激素在新梢发育中的作用和相关基因鉴定还有待深入研究。植物激素是植物体内产生的一些微量且在自身生理过程中发挥重要调节作用的有机化合物,分别或协同调控植物的生长发育和分化[1]。激素在植物生长发育的不同阶段发挥不同的作用,参与的主要生理过程包括种子的休眠和萌发[2]、果实的生长发育[3]以及植物的衰老[4]等。通过对低芽表型陆地棉和高芽表型突变体陆地棉腋芽进行转录组测序发现,大量的差异表达基因与激素代谢和激素信号转导有关[5],表明内源激素是棉花腋芽生长的主要因素。研究表明,赤霉素(GA)[6]、脱落酸(ABA)[7]和吲哚-3-乙酸(IAA)[8]是参与腋芽生长调控的主要激素。GA 在多年生木本植物芽的萌发生长方面起着积极的调节作用;麻风树、木瓜树及其他一些植物进行GA 处理后,能够显著促进其侧芽的生长[9]。缺乏ABA 生物合成基因的拟南芥突变体表现出分枝增加表型,表明ABA 是拟南芥腋芽生长的负调节剂[10],同样对ABA 敏感性降低的转基因杨树也表现出增强的分枝表型[11]。IAA 会抑制腋芽的激活[8],是维持顶端优势的主要信号[12]。对完全不分枝的突变体杉木研究发现,在芽休眠解除期间,IAA 在突变体的顶端茎中积累,并通过细胞分裂素信号通路来增加ABA 的含量进而抑制腋芽的生长[13]。在茶树新梢研究中发现,对茶树外源喷施GA 和IAA 后,新梢生长量增加[14-15],内源ABA 在茶树新梢生长的过程中含量逐渐下降[14]。虽然ABA、GA 和IAA在茶树新梢生长中的作用得到了初步证实,但是激素调控茶芽发育的分子机理仍不清楚。为明确不同激素影响茶树新梢生长发育的主要通路和关键基因,本研究以参与植物生长发育调控的3 种主要激素ABA、GA3和IAA 为研究对象,在茶树越冬芽萌动期进行外源激素喷施后,检测分析处理新梢的表型变化和表达谱差异,拟揭示3 种激素在茶树新梢发育中的主要作用和调控途径,结合表达模式分析,深入挖掘参与新梢发育调控的关键基因,为阐明激素调控茶树新梢发育的分子机制提供理论依据。
1 材料与方法
试验于2022 年3 月在中国农业科学院茶叶研究所国家茶树改良中心进行。
1.1 试验材料
选用龙井43 为供试品种,选择栽培管理等同、长势一致的自然越冬5 年生盆栽苗。
1.2 试验处理
在越冬茶树萌动期(2022 年3 月10 日),选用ABA(Simga A1049,美国)、GA3(BBI Life Sciences,德国)和 IAA(BBI Life Sciences,德国)3 种激素,分别称取一定质量的ABA、GA3、IAA 分别溶于95%的酒精,再用纯净水定容,终浓度为100 μmol·L-1,对盆栽茶树进行喷施处理,以纯净水为对照,处理当日早中晚喷施3 次,每次以液珠滴下为准。于处理后7 d 取茶树腋芽用于转录组分析,每个处理设3 个生物学重复,所取样品放入液氮速冻后-80 ℃保存。在处理后第7 天、第14天、第21 天时拍照鉴定表型并记录。
1.3 总RNA 的提取
总RNA 的提取采用多糖多酚植物总RNA提取试剂盒(TIANGEN,China),用超微量分光光度计(Nanodrop 2000c)检测RNA 的浓度,利用Agilent 5400 片段分析仪一同来检测RNA 的完整性。
1.4 转录组建库及测序分析
样品送北京诺禾致源生物信息科技有限公司进行建库测序。建库使用 NEBNext®Ultra™ RNA Library Prep Kit for Illumina®试剂盒,使用Qubit2.0 Fluorometer 和Agilent 2100 bioanalyzer 进行构建文库质量检测,Illumina NovaSeq 6000 平台测序。经过原始数据过滤、测序错误率检查、GC 含量分布检查,获得高质量的序列数据(Clean reads)。
利用HISAT2 软件将Clean reads 与参考基因组(茶树龙井43 基因组)[16]进行比对,获取Reads 在参考基因组上的定位信息。使用FeatureCounts v. 1.5.0-p3 计算每千个碱基的转录每百万映射读取的 fragments(FPKM值)。采用 DESeq2 来筛选差异表达基因(DEGs),差异基因分析首先对原始的readcount 进行标准化(Normalization),然后通过统计学模型进行假设检验概率(P-value)的计算,最后进行多重假设检验校正(BH),得到FDR 值(错误发现率)。差异基因的筛选条件为P-value≤0.05 且|log 2fold change|≥0。采用 clusterProfiler 软件对差异基因集进行GO 功能富集分析,KEGG 通路富集分析。
1.5 基因表达检测
为验证转录组数据的可靠性,对部分表达差异基因进行基因表达水平验证,通过NCBI(https://www.ncbi.nlm.nih.gov/tools/primer-bl ast)设计qRT-PCR 引物(表1)并用qRT-PCR和琼脂糖凝胶电泳检验引物设计的特异性。以茶树为CsPTB作为内参基因[17],荧光定量反应体系SYBR Mix(Takara)5.0 µL、cDNA 2 µL、上下游引物(10 µmol·L-1)各 1 µL,加水至终体积10 µL。每个样品包含3 个生物学重复,2 个技术重复。充分混匀后进行短暂离心,于LightCycler 480Ⅱ实时荧光定量PCR 仪上进行PCR 扩增,反应程序:95 ℃预变性10 min;95 ℃变性10 s,60 ℃退火15 s,72 ℃延伸15 s,循环45 次。基因相对表达量采用方法计算。

表1 荧光定量PCR 引物设计序列Table 1 Primer sequences of candidate genes used for real-time fluorescence quantitative PCR
1.6 数据分析及作图
使用Photoshop 进行新梢表型图的排版和标注,Excel 进行数据处理及显著性分析(t-test检验),NovoMagic 数据分析云平台进行GO和KEGG 的图片制作,Prism 6.0(GraphPad,美国)绘制基因表达图。
2 结果与分析
2.1 3 种激素处理对茶树新梢发育的表型影响
为探究 3 种激素对茶树新梢生长发育的影响,对处于萌动期的茶树进行外源喷施ABA、GA3和IAA 处理并检测腋芽的长度,结果如图1 和图2 所示。外源ABA 处理抑制新梢萌发生长,与对照组相比,外源ABA 处理3 周内均可抑制茶树新梢萌发生长,且抑制效果在处理第1 周时最显著(图1B,图2);GA3和IAA 处理对新梢萌发生长具有促进作用,外源GA3处理后3 周内均可促进茶树新梢的生长,其中,前两周内芽长都具有极显著差异水平;外源IAA 处理后第2 周芽长极显著伸长(图1C,图2)。

图1 激素处理的芽萌发表型Fig. 1 The phenotype of sprouting buds after hormone treatments

图2 激素处理后芽的长度Fig. 2 Bud length after hormone treatments
2.2 转录组数据分析
利用Illumina NovaSeq 6000 测序平台对已经构建好的12 个cDNA 文库进行测序,得到(4 158.7~4 990.1)万条不同数目的原始序列。数据过滤后得到(4 016.7~4 937)万条有效序列,过滤碱基数量在6.03G~7.1G,并且过滤序列Q20 在96.95%以上,Q30 在91.43%以上,整体错误率在0.03%,表明测序结果可靠,可用于后续分析(表2)。基于处理组与对照的3 种比较分析,获得10 232 个差异表达基因(P-value≤0.05 且|log 2 fold change|≥0)。其中,GA3处理组的差异基因多于ABA 和IAA处理组的差异基因,3 种激素处理都是上调的差异基因数大于下调的差异基因数(图3A)。

图3 差异表达基因统计分析Fig. 3 Statistical analysis of differentially expressed genes

表2 转录组数据质量Table 2 The quality of the transcriptome data
2.3 差异表达基因GO 与KEGG 功能富集分析
为进一步分析预测差异基因的生物功能,对ABA vs CK、GA3vs CK 和IAA vs CK 3 组分别鉴定出的1 986、2 307 个和597 个独有差异基因进行了GO 富集分析和KEGG 途径分析(图3B)。对于GO 和KEGG 功能富集分析,各选出富集程度最显著的20 个条目进行展示。
2.3.1 ABA 处理的差异基因富集分析
GO 富集主要在细胞氨基酸代谢过程、α-氨基酸代谢过程、天冬氨酸家族氨基酸代谢过程、细胞氨基酸生物合成、含硫氨基酸生物合成、α-氨基酸生物合成、天冬氨酸家族氨基酸生物合成、色氨酸家族氨基酸生物合成以及多肽生物合成。对于KEGG 功能富集分析,最显著富集的通路是氨基酸生物合成,这与GO功能富集分析一致(图4)。

图4 “ABA vs CK”差异表达基因的GO 与KEGG 通路分析Fig. 4 GO and KEGG pathway analysis of differentially expressed genes of ‘ABA vs CK’
2.3.2 GA3处理的差异基因富集分析
GO 功能显著富集主要有ATP 酶活性、与物质跨膜运动相结合的ATP 酶活性、与物质的运动相结合的ATP 酶活性、初级活性跨膜转运体活性、p-p 键水解驱动的跨膜转运蛋白活性、线粒体质子转运ATP 合成复合物通路。对于KEGG 功能富集分析,显著富集的通路有氧化磷酸化和光合作用中的相互作用,这与GO 功能富集分析一致(图5)。
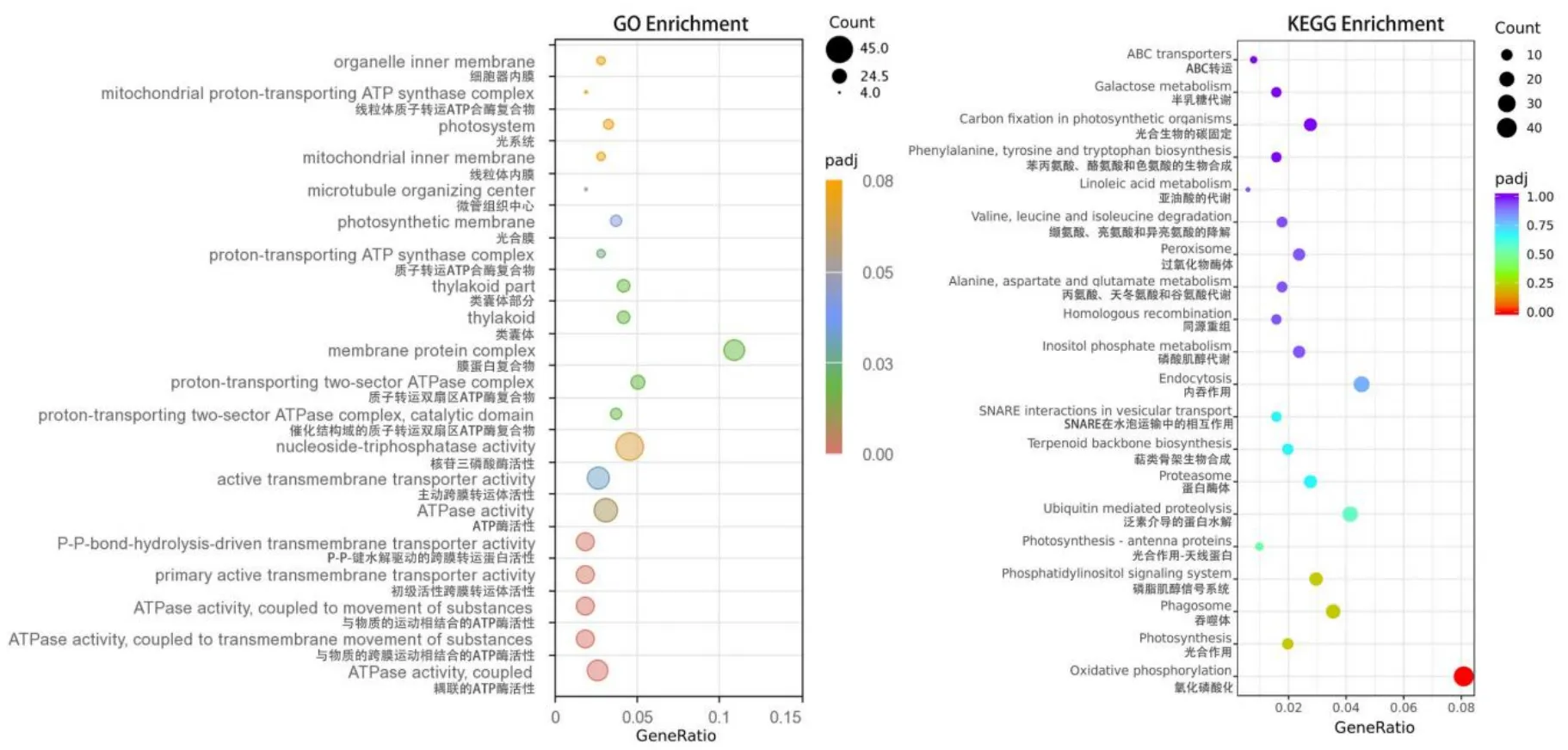
图5 “GA vs CK”差异表达基因的GO 与KEGG 通路分析Fig. 5 GO and KEGG pathway analysis of differentially expressed genes of ‘GA vs CK’
2.3.3 IAA 处理的差异基因富集分析
GO 功能显著富集的主要有细胞分解代谢、氧化酸代谢、有机酸分解代谢和细胞氨基酸代谢。对于KEGG 功能分析,显著富集的通路主要有类黄酮的生物合成(图6)。

图6 “IAA vs CK”差异表达基因的GO 与KEGG 通路分析Fig. 6 GO and KEGG pathway analysis of differentially expressed genes of ‘IAA vs CK’
2.4 萌动芽响应激素的差异表达基因
2.4.1 植物激素信号转导途径及相关基因
ABA 激素处理茶树萌动芽 7 d 后RNA-Seq 结果显示,多个植物激素信号转导途径中的基因表达存在差异(图7)。其中生长素信号通路响应最为显著,生长素的输入载体AUX1 编码基因ChaUn7152.1 上调表达,Cha10g004610 下调表达。生长素早期响应因子SAUR 编码的基因Cha13g005200、Cha08g018660上调表达,Cha06g001420 下调表达;Aux/IAA编码基因Cha12g002960 上调表达;ARF 编码基因Cha07g010980、Cha01g025320 均上调表达;GH3 编码基因Cha11g001650、ChaUn5814.1、Cha05g009180 和Cha08g015920 上调表达,Cha08g015920 下调表达。
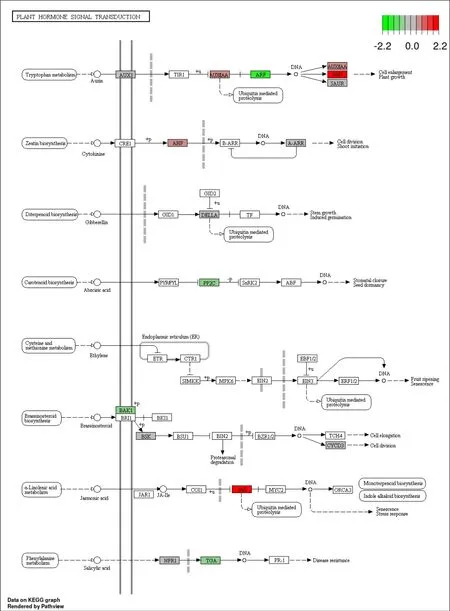
图7 KEGG map 分析植物激素信号转导相关的差异表达基因Fig. 7 KEGG map analysis of differentially expressed genes related to plant hormone signal transduction
在油菜素内酯信号通路中,受体激酶BAK1 编码基因Cha02g013480 下调表达。类受体胞质激酶BSK3 编码基因Cha02g018990、Cha09g000720 上调表达,ChaUn5480.11 下调表达。 周期蛋白 CYCD3 编码的基因Cha01g019170 表达上调、Cha09g003380 下调表达。在水杨酸合成-降解途径中,水杨酸受体NPR1 编码基因Cha14g009990 上调表达、Cha07g000170 下调表达。转录因子TGA 编码基因Cha11g003270 下调表达。在细胞分裂素信号转导途径中,磷酸转运蛋白AHP 编码基因Cha06g010480 上调表达,A-ARR 蛋白编码基因Cha10g001940、ChaUn7487.1 下调表达。在茉莉酸信号通路中,关键的调节因子 JAZ编码基因Cha15g011110 上调表达。在GA 信号通路中,关键成员蛋白 DELLA 编码基因Cha14g012470(GAI)下调表达。在ABA 信号转导途径中,第二信使 PP2C 编码基因Cha06g013790 下调表达。
2.4.2 光合作用信号转导途径及相关基因
光合作用信号通路中的光反应模块中,富集于光系统Ⅱ中大量的差异表达基因均上调表达,其中包括PSBR 编码基因Cha08g018420,PSBW 编码基因Cha13g007540、Cha11g010980,PSBO 编码基因Cha01g020400(PSBO1)、Cha03g016410(PSBO2)、PSBP 编码基因Cha05g016390,PSBQ 编码基因Chaun4943.2(PSBQ-2)。除了光系统Ⅱ的差异基因上调表达,光系统Ⅰ的差异基因也上调表达,其中包括PSAD 编码基因Cha09g015530,PSAO编码基因 Cha13g005990,LHCA 编码基因Cha05g011790、Cha03g010840、Cha15g003570,PSAO 编码基因Cha13g005990 均上调表达。卡尔文循环中 Cpn60beta2 编码基因Cha01g023840、Cha13g009810 上调表达,RCA编码基因Cha11g006560 上调表达,PTAC14编码基因Cha07g000840 上调表达,果糖二磷酸醛缩酶 FBA 编码基因 Cha02g017780、Cha10g008000 均上调表达。 萌发缺陷EMB3119 编码基因Cha02g008250 上调表达,磷酸三酯异构酶TIM 编码基因Cha02g018040上调表达。叶绿体中 2-磷酸甘油酸磷酸酶PGLP2 编码基因 Cha07g015500,伴侣蛋白CPN60A 编码基因Cha13g005110 上调表达,过氧化物酶体中羟基丙酮酸还原酶HPR 编码基因Chaun10015.2、乙醇酸氧化酶GOX1 编码基因Cha05g011660 和丙氨酸-2-氧戊二酸氨基转移酶AOAT2 编码基因Cha02g000210 均上调表达(图8)。

图8 MAPMAN 分析光合作用途径相关的差异表达基因Fig. 8 Differentially expressed genes associated with photosynthetic pathways identified by MAPMAN analysis
2.4.3 类黄酮信号转导途径及相关基因
类黄酮生物合成信号通路中,木质素相关的差异基因全部上调表达,包括苯丙氨酸解氨酶 PAL 编码基因 Cha08g005720 、Cha13g004970、Cha01g002680、Cha11g004750、Cha10g006940、Cha04g019190,肉桂酸-4-羟化酶C4H 编码基因Cha04g013980,肉桂醇脱氢酶CAD 编码基因Cha13g011050、Cha03g012950和CCR 编码基因Cha03g007510。黄酮醇合成酶FSL 编码基因Cha04g009620 上调表达,UDP-葡萄糖转移酶编码基因Cha04g012480、Cha12g011140、Cha12g001840、Cha02g015810、Cha04g021950、Cha06g015420、Chaun10809.1、Cha04g003460 上调表达,黄烷酮3-羟化酶F3H编码基因Cha01g016660、Cha09g001340 上调表达。无色花青素还原酶 LAR 编码基因Chaun10521.1、Cha03g011900、Cha09g002140、Chaun37508.1 均上调表达(图9)。
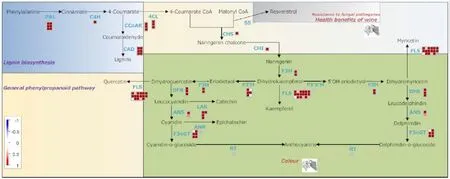
图9 MAPMAN 分析类黄酮生物合成相关的差异表达基因Fig. 9 Differentially expressed genes related to flavonoid biosynthesis identified by MAPMAN analysis
2.5 差异表达基因RT-qPCR 验证
为了进一步验证转录组数据的准确性,从3 个激素处理的各个转录组数据中选取了差异极显著的8 个差异基因,分别是UGT71B6、GSTF2、MBD9、HB-7、PPCK1、PPC3、GSH1、GER3进行qRT-PCR 验证。如图10 所示,8个差异表达基因的荧光定量表达水平的变化与转录组基因丰度变化趋势一致,进一步验证了转录组测序数据的可靠性。

图10 8 个差异表达基因的表达水平验证Fig. 10 Verification of the expression levels of 8 differentially expressed genes
3 讨论
前人研究表明,外源喷施GA 能够促进休眠解除,喷施ABA 能够延迟芽萌发[2,18]。对草本植物绿豆的研究中,喷施ABA 显著降低了株高,缩短了节间长度[19]。潘根生等[20]研究发现,茶树叶面喷施GA3后,新梢的生长量增大,生长速率加快。叶面喷施IAA 能够促进F1 代苜蓿种子的萌发,其是通过调控萌发过程中内源激素ABA 和GA 的变化从而影响种子的萌发和生长[21]。本研究中,在茶芽处于萌动期时,喷施ABA 7 d 后观察到显著的芽抑制表型,喷施GA37 d 后观察到明显的芽生长促进表型。喷施激素14 d 的结果表明,茶树对于外源激素的响应是一个短期的反应,ABA 处理对于新梢的抑制作用也会不断地减弱。GA3处理的新梢中生长积极调节因子在不断的积累,更加增强了新梢的发育。IAA 处理可能调控了芽萌发过程中内源激素GA 含量的增加从而影响芽萌发过程。可见,GA3和IAA 对春季茶芽萌发生长有正向的调控作用,ABA 的作用相反。
ABA 处理茶树新梢中植物激素信号转导通路GAI基因存在显著差异表达。DELLA 蛋白作为植物特有的转录因子,在GA 信号转导途径中GA 主要通过降解此蛋白来调节植物的生长发育。拟南芥GAI 突变体对GA 信号不敏感,植株表现出不正常的矮化表型[22]。在烟草中过表达DkGAI2会出现植株矮化、节间缩短等表型,转基因烟草植株中GA4的含量降低,说明DkGAI主要通过降低GA4的含量从而引起植株矮化[23]。本研究同样发现GAI在ABA 处理7 d 下调表达。ABA 处理的茶芽中筛选到的GAI基因,可能是ABA 处理茶芽生长受到抑制的内部原因。
激素同样参与植物的光合作用调控。研究表明,外源施用GA3能提升大豆植株的光合活性[24]。外源施用GA3还可以提高水稻叶片中叶绿素总量以及叶绿素a 的含量[25]。但是外源GA 施用对光合作用的调控机制目前还不清楚。本研究中,GA3处理的茶芽间距伸长,表现为生长促进性表型。GA3处理的茶芽中光合通路途径中的大多数基因上调表达,其中,PSBO 蛋白是唯一放氧必需的外周蛋白,与PSBQ、PSBP 共同组成一个放氧复合体,以利于维持放氧反应的无机辅因子,是高等植物放氧所必须的[26]。光合作用通路中PSBO2、PSBQ-2 和PSBP-1基因的上调增强了茶芽的光合效率,促进了茶芽伸长。因此,GA3处理的茶树可能通过加强光合作用为茶芽生长发育提供物质和能量支持。
激素对植物的次级代谢过程有着非常重要的影响。外源生长素施用能够增强查尔酮合酶(CHS)蛋白表达以及总黄酮量,类黄酮物质直接影响生长素载体分布、含量和活性来调节生长素的活性运输[27]。生长素含量与吲哚乙酸氧化酶活性呈负相关,某些类黄酮能通过控制此酶的活性,从而控制生长素的含量,最终影响植物的生长发育[28]。很多研究都证明植物的生长发育与类黄酮和生长素之前的相互作用有关,但是作用机理以及分子的调控机理仍需深入研究。本研究表明,IAA 处理的茶芽中类黄酮生物合成相关基因FLS1、F3H、CHIL、LDOX、C4H表达上调。结果还显示,谷胱甘肽代谢通路的谷胱甘肽转移酶GSTF2和GSTT1上调表达。有研究表明谷胱甘肽转移酶可以促进类黄酮物质的生成[29]。可见茶芽萌发过程中的类黄酮和谷胱甘肽转移酶类物质代谢可能受IAA 信号调控,与茶芽的生长发育密切相关。新梢是茶树生长发育最活跃的器官,类黄酮合成相关的基因在新梢发育过程中存在差异表达,但是这些基因是否参与新梢的生长发育还需要进一步的研究。
综合分析表明,ABA 处理中的氨基酸生物合成通路、GA3处理中的氧化磷酸化通路和光合作用通路、IAA 处理中的类黄酮生物合成通路是参与茶树新梢生长发育的重要通路,GAI、PSBO2、PSBQ-2和PSBP-1可能是参与新梢生长发育的关键基因。对这些基因功能的深入研究,将有助于茶树新梢生长发育调控机理的全面揭示。
