CT增强碘对比剂急性不良反应发生现况及影响因素
2023-06-29杨秋月汪晖李琴李震
杨秋月,汪晖,李琴,李震
·科研论著·
CT增强碘对比剂急性不良反应发生现况及影响因素
杨秋月,汪晖*,李琴,李震
华中科技大学同济医学院附属同济医院,湖北 430030
探讨CT增强碘对比剂急性不良反应发生现况,并分析其影响因素。选取2021年4月—2021年6月于武汉市某三级甲等医院行CT增强检查的5 885例病人为研究对象,采用自制问卷(包括病人个人因素、碘对比剂因素、检查前准备相关因素、环境因素及急性不良反应发生情况5个维度)对病人进行调查。5 885例病人中,急性不良反应发生率为2.72%(160/5 885);超敏/过敏样反应发生率为0.44%(26/5 885);化学毒性/生理反应发生率为2.28%(134/5 885);次高渗碘对比剂所致的急性不良反应发生率高于等渗碘对比剂;98.75%的病人表现为轻度急性不良反应,82.50%的急性不良反应发生在碘对比剂开始注射后的前5 min。Logistic回归分析结果显示,年龄、体质指数、基础疾病、过敏史、就医方式、碘对比剂种类为CT增强碘对比剂急性不良反应的独立影响因素(<0.05)。CT增强碘对比剂急性不良反应主要为轻度化学毒性/生理反应,一般发生在碘对比剂开始注射后的前5 min,年龄、体质指数、基础疾病、过敏史、就医方式、碘对比剂种类是CT增强碘对比剂急性不良反应发生的影响因素。
碘对比剂;急性不良反应;CT增强;体层摄影术;X线计算机;影响因素;前瞻性研究
全世界每年约有7 500万人使用碘对比剂(iodine contrast medium,ICM),且呈逐年上升趋势,尤其是在CT增强检查中的应用。虽然碘对比剂在不断改良,应用上也由最初的离子型转变为非离子型,安全性也有所提高,但由于日益增加的使用率,不良反应的发生率也随之提高[1⁃2]。约90%的不良反应为急性不良反应(acute adverse reactions,AARs),且几乎所有危及生命的不良反应都发生在碘对比剂注射后的前20 min内[3⁃4]。因此,调查研究CT增强碘对比剂急性不良反应发生现况及影响因素有十分重要的意义。碘对比剂急性不良反应是指在碘对比剂注射后1 h内发生的不良反应,根据其发生机制,可分为超敏/过敏样反应和化学毒性/生理反应两大类[3]。研究表明,研究对象及研究方法不同时,碘对比剂急性不良反应的发生率存在很大差异。国外多项回顾性研究对碘对比剂急性不良反应发生率报道普遍偏低,仅为0.18%~1.03%,可能忽略了化学毒性/生理反应的统计[5⁃9];但在一些前瞻性研究中,其发生率报道较高,为2.4%~4.3%[10⁃12]。国内关于碘对比剂急性不良反应的研究甚少,基本都是对以往病历资料的回顾性分析,研究内容不全面。本研究采用基于德尔菲法编制的调查问卷,前瞻性现场收集病人资料,以总结分析CT增强碘对比剂急性不良反应发生现况及影响因素,以达到预警和控制碘对比剂急性不良反应的发生,为制定相应的防范和管理措施提供循证依据。
1 对象与方法
1.1研究对象选取2021年4月—2021年6月于武汉市某三级甲等医院行CT增强检查的所有病人为研究对象。纳入标准:行CT增强检查,且知晓本研究目的及意义,签署知情同意书,并愿意配合调查。排除标准:严重视听及交流障碍,且无陪同家属或陪同家属同样也存在交流障碍,无法配合完成问卷调查。样本量以现况调查的样本量计算公式(=×/)进行估算,为总调查人数,值依研究项目容许误差大小而定(本研究K为178),为碘对比剂急性不良反应预计发生率,=1-。本研究容许误差15%。国外相关前瞻性研究指出,CT增强碘对比剂急性不良反应发生率为2.4%~4.3%[10⁃12],本研究取为3.0%,预计纳入病例数为5 750例。本研究共发放6 000份问卷,回收5 900份,问卷回收率为98.3%,回收的5 900份问卷中,有效问卷5 885份,最终纳入研究。本研究已通过伦理委员会审查,审查号:TJ⁃IRB20210635。
1.2研究材料共纳入5种碘对比剂,分别为碘美普尔注射液(100 mL:40 g碘)、碘普罗胺注射液(100 mL:37 g碘)、碘海醇注射液(100 mL:30 g碘)、碘佛醇注射液(100 mL:35 g碘)和碘克沙醇注射液(100 mL:32 g碘)。其中,碘克沙醇注射液为等渗碘对比剂,其余为次高渗碘对比剂。
1.3研究方法采用前瞻性队列研究的方法,以观察对象开始注射碘对比剂为随访起点,碘对比剂注射后1 h或1 h内病人发生不良反应为随访终点。
1.3.1数据收集过程①检查前调查人员发放纸质版调查问卷并面对面访问病人,填写问卷中病人个人因素、检查前准备相关因素部分;②病人携带调查问卷进入检查室,由机房护士完成问卷中碘对比剂因素、环境因素部分及病人检查过程中碘对比剂急性不良反应的发生情况;③检查后,病人携带调查问卷至观察室留观1 h,调查人员记录病人留观期间碘对比剂急性不良反应发生情况,并回收调查问卷。
1.3.2数据质量控制准确性:1)采用德尔菲法编制调查问卷,以确保调查因素全面、科学;2)成立调查小组,小组成员学历均为本科及以上,本研究领域工作年限≥5年,并于调查前进行人员培训,使调查成员对问卷的所有条目都有统一的认识;3)定期进行会议讨论,及时反馈和修改问卷;4)采用EpiData双人核对录入问卷信息并建立数据库,该软件适合大样本数据录入,可设置条目报警值,最大限度降低数据录入误差。完整性:1)调查问卷另设立病人信息栏(联系方式、ID号、检查时间及地点),每天收集并整理调查资料,发现调查问卷信息不全时,及时联系病人或查阅电子病历,补全所有条目;2)利用问卷星制作“CT增强碘对比剂不良反应上报系统”,并生成二维码,发放给部分因特殊情况被迫离开观察室,未达到观察时间(1 h)的病人,并做好信息登记。嘱病人离开后,若因碘对比剂注射出现任何不适,在得到处理和缓解的情况下,填报该系统,该系统填报内容包括病人姓名、性别、ID号、联系方式、检查时间、检查地点、发生不良反应时间、症状等信息,对于文盲或缺乏智能手机的病人,给予其纸质说明和调查员联系方式,在家属或病房责任护士的协助下进行电话反馈,每日整理该系统信息和电话信息,并关联其调查问卷,以避免碘对比剂急性不良反应数据的遗漏。
1.3.3终点评价指标参照欧洲泌尿生殖放射学会(ESUR)对比剂指南10.3版[3]中有关碘对比剂急性不良反应的定义、分类及临床表现,收集碘对比剂注射过程中及注射后1 h内发生的不良反应(发热感除外)。化学毒性/生理反应:自限性恶心、自限性呕吐、短暂的潮红、心慌/胸闷、头痛/头晕、轻度高血压、自行缓解的血管迷走反应为轻度反应;持续性恶心/呕吐、中度高血压、单一胸痛、需要治疗或对治疗有反应的血管迷走反应为中度反应;治疗无效的血管迷走反应、心律失常、抽搐/癫痫、重度高血压为重度反应。超敏/过敏样反应:自限性荨麻疹/瘙痒、皮肤水肿、自限性喉咙发痒、鼻充血、流鼻涕/打喷嚏/结膜炎为轻度反应;弥漫性荨麻疹/瘙痒、生命体征稳定情况下的弥漫性红斑、喉咙发紧/声音嘶哑但不伴有呼吸困难、面部水肿但不伴有呼吸困难、喘息/支气管痉挛并伴有轻度或无缺氧为中度反应;过敏性休克、心搏骤停、弥漫性红斑并伴有低血压、弥漫性水肿或仅面部水肿伴有呼吸困难、喉头水肿并伴有哮鸣音或缺氧、喘息/支气管痉挛并伴有明显的缺氧为重度反应。
1.3.4统计学方法采用SPSS 19.0软件进行数据统计分析,符合正态分布的定量资料以均数±标准差(±)表示,行检验;定性资料以例数、百分比(%)表示,行2检验或Fisher确切概率法;采用Logistic回归进行多因素分析。以<0.05为差异有统计意义。
2 结果
2.1CT增强碘对比剂急性不良反应发生情况 5 885例病人中,男3 246例,女2 639例;年龄8个月至91岁[(53.67±15.31)岁]。其中,160例(2.72%)病人出现急性不良反应。超敏/过敏样反应发生率为0.44%(26/5 885),主要表现为荨麻疹,占急性不良反应总例数的16.25%(26/160);化学毒性/生理反应发生率为2.28%(134/5 885),主要表现为恶心、呕吐、头痛头晕,占急性不良反应总例数的83.75%(134/160)。出现急性不良反应的病人中98.75%(158/160)表现为轻度急性不良反应,1.25%(2/160)的病人为中重度急性不良反应。82.50%(132/160)的病人急性不良反应发生在碘对比剂注射开始后的前5 min;33.13%(53/160)发生在碘对比剂注射过程中;49.38%(79/160)发生在碘对比剂注射完毕后的前5 min。详见表1。

表1 CT增强碘对比剂急性不良反应发生情况(n=160) 单位:[例(%)]
2.2不同种类碘对比剂急性不良反应发生情况 5 885例病人中,碘美普尔注射液、碘普罗胺注射液、碘海醇注射液、碘佛醇注射液和碘克沙醇注射液5种碘对比剂所导致的急性不良反应发生率依次为3.6%、3.7%、1.8%、2.6%和1.7%,5种碘对比剂急性不良反应发生情况比较,差异有统计学意义(<0.05);次高渗碘对比剂所致的急性不良反应发生率高于等渗碘对比剂,差异有统计学意义(<0.05);5种碘对比剂在急性不良反应类型和发生时间上差异也有统计学意义(<0.05)。详见表2。
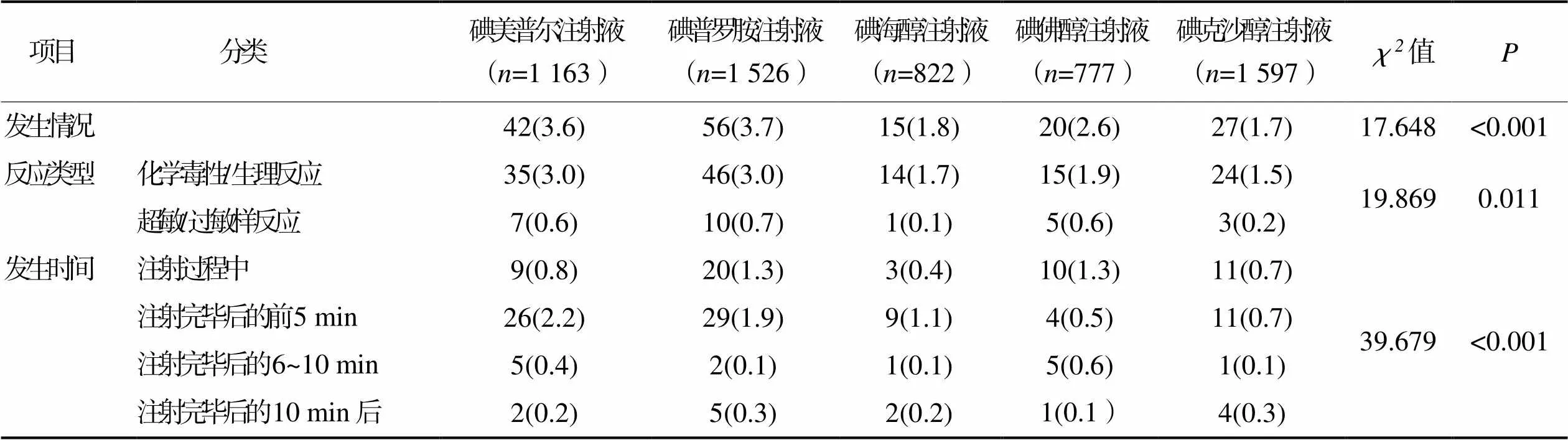
表2 不同种类碘对比剂急性不良反应发生情况(n=5 885) 单位:例(%)
2.3碘对比剂急性不良反应发生的单因素分析
2.3.1个人因素(见表3)

表3 发生碘对比剂急性不良反应个人因素的单因素分析结果(n=5 885)
①采用Fisher确切概率法。
2.3.2碘对比剂因素(见表4)
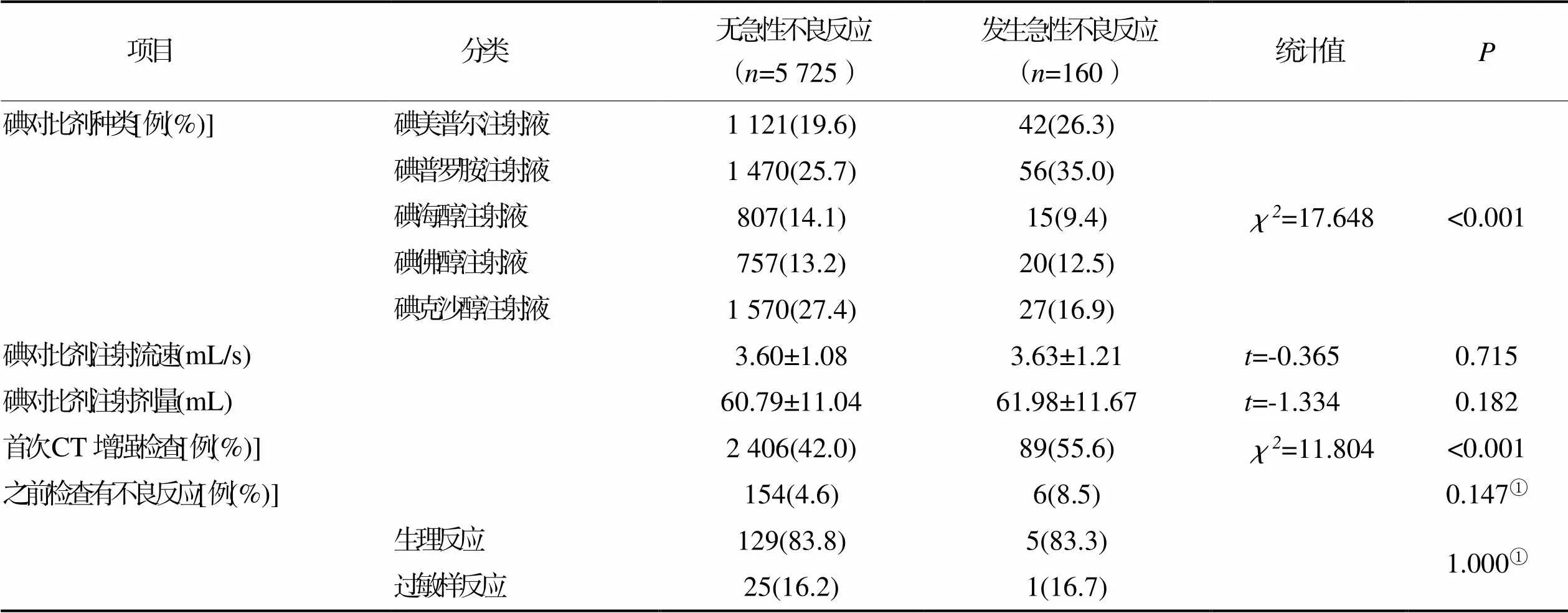
表4 发生碘对比剂急性不良反应碘对比剂因素的单因素分析结果(n=5 885)
① 采用Fisher确切概率法。
2.3.3检查前准备相关因素(见表5)

表5 发生碘对比剂急性不良反应检查前准备相关因素的单因素分析结果(n=5 885) 单位:例(%)
2.3.4环境因素(见表6)

表6 发生碘对比剂急性不良反应环境因素的单因素分析结果(n=5 885) 单位:℃
2.4碘对比剂急性不良反应发生的多因素Logistic回归分析将单因素分析中差异有统计学意义的自变量,包括年龄、体质指数、化疗史、过敏史、首次CT增强检查、检查前禁食时长、就医方式、估算的肾小球滤过率、碘对比剂种类,以及一些虽然差异无统计学意义但临床上认为与因变量关系密切的自变量,包括性别、用药史、基础疾病、CT检查项目、检查前是否水化、注射流速和注射剂量,共16个自变量纳入Logistic回归分析,结果显示,年龄、体质指数、基础疾病、过敏史、就医方式、碘对比剂种类为CT增强扫描碘对比剂急性不良反应的影响因素(<0.05)。其中,年龄为保护性因素,体质指数、有基础疾病或过敏史、门诊就医、使用碘美普尔注射液和碘普罗胺注射液为危险因素。详见表7、表8。

表7 变量赋值情况

表8 发生碘对比剂急性不良反应的多因素Logistic回归分析结果(n=5 885)
3 讨论
3.1CT增强碘对比剂急性不良反应发生现状本研究结果显示,5 885例病人CT增强碘对比剂急性不良反应总发生率为2.72%,高于Kim等[5]的研究结果(1.03%),但与Gomi等[11]的研究结果(2.7%)一致,可能与各研究收集数据的方式不同有关。Kim等[5]研究通过回顾以往上报资料进行统计,可能存在漏报轻度化学毒性反应,所以研究结果偏低;Gomi等[11]研究的数据收集方法与本研究一样,采用前瞻性现场资料收集的方式,数据更加完整。因此研究结果一致。本研究结果显示,82.50%的急性不良反应发生在碘对比剂开始注射后的前5 min,远早于曹建勋等[4,13]研究提出的15 min,可能与急性不良反应的反馈方式不同有关,本研究采取严格留观制,由专业医务人员评估,曹建勋等[4,13]研究数据大多来源于病人自行反馈,可能存在时间上的延迟。本研究5 min内发生的急性不良反应中,近一半发生在碘对比剂注射过程中,且主要表现为一过性的恶心、呕吐等,这对于优化检查前的宣教内容提供了循证依据。提前向病人宣教碘对比剂注射过程中的全面感受(由单一热感增加恶心、呕吐感等),对消除病人恐慌、焦虑情绪、提高病人检查配合度、减少二次曝光、保证其检查安全具有十分重要的意义。
3.2CT增强碘对比剂急性不良反应发生的影响因素本研究基于德尔菲专家函询法构建的调查问卷科学、可靠,加上前瞻性现场收集资料的方式,能更全面、准确地收集病人资料,Logistic回归分析的相关变量也更全面,能最大化地消除混杂因素的影响,研究结果偏倚小,且前瞻性队列研究与病例对照研究相比,避免了与对照选择相关的问题。由于本研究对象所使用的碘对比剂全部进行预热处理(37 ℃)、每种碘对比剂对应1个浓度,所以碘对比剂浓度和碘对比剂是否预热2个因素未纳入研究。国内外多项研究指出,基础疾病史[14⁃20]、过敏史[14⁃15,21⁃23]、门诊病人[13]、使用碘美普尔注射溶液或碘普罗胺注射溶液[5,11,24⁃25]为CT增强碘对比剂急性不良反应发生的风险因素,本研究也得出了相同的结论。但除此之外,本研究还得出低龄、体质指数2个新的风险因素。
3.2.1年龄本研究结果显示,CT增强碘对比剂急性不良反应与年龄相关(<0.05)。虽然国内外有相关报道,但由于所使用的碘对比剂类型、研究方法及研究人群种族差异等原因,各项研究报道的急性不良反应好发年龄组不同。Gomi等[11]研究指出,年龄≤59岁病人使用次高渗碘对比剂时,急性不良反应发生率(4.5%)高于年龄≥60岁病人(1.9%);Zhang等[26]研究指出,次高渗碘对比剂(碘普罗胺注射溶液和碘帕醇注射溶液)急性不良反应常见于50~60岁的病人;甘淼等[24]研究指出,非离子型碘对比剂(碘普罗胺注射液、碘海醇注射液、碘帕醇注射液、碘佛醇注射液和碘克沙醇注射液)急性不良反应常见于44~56岁病人。本研究指出,年龄为CT增强碘对比剂急性不良反应的保护性因素,年龄每增加1岁,病人发生急性不良反应的风险可降低3%[OR=0.97,95%CI(0.96,0.99)],若对年龄进行分层,与年龄<15岁的病人比较,年龄>35~60岁和>60岁的病人发生急性不良反应的风险分别可降低71%[OR=0.29,95%CI(0.10,0.85)]、83%[OR=0.17,95%CI(0.05,0.55)],反之,年龄越小发生风险越大。与其他研究比较,本研究提出的风险年龄组更低龄化,这可能与研究对象的纳入标准及种族、地域差异有关,本研究涵盖所有年龄组,而其他研究多选择年龄≥18岁的成年人为研究对象。这种低龄化的风险可能与其产生的心理效应有关[11]。年轻人经历事情少,心理承受力差,较年长者更容易出现紧张、焦虑情绪,但因心理效应引起的急性不良反应可通过适当的心理护理得到有效防范[27⁃28]。这也可能与年龄相关的内在生理变化有关[29],随着年龄的增长,机体敏感性降低、耐受性增强。因此,年长者表现出用药的相对安全性。
3.2.2体质指数体质指数被认为是很多疾病的风险因素,如高血压、糖尿病、冠心病等,但首次被确定为CT增强碘对比剂急性不良反应发生的风险因素。本研究结果显示,体质指数每增加1个单位病人发生急性不良反应的风险可增加6%[OR=1.06,95%CI(1.01,1.11)]。这可能与病人体质指数差异所导致的碘对比剂注射剂量不同有关。研究表明,急性不良反应中的化学毒性/生理反应的发生与碘对比剂注射剂量增加有关[4]。本研究中,83.75%的急性不良反应为化学毒性/生理反应。碘对比剂注射剂量严格按照病人身高、体重进行公式计算,体质指数偏大的病人碘对比剂注射剂量偏多。而关于急性不良反应中的过敏样反应,少部分被认定为免疫介导的真正过敏反应,即超敏反应,大部分被认为是由于药物成分或经补体激活途径等方式导致病人表现与过敏反应相似症状的类过敏反应[18,30]。但不管是哪种反应机制,通常最终都会导致嗜碱性粒细胞和肥大细胞释放组胺等活性介质[18,31⁃34],尤其是荨麻疹病人,一定有组胺的释放,但组胺释放的途径和确切原因尚不清楚[35⁃37]。有研究指出,体质指数增加会导致机体免疫反应和组胺反应的增强[38],这也许能对体质指数与急性不良反应中的超敏/过敏样反应的相关性做出合理解释。
4 研究的局限性及展望
由于时间、经费及精力有限,本研究局限于单一机构,缺乏多中心的合作研究;并不是所有的病人都能做到留观1 h,尽管做了最大化的质量控制,但仍有可能存在急性不良反应的漏报;研究时间比较短,对于环境因素的研究,局限在机房温度、室外气温和室内外温差,缺乏月份、季节等环境因素的研究。未来将开展多中心合作研究,并延长研究时间,探索更全面的研究环境因素对CT增强碘对比剂急性不良反应发生的影响。
[1] 中华医学会放射学分会对比剂安全使用工作组.碘对比剂使用指南(第2版)[J].中华医学杂志,2014,94(43):3363-3369.
Working Group on Safe Use of Contrast Agents,Chinese Society of Radiology.Guide to the use of iodine contrast agents (2nd edition)[J].National Medical Journal of China,2014,94(43):3363-3369.
[2] 钞俊,李洁欣,邹文远.碘对比剂过敏反应与临床应用现状及展望[J].中国老年保健医学,2014,12(6):79-81.
CHAO J,LI J X,ZOU W Y.Current situation and prospect of allergic reaction and clinical application of iodine contrast agent[J].Chinese Journal of Geriatric Care,2014,12(6):79-81.
[3] American College of Radiology.ACR manual on contrast media(Version 10.3)[M].Berlin:Springer-Verlag,2018:22.
[4] 曹建勋,姚国立,张康燕,等.20 418例CT检查非离子型碘对比剂不良反应分析[J].中国医学影像学杂志,2017,25(11):876-880.
CAO J X,YAO G L,ZHANG K Y,.Adverse reactions induced by non-ionic iodinated contrast agent in 20,418 patients receiving CT examination[J].Chinese Journal of Medical Imaging,2017,25(11):876-880.
[5] KIM S R,LEE J H,PARK K H,.Varied incidence of immediate adverse reactions to low-osmolar non-ionic iodide radiocontrast media used in computed tomography[J].Clinical and Experimental Allergy:Journal of the British Society for Allergy and Clinical Immunology,2017,47(1):106-112.
[6] SUH Y J,YOON S H,HONG H,.Acute adverse reactions to nonionic iodinated contrast media:a meta-analysis[J].Investigative Radiology,2019,54(9):589-599.
[7] DILLMAN J R,STROUSE P J,ELLIS J H,.Incidence and severity of acute allergic-like reactions to i.v.nonionic iodinated contrast material in children[J].American Journal of Roentgenology,2007,188(6):1643-1647.
[8] CALLAHAN M J,POZNAUSKIS L,ZURAKOWSKI D,.Nonionic iodinated intravenous contrast material-related reactions:incidence in large urban children's hospital--retrospective analysis of data in 12,494 patients[J].Radiology,2009,250(3):674-681.
[9] FAROLFI A,DELLA LUNA C,RAGAZZINI A,.Taxanes as a risk factor for acute adverse reactions to iodinated contrast media in cancer patients[J].The Oncologist,2014,19(8):823-828.
[10] NAGAMOTO M,GOMI T,TERADA H,.Evaluation of the acute adverse reaction of contrast medium with high and moderate iodine concentration in patients undergoing computed tomography[J].Radiation Medicine,2006,24(10):669-674.
[11] GOMI T,NAGAMOTO M,HASEGAWA M,.Are there any differences in acute adverse reactions among five low-osmolar non-ionic iodinated contrast media?[J].European Radiology,2010,20(7):1631-1635.
[12] MOTOSUGI U,ICHIKAWA T,SANO K,.Acute adverse reactions to nonionic iodinated contrast media for CT:prospective randomized evaluation of the effects of dehydration,oral rehydration,and patient risk factors[J].American Journal of Roentgenology,2016,207(5):931-938.
[13] LI X,CHEN J,ZHANG L,.Clinical observation of the adverse drug reactions caused by non-ionic iodinated contrast media:results from 109,255 cases who underwent enhanced CT examination in Chongqing,China[J].The British Journal of Radiology,2015,88(1047):20140491.
[14] IORDACHE A M,DOCEA A O,BUGA A M,.The incidence of skin lesions in contrast media-induced chemical hypersensitivity[J].Experimental and Therapeutic Medicine,2019,17(2):1113-1124.
[15] TSUSHIMA Y,ISHIGUCHI T,MURAKAMI T,.Safe use of iodinated and gadolinium-based contrast media in current practice in Japan:a questionnaire survey[J].Japanese Journal of Radiology,2016,34(2):130-139.
[16] ROSADO INGELMO A,DOÑA DIAZ I,CABAÑAS MORENO R,.Clinical practice guidelines for diagnosis and management of hypersensitivity reactions to contrast media[J].Journal of Investigational Allergology & Clinical Immunology,2016,26(3):144-155.
[17] LANG D M,ALPERN M B,VISINTAINER P F,.Elevated risk of anaphylactoid reaction from radiographic contrast media is associated with both beta-blocker exposure and cardiovascular disorders[J].Archives of Internal Medicine,1993,153(17):2033-2040.
[18] 刘红娜,吴英,潘春燕.碘对比剂过敏样反应研究进展[J].临床误诊误治,2019,32(1):113-116.
LIU H N,WU Y,PAN C Y.Research progress on allergic reaction of iodine contrast agent[J].Clinical Misdiagnosis & Mistherapy,2019,32(1):113-116.
[19] 李艳艳,程一帆,杨雅淋,等.碘对比剂静脉注射致皮肤不良反应的危险因素分析[J].中国药房,2020,31(18):2252-2258.
LI Y Y,CHENG Y F,YANG Y L,.Analysis of risk factors of skin adverse reactions by intravenous injection of iodine contrast agent[J].China Pharmacy,2020,31(18):2252-2258.
[20] 韩玫,黄婷婷.CT增强碘对比剂过敏反应的高危因素分析[J].河南医学研究,2021,30(2):207-210.
HAN M,HUANG T T.High risk factors of anaphylactic reaction of iodine contrast medium in CT enhance scan[J].Henan Medical Research,2021,30(2):207-210.
[21] KIM Y S,YOON S H,CHOI Y H,.Nausea and vomiting after exposure to non-ionic contrast media:incidence and risk factors focusing on preparatory fasting[J].The British Journal of Radiology,2018,91(1087):20180107.
[22] GOKSEL O,AYDıN O,ATASOY C,.Hypersensitivity reactions to contrast media:prevalence,risk factors and the role of skin tests in diagnosis--a cross-sectional survey[J].International Archives of Allergy and Immunology,2011,155(3):297-305.
[23] SHEHADI W H.Adverse reactions to intravascularly administered contrast media.A comprehensive study based on a prospective survey[J].The American Journal of Roentgenology,Radium Therapy,and Nuclear Medicine,1975,124(1):145-152.
[24] 甘淼,刘畅,赵丽,等.CT对比剂急性不良反应的相关因素分析[J].中国医科大学学报,2020,49(5):458-462.
GAN M,LIU C,ZHAO L,.Analysis of related factors of acute adverse reaction caused by contrast agents used in computed tomography[J].Journal of China Medical University,2020,49(5):458-462.
[25] AN J,JUNG H,KWON O Y,.Differences in adverse reactions among iodinated contrast media:analysis of the KAERS database[J].The Journal of Allergy and Clinical Immunology in Practice,2019,7(7):2205-2211.
[26] ZHANG B,DONG Y H,LIANG L,.The incidence,classification,and management of acute adverse reactions to the low-osmolar iodinated contrast media isovue and ultravist in contrast-enhanced computed tomography scanning[J].Medicine,2016,95(12):e3170.
[27] 朱雪平.临床护理路径和心理干预对CT增强检查的联合护理效果探讨[J].当代临床医刊,2020,33(6):529-530.
ZHU X P.Discussion on the combined nursing effect of clinical nursing path and psychological intervention on enhanced CT examination[J].Journal of Contemporary Clinical Medicine,2020,33(6):529-530.
[28] 张惠敏,金晨.心理护理对CT增强造影剂过敏反应的影响[J].实用临床护理学电子杂志,2019,4(27):133.
ZHANG H M,JIN C.Effect of psychological nursing on allergic reaction of contrast agent enhanced by CT[J].Electronic Journal of Practical Clinical Nursing Science,2019,4(27):133.
[29] 潘杰,刘来浩,牟建伟.肠道菌群与人类健康研究进展[J].山东师范大学学报(自然科学版),2021,36(4):337-365.
PAN J,LIU L H,MU J W.Research progress of gut microbiota and human health[J].Journal of Shandong Normal University (Natural Science),2021,36(4):337-365.
[30] KYUNG E J,RYU J H,KIM E Y.Evaluation of adverse reactions to contrast media in the hospital[J].The British Journal of Radiology,2013,86(1032):20130418.
[31] 杨旭,黄晓青,华潞,等.52例冠状动脉造影患者非离子型含碘对比剂过敏不良反应分析[J].中国循环杂志,2015,30(8):741-743.
YANG X,HUANG X Q,HUA L,.Analysis of allergic adverse reaction caused by non-ionic iodinated contrast media in 52 patients with coronary angiography[J].Chinese Circulation Journal,2015,30(8):741-743.
[32] NAGY J A,BENJAMIN L,ZENG H Y,.Vascular permeability,vascular hyperpermeability and angiogenesis[J].Angiogenesis,2008,11(2):109-119.
[33] WALLER D G.Allergy,pseudo-allergy and non-allergy[J].British Journal of Clinical Pharmacology,2011,71(5):637-638.
[34] SZEBENI J,MUGGIA F,GABIZON A,.Activation of complement by therapeutic liposomes and other lipid excipient-based therapeutic products:prediction and prevention[J].Advanced Drug Delivery Reviews,2011,63(12):1020-1030.
[35] BUSH W H,SWANSON D P.Acute reactions to intravascular contrast media:types,risk factors,recognition,and specific treatment[J].American Journal of Roentgenology,1991,157(6):1153-1161.
[36] COHAN R H,DUNNICK N R.Intravascular contrast media:adverse reactions[J].American Journal of Roentgenology,1987,149(4):665-670.
[37] DUNNICK N R,COHAN R H.Cost,corticosteroids,and contrast media[J].American Journal of Roentgenology,1994,162(3):527-529.
[38] SUH M J,PARK J A,KO H,.Is body mass index related to skin reactivity to histamine but not to specific allergens?A 2-year follow-up study on Korean children[J].American Journal of Rhinology & Allergy,2022,36(1):142-148.
Analysis of the current situation and influencing factors of acute adverse reactions of CT⁃enhanced iodine contrast medium
YANGQiuyue, WANGHui, LIQin, LIZhen
Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Hubei 430030 China
To investigate the occurrence of acute adverse reactions(AARs) of iodine contrast medium(ICM) with CT⁃enhancement,and analyze its influencing factors.Method:A total of 5 885 patients who underwent enhanced⁃CT examination in a a tertiary grade A hospital in Wuhan from April 2021 to June 2021 were selected as the study subjects.A self⁃designed questionnaire(including five dimensions of patient's personal factors,iodine contrast medium factors,factors related to preparation before examination,environmental factors and occurrence of AARs) was used to investigate the patients.Among 5 885 patients,the incidence of AARs was 2.72%(160/5 885);The incidence of hypersensitive/allergic⁃like reaction was 0.44%(26/5 885);The incidence of chemical toxicity/physiological reaction was 2.28%(134/5 885);The incidence of AARs caused by secondary hypohypertonic contrast medium was higher than that caused by iso⁃osmolar contrast medium;98.75% of the patients presented with AARs,and 82.50% of AARs occurred within the first 5 minutes after the initiation of ICM injection.Logistic regression analysis showed that age,BMI,basic disease,allergy history,the way of seeking medical attention, and ICM type were independent influencing factors of AARs of CT⁃enhanced ICM(<0.05).Ct⁃enhanced AARs were mainly mild chemical toxicity/physiological reactions,which generally occurred in the first 5 minutes after the initiation of ICM injection.Age,BMI,basic disease,allergy history,the way of seeking medical attention,and ICM type were independent influencing factors of AARs of CT⁃enhanced ICM.
iodine contrast medium,ICM; acute adverse reaction; CT⁃enhancement;tomography; X⁃ray computer; influencing factors; prospective research
10.12102/j.issn.1009-6493.2023.12.008
(2022-07-11;
2023-05-22)
杨秋月,主管护师,硕士
汪晖,E⁃mail:tjwhhlb@126.com
杨秋月,汪晖,李琴,等.CT增强碘对比剂急性不良反应发生现况及影响因素[J].护理研究,2023,37(12):2122⁃2129.

WANG Hui, E⁃mail: tjwhhlb@126.com
(本文编辑 曹妍)
