新疆野生核桃 JfDREB1A基因的克隆与原核表达分析
2023-06-26韩立群
韩立群 ,张 捷 ,赵 钰 ,梅 闯,马 凯
(1.新疆农业大学 园艺学院,乌鲁木齐 830052; 2.新疆农业科学院 园艺作物研究所,新疆特色果蔬基因组研究与遗传改良重点实验室,农业部新疆地区果树科学观测试验站,乌鲁木齐 830091; 3.新疆林业学校,乌鲁木齐 830026)
低温作为一种非生物胁迫已经成为世界最为严重的灾害之一,影响植物的生长发育,严重时会造成植物的死亡[1-2]。揭示植物感知低温信号的机理对探究植物是如何避免低温损伤十分必要[3]。目前,CBF(C-repeat binding factor)转录因子又称为DREB1(Dehydration-responsive element binding factor 1),其介导的低温信号转导是研究最为透彻的植物低温响应机制[4-5]。DREB1/CBF转录因子编码一个植物所特有的高度保守DNA结合结构域(AP2结构域)和两个特征序列(PKK/RPAGRTKFRETRHP和DSAWR)[6-7]。低温胁迫下,DREB1/CBF的表达受到诱导,结合其下游低温应答相关基因启动子区域的顺式作用元件,从而调控基因的表达,增强植物的低温耐受性[1, 8],其功能作用已经在榛子(Corylusheterophylla)[9]、野扁桃(Amygdalusledebouriana)[10]、新疆野苹果(Malussieversii)[11]、欧李(Cerasushumilis)[12]等多种果树中得到初步验证。
核桃(JuglansregiaL.)属胡桃科核桃属落叶禾木,是世界四大坚果之一,低温会严重影响其正常生长发育,制约核桃产业的发展和经济效益的提高[13]。野生植物经极端自然环境选择,是挖掘植物优异抗性基因的重要材料[2]。新疆野生核桃(JuglansfallaxD.)是中国珍稀野生植物资源,是新疆栽培核桃的直系祖先,在长期进化过程中形成了许多特有变异,具有很大的挖掘利用潜力[14-15]。韩立群等[16]前期研究发现,新疆野生核桃群落中存在具有较强耐寒能力的株系。然而,关于新疆野生核桃低温响应关键基因的挖掘鲜有报道。因此,本研究以经过初步鉴定具有较强耐寒能力的新疆野生核桃‘小矩圆核桃’类型为材料,克隆其低温响应关键基因JfDREB1A,进行生物学与表达水平分析,构建原核表达载体并诱导目的蛋白表达,以期为揭示该蛋白在调控新疆野生核桃响应低温胁迫中的功能作用奠定基础。
1 材料与方法
1.1 试验材料及处理
试验材料为新疆巩留县野核桃沟自然保护区中的‘小矩圆核桃’类型。2020-09-28,在核桃果实成熟时,收集种子,带回实验室置于4 ℃冰箱中沙藏3个月,然后冷水浸泡催芽,当种子露白时播种于营养钵(20 cm×20 cm)中,基质为草炭土∶珍珠岩=3∶1(体积比),每个营养钵点播1粒种子,共播种100粒,获得幼苗90株。当幼苗生长至30 cm高时,选择生长良好且长势一致的幼苗5株,采取顶叶下2~5片嫩叶液氮速冻,置于 -80 ℃冰箱中保存,备用;选择幼苗35株,用于低温胁迫下基因的表达量测定。
1.2 方 法
1.2.1JfDREB1A基因克隆 使用天根公司的植物总RNA提取试剂盒提取新疆野生核桃叶片中的总RNA,通过High Capacity cDNA反转录试剂盒(Thermo Fisher Scientific,上海)推荐反应体系合成cDNA第一链。根据GenBank公布的核桃CBF基因(登录号:AFV93473.1)设计引物(表1),使用PrimeSTAR GXL Premix(TaKaRa,大连)按照说明书进行PCR反应,反应体系:PrimeSTAR GXL Premix 12.5 μL,上、下游引物0.5 μL,cDNA模板1 μL,加ddH2O水至25 μL;反应程序:98 ℃预变性5 min,98 ℃变性10 s, 56 ℃退火15 s,72 ℃延伸60 s,30个循环。扩增产物经1%琼脂糖凝胶电泳检测后,使用MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0进行纯化(TaKaRa,大连),回收的产物与pMD19-T载体(TaKaRa,大连)连接,转化大肠杆菌DH5α感受态细胞,测序得到新疆野生核桃JfDREB1A基因的cNDA全长序列。

表1 引物列表Table 1 List of primers
1.2.2 生物信息学分析 利用ExPASy ProtParam软件预测JfDREB1A蛋白质的等电点和相对分子质量,利用Predict Protein和SMART软件预测JfDREB1A蛋白的二级结构和保守功能域,利用DNAMAN软件进行同源序列分析,利用MEGA7软件绘制系统发育树。
1.2.3JfDREB1A基因的表达水平分析 将幼苗置于4 ℃人工培养箱(DLRX-450B-LED,锦玟,上海)中进行胁迫处理,时间设置为0、1、2、4、8、12和24 h,分别取顶叶下2~5片嫩叶液氮速冻,置于-80 ℃冰箱保存,备用。使用Primer 5.0设计引物,以18S rRNA作为内参,利用qTOWER 3 G荧光定量PCR仪(Analytikjena,德国),使用SYBR Green qPCR Master Mix kit(赛维尔,武汉)方法对幼苗在低温下的基因表达水平进行分析。qPCR反应体系:qPCR Mix 7.5 μL,上、下游引物0.75 μL,cDNA模板2 μL,加ddH2O水至15 μL;反应程序:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火30 s,40个循环,熔解曲线(95 ℃~65 ℃,0.3 ℃/15 s),3次生物学重复试验,采用2-ΔΔCt方法计算相对表达量。
1.2.4JfDREB1A基因的原核表达载体构建 设计带有BamHI和SalI的酶切位点引物(表1),以JfDREB1A质粒为模板,利用高保真聚合酶TransStar KD Plus(TransGen)进行PCR扩增,按照孙伟等[17]方法进行酶切连接转化,菌液PCR及测序鉴定阳性克隆。将测序正确的重组质粒转化大肠杆菌DE3感受态细胞,菌液PCR筛选阳性克隆,用于接下来的JfDREB1A蛋白诱导试验。
1.2.5 融合蛋白在大肠杆菌中的诱导表达 取重组菌液接种于2 mL液体LB培养基中,37 ℃、200 r/min培养12~16 h。次日使用1∶50配比转接到10 mL现配LB液体培养基中,待菌液浓度达到OD600为0.6~0.8时(约3 h),加入(PTG(Isopropyl beta-D-thiogalacyranoside)至终浓度分别为0、0.2、0.5、1.0、1.5和2.0 mmol/L, 37 ℃诱导4 h。0.5 mmol/L IPTG诱导4 h的pET-28a空载体作为对照。取100 μL菌液, 12 000 r/min,离心2 min,弃上清,用40 μL PBS 悬浮菌体,加入10 μL 5×SDS Loading Buffer, 95 ℃变性5 min,冷却至4 ℃后备用。取10 μL进行12% SDS-PAGE电泳检测,确定最适诱导剂浓度。
按上述方法,以终浓度0.5 mmol/L IPTG进行诱导表达,以相同条件的pET-28a转化菌为对照,37 ℃条件下培养0、2、4和6 h后分别收集菌液,进行12% SDS-PAGE电泳检测,确定最适培养时间。
1.2.6 数据分析 采用Microsoft Office Excel 2019进行试验数据分析及图表制作,低温胁迫下的表达水平采用SPSS 21.0软件统计分析,进行One Way ANOVA和Duncan’s多重比较(P<0.05)。
2 结果与分析
2.1 JfDREB1A基因的克隆和生物信息学分析
以新疆野生核桃嫩叶cDNA为模板,通过PCR扩增获得了DREB1A基因的编码区,长度为645 bp(图1),相对分子质量为23.96 ku,理论等电点为6.2。NCBI比对表明,该基因与拟南芥DREB1A同源,命名为JfDREB1A。

M.DL2000 marker; 1. JfDREB1A
利用Predict Protein和SMART软件预测JfDREB1A蛋白的二级结构和保守功能域,结果表明:该蛋白由214个氨基酸组成,H-螺旋占 23.36%,H-环64.02%,包含大约60个氨基酸组成的一个AP2结构域,属于典型的DREB1/CBF转录因子(图2)。
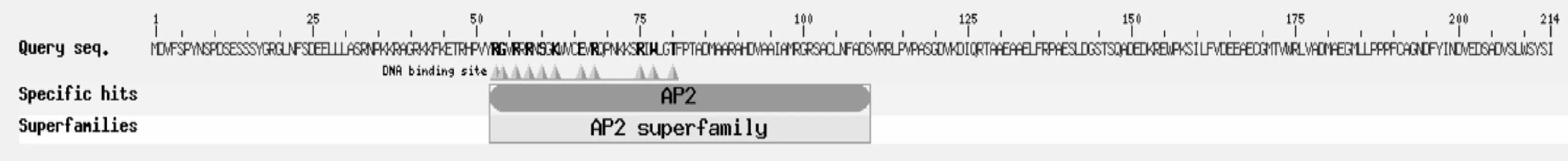
图2 JfDREB1A蛋白的结构示意图Fig.2 Schematic diagram of JfDREB1A protein structure
利用DNAMAN 9.0软件对新疆野生核桃JfDREB1A的氨基酸序列与其他植物基因编码序列进行多序列比(图3),结果表明,JfDREB1A编码蛋白与其他植物的DREB1转录因子具有高度同源性,其中同普通核桃的相似性为100%,JfDREB1A基因具有高度保守性。利用MEGA 7.0软件将JfDREB1A与其他植物DREB1转录因子构建系统进化树,结果发现,JfDREB1A与普通核桃(AFV93473.1)的DREB1基因聚集在同一分支上,亲缘关系最近(图4)。

AFV93473.1.核桃; ALJ92425.1.香樟; AYM54799.1.美味猕猴桃; QDM14392.1.软枣猕猴桃; AIX87844.1.扁桃;ADZ23479.1.白桦; ABC79626.1.毛白杨; ABR23056.1.番薯; XP_042976720.1.美国山核桃

图4 JfDREB1A蛋白与其他物种DREB转录因子氨基酸序列的系统进化树Fig.4 Phylogenetic tree of JfDREB1A protein and other DREB1A transcription factors
2.2 JfDREB1A基因在低温胁迫下的表达水平
在4 ℃低温胁迫处理下,JfDREB1A基因在1 h时表达量即明显上调,直到8 h时达到最大,相对表达量为2.05,为对照的2.1倍,之后开始降低并保持相对恒定,处理24 h时的表达量仍高于对照(图5)。
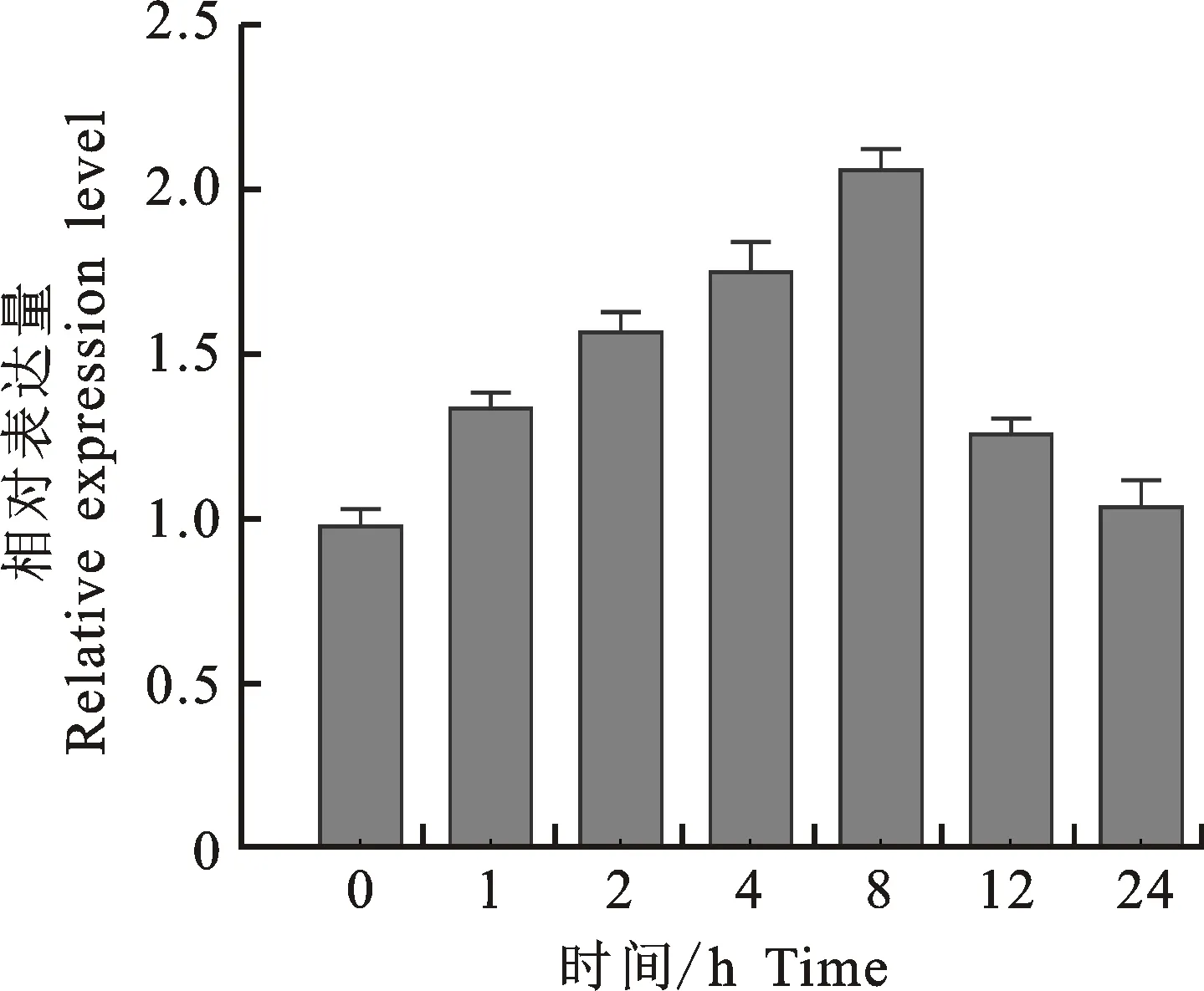
图5 JfDREB1A基因在4 ℃低温胁迫下的表达变化Fig.5 Relative expression level of JfDREB1A gene at 4 ℃
2.3 原核表达载体构建及SDS-PAGE检测
将JfDREB1A基因片段与pET-28a(+)表达载体连接后,转化大肠杆菌(DE3),成功获得pET-28a-JfDREB1A重组表达质粒,经菌液PCR鉴定,表达载体正确(图6)。

M.DL2000 marker; A:1.pET-28a-JfDREB1A; B:1~8.pET-28a-JfDREB1A菌液PCR
SDS-PAGE电泳检测结果如图7所示,在诱导温度为37 ℃,0.2、0.5、1.0、1.5 mmol/L的IPTG诱导下,均能诱导出pET-28a-JfDREB1A蛋白,且与预期大小一致,而经0.5 mmol/L IPTG诱导的对照pET-28a空载体则没有表达(图7)。另外,用0.5 mmol/L IPTG诱导JfDREB1A重组蛋白2、4和6 h,均能诱导出pET-28a-JfDREB1A蛋白,在2 h时表达量达到峰值,而对照pET-28a空载体则没有表达(图8)。

M.蛋白质标准分子量; 1.pET-28a-JfDREB1A未诱导; 2~5.pET-28a-JfDREB1A经终浓度为0.2、0.5、1.0、1.5 mmol/L的IPTG诱导4 h; 6.pET-28a空载体经终浓度为0.5 mmol/L的IPTG诱导4 h

M.蛋白质标准分子量; 1~4.pET-28a-JfDREB1A经终浓度为0.5 mmol/L的IPTG诱导0、2、4、6 h; 5~8.pET-28a空载体经终浓度为0.5 mmol/L的IPTG诱导0、2、4、6 h
3 讨论与结论
研究植物如何响应低温胁迫一直是植物研究领域中的热点话题,对于保障植物可持续发展有着重要的理论与实践价值[3, 18]。植物可通过转录因子调节应激信号途径中基因的表达,从而响应低温逆境胁迫[19],DREB1/CBF转录因子能与DRE/CRT元件结合,在植物应对低温等非生物胁迫中发挥着重要作用[1, 20-21]。本研究从新疆野生核桃中克隆得到JfDREB1A基因的cDNA全长序列,对其结构域、进化关系、低温胁迫表达特征及蛋白的诱导表达等方面进行了分析。新疆野生核桃JfDREB1A基因的开放阅读框为645 bp,蛋白质分子质量为23.96 ku,具有DREB1/CBF转录因子的保守结构域,与普通核桃的CBF基因(AFV93473.1)聚集在同一分支上,亲缘关系最近。研究发现,当受到低温胁迫时,核桃CBF基因表达上调,预测其受低温信号调节,在核桃适应寒冷的过程中起着重要作用[22]。与同源的核桃CBF基因相似,JfDREB1A基因对低温胁迫表现出很强的诱导表达特征,4 ℃低温胁迫1 h时表达量即明显上调,8 h时达到最大,推测JfDREB1A基因在新疆野生核桃响应低温过程中可能具有一定功能。
为进一步探索JfDREB1A基因在大肠杆菌(DE3)感受态细胞中的高效表达,构建了pET-28a-JfDREB1A重组表达质粒,经SDS-PAGE检测得到大小约为29 ku的融合蛋白pET-28a-JfDREB1A,与预测蛋白大小相符。原核表达融合蛋白的结果易受多种条件影响[23]。不同的蛋白,最佳诱导剂浓度和诱导时间也不同[24-25]。新疆野生核桃pET-28a-JfDREB1A重组蛋白在诱导剂IPTG终浓度为0.5 mmol/L、诱导时间为 2 h时表达量最高。在添加一定浓度IPTG时,IPTG浓度和表达速度成正比,新疆野生核桃pET-28a-JfDREB1A重组蛋白在2 h表达量最高,可能是由于IPTG的终浓度比上述研究浓度要高。由于原核表达受诱导温度、诱导剂浓度和诱导时间等多种条件影响,还需进一步优化以更好地获取目的蛋白,制备抗体、研究其功能作用。
