电针对胰岛素抵抗大鼠肝脏组织SIRT1/ATG7信号通路的影响*
2023-06-25王静芝王雅媛郑紫桐梁凤霞
易 璇, 陈 丽, 王静芝, 王雅媛, 郑紫桐, 梁凤霞
湖北中医药大学针灸骨伤学院,武汉 430065
胰岛素抵抗(insulin resistance,IR)是一种由于内分泌系统异常而导致的复杂病理状态。它是糖尿病、冠心病、多囊卵巢综合征等多种疾病的共同危险因素[1-2],严重威胁着人类的健康。IR不仅存在于骨骼肌、脂肪、肾脏等组织器官中,也存在于肝脏组织中[3]。研究表明,肝脏脂肪含量与胰岛素敏感性密切相关,降低肝脏脂肪含量能够提高机体胰岛素敏感性,改善IR[4]。又因为自噬是脂肪降解和储存的重要环节[5],研究肝脏组织的自噬途径成为改善肝脏胰岛素敏感性的突破口。沉默信息调节因子1(silent information regulator 2 related enzyme 1,SIRT1)是一种诱导自噬的乙酰化酶,其可以通过去乙酰化自噬相关蛋白7(autophagy-related protein 7,ATG7)形成复合体,从而激活自噬。肝脏SIRT1表达降低,导致ATG7乙酰化水平升高,可引起自噬流受损、肝脏脂质沉积和血糖稳态失衡[6-7]。本团队前期研究发现低频电针可以减轻外周和中枢炎症状态,调控能量代谢,改善IR,这种作用与SIRT1对其底物的去乙酰化调控有关[8-9]。但是中枢SIRT1抑制剂并不能完全阻断针刺效应,电针治疗还可能通过其他途径影响IR。本文在前期研究基础上,观察电针对肝脏组织SIRT1/ATG7信号通路的影响,探讨电针治疗IR的潜在机制。
1 材料与方法
1.1 实验动物
60只7周龄Wistar雄性大鼠,体质量(220±20)g,来源于湖北省实验动物研究中心,许可证号:SCXK(鄂)2020-0018。饲养条件:湖北中医药大学SPF级动物房,温度(25±2)℃,相对湿度(50±5)%,大鼠自由进食与饮水,12 h/12 h明暗周期。本实验操作严格遵守《关于善待实验动物的指导性意见》中的相关规定。
1.2 主要试剂与仪器
0.30×13 mm一次性无菌针灸针、HANS LH202H型电针治疗仪(北京华运安特科技有限责任公司),冷冻离心机(湖南湘仪实验室仪器开发有限公司),电泳仪(北京六一仪器厂),酶标仪(Diatek公司)、扫描仪(Canon公司)。
β-actin抗体(天德悦),SIRT1一抗、ATG7一抗(Abcam)、p-GSK-3β一抗(CST)、HRP-Goat anti Rabbit二抗(ASPEN)、SDS-PAGE凝胶制备试剂盒、RIPA裂解液、BCA蛋白质浓度测定试剂盒、ECL化学发光检测试剂盒、磷酸化蛋白酶抑制剂(ASPEN)、Protein A+G Agarose(碧云天)。
1.3 模型制备及评价
实验大鼠适应性饲养1周后,随机选取10只以普通饲料喂养,8周后随机选取其中8只作为正常组,剩余50只以高脂饲料喂养,制备IR大鼠模型。喂养8周后,测量大鼠体质量,从高于正常组体质量平均值20%的40只大鼠中随机取3只行高胰岛素-正葡萄糖钳夹术(hyperinsulinemic-euglycemic clamp,HEC)以确定IR模型是否复制成功。若所测大鼠的葡萄糖输注率(glucose infusion rate,GIR)小于正常组20%则认定为IR。将造模成功的40只大鼠随机进行编号,并挑选32只随机分入模型组、电针组、SIRT1激活剂组和SIRT1抑制剂+电针组,每组8只。
1.4 干预方法
电针组参照《实验针灸学》[10]选取中脘、关元、足三里及丰隆四穴进行电针干预。足三里和丰隆连接同一组导线,关元和中脘连接另一组导线。电针刺激采用连续波,频率2 Hz,强度1 mA。每次10 min,隔日1次,每周干预3次,共干预8周。SIRT1激活剂组给予SIRT1激活剂白藜芦醇(200 mg/kg)灌胃给药,每周3次,共8周。SIRT1抑制剂+电针组给予SIRT1特异性抑制剂EX527(10 mg/kg)腹腔注射给药,每周3次,共8周,并于注射后实施与电针组相同的治疗。
1.5 标本采集
干预结束后,各组大鼠禁食不禁水12 h,采用2%戊巴比妥钠(0.25 mL/100 g)行腹腔注射麻醉,取肝脏组织,置于液氮中速冻后保存于-80℃冰箱备检。
1.6 观察指标及检测方法
1.6.1 餐后血糖(postprandial blood glucose,PBG)及腹腔胰岛素耐量(intraperitoneal insulin tolerance test,IPITT)检测 电针干预前及干预8周后,对各组大鼠进行尾尖取血,用快速血糖仪测定大鼠PBG。电针干预6周后,对各组大鼠进行IPITT检测,所有大鼠空腹12 h,尾尖取血测空腹血糖,然后行腹腔胰岛素注射(1 U/kg),并测量注射后30、60、90、120 min的血糖值。
1.6.2 全身胰岛素敏感性测定 电针干预8周后,每组大鼠各取3只行HEC检测。术前大鼠禁食8 h,在尾根部注射局麻(2%利多卡因0.5 mL)。行尾动脉插管,接装有肝素生理盐水的注射器。尾静脉插管并分别连接肝素生理盐水及小三通。小三通管分别连接胰岛素注射液和30%葡萄糖注射液。取尾动脉血0.5 mL测基础血糖。接着以恒定速度[0.25 U/(kg·h)]输入胰岛素,每5 min测1次血糖并调整GIR,使血糖保持在稳定范围内(基础血糖±0.5 mmol/L)。共采血24次,取60 min~120 min的GIR,求平均值,其值越低,表示IR越严重。
1.6.3 Western blot法检测大鼠肝脏组织中SIRT1、ATG7、p-GSK-3β蛋白表达 提取肝脏组织总蛋白,测定样品蛋白浓度。进行SDS-PAGE电泳,之后进行转膜,封闭1 h,除去封闭液,加入一抗[β-actin(1∶10000);SIRT1(1∶1000);ATG7(1∶1000);GSK-3β(1∶2000)]4℃孵育过夜。回收一抗,用TBST洗3次,每次5 min。加入稀释好的二抗,室温孵育30 min,用TBST在室温下摇床上洗4次,每次5 min。进行化学发光检测,分析蛋白相对表达量。
1.6.4 免疫共沉淀技术检测ATG7蛋白乙酰化的水平 细胞充分裂解后取上清。加入抗体,4℃缓慢摇动孵育过夜,加入Agarose protein A+G,置于4℃摇转仪中反应6 h。离心5 min,弃上清,留沉淀于管中,用预冷的PBS洗涤上述沉淀3遍。收集沉淀,加入上样缓冲液重悬,沸水煮5 min。Western blot法检测乙酰化ATG7水平。
1.7 统计学方法
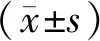
2 结果
2.1 模型评价
与正常组比较,造模后高脂喂养组大鼠GIR显著降低(P<0.05),说明IR大鼠模型制备成功。见图1。

与正常组比较,*P<0.05;n=3图1 造模后正常组与高脂组大鼠GIR的比较Fig.1 Comparison of GIR between normal group and high-fat group
2.2 各组大鼠PBG、IPITT、GIR比较
与正常组相比,模型组PBG显著升高(P<0.01),GIR显著降低(P<0.01);与模型组相比,电针组PBG显著降低(P<0.05),GIR显著升高(P<0.01),SIRT1激活剂组GIR显著升高(P<0.05);与电针组相比,SIRT1抑制剂+电针组GIR显著降低(P<0.05)。在IPITT实验中,60、90、120 min时,模型组IPITT水平均显著高于正常组(均P<0.01),电针组与SIRT1激活剂组IPITT水平均显著低于模型组(均P<0.05)。见图2。

A:GIR检测(n=3);B:PBG检测(n=8);C:IPITT检测(n=8);1:正常组;2:模型组;3:电针组;4:SIRT1激活剂组;5:SIRT1抑制剂+电针组;与正常组比较,**P<0.01;与模型组比较,#P<0.05 ##P<0.01;与电针组比较,△P<0.05图2 各组大鼠PBG、IPITT、GIR的比较Fig.2 Comparison of PBG、IPITT and GIR of rats in each group
2.3 各组大鼠肝脏组织p-GSK-3β蛋白表达比较
与正常组相比,模型组肝脏组织p-GSK-3β蛋白表达显著升高(P<0.01);与模型组相比,电针组肝脏组织p-GSK-3β蛋白表达显著降低(P<0.01),SIRT1激活剂组肝脏组织p-GSK-3β蛋白表达显著降低(P<0.05)。见图3。

1:正常组;2:模型组;3:电针组;4:SIRT1激活剂组;5:SIRT1抑制剂+电针组;与正常组比较,**P<0.01;与模型组比较,#P<0.05 ##P<0.01;n=8图3 各组大鼠肝脏p-GSK-3β蛋白表达比较Fig.3 Comparison of p-GSK-3β protein expression levels in rat liver tissues in each group
2.4 各组大鼠肝脏组织SIRT1、ATG7蛋白表达比较
与正常组相比,模型组肝脏组织SIRT1、ATG7蛋白表达显著降低(均P<0.01);与模型组相比,电针组肝脏组织SIRT1、ATG7蛋白表达显著升高(均P<0.01),SIRT1激活剂组肝脏组织SIRT1、ATG7蛋白表达显著升高(均P<0.01),SIRT1抑制剂+电针组肝脏组织ATG7蛋白表达显著升高(P<0.05);与电针组相比SIRT1抑制剂+电针组肝脏组织ATG7蛋白表达显著降低(P<0.05)。见图4。

1:正常组;2:模型组;3:电针组;4:SIRT1激活剂组;5:SIRT1抑制剂+电针组;与正常组比较,**P<0.01;与模型组比较,#P<0.05 ##P<0.01;与电针组比较,△P<0.05;n=8图4 各组大鼠肝脏组织SIRT1、ATG7蛋白表达比较Fig.4 Comparison of SIRT1 and ATG7 protein expression levels in rat liver tissues in each group
2.5 各组大鼠肝脏组织ATG7蛋白乙酰化水平比较
与正常组相比,模型组肝脏组织ATG7蛋白乙酰化水平升高;与模型组相比,电针组肝脏组织ATG7蛋白乙酰化水平降低,SIRT1激活剂组肝脏组织ATG7蛋白乙酰化水平降低,SIRT1抑制剂+电针组肝脏组织ATG7蛋白乙酰化水平降低;与电针组相比SIRT1抑制剂+电针组肝脏组织ATG7蛋白乙酰化水平升高。见图5。
3 讨论
IR与多种疾病的发生密切相关,早期干预IR提高胰岛素敏感性,对防治IR相关疾病具有重要意义。从中医角度分析,IR的产生多与痰浊内阻,脾肾亏虚有关[11],因此,治疗IR应从化痰祛湿,补益脾肾立法。大量研究表明,针灸可有效治疗IR相关疾病[12-14]。且基于众多专家治疗IR的选穴经验,发现中脘、关元、足三里、丰隆为治疗IR的首选穴[15]。其中中脘可健脾化湿,丰隆可化痰开窍,两者配合可化痰祛湿;关元可固本培元,足三里可健脾益气,两者配合可补益脾肾。因此本实验选取上述四穴进行电针治疗。大量研究显示2 Hz低频电针能够有效地改善IR[16-18],且在前期实验中也得到验证[8-9],因此本实验继续沿用2 Hz电针干预IR大鼠,并观察其效应。在电针强度、留针时间,以及干预频次和疗程上,至今还没有统一方案。因此,本实验结合课题组以往的研究结果,考虑实验安全性,最终将电针参数定为2 Hz,1 mA,连续波,每日电针10 min,每周治疗3次,总疗程8周。
肝脏是胰岛素信号调节葡萄糖、脂质和蛋白质代谢的重要器官之一,GSK-3β是参与肝糖代谢的关键酶。有研究表明,降低GSK-3β的磷酸化水平,促进GSK-3β蛋白底物GS的正性表达,能够提高胰岛素信号通路的传导,增强胰岛素的敏感性,改善肝脏IR[19]。因此p-GSK-3β可反应肝脏胰岛素敏感性水平。采用HEC检测大鼠GIR,可较好地反映全身胰岛素敏感性,为评估IR的金标准。本研究结果显示,与正常组相比,模型组PBG、IPITT水平显著上升,GIR显著下降,p-GSK-3β蛋白表达显著上升,证明高脂诱导的大鼠存在胰岛素敏感性降低的现象。电针干预后,大鼠PBG、IPITT、GIR、p-GSK-3β蛋白表达变化均被逆转,证明电针可以提高大鼠胰岛素敏感性,改善IR,这与前期研究结果一致[8-9]。
SIRT1是一种NAD+依赖性去乙酰化酶,影响多种组织与器官的能量代谢[20]。SIRT1通过对靶蛋白的乙酰化调控参与基因转录、细胞凋亡、代谢等多个过程[21]。据研究表明,SIRT1可以通过刺激胰岛素分泌、调控胰岛素信号通路与降低炎症反应等途径,提高机体胰岛素敏感性,改善IR[22]。白藜芦醇为SIRT1的激活剂,可提高SIRT1去乙酰化酶活性,增强胰岛素敏感性[23],在整体条件下减少喂饲高脂肪引起的IR。EX527为SIRT1的抑制剂,可抑制SIRT1去乙酰化酶活性[24],是与白藜芦醇做对比实验的理想药剂。ATG7是一种蛋白因子,有研究表明其表达水平与细胞自噬密切相关,SIRT1可通过去乙酰化ATG7,从而促进细胞的自噬[25]。而自噬可以提高肝脏胰岛素敏感性,抑制肝细胞自噬,则导致肝脏胰岛素敏感性降低[26-28]。因此,电针改善IR的机制可能与其激活SIRT1表达,去乙酰化作用于ATG7,促进细胞自噬,从而改善胰岛素敏感性有关。本实验以SIRT1激活剂为对照,观察肝脏SIRT1对ATG7的去乙酰化作用,运用SIRT1特异性抑制剂EX527,结合电针效应的变化,揭示电针通过SIRT1/ATG7信号通路改善IR的作用机制。本研究结果提示当SIRT1表达降低时,ATG7乙酰化水平升高,从而引起IR;当SIRT1表达升高时,ATG7乙酰化水平降低,从而改善IR。说明电针可以通过调节SIRT1、ATG7表达,提高胰岛素敏感性,改善IR,但SIRT1/ATG7只是电针作用于大鼠肝脏组织,改善IR的途径之一,并不是唯一途径。由此可推论,电针可能通过激活肝脏SIRT1,去乙酰化作用于ATG7,从而改善IR。
大量的研究证实了电针可以通过SIRT1介导的信号通路改善IR。黄琪等[29]建立肥胖大鼠模型,运用电针对其进行治疗,结果发现电针可改善肥胖大鼠胰岛素敏感性,其机制可能与SIRT1/NF-κB信号通路有关。杨亚南等[30]通过实验研究发现,电针增强肥胖大鼠胰岛素敏感性,改善IR,其机制可能与电针调控SIRT1/FoxO1通路有关。另有研究发现,标本配穴电针提高股四头肌SIRT1蛋白表达水平可能是其增强IR大鼠胰岛素敏感性、改善IR的重要机制之一[31]。本实验研究显示,电针能够提高IR大鼠肝脏与全身胰岛素敏感性,改善IR,其机制与电针激活肝脏SIRT1,干预ATG7乙酰化作用有关。与上述众多实验报道相一致。
综合上述内容,电针疗法可提高IR大鼠全身及肝脏胰岛素敏感性,有效改善IR,其作用机制可能与电针激活肝脏SIRT1/ATG7信号通路有关。本研究深入探讨电针通过SIRT1介导的信号通路改善胰岛素抵抗的作用与机制,不仅为针灸临床防治胰岛素抵抗提供有效的理论和实验依据,而且有助于在世界范围内推广针灸防治胰岛素抵抗相关疾病,造福于人类。
