儿童塑型性支气管炎临床特征及复发危险因素分析
2023-06-20田小银张光莉王崇杰谷瑞雪李媛媛李沁原罗健罗征秀
田小银 张光莉 王崇杰 谷瑞雪 李媛媛 李沁原 罗健 罗征秀
(重庆医科大学附属儿童医院呼吸科/国家儿童健康与疾病临床医学研究中心/儿童发育疾病教育部重点实验室/儿科学重庆市重点实验室,重庆 400014)
塑型性支气管炎(plastic bronchitis,PB)是一种累及各个年龄段的临床少见呼吸系统疾病,其特点为气道内形成局部或广泛橡胶状管型,导致气道部分或完全性阻塞,若不及时解除气道阻塞,可引起肺通气功能障碍,诱发呼吸困难,甚至致命性呼吸窘迫,后期可遗留肺不张、闭塞性支气管炎、支气管扩张等,对患儿肺功能及生活质量产生较大影响[1-4]。经支气管镜下取出或咳出物中见支气管塑型样物即可诊断[1,4]。支气管镜检查清除塑型物是治疗PB的重要手段。PB确切患病率尚缺乏流行病学证据,随着近年来支气管镜的广泛应用,PB 病例不断被发现,但由于PB 症状不典型,易引起误诊或漏诊,当塑型物及其分支堵塞气道后,可出现迅速加重的呼吸衰竭危及生命。此外,少数患儿可能反复形成塑型物,目前对PB患儿塑型物反复形成的探讨甚少,仅有个案报道认为合并气道高反应者可能易复发PB[5-6]。本研究回顾性分析我院107 例PB 患儿的临床特征,探讨塑型物反复发生的危险因素,以提高对该病的早期识别能力及诊治水平,改善患儿预后。
1 资料与方法
1.1 研究对象
回顾性分析2012年1月—2022年7月于重庆医科大学附属儿童医院住院治疗的107 例PB 患儿的临床资料。纳入标准:(1)年龄1 月龄至18 岁,性别不限;(2)住院治疗的肺炎患儿;(3)支气管镜检查见气道部分或全部堵塞,取出分泌物呈“树枝样”塑型性改变。排除标准:(1)临床资料不完整者;(2)先天性心脏病者;(3)淋巴管回流异常者;(4)支气管异物吸入者。本研究获得重庆医科大学附属儿童医院医学伦理委员会审批同意,批准号为(2022) 年伦审(研) 第(458)号。
1.2 资料收集
通过电子病历系统回顾性收集患儿临床资料,包括起病年龄、性别、住院时长、基础疾病、病程、临床症状及体征、实验室检查结果、影像学表现、支气管镜检查结果、诊治经过及转归等。通过电话及门诊、住院电子病历系统收集患儿随访及预后情况。
1.3 观察指标
根据塑型物发生次数将PB患儿分为单次PB组与复发性PB组。单次PB组:塑型物发生1次;复发性PB组:塑型物发生≥2次;总结两组的临床特征并分析反复发生塑型物的危险因素。
1.4 统计学分析
采用SPSS 27.0 软件进行统计学分析。计数资料以例数及百分率(%)表示,组间比较采用卡方检验。计量资料符合正态分布的以均数±标准差(±s)表示,组间比较采用两样本t检验;非正态分布的以中位数(四分位数间距)[M(P25,P75)]表示,组间比较采用Mann-WhitneyU检验。取单因素分析中P<0.05 的指标再行多因素logistic回归分析塑型物反复发生的危险因素。P<0.05 为差异有统计学意义。
2 结果
2.1 一般人口学及临床特征
共收集107 例PB 患儿,其中男性61 例(57.0%),女性46 例(43.0%),中位年龄5.0(2.5,7.9) 岁,<1 岁6 例(5.6%),1~岁23 例(21.5%), 3~岁37 例(34.6%), ≥6 岁41 例(38.3%)。住院中位时间12(8,19)d。合并支气管哮喘14 例(13.1%),合并过敏性疾病史25 例(23.4%),肺血管畸形4例(3.7%),原发性纤毛运动障碍1例(0.9%)。
所有患儿均有咳嗽。发热96 例(89.7%),其中高热90例(84.1%),超高热6例(5.6%),平均热程11(7,15)d。气促73 例(68.2%),呼吸衰竭64 例(59.8%)。34 例(31.8%)合并肺外多脏器(≥2 个)功能损害,其中急性肝损伤27 例(25.2%),神经系统受累25例(23.3%),心血管系统损害18 例(16.8%),凝血功能障碍10 例(9.3%),急性肾损伤6例(5.6%)。
2.2 实验室检查
107 例患儿入院时均行外周血相关实验室检查,其中白细胞计数7.40(4.60,12.05)×109/L,18 例(16.8%)升高,19 例(17.8%)降低;血小板计数245.50 (172.00,340.00) ×109/L,5 例(4.7%)升高,12 例(11.2%)降低;贫血17 例(15.9%);C 反应蛋白19.50(8.00,46.58)mg/L,53 例(49.5%) 升高;降钙素原0.48 (0.14,2.19)ng/mL,52 例(48.6%)升高。谷丙转氨酶24.70(16.88,41.73)U/L,升高27 例(25.2%);血清白蛋白37.25 (28.30,42.03) g/L,29 例(27.1%) <30 g/L;乳酸脱氢酶405.70 (259.75,718.25) U/L, 39 例(36.4%) 升高; 38 例(35.5%)电解质紊乱;13例(12.1%)心肌标志物升高。D-二聚体2.17(0.79,4.22)mg/L。
2.3 影像学检查
107 例患儿均行胸部CT 检查,其中肺叶受累≥2个54例(50.5%),肺不张66例(61.7%),胸腔积液52例(48.6%),气胸11例(10.3%),纵隔气肿6例(5.6%),皮下积气4例(3.7%),心包积气2例(1.9%)。66例(61.7%)行气管三维重建,39例(59.1%)提示部分支气管未显影或堵塞。
2.4 病原学检测呼吸道病原检出情况
107例患儿均行呼吸道病原学检测,检测标本为鼻咽抽吸物和/或支气管肺泡灌洗液,若相关病毒、非典型病原体(polymerase chain reaction,PCR)阳性(≥103copies/mL)和/或抗原检测阳性,则考虑其感染[7];细菌培养阳性需结合临床综合考虑感染或临床分离株。其中肺炎支原体感染47例(43.9%);腺病毒感染28 例(26.2%),流感病毒感染17 例(15.9%),副流感病毒感染9 例(8.4%);临床常见前3位细菌感染23例(21.5%),常见≥2种病原体混合感染30例(28.0%)。见表1。

表1 107例PB患儿临床常见呼吸道病原学检出情况
2.5 支气管镜检查及气道内塑型物取出术
107例患儿均行支气管镜检查及气道内塑型物取出术。初次镜检平均病程为(11±6)d,81 例(75.7%)患儿病程2周内完成支气管镜检查,并确诊PB。支气管镜下均可见气道黏膜充血、水肿、塑型物堵塞,其中22 例(20.6%)累及肺叶≥2 个,5 例(4.7%)累及全肺叶。71 例(66.4%)发生1次塑型物(单次PB组);36例发生2次以上塑型物(复发性PB 组),其中18 例(33.6%)发生2 次塑型物,另18 例(16.8%)发生3 次及以上塑型物,均一次性取出塑型物,见图1。14 例(13.1%)塑型物行组织学检查,11 例提示纤维素性渗出及炎症细胞浸润,3例提示大量红细胞、纤维素性渗出及少量炎症细胞浸润,见图2。

图1 “树枝样”塑型物 A、B 均为支气管镜下取出的塑型物。

图2 塑型物病理结果 大量纤维素性渗出,伴中性粒细胞、单核细胞为主的炎症细胞浸润(苏木精-伊红染色,×100)。
2.6 塑型物反复发生的危险因素分析
单次PB组与复发性PB组患儿一般情况比较见表2。两组热程、并发肺外多脏器功能损害、谷丙转氨酶、血清白蛋白<25 g/L、合并肺不张、镜下PB累及≥2个肺叶、首次取出塑型物后仍需有创通气比较差异有统计学意义(P<0.05)。排除谷丙转氨酶(两组中位数均在正常参考值范围内)后,将其余指标纳入logistic 回归分析,发现镜下PB 累及≥2 个肺叶(OR=3.376,95%CI:1.044~10.919,P=0.042)、首次取出塑型物后仍需有创通气(OR=3.275,95%CI:1.086~9.880,P=0.035)、并发肺外多脏器功能损害(OR=2.906,95%CI:1.098~7.695,P=0.032)为PB 患儿塑型物反复发生的独立危险因素,见表3。

表2 单次组与复发组PB患儿临床特征比较

表3 PB患儿塑型物反复发生的危险因素logistic回归分析结果
2.7 治疗及转归
107 例患儿均行支气管镜检查及塑型物取出术,其中8 例(7.5%)行镜下冷冻治疗术。38 例(35.5%)入住儿童重症监护室治疗,时长为12(8,18)d。33 例(30.8%)予有创机械通气,通气时长10(7,14)d,其中25例(23.4%)取出塑型物后仍需有创通气。16例(15.0%)予无创通气治疗,通气时长4.5(2.0,9.3)d。7 例(6.5%)行胸腔闭式引流术,3 例(2.8%)行血液透析治疗。2例(1.9%)因体肺侧枝血管形成,行数字减影血管造影介入封堵术,其中1例治疗后仍反复咯血行肺叶切除术。
69 例(64.5%)患儿预后良好,肺部病变吸收,见图3。其中单次PB 组52 例(73.2%),复发性PB 组17 例(47.2%)。38 例(35.5%)患儿预后不良,其中单次PB 组19 例(26.8%),复发性PB组19 例(52.8%);死亡4 例,其中单次PB 组1 例(1.4%),复发性PB 组3 例(8.3%)。随访3 个月,遗留支气管扩张12例,闭塞性支气管炎11例,肺不张10 例,闭塞性细支气管炎3 例,肺纤维化1例。
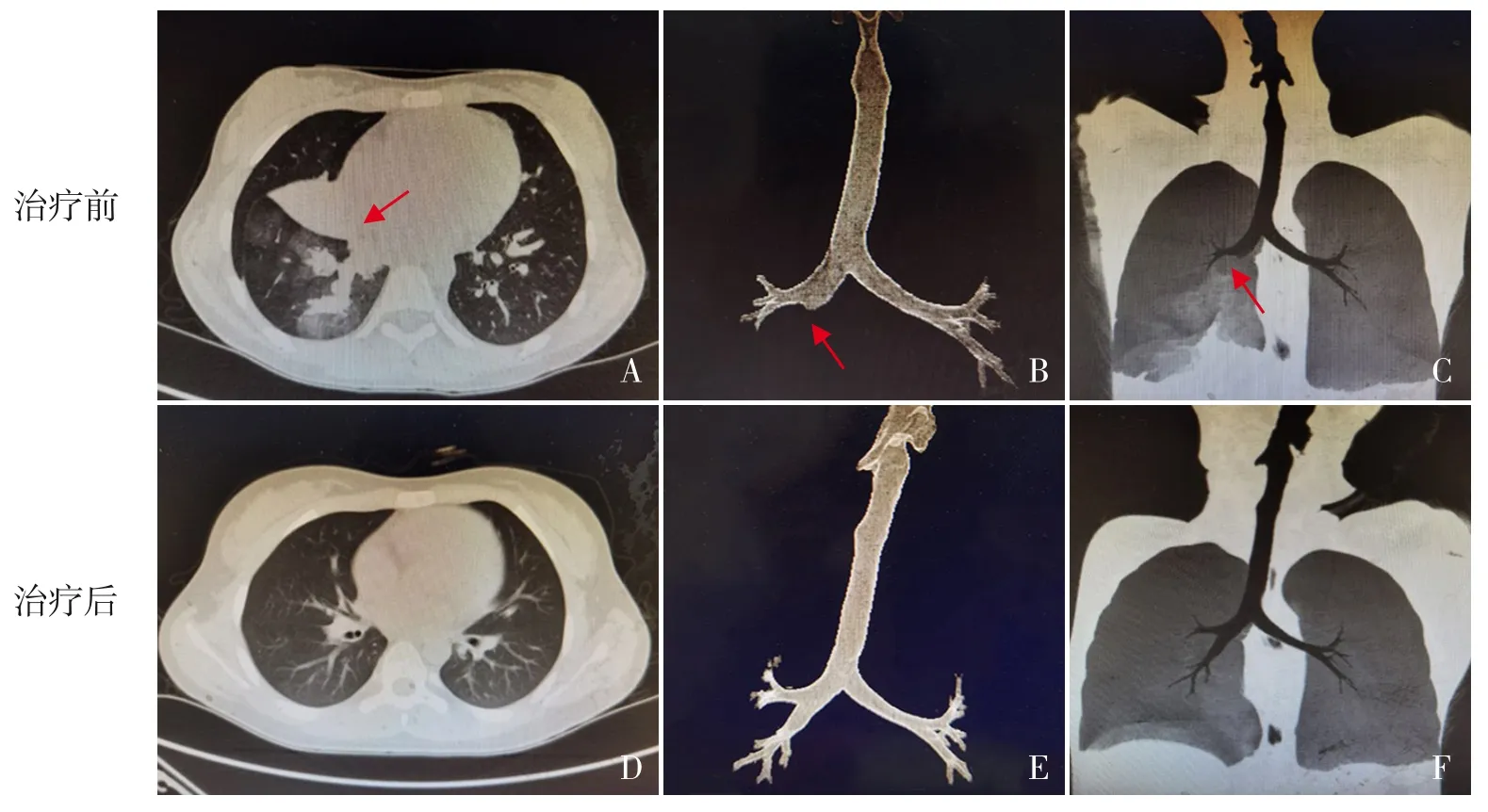
图3 PB患儿治疗前后胸部CT比较 治疗前,右肺中、下叶实变伴不张(A箭头处),气道重建示右中间支气管、中下叶支气管未显影(B、C箭头处);治疗后,双肺病变基本吸收(D),气道重建未见异常(E、F)。
3 讨论
1902 年Beitmann 等[8]首次报道PB,并依据解剖位置及基础疾病对其进行分类,此后在成人和儿童病例中均有报道,但目前尚无明确发病率统计,学界普遍认为PB 是一种较少见的呼吸系统疾病,但随着诊疗技术不断提高,确诊报道例数逐渐增多。
PB 主要依据支气管镜下取出或咳出物中见支气管塑型物进行诊断,病因复杂,呼吸道感染、先天性心脏病及呼吸道变应性疾病是导致PB 的主要病因,PB 也可继发于囊性纤维化、淋巴管畸形等[9-11]。目前最常用的分类方法是1997 年由Seear等[9]提出的依据塑型物的病理组织学特点分为Ⅰ型和Ⅱ型。Ⅰ型为炎症型,多为呼吸系统疾病引起,尤其是感染性疾病,病理切片可见大量炎症细胞浸润和纤维素性渗出;Ⅱ型为非细胞型,主要与先天性心脏病及淋巴管回流异常等相关,病理切片主要为黏蛋白,无或只有少量细胞浸润。本研究107 例PB 患儿均为Ⅰ型,既往国内病例报道也多为Ⅰ型PB[12-13]。目前国外学者病例报道大多为Ⅱ型PB[14-15]及少数由流感病毒感染所致Ⅰ型PB[16],其中紫绀型先天性心脏病为最常见原因之一,绝大部分发生于紫绀型先天性心脏病姑息治疗术后,如Fontan术后[10]。
PB在各个年龄段均可发病,多见于2~12岁儿童[3]。本组107 例患儿中,中位年龄5 岁,其中3岁以上患儿78例(72.9%),与舒玲莉等[13]报道相符。本研究中PB 患儿主要临床表现为咳嗽(100%)、发热(89.7%)、气促(67.3%)、呼吸困难(59.8%),合并肺不张(61.7%)、胸腔积液(48.6%),CT气管重建可提示部分支气管未显影或堵塞,与既往报道[4]一致。外周血炎症指标无特异性改变,白细胞计数、C 反应蛋白、降钙素原、乳酸脱氢酶可正常或轻度升高。本研究PB 患儿主要由呼吸道感染引起,最常见病原体为肺炎支原体,其次为腺病毒、流感病毒,与既往报道[13,17-18]一致。多数PB患儿临床症状较重,病情进展快,临床上针对肺炎患儿,若出现持续高热伴气促、迅速加重的呼吸道梗阻、通气功能障碍、不易纠正的低氧血症,胸部CT 提示肺不张或胸腔积液,需高度警惕PB 的发生,应尽早实施支气管镜检查明确。
PB 的治疗关键是早诊断,抑制塑型物生成,及时取出内生异物,缓解气道梗阻,改善通气[19]。经支气管镜行气道内塑型物取出术,是PB 患儿治疗的重要措施,当钳取困难时,可行介入治疗如冷冻治疗术,同时,需配合支气管肺泡灌洗、针对病原学治疗、必要时辅助通气等措施,加强分泌物排出、减轻气道炎症,有助于解除呼吸道梗阻。多数PB患儿在经首次支气管镜清除塑型物后,病情可较快缓解。本研究36例(33.6%)患儿经第1次支气管镜取净塑型物后,临床症状/体征改善不明显,或复查影像学吸收不佳,气管镜证实再次发生塑型物,导致持续性气道阻塞。多因素logistic分析显示,镜下PB累及≥2个肺叶、首次取出塑型物后仍需有创通气、并发肺外多脏器功能损害为PB 患儿塑型物反复发生的独立危险因素。既往研究[18,20-21]显示,气道炎症是呼吸道感染发生PB的重要机制,大量炎性细胞浸润和炎症介质释放,导致气道黏膜充血水肿、上皮细胞损伤脱落,从而引起气道堵塞及炎性狭窄,同时,炎症介质如白细胞介素可使呼吸道上皮细胞内黏蛋白大量加速生成,而细胞外高水平的刺激物如ATP、组胺等可使呼吸道黏液分泌增加数百倍,造成气道内黏液高分泌状态;其次,重度炎症还可继发黏膜纤毛清除功能障碍[22],使气道内大量脱落的细胞及黏液不能及时排出,从而导致内生塑型物的形成。部分PB 患儿因存在持续性或反复的呼吸道阻塞,导致难以纠正的低氧血症,可累及全身各个器官,导致其缺氧损伤,若合并多脏器功能损害时,如急性肝损伤、心血管系统损害、神经系统受累、凝血功能障碍、急性肾损伤等,则提示患儿气道炎症重,肺外多组织出现缺氧,需持续有创通气维持,从而形成恶性循环,阻碍气道炎症恢复,促进塑型物的再生成。同时,PB 的临床表现还取决于内生异物的生成速度及阻塞范围,既往研究[4]也表明,在肺炎支原体肺炎中,多肺叶受累是形成塑型物的独立危险因素。因此,结合本研究结果,对于镜下PB累及≥2个肺叶、首次取出塑型物后仍需有创通气、并发肺外多脏器功能损害的PB 患儿,提示气道炎症重,临床需高度关注,警惕塑型物反复生成可能,若病情缓解不佳或缓解后再次加重,需尽快再次行支气管镜检查。
经积极正规治疗,多数PB 患儿预后良好,本研究中少数患儿遗留后遗症(主要为呼吸系统),最常见为支气管扩张、闭塞性支气管炎、肺不张,极少数患儿可能出现无法缓解的呼吸窘迫,进而多脏器功能衰竭而最终死亡。本研究死亡4例,均与患儿合并严重基础病、合并多脏器功能衰竭等因素有关。
综上所述,对持续高热伴气促、呼吸衰竭,合并肺不张或胸腔积液的肺炎患儿,需高度警惕PB可能。支气管镜下PB累及≥2个肺叶、首次取出塑型物后仍需有创通气、并发肺外多脏器功能损害可能是PB患儿塑型物反复发生的危险因素。
本研究是目前单中心报道样本量最大的分析PB临床特征的研究,且首次分析了PB患儿塑型物反复发生的危险因素。但本研究为回顾性分析,病例数量及临床资料有限,可能导致相关研究结果局限,代表性不够,今后还需多中心、前瞻性研究进一步深入探讨,以期为PB 的临床诊疗提供更多的循证医学依据,改善患儿预后,提高生活质量。
