大黄素甲醚通过调节RAGE/MAPK信号通路减轻糖尿病性骨质疏松损伤
2023-06-19赵国宏白莉敏
杨 璐,赵国宏,白莉敏*
(1中国人民解放军空军军医大学第二附属医院老年医学科,西安 710032;2中国人民解放军空军军医大学第二附属医院内分泌科;*通讯作者,E-mail:Limin864517987@126.com)
糖尿病骨质疏松(diabetic osteoporosis,DOP)是一种严重的糖尿病并发症,其特征是骨量减少和微结构改变[1]。晚期糖基化终产物(advanced glycation end products,AGEs)[2]的过度积累及其信号转导受体晚期糖基化终产物受体(receptor of advanced glycation endproducts,RAGE)的高表达可阻止成骨细胞增殖,增加破骨细胞形成,减少骨形成,增加骨骼脆性[3]。目前治疗DOP的疗法包括增加骨形成的药物(阿巴拉帕肽、甲状旁腺激素等)、减少骨吸收药物(降钙素、双膦酸盐类药物等)、促进骨骼矿化的药物(钙和维生素D)[4]。上述疗法存在副作用,且长期疗效存疑[5]。迫切需要开发新型DOP治疗药物。蒽醌类物质具有良好的抗糖尿病和骨质疏松症功效[6],蒽醌类物质可抑制α-葡萄糖苷酶[7]和蛋白酪氨酸磷酸酶1B[8]活性以及破骨细胞形成[9]。大黄素甲醚(physcion,PHY)是一种从中药大黄中分离得到的蒽醌类物质,具有多种生物活性,如抗癌、抗菌、抗氧化和抗炎活性[10-12]。Inalegwu等[13]研究表明大黄素甲醚可改善糖尿病大鼠模型的空腹血糖(fasting blood glucose,FBG)、胰岛素抵抗、血脂异常、炎症反应和氧化应激标志物,且无明显毒性。然而,目前尚不清楚大黄素甲醚治疗DOP的效果。因此,本研究观察了大黄素甲醚对高脂饮食联合链脲佐菌素(streptozotocin,STZ)注射诱导建立的DOP模型大鼠的FPG、空腹胰岛素(fasting insulin,FINS)、血清脂代谢指标、血清氧化应激指标、胫骨组织学病变、胫骨力学参数、成骨/破骨调控基因转录、RAGE/丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号通路的影响,旨在探讨大黄素甲醚治疗DOP模型大鼠的作用及机制。
1 材料与方法
1.1 材料
1.1.1 实验试剂 大黄素甲醚(Physcion,PHY,批号:HY-N0108,纯度:99.10%)购自美国Med Chem Express公司。链脲佐菌素(STZ,批号:S0130)、二甲基亚砜(DMSO,批号:D2650)购自美国Sigma-Aldrich公司。标准饲料(批号:D12450J)、高脂饲料(批号:D12492)购自美国Research Diets公司。胰岛素(INS,批号:H203-1-1)、总胆固醇(TC,批号:A111-1-1)、甘油三酯(TG,批号:A110-1-1)、低密度脂蛋白胆固醇(LDL-C,批号:A113-1-1)、高密度脂蛋白胆固醇(HDL-C,批号:A112-1-1)、超氧化物歧化酶(SOD,批号:A001-3-2)、过氧化氢酶(CAT,批号:A007-1-1)、谷胱甘肽过氧化物酶(GSH-PX,批号:A005-1-2)、丙二醛(MDA,批号:A003-1-2)试剂盒购自南京建成生物工程研究所。苏木精和伊红(HE)染色试剂盒(批号:C0105M)购自碧云天生物技术研究所。PrimerScript RT试剂盒(批号:RR047A)、SYBR Premix Ex Taq Ⅱ试剂盒(批号:RR820A)购自日本TaKaRa公司。晚期糖基化终产物受体(RAGE,批号:ab216329))、p38丝裂原活化蛋白激酶(p38 MAPK)(批号:ab170099)、p-p38 MAPK(批号:ab178867)和GAPDH(批号:ab8245)一抗及HRP标记的二抗(ab6721)购自美国Abcam公司。
1.1.2 实验动物 100只6~7周龄无特定病原体级SD雄性大鼠(210~250 g)购自陕西君行生物科技有限公司,生产许可证:SCXK(陕)2022-001。大鼠在(23±2)℃、湿度(55±5)%、12 h明暗循环条件下饲养,不限制饮食。本研究内容已获得中国人民解放军空军军医大学第二附属医院伦理审查委员会批准(审批号:201907210057)。
1.2 方法
1.2.1 DOP大鼠模型的建立 通过高脂饮食联合STZ注射诱导建立DOP大鼠模型[14]。大鼠首先适应性喂养1周,然后取85只大鼠进行建模。使用高脂饲料喂养8周,然后连续2 d腹腔注射STZ(35 mg/kg),继续用高脂饲料喂养1周后尾静脉采血,检测FPG,当FPG≥16.7 mmol/L表示糖尿病大鼠建模成功。所有大鼠继续用标准饲料饲养8周,然后利用Quantum FX micro-CT机对大鼠胫骨进行扫描并测定骨密度(bone mineral density,BMD),当BMD小于正常大鼠平均BMD 2.5个标准差时表示DOP建模成功[15]。其余15只大鼠用标准饲料正常喂养。
1.2.2 大鼠分组及给药处理 本研究共有72只建模成功。将建模成功的DOP大鼠随机分为4组(n=18):模型组、PHY低剂量组、PHY中剂量组和PHY高剂量组。正常饲养的大鼠作为对照组(n=15)。PHY低剂量组、PHY中剂量组和PHY高剂量组大鼠分别给予灌胃2 ml剂量为10,20,30 mg/kg的大黄素甲醚[13]。大黄素甲醚经DMSO溶解后用生理盐水稀释,终浓度为5% DMSO。对照组和模型组大鼠分别灌胃2 ml的5% DMSO。各组大鼠均治疗12周。
1.2.3 FPG和空腹胰岛素(FINS)检测 末次治疗24 h后,对各组大鼠尾静脉采血,使用强生稳步血糖仪检测FPG。通过ELISA法检测FINS。
1.2.4 血清脂代谢指标检测 末次治疗24 h后,对各组大鼠尾静脉采血,4 ℃下3 000 r/min离心10 min,取血清,使用贝克曼AU680自动生化分析仪检测血清胆固醇(serum total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)和高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)。
1.2.5 血清氧化应激指标检测 根据试剂盒说明书检测各组大鼠血清氧化应激指标超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)和丙二醛(malonaldehyde,MDA)水平。
1.2.6 HE染色检测大鼠胫骨组织学病变 末次治疗24 h后,分离各组大鼠左胫骨,4%多聚甲醛固定72 h,10%DETA脱钙3个月,梯度乙醇脱水和二甲苯透明后,石蜡包埋制作4 μm厚的切片。按试剂盒说明进行HE染色,观察大鼠胫骨组织形态改变。
1.2.7 大鼠胫骨微型计算机断层扫描(micro-CT)分析 利用Quantum FX micro-CT机对各组大鼠胫骨进行扫描,扫描参数:能量/强度70 kVp,114 μA,8 W,扫描时间29.7 min。利用micro-CT自带软件SCANCO Medical AG进行骨力学参数定量分析,参数如下:骨密度(bone mineral density,BMD)、骨小梁数量(trabecular number,Tb.N)和骨小梁厚度(trabecular thickness,Tb.Th)。
1.2.8 免疫组织化学分析 将各组大鼠胫骨石蜡切片用二甲苯脱蜡,梯度乙醇水化,3%的H2O2室温孵育10 min,使用5%牛血清白蛋白封闭30 min。将切片与稀释度均为1∶500的RAGE和p38 MAPK一抗在4 ℃下孵育过夜,然后与稀释度为1∶500的HRP标记的二抗37 ℃孵育30 min。DAB显色,苏木精复染。使用奥林巴斯BX53显微镜拍摄照片。用Image Pro Plus6.0软件定量计算阳性蛋白染色面积百分比。
1.2.9 qRT-PCR分析RAGE、Runx2、OCN、OPN、ALP、BMP-2、RANK、RANKL和OPG基因表达水平 使用TRIzol试剂提取总RNA。使用PrimeScript RT试剂盒进行逆转录。使用SYBR Premix Ex Taq Ⅱ在ABI 7500实时荧光定量PCR仪上进行PCR。扩增条件如下:95 ℃ 5 min,95 ℃ 10 s,60 ℃ 20 s,72 ℃ 15 s,40次循环。GAPDH作为内参基因。通过2-ΔΔCt法计算靶基因的相对表达水平。引物序列信息见表1。
1.2.10 Western blot分析RAGE、p38 MAPK和p-p38 MAPK蛋白表达水平 用RIPA裂解缓冲液从各组大鼠胫骨组织中提取蛋白质,然后用BCA试剂盒测定蛋白质浓度。将蛋白质在10% SDS-PAGE上电泳分离并电转移到PVDF膜上,与RAGE(稀释度为1∶1 000)、p38 MAPK(稀释度为1∶1 000)和p-p38 MAPK(稀释度为1∶1 000)和GAPDH(稀释度为1∶1 000)一抗在4 ℃孵育过夜后,与HRP标记的二抗(稀释度为1∶1 000)37 ℃孵育2 h。使用ECL试剂盒显影。GAPDH作为内参蛋白。
1.3 统计学分析
采用SPSS 22.0软件分析本研究数据。采用单因素方差分析及LSD检验分析组间差异。P<0.05表示差异有统计学意义。
2 结果
2.1 大黄素甲醚对DOP大鼠FPG和FINS的影响
各组大鼠的FPG和FINS水平差异有统计学意义(P<0.001,见表2)。与对照组比较,模型组大鼠的FPG和FINS水平均升高(P<0.05)。与模型组比较,PHY低剂量组、PHY中剂量组和PHY高剂量组大鼠的FPG和FINS水平均降低,且呈PHY剂量依赖性降低趋势(P<0.05,见表2)。

表2 各组大鼠的FPG和FINS水平
2.2 大黄素甲醚对DOP大鼠血清脂代谢指标的影响
各组大鼠的血清脂代谢指标水平差异有统计学意义(P<0.001,见表3)。与对照组比较,模型组大鼠的血清TC、TG和LDL-C水平均升高,HDL-C水平降低(P<0.05)。与模型组比较,PHY低剂量组、PHY中剂量组和PHY高剂量组大鼠的血清TC、TG和LDL-C水平均呈PHY剂量依赖性降低,HDL-C水平呈PHY剂量依赖性升高(P<0.05,见表3)。

表3 各组大鼠的血清TC、TG、LDL-C和HDL-C水平 (mmol/L)
2.3 大黄素甲醚对DOP大鼠血清氧化应激指标的影响
各组大鼠的血清氧化应激指标水平差异有统计学意义(P<0.001,见表4)。与对照组比较,模型组大鼠的血清SOD、CAT和GSH-PX水平均降低,MDA水平升高(P<0.05)。与模型组比较,PHY低剂量组、PHY中剂量组和PHY高剂量组大鼠的血清SOD、CAT和GSH-PX水平均呈PHY剂量依赖性升高,MDA水平呈PHY剂量依赖性降低(P<0.05,见表4)。

表4 各组大鼠的血清SOD、CAT、GSH-PX和MDA水平
2.4 大黄素甲醚对DOP大鼠胫骨组织学改变的影响
HE染色结果显示,对照组大鼠胫骨组织形态正常;模型组胫骨出现明显的骨质疏松,骨小梁数量减少,间距增宽,厚度变薄,连续性差。与模型组比较,PHY低剂量组、PHY中剂量组和PHY高剂量组大鼠的胫骨组织形态均明显改善,且呈PHY剂量依赖性良好改善(见图1)。

图1 各组大鼠胫骨HE染色(×100)
2.5 大黄素甲醚对DOP大鼠胫骨力学参数的影响
各组大鼠的胫骨力学参数水平差异有统计学意义(P<0.001,见表5)。与对照组比较,模型组大鼠的胫骨BMD、Tb.N和Tb.Th水平均降低(P<0.05);与模型组比较,PHY低剂量组、PHY中剂量组和PHY高剂量组大鼠的胫骨BMD、Tb.N和Tb.Th水平均升高,且呈PHY剂量依赖性升高(P<0.05,见表5)。

表5 各组大鼠的胫骨BMD、Tb.N和Tb.Th水平
2.6 大黄素甲醚对DOP大鼠胫骨成骨和破骨相关基因转录的影响
各组大鼠胫骨组织中Runx2、OCN、OPN、ALP、BMP-2、RANK、RANKL和OPG的mRNA水平差异有统计学意义(P<0.05,见图2)。与对照组比较,模型组大鼠的胫骨组织中Runx2、OCN、OPN、ALP、BMP-2和OPG的mRNA相对表达量均降低,RANK和RANKL的mRNA相对表达量均升高(P<0.05);与模型组比较,PHY低剂量组、PHY中剂量组和PHY高剂量组大鼠的胫骨组织中Runx2、OCN、OPN、ALP、BMP-2和OPG的mRNA相对表达量均呈PHY剂量依赖性升高,RANK和RANKL的mRNA相对表达量均呈PHY剂量依赖性降低(P<0.05,见图2)。
2.7 大黄素甲醚对DOP大鼠胫骨RAGE/MAPK信号通路的影响
免疫组化染色结果显示,各组大鼠胫骨组织中RAGE和p38 MAPK的阳性染色面积百分比差异有统计学意义(P<0.05,见图3)。与对照组比较,模型组大鼠的胫骨组织中RAGE和p38 MAPK的阳性染色面积百分比均升高(P<0.05);与模型组比较,PHY低剂量组、PHY中剂量组和PHY高剂量组大鼠的胫骨组织中RAGE和p38 MAPK的阳性染色面积百分比均降低,且呈PHY剂量依赖性降低(P<0.05,见图3)。
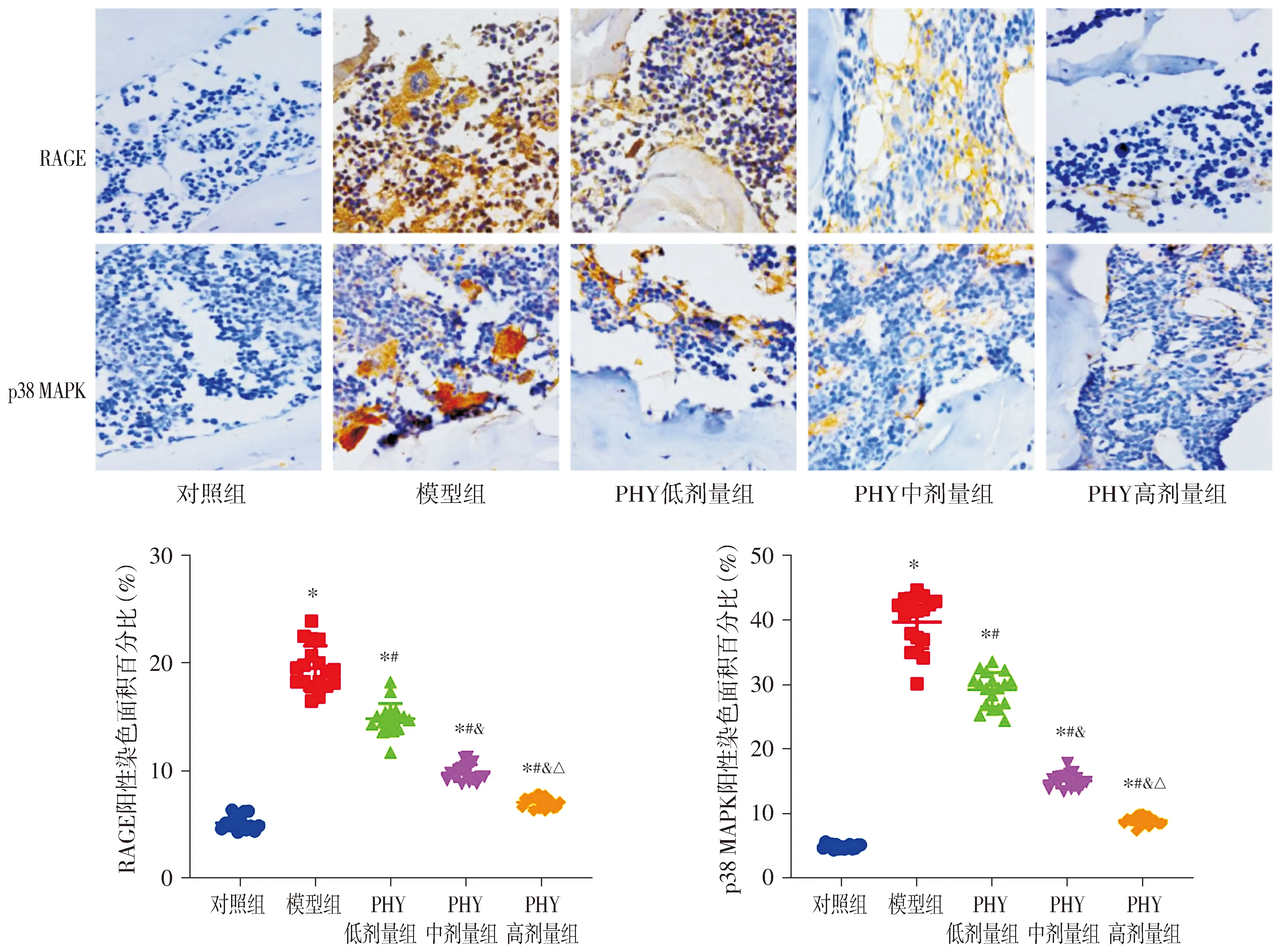
黄色或黄褐色区域表示阳性染色区域;与对照组比较,*P<0.05;与模型组比较,#P<0.05;与PHY低剂量组比较,&P<0.05;与PHY中剂量组比较,△P<0.05
qRT-PCR和Western blot结果显示,各组大鼠胫骨组织中RAGE的mRNA和蛋白表达水平及p38 MAPK的磷酸化水平差异均具有统计学意义(P<0.05,见图4)。与对照组比较,模型组大鼠的胫骨组织中RAGE的mRNA和蛋白表达水平及p38 MAPK的磷酸化水平均升高(P<0.05);与模型组比较,PHY低剂量组、PHY中剂量组和PHY高剂量组大鼠的胫骨组织中RAGE的mRNA和蛋白表达水平及p38 MAPK的磷酸化水平均降低,且呈PHY剂量依赖性降低(P<0.05,见图4)。
3 讨论
目前,大黄蒽醌类物质已经应用于DOP大鼠模型的治疗中,可有效提高DOP大鼠的骨密度和骨矿含量[16]。大黄素甲醚(physcion,PHY)是一种大黄中分离得到的蒽醌类物质,Inalegwu等[13]报道大黄素甲醚可有效降低糖尿病大鼠的FBG,改善胰岛素敏感性和血脂异常,抑制炎症和氧化应激,且无明显毒性。本研究考察了大黄素甲醚治疗DOP的效果,结果表明,大黄素甲醚剂量依赖性地降低了DOP大鼠中FPG和FINS水平,并降低了血清TC、TG和LDL-C水平,升高了血清HDL-C水平,从而改善了DOP大鼠的糖脂代谢,减轻了糖尿病症状,与Inalegwu等[13]报道的结果一致。本研究还发现,大黄素甲醚剂量依赖性地改善了DOP大鼠的胫骨组织形态并升高了胫骨力学参数BMD、Tb.N和Tb.Th水平,从而缓解了DOP大鼠的骨质疏松,提示大黄素甲醚在治疗DOP方面具有潜力。
氧化应激在骨代谢中具有重要地位,也是骨质疏松的主要诱因之一,氧化应激会降低成骨细胞活性和数量,从而加速骨质流失[17]。高糖刺激可升高成骨细胞中活性氧(reactive oxygen species, ROS)水平、降低矿化能力和OCN的基因表达,最终诱导骨质疏松的发生[18]。此外,ROS可通过促进破骨细胞形成[19]、下调OPG的表达和上调RANKL的表达来促进骨吸收[20]。因此,提高糖尿病患者的机体抗氧化能力是防治骨质疏松的重要途径。其他学者报道了大黄素甲醚的抗氧化功能[21]。本研究表明,大黄素甲醚剂量依赖性地升高了DOP大鼠血清抗氧化酶(SOD、CAT和GSH-PX)水平,降低了氧化产物(MDA)水平,从而抑制了氧化应激。
Runx2、OCN、OPN、ALP、BMP-2、RANK、RANKL和OPG是重要的成骨/破骨调控基因。活化的Runx2可增加ALP活性和骨基质蛋白(OCN和OPN)的合成,从而促进成骨细胞分化,BMP-2可诱导Runx2的活化[22-24]。RANK、RANKL和OPG是调控破骨细胞分化的重要基因。RANK通过与RANKL结合促进破骨细胞分化和成熟,OPG是RANKL的诱骗受体,其通过与RANK竞争性结合阻断RANK与RANKL的相互作用,抑制骨吸收[25]。本研究表明,大黄素甲醚剂量依赖性地上调了DOP大鼠胫骨组织中Runx2、OCN、OPN、ALP、BMP-2和OPG的转录,下调了RANK和RANKL的转录。这些结果提示大黄素甲醚可能通过促进成骨细胞分化和抑制破骨细胞分化来延缓骨质疏松的发生。
RAGE是AGEs的受体,高表达的RAGE可阻止成骨细胞增殖,增加破骨细胞形成[26]。其他学者研究表明,p38 MAPK是RAGE的下游靶基因[27],p38 MAPK是破骨细胞分化过程中必不可少的一种MAPK家族蛋白激酶,RANK与RANKL结合可激活p38 MAPK,激活的p38 MAPK通过活化其下游促进破骨细胞分化[28]。p38 MAPK也可以通过上调转录因子c-Fos来影响破骨细胞的分化成熟[29]。据报道,知母皂苷A-III通过抑制RAGE/MAPK信号通路来保护成骨细胞免受AGEs诱导的损伤并减轻斑马鱼DOP[3]。Selim等[30]的分子对接研究表明,大黄素甲醚可特异性抑制脂多糖诱导的肝细胞癌细胞系(HepG2)中p38 MAPK信号通路介导的炎症。本研究表明,大黄素甲醚剂量依赖性地抑制了DOP大鼠胫骨组织中RAGE的表达和p38 MAPK的活化,因此,大黄素甲醚可能通过抑制RAGE/MAPK信号通路发挥抗DOP作用。
综上所述,本研究表明大黄素甲醚在治疗DOP大鼠中具有良好的效果,其机制可能与促进成骨细胞分化、抑制破骨细胞分化和RAGE/MAPK信号通路有关。大黄素甲醚在治疗DOP方面具有一定的研究开发价值。
