荷载达沙替尼的姜黄素-透明质酸自组装胶束的药代动力学
2023-06-19马雅婷路星烯胡宇杰谢继红杜俊彦李见春
许 学,马雅婷,路星烯,胡宇杰,谢继红,张 磊,杜俊彦,计 军,李见春
(安徽省蚌埠市蚌埠医学院药学院药剂教研室,蚌埠 233000;*通讯作者,E-mail:Lijc66577@sohu.com)
聚合物胶束(polymeric micelles, PMs)已广泛用于抗肿瘤药物的载体[1]。当水中的聚合物浓度超过临界胶束浓度(CMC)时,两亲性聚合物会自组装,形成具有核壳结构的纳米颗粒,其中组装在核心中的疏水链段作为难溶药物的储存器,而分布在外壳中的亲水链段可提高纳米粒的稳定性[2]。将难溶性的药物包载入胶束的疏水核心中,可以改善药物的溶解性并降低其毒副作用[3]。此外,亲水性外壳的设计和优化可以使胶束系统形成一个空间屏障,能防止单核巨噬细胞的吞噬作用,并确保低临界胶束浓度、高溶解度和在水溶液中的稳定性[4],在医学、营养学、食品科学等方面具有广泛的应用前景[5]。
透明质酸(HA)是一种天然多糖,是人体细胞间质、滑液和其他组织的主要成分[6]。因此,以HA为载体的纳米粒子具有良好的生物降解性、生物相容性和非免疫原性。因此,HA修饰的纳米颗粒可能通过受体介导的内吞作用优先被肿瘤组织吸收[7]。
近年来,由于单一化疗药物对肿瘤的治疗效果不理想,联合用药已出现在癌症治疗阶段,并取得了令人惊讶的效果。两种或多种药物对肿瘤的协同作用远优于单一药物[8]。达沙替尼(Dasatinib,DAS)是一种多激酶抑制剂[9],用于治疗对伊马替尼耐药或不耐受的慢性粒细胞白血病[10]。DAS对许多实体肿瘤也显示出良好的治疗效果,包括肝癌、肺癌、乳腺癌等[11]。研究发现,DAS可以抑制细胞周期检查点激酶1(Chk1)并阻断G0/G1中的HepG2细胞[12]。姜黄素(CUR)是一种天然多酚化合物,具有抗氧化、抗炎、消除自由基以及抑制肿瘤生长等药理作用[13],在G2/M期阻断HepG2细胞[14]。在DAS和CUR的联合作用中,DAS阻断G0/G1期肿瘤细胞,CUR阻断G2/M期肿瘤细胞[15]。它们都作用于肿瘤细胞的不同细胞周期,并结合起来发挥抗肿瘤作用。
尽管两种药物之间的协同疗效显著,但是DAS和CUR都具有水溶性差、半衰期短、毒性大等一系列缺点,所以需要将两种药物装载于同一纳米递药系统中,以此来实现两药减毒增效的作用[16]。本研究中,疏水性药物CUR通过pH敏感性酯键与天然多糖HA连接,形成两亲性聚合物透明质酸-姜黄素(HA-CUR),然后以HA-CUR和D-a-生育酚酸聚乙二醇琥珀酸(TPGS)为载体,形成以DAS为核心的自组装混合胶束纳米粒子(THCD-NPs)。混合胶束可以使DAS和CUR共给药,同时做成的胶束可以提高DAS和CUR的溶解度和稳定性,延迟药物在体内的滞留时间[17]。本研究通过建立高效液相色谱法(HPLC)测定胶束给药后生物样品中药物含量的方法,为相关胶束制剂和临床应用提供可靠、准确的检测依据。
1 材料与方法
1.1 实验仪器
XW-80A微型旋涡混合仪(上海沪西分析仪器厂);Mini Max 17台式高速离心机(湖南可成仪器设备有限公司);高效液相色谱仪(日本岛津公司)。
1.2 原料和试剂
姜黄素(麦克林公司,C11599368,98%);达沙替尼(麦克林公司,C10478494,98%);姜黄素-达沙替尼胶束(本实验室自制);罗格列酮(ROZ)标准品(MACKLIN公司,C10534101,99%);肝素钠(辰欣药业股份有限公司);冰醋酸(天津大茂试剂厂);甲醇;超纯水。
1.3 实验细胞、动物
4T1细胞(购于武汉普诺赛生命科技有限公司);SD大鼠,雌性,15~20只,6~7周龄,体质量(200±20)g,购于济南朋悦实验动物繁育有限公司(许可证号2021143),符合蚌埠医学院动物伦理标准与使用委员会的要求(伦理批件号SCXK2020-0005)。
1.4 方法
1.4.1 THCD-VPs的制备 采用简单的酯化反应将透明质酸的羧基与姜黄素的羟基相连接,得到HC嵌段共聚物。按课题组前期方法,将透明质酸HA(0.1 mmol)、4-二甲氨基吡啶DMAP(0.4 mmol)、碳二亚铵盐酸盐EDC(0.4 mmol)充分溶解于DMSO/H2O(V/V,1∶1)中,在60 ℃下搅拌1 h以激活羧基。将反应液温度降至45 ℃,加入0.4 mmol CUR继续搅拌反应48 h。待反应完全后,将反应物转移至透析袋(Mw 3 500 D)内,用去离子水透析2 d(每5 h更换透析液),透析结束后将所得溶液经0.45 μm滤膜过滤,以去除未反应的催化剂及反应物,将续滤液通过冷冻干燥得到产物HC复合物。
在本课题组前期实验基础上,本研究用旋转蒸发法制备胶束。取20 mg载体材料(HC、TPGS,HC与TPGS的质量比例为6∶1),2 mg药物DAS,加入等量水与甲醇,使之充分溶解。将混合溶液于冰浴条件下超声30 min后,使用旋转蒸发仪将溶剂全部去除,再加入适量双蒸水溶解所得薄膜,溶液经0.22 μm滤膜过滤,即得胶束溶液。
1.4.2 色谱条件 高效液相色谱仪:日本岛津SPD-16紫外-可见检测器;色谱柱:Phenomenex Luna C8硅胶键合色谱柱(4.6 nm×250 nm,5 μm);流动相:采用二元高压梯度法,50 mmol/L醋酸铵(pH4.0)-乙睛(0~13 min体积比60∶40;13~23 min体积比30∶70),检测波长:320 nm;370 nm(双波长检测);柱温25 ℃;进样量20 μl。
1.4.3 溶液配制 标准品溶液:精密称取药物达沙替尼(DAS)25.00 mg、姜黄素(CUR)25.00 mg,将两种药物分别置于25 ml的容量瓶中,采用甲醇稀释至刻度,得DAS和CUR的终浓度为1.00 mg/ml。
内标溶液:称取罗格列酮(ROZ)25.00 mg置于50 ml的容量瓶中,采用甲醇稀释至刻度,得ROZ的终浓度为500 μg/ml。
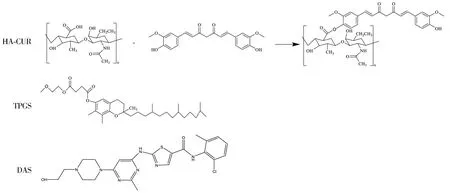
图1 纳米给药体系THCD-NPs的构建
1.4.4 血浆样品处理 取100 μl大鼠含药血浆于1.5 ml EP管中,加入10 μl内标溶液(500 μg/ml)、300 μl甲醇,涡旋混匀,离心10 min(5 000 r/min),取上清液20 μl进样分析。
1.4.5 专属性考察 空白血浆的配制:收集健康SD大鼠全血,离心10 min(5 000 r/min)取上清得空白血浆样品。
模拟血浆样品的配制:将DAS或CUR溶液与内标ROZ溶液、空白血浆混合,加入300 μl甲醇混匀,离心10 min(5 000 r/min),得含药模拟血浆,取20 μl上清液进样分析。
实际血浆样品溶液的配制:健康SD大鼠经尾静脉给药后,于不同时间点(0,0.25,0.5,1,2,4,8,12,24,36,48 h)采集全血,经1.4.4方法处理后,加入10 μl内标溶液、300 μl甲醇,涡旋混匀,离心10 min(5 000 r/min),取上清20 μl进样分析。
按上述1.4.2条件进行处理和分析,以确定血浆中的内源性杂质是否会干扰DAS、CUR及内标ROZ的检测。
1.4.6 DAS标准曲线的绘制 将DAS溶液(1.00 mg/ml)用甲醇配制成0.1,0.2,0.5,1.0,2.0,5.0,10.0 μg/ml系列浓度。按1.4.4操作,收集20 μl上清进样。绘制DAS的标准曲线,其横轴为DAS的浓度,纵轴为DAS对应的峰面积与内标ROZ峰面积比值。
1.4.7 CUR标准曲线的绘制 将CUR溶液(1.00 mg/ml)用甲醇配制成0.2,0.5,1.0,2.0,5.0,10.0,20.0 μg/ml系列浓度。按1.4.4法操作,收集20 μl上清进样。绘制CUR的标准曲线,其横轴为CUR的浓度,纵轴为CUR对应的峰面积与内标ROZ峰面积比值。
1.4.8 精密度和准确度 制备3种浓度的CUR(0.5,2.0,5.0 μg/ml)、DAS(0.5,2.0,5.0 μg/ml)溶液,每个浓度平行5份。按1.4.4法测定3 d,计算相应的待测物浓度与日内、日间精密度与准确度。
1.4.9 稳定性 制备3种浓度的CUR(0.5,2.0,5.0 μg/ml)、DAS(0.5,2.0,5.0 μg/ml)溶液,每个浓度每个检测时间点平行5份,考察含药血浆室温放置24 h、-80 ℃反复冻融3次和在-80 ℃冷冻保存7 d的稳定性。
1.5 药代动力学评价
1.5.1 细胞药动学 将4T1细胞接种在6孔板(3×105个/孔)中,过夜培养后,加入DAS+CUR和THCD-NPs(CUR浓度为7.5 μmol/L、DAS浓度为22.5 μmol/L)在37 ℃下分别孵育4,12,24 h。孵育结束后,离心(2 500 r/min,10 min)弃去上清液,加入10 μl细胞裂解液,冰浴0.5 h。4 ℃(5 000 r/min,0.5 h)下离心,取2 μl上清液,加入100 μl甲醇超声提取药物。通过HPLC测定DAS和CUR浓度,并计算每单位蛋白质的药物浓度。
1.5.2 动物实验方案 将12只健康雌性SD大鼠随机分成两组:CUR+DAS组(物理混合)和胶束THCD-NPs组,分别尾静脉注射CUR+DAS(5 mg/kg)、THCD-NPs(5 mg/kg),于给药后0.25,0.5,1,2,4,6,8,12,24,36,48 h分别取眼静脉丛血液500 μl于1.5 ml含肝素钠离心管中,5 000 r/min离心10 min,收集上清液,按1.4.4法测定,分别得到两组不同时间点的血浆药物浓度,绘制CUR+DAS、THCD-NPs的血药浓度-时间曲线,用Win Nolin 8.2软件计算药代动力学参数。
2 结果
2.1 专属性考察
DAS约在4.5 min出峰,CUR的出峰时间在19.5 min,内标ROZ在9.5 min左右出峰(见图2),DAS、CUR均能较好地分离,血浆中内源性杂质对DAS、CUR及ROZ色谱峰均无显著干扰,表明该方法专属性良好,符合血浆样品药物含量测定要求。
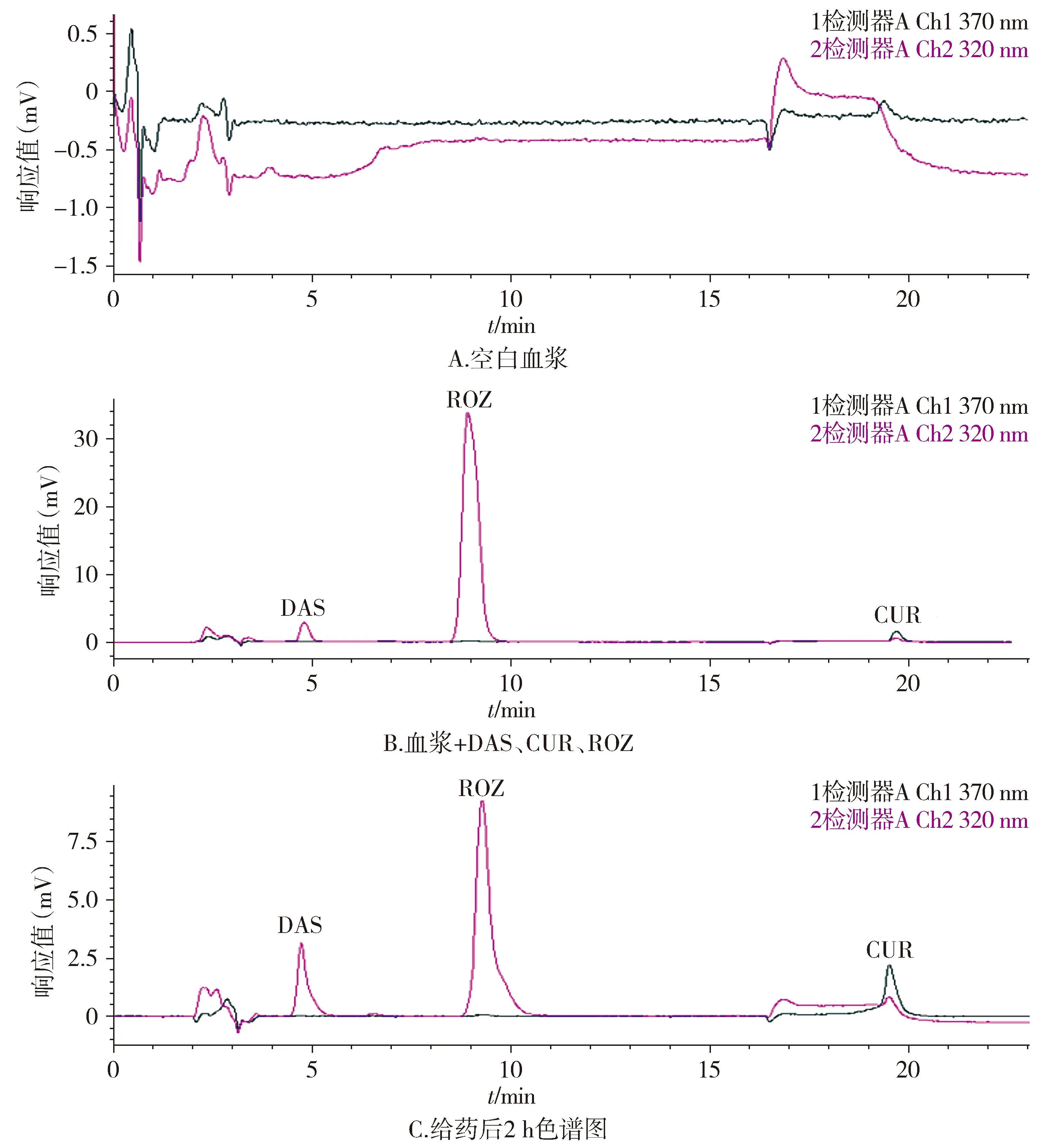
图2 DAS和CUR血浆样品的HPLC专属性检测图
2.2 标准曲线的绘制
由图3可知,DAS和CUR的回归方程分别为:y=0.073x+0.006,R2=0.995 5;y=0.042 7x-0.007 1,R2=0.997 4,CUR在1~20 μg/ml浓度内峰面积线性关系良好,DAS在1~10 μg/ml浓度内峰面积线性关系良好,DAS最低定量下限(LLOQ)为0.01 μg/ml,CUR最低定量下限(LLOQ)为0.2 μg/ml。
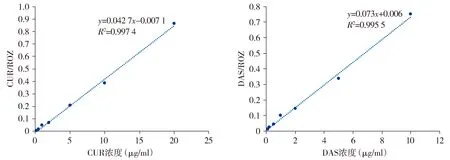
图3 CUR和DAS标准曲线
2.3 精密度与准确度
CUR溶液和DAS溶液日间、日内精密度值均小于15%,准确度在85%~115%(见表1~4),符合生物样品含量测定要求。

表1 大鼠血浆中药物CUR的日内、日间精密度 (n=5)
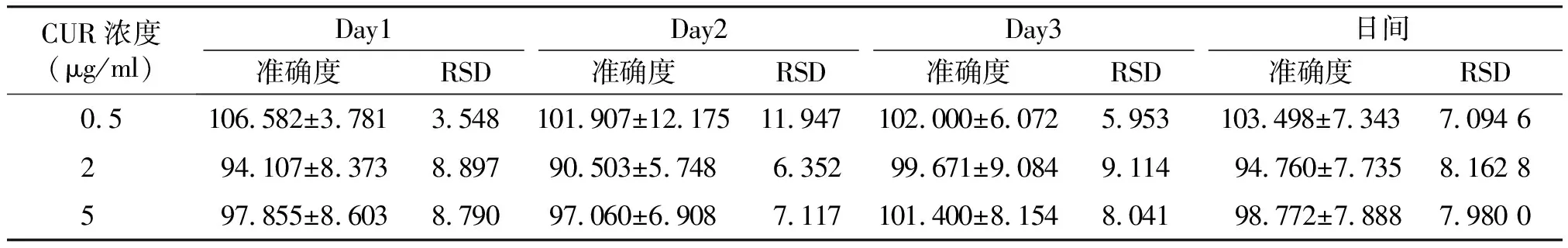
表2 大鼠血浆中药物CUR的日内、日间准确度 (n=5,%)

表3 大鼠血浆中药物DAS的日内、日间精密度 (n=5)
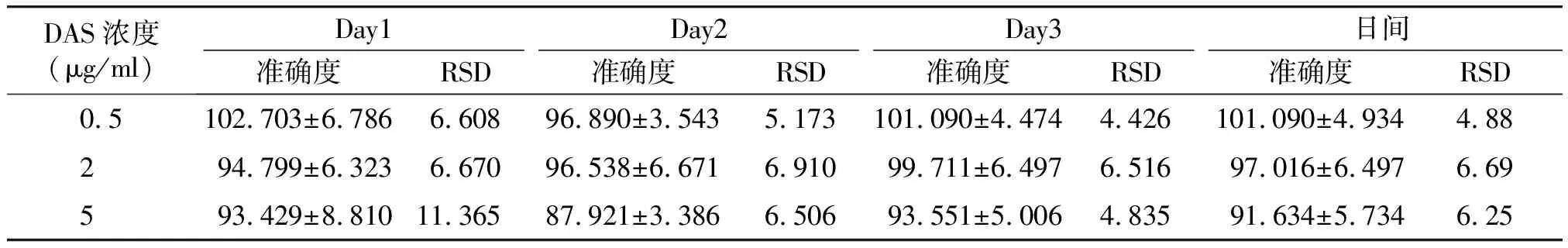
表4 大鼠血浆中药物DAS的日内、日间准确度 (n=5,%)
2.4 稳定性
不同浓度的CUR(0.5,2.0,5.0 μg/ml)、DAS(0.5,2.0,5.0 μg/ml)含药血浆分别在-80 ℃冷冻保存7 d、-80 ℃反复冻融3次和室温放置24 h的条件下,每个浓度样品进行5次样本分析。结果显示,各浓度在以上储存条件下的检测值相对于理论值分别在85.0%~115%,均RSD<15.0%(表5,6),说明样品在实验设计的条件下稳定性均良好。
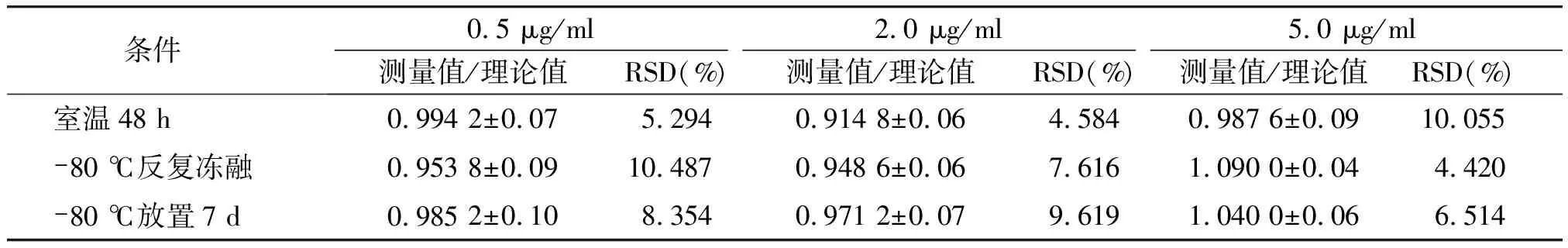
表5 不同条件下SD大鼠血浆中CUR的稳定性 (n=5)
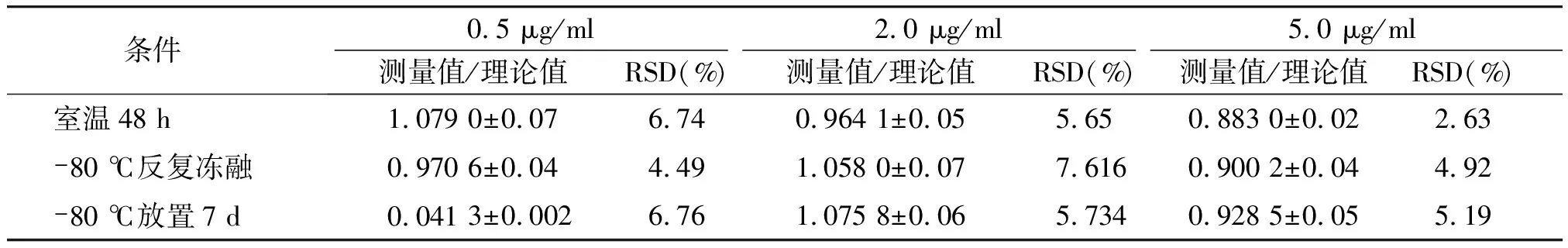
表6 不同条件下SD大鼠血浆中DAS的稳定性 (n=5)
2.5 细胞内药物动力学
药物在细胞中有效的积累是治疗疾病的关键,分别研究4,12,24 h细胞中DAS和CUR的累积量,结果见图4。THCD-NPs组DAS和CUR的累积量在每个时间点都高于DAS+CUR组,这证明了THCD-NPs具有良好的细胞靶向性;这主要是因为引入了透明质酸,其可以更好地被肿瘤细胞吸收并增加药物内吞。
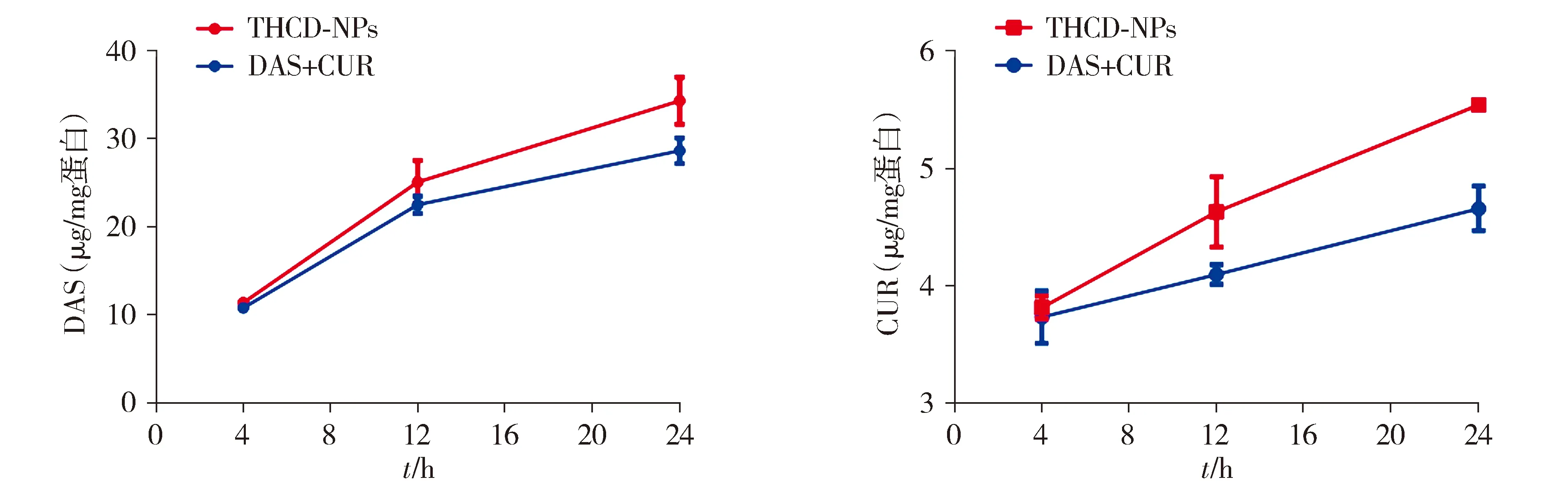
图4 DAS+CUR、THCD-NPs在4T1细胞中的药时曲线(n=3)
2.6 大鼠体内药物动力学
SD大鼠按照5 mg/kg(CUR为1.25 mg/kg,DAS为3.75 mg/kg)的剂量分别经尾静脉注射DAS+CUR、THCD-NPs溶液,各组药动学参数拟合结果见图5和表7。由药时曲线可以看出THCD-NPs组CUR和DAS在体内的作用时间延长,并且在48 h时,相比于DAS+CUR组,THCD-NPs组CUR和DAS药物的浓度均有所增加,表现出一定的缓释作用。药代动力学参数结果显示,THCD-NPs组DAS的AUC0-∞是DAS+CUR组的7.989倍,说明DAS在血浆中的含量显著增加,DAS的生物利用度提升;DAS+CUR组的清除率(CL)是THCD-NPs组的8.02倍,说明DAS体内的循环时间显著延长;THCD-NPs组CUR的MRT0-∞,AUC0-∞、t1/2明显提高,清除率(CL)明显降低,说明荷载于THDR-NPs中的DAS和CUR可以使药物以更高的浓度被吸收,从而提高治疗效果。
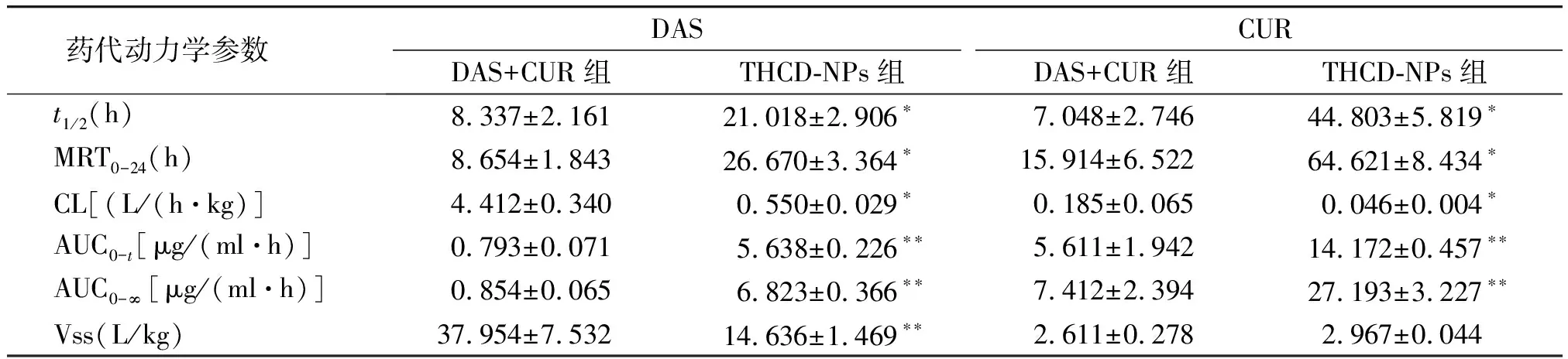
表7 尾静脉注射DAS+CUR、THCD-NPs后大鼠体内DAS和CUR药代动力学参数 (n=6)

图5 DAS+CUR、THCD-NPs在大鼠中的药时曲线(n=6)
3 讨论
根据文献查阅,文献大多采用一种等度洗脱法,但是这样的方法面对大量的产品会十分繁琐,本方法采用了二元高压梯度,可以同时测量3种药物的浓度,同时峰形好、分离度高,ROZ作为内标物,其色谱行为、色谱条件与待测物CUR、DAS较接近,且分离度较好、稳定性好、信号强。此外,采用二元高压梯度法对样品进行分析,目标峰均出现在4.00 min之后,可以较好避免血浆中内源性物质的干扰,同时又能够显著缩短样品的分析周期,从而加快分析速度。有文献报道CUR、DAS血浆样品前处理方法为萃取法和蛋白沉淀法。萃取法首先酸化血浆样品,之后用有机溶剂进行萃取,其操作流程复杂,且萃取溶剂一般为乙醚、乙酸乙酯等毒性试剂。蛋白沉淀法与液液萃取法相比更为方便、安全,在满足定量要求的同时大大减少了预处理时间,一定程度可以加快分析速度,提升效率。对于蛋白沉淀剂的选择,考察了最常用的甲醇和乙腈,发现CUR、DAS的提取回收率均符合生物样品的测定要求,鉴于甲醇较乙腈毒性小、成本低。因此本实验选取甲醇去除蛋白沉淀以处理血浆样品。
根据文献的查阅,对于药动力学研究,文献大多采用动物实验证明,本次实验在动物实验的基础上添加了细胞实验,以此进一步验证了荷载达沙替尼的姜黄素-透明质酸自组装胶束的药动学,得到的药动学数据为荷载达沙替尼的姜黄素-透明质酸自组装胶束进一步的研究与开发提供了科学依据。
本文建立了HPLC法测定SD大鼠血浆中DAS、CUR的浓度,以罗格列酮作为内标,利用甲醇去除蛋白沉淀的方法处理血浆样品,该方法专属性高,不受内源性杂质的干扰。经验证,该方法专属性高,符合生物样品分析的要求。
本实验将乳腺癌4T1细胞分别与DAS+CUR、THCD-NPs共孵育,不同时间点测定4T1细胞的药物摄取率,同时间点细胞的摄取率THCD-NPs组均大于CUR+DAS组;采用了大鼠尾静脉注射给药,眼眶后静脉丛取血,利用甲醇去除蛋白沉淀的方法处理血浆样品,用Win Nolin 8.2软件计算药代动力学参数,与物理混合的DAS+CUR比较,聚合物胶束组由于本身特殊的结构,有效地延长了药物在体内和体外的循环时间并保持稳定,表现出良好的体内缓释效果及长循环性能,从而提高药物治疗效果。
