ALG3通过JAK/STAT通路促进三阴性乳腺癌增殖、侵袭和迁移
2023-06-19邢现菲李瑞华韩亚娟张竞竞邵渝欢马赛菲刘亚萌韩正全
邢现菲,李瑞华,韩亚娟,张竞竞,邵渝欢,马赛菲,刘亚萌,韩正全*
(1蚌埠医学院第一附属医院肿瘤内科,蚌埠 233000;2蚌埠医学院第一附属医院消化内科;3蚌埠医学院第一附属医院耳鼻咽喉头颈外科;*通讯作者,E-mail:dochyj@163.com)
乳腺癌是女性中最常见的癌症,它是世界上妇女死亡的第二大常见原因[1]。近年来,虽然手术和术后化疗在乳腺癌治疗方面取得了显著进展,但是,乳腺癌的5年生存率仍然不高,特别是三阴性乳腺癌(triple negative breast cancer,TNBC)的治疗效果较差,严重威胁患者生存。糖基化是在包括乳腺癌、卵巢癌和内膜癌在内的不同类型癌症中观察到的一种关键修饰,其促进了乳腺癌细胞的黏附、增殖和转移[2]。糖基转移酶在癌细胞中的差异表达是肿瘤糖基化异常的主要原因之一,而ALG家族代表了一类关键的糖基转移酶[3,4]。α-1,3-甘露糖基转移酶(alpha-1,3-mannosyltransferase,ALG3)是ALG家族的一员,位于染色体3q27.1区域[5],是一种完整的ER膜蛋白,具有多个跨膜区域。研究表明,ALG3与肿瘤的发生发展相关,如口腔鳞状细胞癌[6]、非小细胞肺癌[7]、膀胱癌[8]等,但在乳腺癌方面的研究报道较少,因此,本研究将通过RNA干扰技术下调/过表达乳腺癌细胞中ALG3的表达量,观察ALG3对乳腺癌增殖、侵袭和迁移等生物学行为的影响,并探究其可能的分子机制,旨在为乳腺癌患者的预后和治疗提供理论基础。
1 材料和方法
1.1 实验材料
正常人乳腺细胞HBL-100和乳腺癌细胞SKBr3、MCF-7、MDA-MB-231均购自武汉普诺赛生物科技有限公司。BALB/c裸鼠购自上海斯莱克实验动物有限责任公司,动物实验过程符合蚌埠医学院第一附属医院伦理委员会批准。DMEM培养基、RPMI-1640培养基、胰蛋白酶、青链霉素双抗、PBS缓冲溶液购自武汉普诺赛生物科技有限公司,胎牛血清(FBS)、Materigel胶购自浙江天杭生物科技股份有限公司,si-NC、siRNA、mimic-NC、mimic均购自上海生工生物工程股份有限公司,转染试剂Lip 2000由Thermo Fisher Scientific(美国)公司购买,一抗(GAPDH、ALG3、JAK2/p-JAK2、STAT3/p-STAT3、Bcl-2、MMP2、Cyclin D1)购于武汉三鹰生物技术有限公司,辣根过氧化物酶标记的羊抗兔二抗、ECL显影液购于Abbkine(美国)科技有限公司,JAK/STAT抑制剂WP1066、Transwell小室、BCA蛋白浓度测量试剂盒、脱脂奶粉均购自碧云天生物技术有限公司。
1.2 实验方法
1.2.1 细胞培养及转染 HBL-100、MDA-MB-231、MCF-7在含10%胎牛血清的DMEM培养基中培养,SKBr3在含10%胎牛血清的RPMI-1640培养基中培养,在37 ℃和5% CO2饱和湿度的培养箱中培养。转染对象为处于对数生长期的细胞,要求转染时细胞密度达到50%~60%,在下调ALG3时,分别转染si-NC、ALG3-S1、ALG3-S2、ALG3-S3,选择敲减效率最明显的序列构建ALG3-KD组;在上调ALG3时,分别转染mimic-NC、ALG3-mimic验证转染效率,选择ALG3-mimic构建ALG3-OE组。转染步骤严格按照转染试剂说明书进行,在后续实验中将进行如下分组:control组(Lip2000)、NC-KD组(Lip2000+si-NC)、ALG3-KD组(Lip2000+ALG3-siRNA)和NC-OE组(Lip2000+mimic-NC)、ALG3-OE组(Lip2000+ALG3-mimic)以及ALG3-OE+WP1066组(使用通路抑制剂WP1066培养ALG3-OE组细胞)。本研究中使用的ALG3特异性序列见表1。

表1 引物序列
1.2.2 CCK-8和集落克隆实验检测增殖能力 CCK-8实验:将转染后处于对数生长期的control组、NC-KD组和ALG3-KD组MDA-MB-231细胞重新消化离心,计数后接种于96孔板中,调整每孔细胞悬液为100 μl,细胞密度为3 000个/孔,每组设置5个复孔,放入37 ℃细胞培养箱内,分别于24,48,72,96 h时,每孔加入CCK-8溶液10 μl,37 ℃细胞培养箱内孵育1 h后,在酶标仪上选择460 nm波长测定吸光度。本实验重复3次。
集落克隆实验:将转染后处于对数生长期的1.2.1各组MDA-MB-231细胞重新消化离心,以500个/孔种植于6孔板,每3 d换一次液,显微镜下观察细胞形态的同时观察克隆数目,待6孔板中大多数单个细胞克隆数大于50个时,弃上清,PBS缓冲溶液洗涤一次;加入1 ml 4%多聚甲醛至每个孔内,4 ℃冰箱固定细胞20 min,PBS洗涤细胞一次;每孔加入结晶紫1 ml,进行染色15~20 min,PBS洗涤细胞若干次,倒扣晾干,拍照计数。本实验重复3次。
1.2.3 裸鼠移植瘤模型的构建 收集转染后处于对数生长期的NC-KD组和ALG3-KD组MDA-MB-231细胞,用DMEM培养基制成细胞悬液,以5×106个/只的密度注射到裸鼠上肢腋下,将裸鼠分为NC-KD组(注射NC-KD组MDA-MB-231细胞)和ALG3-KD组(注射ALG3-KD组MDA-MB-231细胞),每组6只。每4 d用游标卡尺测量肿瘤大小,瘤体体积=π/6×L×W×W=3.14/6×L×W×W(L代表长径,W代表短径)。26 d后,将裸鼠断椎处死,用弯头镊和眼科剪将皮下肿瘤钝性分离,称重。
1.2.4 细胞划痕实验检测迁移能力 将转染后处于对数生长期的control组、NC-KD组和ALG3-KD组MDA-MB-231细胞重新消化离心,以5×105个/孔的密度种植于6孔板,待细胞贴壁后换成无血清DMEM培养基,培养过夜。无菌10 μl枪头垂直于细胞面划痕,洗涤后使用无血清DMEM培养基继续培养。分别于0,24,48 h将6孔板置于倒置显微镜下拍照,每组随机选择3个划痕视野拍照,并做好标记,计算迁移率。本实验重复3次。
1.2.5 Transwell实验检测侵袭和迁移能力 迁移实验:将转染后处于对数生长期的1.2.1各组MDA-MB-231细胞重新消化离心,用无血清培养基重悬并计数,以1.5×104/孔分别种植于Transwell小室,每组设3个复孔,加入无血清DMEM培养基定量至100 μl,小室置于24孔板,下室孔内加入600 μl含10%胎牛血清的培养基。培养箱内培养24 h,取出Transwell小室,棉签轻轻擦拭小室膜上表面多余的细胞,4%多聚甲醛固定15~20 min,结晶紫溶液浸泡染色15~20 min,PBS漂洗掉多余的染料,晾干后于倒置显微镜下拍照,观察小室膜下表面细胞数量。本实验重复3次。
侵袭实验:4 ℃环境下将Materigel基质胶与基础培养基按1∶8的比例稀释,每孔加入60 μl的Materigel基质胶均匀覆盖Transwell小室底部,置于培养箱孵育30 min。基质胶凝固后,将转染后处于对数生长期的1.2.1各组MDA-MB-231细胞重新消化离心,用无血清培养基重悬并计数,将各组细胞以1.5×104/孔的密度种植于小室上室,其余步骤与迁移实验相同,培养48 h后多聚甲醛固定,结晶紫染色,晾干后于倒置显微镜下拍照,检测细胞数量。本实验重复3次。
1.2.6 Western blot检测ALG3、JAK/STAT信号通路相关蛋白表达 分别将1.2.1各组细胞裂解后提取蛋白,使用BCA法测定蛋白浓度,于SDS-PAGE上取等量蛋白样品进行电泳,PVDF膜转膜,5%脱脂牛奶封闭2 h,一抗(GAPDH、ALG3、JAK2/p-JAK2、STAT3/p-STAT3、Bax、MMP2、Cyclin D1)按1∶1 000稀释,4 ℃条件下孵育过夜。TBST溶液洗5次,每次5 min,二抗按1∶10 000稀释,室温下孵育2 h,TBST溶液洗5次,每次5 min,ECL显影液曝光显影,Image J分析实验结果。
1.3 统计学方法
2 结果
2.1 ALG3在乳腺癌细胞中高表达
Western blot实验结果表明,与正常乳腺上皮细胞HBL-100相比,乳腺癌细胞SKBr3、MCF-7、MDA-MB-231中的ALG3的表达量明显增加,其中MDA-MB-231和MCF-7细胞的差异具有统计学意义(P<0.05),而SKBr3细胞的差异无统计学意义(P>0.05,见图1)。由于MDA-MB-231细胞中ALG3表达升高最显著,因此,选择MDA-MB-231细胞作为后续研究对象。
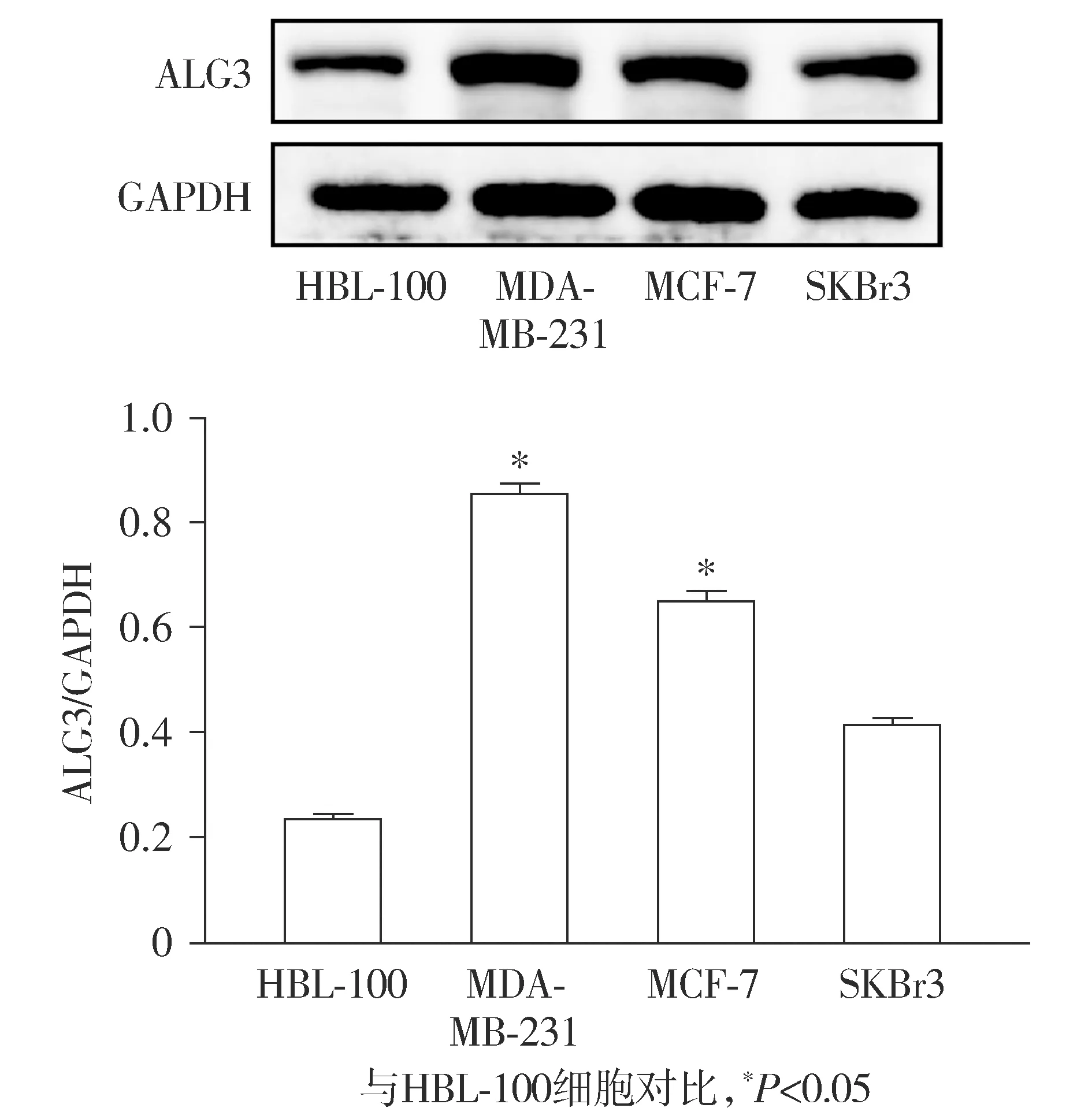
图1 ALG3在正常人乳腺上皮细胞和各种乳腺癌细胞中的表达(n=3)
2.2 ALG3敲减/过表达序列的筛选及验证
Western blot结果显示,与control组和NC-KD组比较,ALG3-S3组ALG3敲减效果最好,差异具有统计学意义(P<0.01);与control组和NC-OE组比较,ALG3-mimic组ALG3表达显著增加(P<0.01,见图2)。故选择ALG3-S3和ALG3-mimic用于后续敲减/过表达。
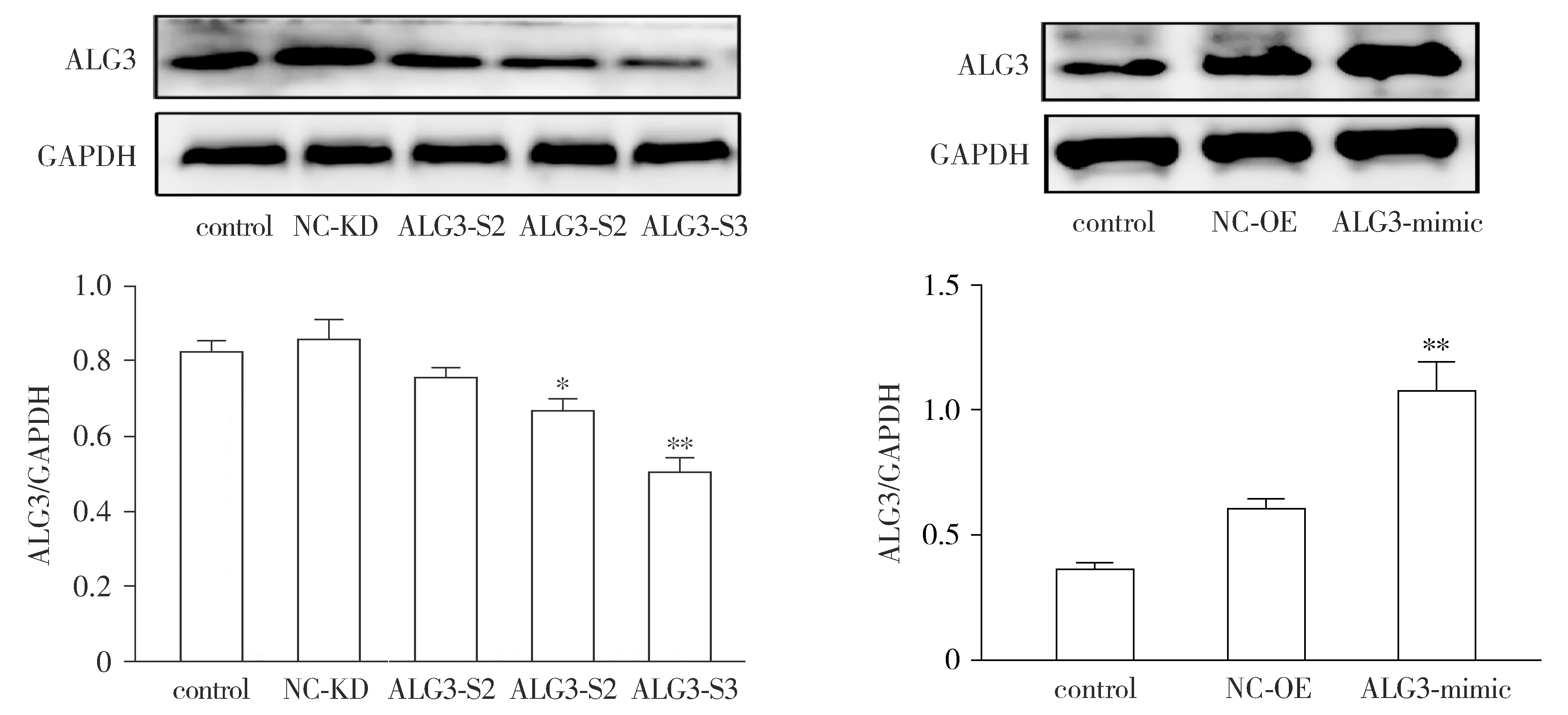
与control组和各自对应的NC组比较,*P<0.05,**P<0.01
2.3 下调ALG3抑制MDA-MB-231细胞的增殖能力
集落克隆和CCK-8实验结果表明,与control组和NC-KD组比较,ALG3-KD组细胞的增殖率降低,差异具有统计学意义(P<0.05,见图3A)。
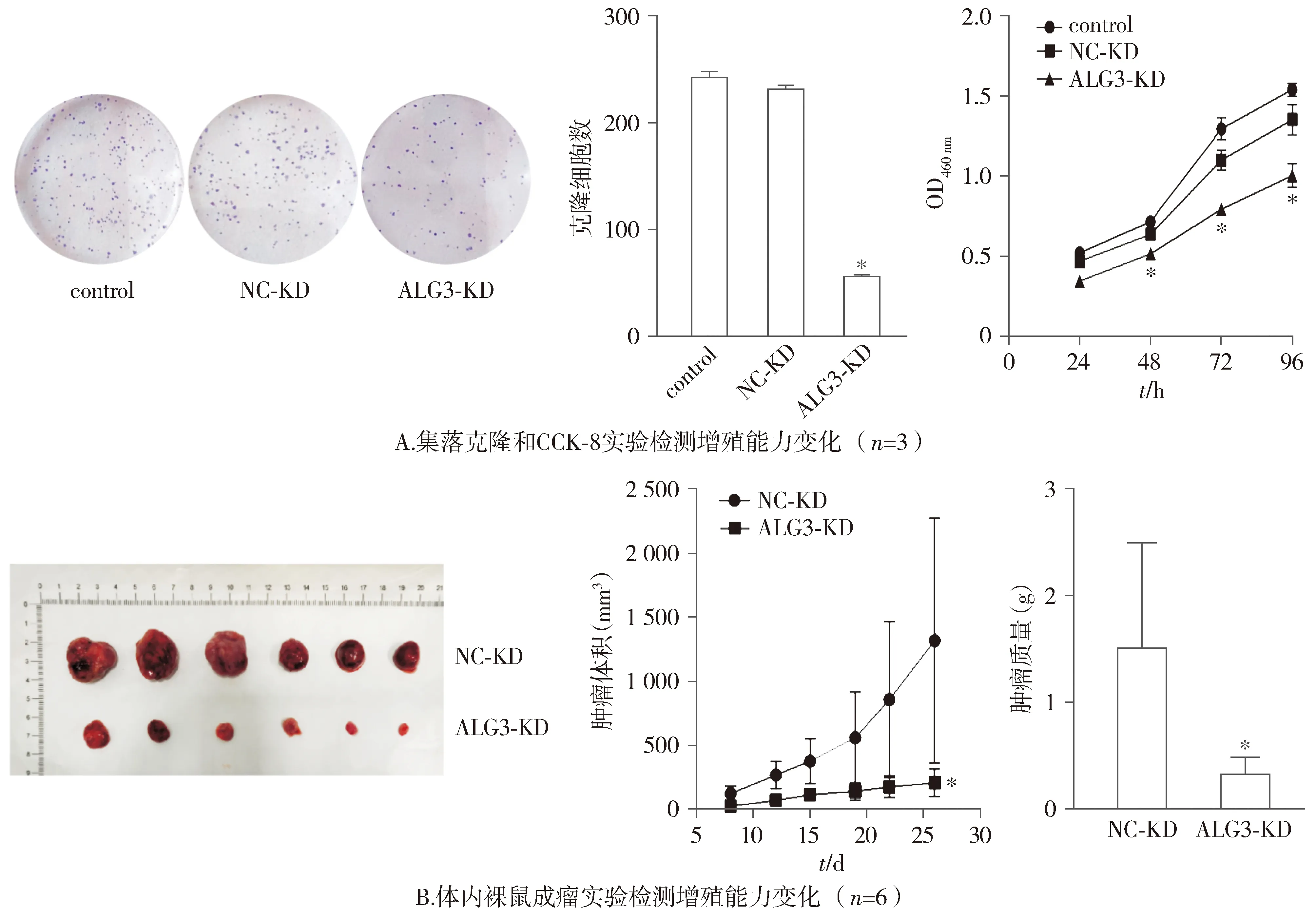
与control组和NC-KD组对比,*P<0.05
裸鼠成瘤实验表明,与NC-KD组比较,ALG3-KD组裸鼠肿瘤的体积和质量明显较慢,差异具有统计学意义(P<0.05,见图3B)。
2.4 下调ALG3抑制MDA-MB-231细胞侵袭和迁移能力
划痕实验结果显示,与control组和NC-KD组比较,ALG3-KD组划痕愈合显著延迟,迁移能力明显减弱,差异具有统计学意义(P<0.05,见图4A);Transwell实验结果显示,与control组和NC-KD组比较,ALG3-KD组24 h时乳腺癌细胞的迁移能力降低,ALG3-KD组48 h时跨膜细胞数减少,差异具有统计学意义(P<0.05,见图4B)。
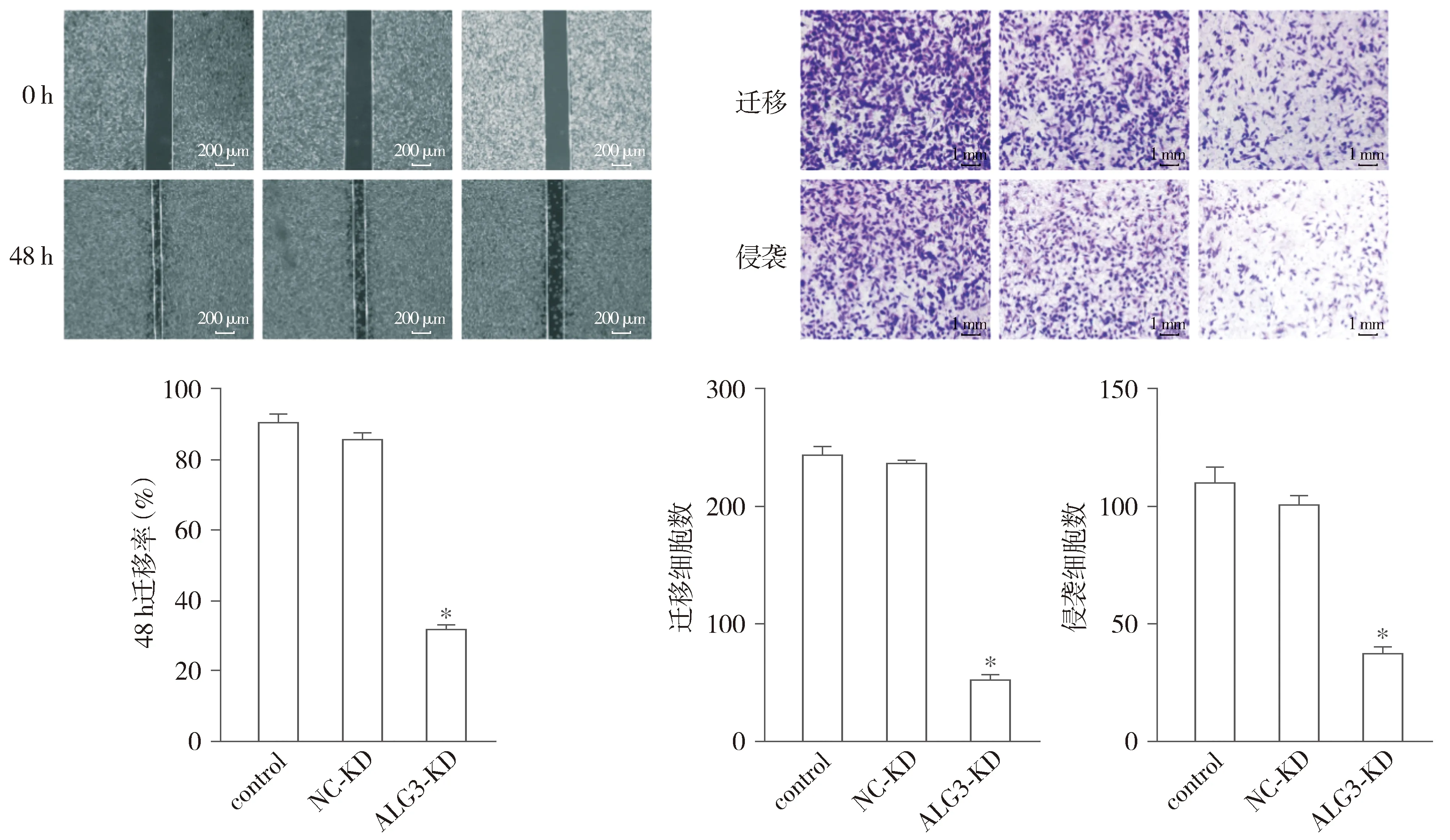
A.划痕实验检测迁移能力变化(×4)B.Transwell检测侵袭和迁移能力变化(结晶紫染色,×10)
2.5 下调ALG3可以抑制MDA-MB-231细胞中JAK/STAT通路蛋白表达
Western blot结果显示,与control组和NC-KD组比较,ALG3-KD组JAK2/p-JAK2、STAT3/p-STAT3、MMP2、Cyclin D1的表达均受到抑制,相反,Bax在ALG3-KD组中的表达升高,而且磷酸化水平也有所降低,差异具有统计学意义(P<0.05,见图5)。

图5 下调ALG3对MDA-MB-231细胞中JAK/STAT通路蛋白的影响(n=3)
2.6 WP1066可以抑制ALG3过表达MDA-MB-231细胞的JAK/STAT信号通路
Western blot结果显示,加入通路抑制剂WP1066后,与NC-OE组和ALG3-OE组比较,ALG3-OE+WP1066组JAK/STAT通路相关蛋白JAK2/p-JAK2、STAT3/p-STAT3及其磷酸化水平受到抑制,差异具有统计学意义(P<0.05,见图6)。
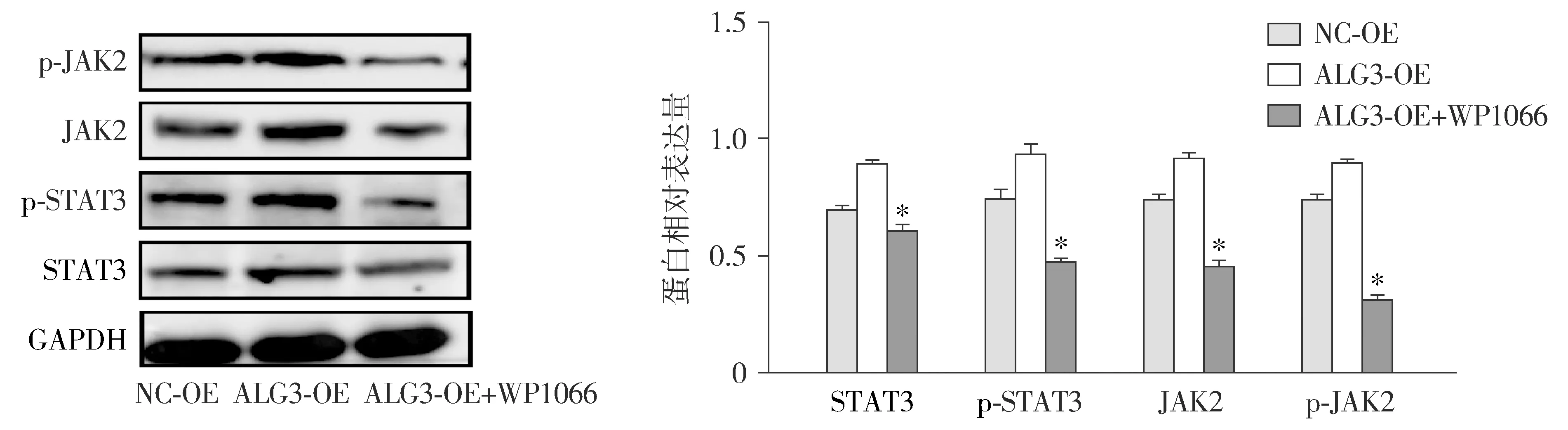
与NC-OE和ALG3-OE组对比,*P<0.05
2.7 抑制JAK/STAT通路后可降低ALG3过表达MDA-MB-231细胞的增殖、侵袭和迁移
集落克隆实验表明,与NC-OE组和ALG3-OE组比较,ALG3-OE+WP1066组细胞的增殖能力被抑制(P<0.05,见图7A);Transwell实验表明,与NC-OE组和ALG3-OE组比较,ALG3-OE+WP1066组24 h时乳腺癌细胞的迁移能力降低,ALG3-OE+WP1066组48 h时跨膜细胞数减少(P<0.05,见图7B)。

A.集落克隆检测抑制JAK/STAT通路后增殖能力变化 B.Transwell检测抑制JAK/STAT通路后侵袭、迁移能力变化(结晶紫染色,×10)
3 讨论
近年来,乳腺癌基因研究一直是热点问题,虽然目前已经有不少分子标志物应用于其临床诊断及治疗,但仍需发现更多的基因治疗靶点。糖基化是蛋白质普遍存在的翻译后修饰[9,10],当正常上皮细胞转化为癌细胞时,表面糖基化变得异常[11],已有相关的糖基化蛋白作为临床上肿瘤标志物,如肝细胞癌的甲胎蛋白(AFP)[12]、结肠癌的癌胚抗原(CEA)[13]和前列腺癌的前列腺特异性抗原(PSA)[14]。糖基化是由多种糖基转移酶通过复杂的生物合成途径产生的,ALG3属于糖基转移酶家族中的一员,其突变可导致糖基化蛋白糖基化不足和糖蛋白功能障碍[15,16],ALG3有助于肿瘤细胞中的高甘露糖型N-聚糖,已经描述了几种高甘露糖型N-连接聚糖的异常表达与癌症进展有关[17],在乳腺癌患者血清中也已经检测到丰富的高甘露糖聚糖[18]。研究表明,下调ALG3可抑制MCF-7细胞在体外和体内的生长[19],而其在三阴性乳腺癌中的功能作用尚不明确。
首先,本研究采用Western blot检测正常人乳腺上皮细胞和不同乳腺癌细胞中ALG3蛋白的表达水平,结果发现,多种乳腺癌细胞中ALG3蛋白的表达水平高于正常人乳腺上皮细胞,且MDA-MB-231细胞中的表达水平最高。为进一步说明ALG3对MDA-MB-231细胞相关生物学行为的影响,通过RNA干扰技术和转染敲减MDA-MB-231细胞中ALG3蛋白的表达,观察下调ALG3蛋白对MDA-MB-231细胞增殖、侵袭和迁移的影响,结果表明,ALG3-KD组MDA-MB-231细胞增殖、侵袭和迁移能力相较于对照组均受到了明显抑制。Cui等[20]的研究表明,ALG3促进卵巢癌的增殖和腹膜转移等恶性行为,且与不良预后相关。Zhao等[21]的研究表明,ALG3在肝细胞癌中过度表达,沉默其表达可以抑制增殖、侵袭迁移能力。同理,Li等[22]的研究证实了ALG3在膀胱癌中也呈现高表达状态,下调ALG3的表达可以抑制膀胱癌的发生发展。本研究的结果与上述文献报道的结果一致。
据报道,ALG3可能通过CDK-周期蛋白途径促进口腔鳞状细胞癌的侵袭性行为[6],还可以通过FTX/miR-342轴促进急性髓系白血病的耐药发展[4]。本研究通过Western blot检测肿瘤增殖、侵袭和凋亡相关基因变化,发现ALG3可以调节Bcl-2、MMP2、Cyclin D1的表达,而这些基因蛋白都是与JAK/STAT通路相关的下游蛋白,提示ALG3促进MDA-MB-231细胞的恶性行为可能与该通路相关。酪氨酸蛋白激酶/信号传导和转录激活因子(Janus kinase-signal transducers and activators of transcription,JAK/STAT)是从膜表面传递外部信号激活靶基因转录的主要信号级联途径之一,其信号异常有助于肿瘤的增殖和转移[23],当有配体与细胞表面受体结合时,JAKs会通过磷酸化STATs从而形成二聚体进入细胞核内与DNA结合,调节目标基因的转录[24]。STATs磷酸化导致稳定的二聚体的形成,这些二聚体在细胞核中易位,并与基因启动子区域的特定回文序列结合,启动转录反应,从而调节细胞的增殖、分化和凋亡[25,26]。研究表明,JAK/STAT信号通路对于乳腺癌细胞的增殖及凋亡具有重要作用,抑制该信号通路可抑制癌细胞的发生及发展[27],因此,对于开发乳腺癌的新的治疗方法,JAK/STAT通路应该是一个潜在的靶点。在本研究中,为了确定ALG3介导的影响MDA-MB-231细胞增殖、转移和凋亡的机制,通过Western blot检测下调ALG3表达后JAK/STAT信号通路相关蛋白,表现为增殖、转移相关蛋白(MMP2、Cyclin D1)表达受到抑制,凋亡相关蛋白(Bcl-2)表达水平升高,且磷酸化水平降低,提示下调ALG3可以抑制JAK/STAT信号通路下游蛋白的表达和磷酸化。此外,使用WP1066阻断JAK/STAT通路后,ALG3-OE+WP1066组MDA-MB-231细胞增殖、侵袭和迁移水平受到不同程度的影响,表明抑制JAK/STAT通路可以降低ALG3对MDA-MB-231细胞的增殖、侵袭和迁移能力。由此推测,ALG3可能通过激活JAK/STAT通路下游蛋白(JAK2/pJAK2、STAT3/pSTAT3、Bcl-2、MMP2、Cyclin D1)及其磷酸化,从而促进MDA-MB-231细胞的增殖、侵袭和迁移。
综上所述,ALG3可能通过激活JAK/STAT信号通路促进乳腺癌细胞增殖、侵袭和迁移,可能成为乳腺癌分子诊断及治疗靶点,但具体通过何种方式影响JAK/STAT通路仍需进一步研究。然而,本研究仍有一定的局限性,仅从细胞层面进行验证,后续还可以在生信、组织和体内实验上进行更深层次的研究,给本研究提供更充分的理论依据。
