外泌体包裹GDF15 siRNA靶向治疗肝癌的研究
2023-06-19冯东林曹正聪张会斌李招招杜海琛王昭维
冯东林,曹正聪,何 柳,张会斌,李招招,杜海琛,王昭维,何 磊,李 萌*,郭 惠
(1陕西中医药大学,陕西省中药基础与新药研究重点实验室,咸阳 712046;2空军军医大学药学系生物制药学教研室;3陕西学前师范学院信息工程学院;4陕西师范大学校医院;*通讯作者,E-mail:limeng@fmmu.edu.cn;#共同通讯作者,E-mail:guohui@sntcm.edu.cn)
肝癌是我国最常见恶性肿瘤之一,虽然过去数十年我国肝癌发病率和死亡率呈现下降趋势,但目前我国肝癌患者和死亡人数仍处全球第一[1]。2020年Global Cancer Observatory数据库的统计数据显示,全球45.3%的肝癌新发病例及47.1%死亡病例发生在我国[2]。如何进一步降低我国肝癌的疾病负担,仍是我国公共卫生和慢性病防控领域亟待解决的重大问题。
生长分化因子15(growth differentiation factor 15,GDF15)是转化生长因子β(transforming growth factor β,TGF-β)超家族成员之一,也被称为巨噬细胞抑制因子-1(MIC-1)、非甾体抗炎药激活基因-1(NAG-1)、前列腺衍生长因子(PDF)等[3]。本课题组前期研究表明,GDF15能够通过CD48调节Treg细胞,改变肿瘤免疫微环境,促进肝癌的发生发展,是肝癌免疫治疗的重要靶点[4]。且有研究认为GDF15是晚期肿瘤病人发生恶液质的重要原因,通过抑制GDF15的表达,能够显著提升晚期肿瘤病人的生活质量,并延长其生存期[5,6]。同时,GDF15在正常组织中表达量很低,对正常的细胞没有明显的作用。本课题组根据GDF15在肿瘤发生发展中的重要作用,研发了GDF15的单克隆抗体,并证明其能够显著抑制肝癌,该结果获得国家发明专利证书[7]。但是相较于单克隆抗体而言,从基因角度阻断GDF15的表达可以更高效,所以选择更好的干预GDF15的方法对于肝癌治疗意义重大。本研究中,我们设计靶向肝癌的工程化外泌体,同时将GDF15的siRNA包裹在外泌体中,完成了肝癌靶向的基因治疗外泌体的构建。
外泌体是由脂质双分子层包裹组成的纳米级囊泡,直径范围大概在50~200 nm,可在体内细胞间传递重要信息[8,9]。外泌体具有长距离传输和递送生物活性物质的优异特性[10]。可将包裹的生物活性物质有效递送至靶器官,包括难以到达的组织[11]。然而,天然的外泌体并不具有靶向性,通过基因工程技术可对外泌体的结构和组成进行改造,以增加其靶向性和治疗潜力。肝癌特异靶向肽SP94,它的多肽序列为SFSHHTPILPLC,可与肝癌细胞特异性结合,并能够增加肝癌细胞凋亡和抑制新生血管形成,在临床上有重要的用途[12]。基于肝癌治疗的严峻形势,以及本课题组前期对于GDF15的工作,本研究拟开发一种新的肝癌治疗方法。通过基因工程技术,将SP94肽加到Lamp2b的融合基因中,获取SP94肽修饰的工程外泌体,让其具有更强的肝癌靶向能力。同时,我们将GDF15 siRNA通过电转染的方法包裹进肝癌靶向的外泌体中,融合成一个复合物可对肝癌进行靶向治疗,研究其对肝癌的治疗效果,为肝癌的治疗提供更多的临床治疗选择。
1 材料与方法
1.1 细胞培养
小鼠Hepa1-6细胞系、H22细胞系和293T细胞系均购于美国模式培养物研究所ATCC,DMEM和1640培养基购于美国Gibco公司,胎牛血清购于广州赛业生物科技有限公司,青霉素-链霉素混合液购于苏州新赛美生物科技有限公司,在DMEM和1640培养基中添加1%青霉素-链霉素混合液和10%胎牛血清配成完全培养基,在37 ℃、5%CO2细胞培养箱内用DMEM完全培养基培养Hepa1-6和293T细胞,用1640完全培养基培养H22细胞。
1.2 GDF15 siRNA的合成及功能验证
1.2.1 GDF15 siRNA的构建及转染 GDF15 siRNA由北京擎科生物科技有限公司进行设计并合成,合成的GDF15 siRNA的序列为GUGUGUCACUGCAG-ACUUAUG。合成后进行siRNA转染,提前一天将细胞接种于24孔板中,在细胞汇合度为30%左右进行转染。取1 μg的siRNA,加入无血清培养基,混匀后制成无血清siRNA稀释液,终体积为25 μl。取1 μl的EntransterTM-R4000,加入24 μl无血清培养基,充分混匀配制EntransterTM-R4000稀释液,终体积为25 μl,室温孵育10 min。再将EntransterTM-R4000稀释液和siRNA稀释液涡旋混匀,室温放置15 min。然后将转染复合物加入至细胞培养皿,轻微晃动培养皿充分均匀。4 h后观察细胞的状态,并继续培养24 h。然后将细胞用于后续的检测,用实时定量PCR、蛋白免疫印迹和流式细胞术验证GDF15 siRNA的功能。
1.2.2 实时荧光定量PCR(qPCR)检测GDF15 mRNA水平 将转染的细胞用荧光定量PCR法测定GDF15 mRNA表达量。一组为转染无靶向siRNA的对照组,一组为转染GDF15 siRNA的实验组,使用Trizol试剂提取细胞总RNA并检测RNA浓度,取1 mg RNA采用逆转录试剂盒将RNA逆转录为cDNA,在1.5 ml的EP管中加入4 μl 5×HiScript Ⅱ qRT SuperMix Ⅱ逆转录酶试剂,再加入DEPC水补至20 μl,轻柔吹打混匀,在PCR仪中进行逆转录反应,条件为:50 ℃ 15 min;85 ℃ 5 s,反应完全后得到cDNA产物,将其立即用于qPCR反应,以cDNA为模板,按照qPCR试剂盒进行反应体系配制:2×BimakeTM SYBR Green Master Mix 10 μl,上游引物1 μl,下游引物1 μl,cDNA 2 μl,DEPC水补至20 μl。将反应体系加入八联管中,在7500 Fast实时荧光定量PCR系统中进行反应。条件如下:95 ℃ 30 s;95 ℃ 10 s,60 ℃ 30 s,重复40个循环。引物序列见表1。并以β-actin作为内参进行PCR扩增。用GraphPad 8.3软件以2-ΔΔCt法进行统计分析并绘图。
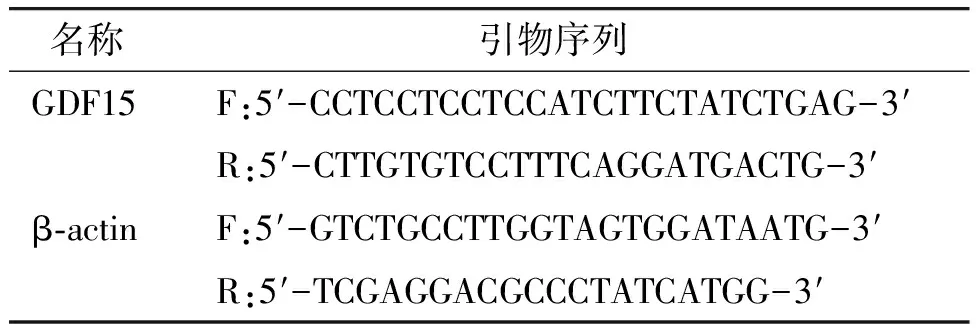
表1 引物序列
1.2.3 蛋白质免疫印迹(Western blot)检测GDF15的蛋白表达 收集转染了GDF15 siRNA的实验组细胞和无靶向的siRNA对照组细胞,用PBS清洗两遍后,离心后留下细胞沉淀,加入80 μl的RIPA裂解液,同时加入1%的蛋白酶,磷酸酶抑制剂,在冰上裂解30 min,在12 000g,4 ℃离心15 min,小心吸取上清于新EP管,即得到细胞的蛋白裂解液。加入样品1/4体积的5×Loading Buffer后煮沸10 min。取制备好的蛋白样品,上样30 μg总蛋白,进行SDS-PAGE电泳,至溴酚蓝跑至玻璃板底部即可停止。采用蛋白湿转转膜法将蛋白转至甲醇活化后的PVDF膜上,在5%脱脂奶粉溶液中室温封闭2 h,封闭结束后,将GDF15和β-actin抗体进行1∶1 000的稀释,4 ℃孵育过夜;HRP标记的二抗1∶3 000稀释,室温孵育二抗1 h。ECL发光液显色,用全自动化学发光成像分析系统进行图像采集。
1.2.4 流式细胞术测定GDF15的表达 将转染的细胞用流式细胞术测定GDF15的表达,一组为无靶向siRNA的对照组,一组为GDF15 siRNA的实验组,分别收集两组细胞,用PBS清洗两遍后,离心后以200 μl的PBS缓冲液进行重新悬浮,加入1.5 ml的EP管中,分别将5 μl的PBS、Isotype IgG、GDF15加入,用移液器将细胞吹分散,室温条件下、避光孵育30 min。以空白对照组和同型对照组设定参数,以此参数对样本数据进行采集,收集的有效细胞数为104个。
1.3 SP94-外泌体的构建及形态观察
1.3.1 外泌体质粒的设计合成 在pcDNA3.1载体中人巨细胞病毒(cytomegalovirus,CMV)启动子的下游,将编码SP94肽和Lamp2b的cDNA片段插入,同时将人流感血凝素(HA)标签添加在Lamp2b序列的末尾,构建成SP94-Lamp2b-HA的质粒。再进行质粒转染,首先提前使用无血清培养基培养HEK293T细胞8 h,再使用转染试剂LipofectamineTM3000将SP94-Lamp2b质粒转染到293T细胞中,5 h后更换加入添加了2 μg/ml嘌呤霉素的DMEM完全培养基,杀伤筛选72 h,即得到能稳定表达工程化外泌体的细胞株。
1.3.2 外泌体收集与提取 将转染了SP94-Lamp2b-HA的293T细胞在培养箱中正常培养3 d,收集培养上清液,4 ℃,400g离心5 min,弃掉细胞沉淀,收集上清,然后在4 ℃,10 000g离心0.5 h,收集上清,得到含有外泌体的细胞培养基,接着在4 ℃,120 000g条件下超速离心90 min,弃掉上清,收集外泌体沉淀,加入200 μl的PBS混合均匀。取GDF15 siRNA,充分溶解于外泌体溶液中,利用电转染的方法将siRNA转染至外泌体中,保存于-80 ℃超低温冰箱冷藏待用。
1.3.3 外泌体表征分析 送上海和元生物公司使用NanoSight NS300和纳米颗粒跟踪分析(nanoparticle tracking analysis,NTA)系统测量外泌体粒径大小。将外泌体溶液用PBS溶液稀释至108粒/ml,根据NanoSight NS300的仪器说明进行上机检测,然后使用NanoSight NTA3.2软件对结果进行分析。送上海和元生物公司使用透射电子显微镜HITACHI-HT7700观察外泌体形态,首先将提取的外泌体用戊二醛溶液固定,然后在铜网上滴加5 μl的外泌体溶液,室温条件下吸附10 min,将多余液体除去,再向铜网上滴加2%磷钨酸溶液约10 μl,室温染色2 min,除去多余的染色液,将铜网晾干,最后上机观察拍照。
1.4 外泌体的肝癌治疗
1.4.1 原位肝癌的构建 6~8周龄雄性C57BL/6小鼠购于空军军医大学实验动物中心,按照10 μl/g的剂量经腹腔注射0.6%戊巴比妥钠进行麻醉处理,用剃毛器剃除小鼠胸部及腹部表面毛发,取仰卧位固定小鼠四肢于实验板上,用75%乙醇常规消毒皮肤,在剑突下1 cm处向上开腹做出0.5~1 cm长的切口,轻轻推挤胸腔使肝左叶露出体表,小心将其推出。用胰岛素针注射20 μl(10 μl生理盐水和10 μl基质胶混合液重悬)的Hepa1-6细胞悬液,约3×106个细胞至肝左叶,平直进针0.5~1 ml后缓慢注射,拔针后用棉签小心按压50~60 s至无血渗出。将肝左叶小心推回腹内,以可吸收外科缝合线缝合腹膜,再以手术缝合线缝合关腹,酒精消毒处理,并在切口左右两侧打入2~3个利多卡因皮丘。
1.4.2 肝癌的治疗和生存期统计 将26只原位肝癌小鼠随机平均分为两组,一组用空载外泌体SP94-外泌体治疗作为对照组,一组用包裹了GDF15 siRNA的外泌体进行治疗作为实验组。在原位肝癌构建模型成功后进行治疗,治疗组通过尾静脉注射包裹了GDF15 siRNA的外泌体进行治疗,对照组单独注射空载外泌体,剂量均为2 mg/kg,每3 d治疗一次,治疗5次后结束治疗。将5只对照组小鼠和5只实验组小鼠用于肿瘤观察。剩下的8只对照组小鼠和8只实验组小鼠用于生存期统计,在常规的条件下继续饲养小鼠,直到其死亡。
1.4.3 小鼠肿瘤的观察 在治疗期间,从第一次治疗开始进行小动物活体成像(IVIS lumina Ⅱ)观察肿瘤生长及外泌体靶向情况,每隔3 d一次,共观察5次。观察前,按小鼠10 μl/g体质量的剂量腹腔注射1×D-荧光素钾盐(D-luciferin solution),10 min后上机进行底物发光图像采集,并根据平均荧光强度进行数据分析和统计。最后一次实验后处死小鼠,解剖出小鼠的肝脏进行拍照,观察肿瘤的生长状况。
1.5 外泌体的体内安全性评价
1.5.1 血液学分析 清洁级C57BL/6小鼠20只,6~8周龄,雌雄各半,购于空军军医大学实验动物中心。将小鼠按雌雄随机分为两组,一组尾静脉注射20 mg/kg的SP94-siRNA-外泌体作为实验组,一组接受生理盐水注射作为对照组,每组10只,实验组每天尾静脉注射20 mg/kg的SP94-siRNA-外泌体一次,对照组每天尾静脉注射生理盐水一次,连续治疗12 d。在最后一次给药后1 d处死小鼠,收集血液样本和主要器官组织(心、肝、脾、肺肾),进行血液学和组织化学分析。用日立7080化学分析仪分析天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、碱性磷酸酶(ALP)、血尿素氮(BUN)和肌酐(CR)等肝肾损伤标志物水平。同时分析炎性细胞因子,如γ干扰素(IFN-γ)、肿瘤坏死因子α(TNF-α)和白细胞介素1β(IL-1β)的水平。
1.5.2 器官HE染色 心、肝、肺、脾和肾主要器官用多聚甲醛固定48 h,组织依次在75%,85%,95%,100%乙醇和二甲苯中脱水,接着将处理后的组织用石蜡包埋,最后将石蜡包埋的组织切成4 μm厚的切片,进行常规苏木精和伊红染色后用显微镜观察。
1.6 统计学分析
使用Prism 8.3.0软件(GraphPad)进行统计分析和数据可视化,数据组间差异分析使用独立样本t检验,生存曲线分析采用对数秩检验(Log rank test),P<0.05视为差异具有统计学意义。
2 结果
2.1 GDF15 siRNA的合成及功能验证
由公司合成的GDF15 siRNA的序列为5′-GUGUGUCACUGCAGACUUAUG-3′。在Hepa1-6和H22细胞中转染了GDF15 siRNA后,结果发现相比于对照组,实验组GDF15的mRNA和蛋白水平表达水平降低,流式细胞术结果也显示实验组的GDF15表达更低,差异有统计学意义(P<0.05,见图1)。

对照组为转染无靶向siRNA的细胞,实验组为转染GDF15 siRNA的细胞;与对照组比较,***P<0.001
2.2 SP94-外泌体的构建及形态观察
将融合表达SP94-Lamp2b-HA的质粒转染到293T细胞中制备稳定的细胞系(见图2A)。纳米颗粒分析仪测量结果显示,未修饰外泌体和肝癌靶向外泌体(SP94-外泌体)的大小都很均匀,粒径大小都在110 nm左右,没有显著差异(见图2B)。使用透射电镜观察转染了GDF15 siRNA的外泌体(SP94-siRNA-外泌体),它的形态和大小与未修饰外泌体和SP94-外泌体都没有明显区别,都为完整的圆球形(见图2C)。以上结果证实已经成功制备出工程化的外泌体。
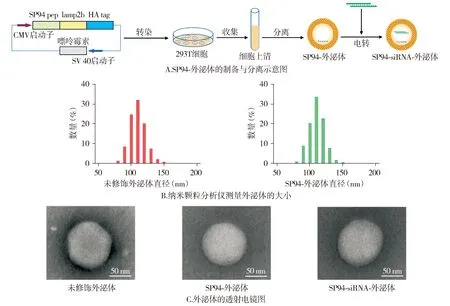
图2 工程化外泌体的构建与形态表征
2.3 SP94-siRNA-外泌体对原位肝癌的治疗作用
通过小动物成像的拍摄,本研究发现实验组的肿瘤荧光强度值偏低(见图3)。进行荧光统计后发现实验组的荧光强度值明显低于对照组(P<0.05,见图3)。且在第20天对小鼠的肝脏进行解剖,实验组的肝脏情况好于对照组,4个肝脏无明显的肿瘤组织块,表面光滑,1个肝脏有少量的肿瘤组织,而对照组的5个肝脏都有较大的肿瘤组织块(见图3),说明实验组的药物对肝癌有着良好的治疗效果。在生存期比较上,实验组的生存期明显长于对照组(P<0.05,见图3)。

对照组注射SP94-外泌体,实验组注射SP94-siRNA-外泌体;绿色圈出部位代表肿瘤组织块;与对照组比较,**P<0.01,***P<0.001
2.4 外泌体安全性评价
通过血液生物化学和血液学分析外泌体的潜在毒性作用,对天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、碱性磷酸酶(ALP)、血尿素氮(BUN)和肌酐(CR)等这些肝肾损伤的关键生物标志物进行检测分析,实验组与对照组比较,这些指标均无统计学差异(P>0.05,见图4A),表明本研究构建的工程化外泌体无明显的肝肾毒性。另外HE染色结果显示,实验组小鼠的心脏,肝脏,脾脏,肺和肾脏没有表现出任何明显的组织病理学异常或损伤(见图4B)。通过血清炎性细胞因子如IL-1β、TNF-α和IL-6的检测发现,实验组小鼠与对照组有相似的水平(见图4C),表明实验组未造成明显炎症反应。在实验期间,实验组小鼠的体重和对照组没有差别(见图4C)。以上结果表明,我们所构建的工程化外泌体不会对小鼠的血液系统和主要器官造成急性毒性。
3 讨论
肝癌是世界上最常见的癌症之一,其发病原因和机制十分复杂,且病人一旦确诊,通常处于晚期,可用于治疗的方式十分有限[13,14]。GDF15是TGF-β超家族的成员之一。在生理条件下GDF15表达水平很低,但在炎症疾病和恶性肿瘤下显著上调[15-17]。有研究报道,GDF15通过Cyclin D1和Cyclin E1的上调以及通过PI21K/AKT和MAPK/ERK信号通路在ErbB3复合物中下调p2促进宫颈癌细胞的增殖[18]。还有研究表明,GDF15通过上皮间充质转化和干细胞特性来促进乳腺癌的放射耐药性[19]。且有研究报道,肝细胞癌中的肝星状细胞通过产生更多的GDF15促进肿瘤生长[20]。
外泌体是由细胞内多泡体与细胞膜融合后,释放到细胞外基质中的膜性囊泡,具有低免疫原性和强生物相容性的特点,可以作为一种运输载体[21]。但是,外泌体缺乏靶向能力[22],不能将药物运输至指定的器官,导致药物难以发挥应有的作用。肝癌特异靶向肽SP94,可与多种肝癌细胞特异结合,并且不影响正常的细胞。我们将SP94多肽表达到外泌体表面,构建了一个可以靶向肝癌的工程化外泌体,很好地解决了药物的精准递送问题,增强了药物的疗效。
本课题组前期开发了GDF15单克隆抗体,通过阻断游离的GDF15能够显著抑制肝癌的生长[4,7]。但由于抗体治疗存在一定的免疫排斥,并且阻断效率存在一定的限制。由于GDF15在正常组织和细胞中表达量非常低,并不具有特殊的生物学功能,因此通过基因治疗的方法抑制GDF15的表达,对于肝癌的临床治疗具有十分重大的意义。我们设计并合成了一个GDF15 siRNA,通过电转染的方法将siRNA导入到工程化外泌体中,通过透射电镜观察发现包裹了GDF15 siRNA的外泌体形态和空载外泌体没有明显区别。之后通过尾静脉注射法给药至小鼠体内,观察发现包裹了siRNA的外泌体能够显著抑制小鼠肝癌的生长,并延长其生存期。并且对其急性毒性进行研究,发现其对小鼠的主要组织无明显影响,小鼠的多种血液指标和炎症指标均未出现明显异常。此研究证明我们开发了一种靶向肝癌基因治疗的新方法,为肝癌的临床治疗提供了更多的选择。
