CSDC2蛋白免疫优势肽段分析及其多克隆抗体的制备
2023-06-12朱荷青玛哈巴肉孜李莹莹张洁许赫李甜甜韩吉龙彭夏雨杨敏
朱荷青,玛哈巴·肉孜,李莹莹,张洁,许赫,李甜甜,韩吉龙,彭夏雨,杨敏*
(1 石河子大学动物科技学院,石河子 832000;2 新疆维吾尔自治区畜牧总站,乌鲁木齐 830000)
绒山羊属于典型的双毛动物,分为覆盖体表的长毛和长毛下致密柔软的羊绒,一簇羊绒由1至3个初级毛囊(Primary Hair Follicle,PHF)产生的长毛和6至15个次级毛囊(Secondary Hair Follicle,SHF)生成的绒毛组成[1-2],而次级毛囊会经历从生长期(anagen)至退行期(catagen)再到休止期(telogen)的周期性再生过程[3]。羊绒产业在我国畜牧业中占有重要地位,如何有效增加绒的产量一直是我国绒山羊种质创新领域的研究热点[4],近年来从分子水平解析次级毛囊周期性生长的机制变得十分重要。毛囊的生长发育是一个复杂的过程,涉及数个信号通路、基因和ncRNA的相互作用[5-6],如Wnt信号通路(Wnt signaling pathway)、成纤维细胞生长因子FGFs(Fibroblast growing factors, FGFs)、转化生长因子TGF(Transforming growth factor, TGF)、表皮生长因子EGF(Epidermal growth factor, EGF)、骨形态发生蛋白BMP(Bone morphogenetic protein, BMP)等[7-10],对调控因子的筛选和基因互作的研究一直是毛囊发育生物学研究的重点。
本课题组前期通过比较转录组学发现含有C2的冷休克结构域(cold shock domain containing C2, CSDC2)在毛囊的生长期高表达,在休止期低表达,经小鼠皮肤组织验证,使用siRNA干扰CSDC2能够令毛囊发育关键基因Foxn1和Notch1的表达量降低[11],因此推测CSDC2参与绒山羊次级毛囊从生长旺盛期到休止期的调控过程,但该假设仍需进一步的实验分析。CSDC2是一种广泛存在于原核和真核生物中的高度保守的RNA结合蛋白(RNA Binding Protein,RBP),RBPs与癌细胞的增殖和分化有关,研究表明CSDC2的启动子内存在一个编码miR-373的位点,miR-373 能与CSDC2的启动子序列互补结合[12-15],所以本研究拟采用染色质免疫共沉淀技术(chromatin immunoprecipitation, ChIP)寻找CSDC2的下游调控基因,探索该基因参与毛囊周期性调控的机制。而ChIP最重要的一步即特异性抗体的选择,因此制备有效的特异性抗体尤为重要。基于此本研究使用生信分析手段筛选出CSDC2的免疫优势肽段并制备多克隆抗体,同时利用免疫印迹检测抗体的特异性,为进一步利用染色质免疫共沉淀技术探索该转录因子在毛囊周期性生长中的分子机制提供条件。
1 材料与方法
1.1 试验动物及试剂
实验级日本大耳白兔,雌性,6~8周龄,体重1 kg。新疆绒山羊,雄性,3周岁,饲养于石河子大学动物科技学院实验站。完全弗氏佐剂、不完全弗氏佐剂、TMB 显色液购自Sigma;脱脂奶粉、HRP-羊抗兔 IgG、PVDF膜、1×TBST、高效RIPA裂解液、PAGE彩胶快速配成试剂盒、ECL显色液购自北京索莱宝科技有限公司。
1.2 CSDC2蛋白的生物信息学分析
从UniProt蛋白质数据库(https://www.uniprot.org/)获取山羊的CSDC2全长氨基酸序列(A0A452FJD6),采用在线二级结构分析软件SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和Predictprotein(https://predictprotein.org/)共同预测二级结构;使用SWISS-MODEL(https://swissmodel.expasy.org/)预测CSDC2蛋白的三级结构;使用Expasy中的ProtParam 蛋白质基本性质分析工具(https://web.expasy.org/protparam/)分析CSDC2 蛋白的基本理化性质和亲水系数;使用在线工具ProtScale(https://web.expasy.org/protscale/)绘制CSDC2蛋白的亲疏水性图谱;利用DNAstar的Protean程序分析CSDC2蛋白的抗原指数、表面可及性、柔韧性;使用TMHHM 2.0(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)分析预测CSDC2的跨膜结构;使用SignalP 5.0(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)预测CSDC2蛋白的信号肽;使用NetPhos 3.1(https://services.healthtech.dtu.dk/service.php?NetPhos-3.1)在线预测CSDC2蛋白的磷酸化位点。
1.3 CSDC2蛋白的抗原表位筛选
应用在线分析软件SVMTriP(http://sysbio.unl.edu/SVMTriP/prediction.php)对CSDC2的抗原表位进行预测,同时综合生信分析结果筛选出该蛋白的免疫优势肽段。
1.4 动物免疫、抗血清 ELISA 检测及纯化
将筛选的N-端氨基酸序列肽段(HSPKSPVWPTFPFHREGSR, aa 15-33)交送武汉爱基百客生物科技有限公司进行多肽合成和钥孔血蓝蛋白(KLH)偶联,于第1、12、26、40、54 d免疫1只SPF级日本大耳白兔,白兔编号E1,于实验前采集白兔血清作为阴性对照。首次免疫佐剂采用完全弗氏佐剂,第 2~5 次免疫采用不完全弗氏佐剂,在免疫前将佐剂与抗原等量混匀并充分乳化,首次免疫剂量为0.7 mg,第 2~5 次免疫剂量为0.35 mg,于初次免疫后第66 d颈动脉采血,4 ℃,1 500 g 离心 20 min,收集上层血清于-80 ℃保存备用。
将无偶联 KLH多肽抗原与包被液按1∶8 000稀释后,每孔100 μL加入96孔板中,4 ℃放置过夜。PBST-5%脱脂奶粉室温封闭 0.5 h后洗涤3次;每孔加入第 66 d白兔免疫血清(按 1∶1 000、1∶5 000、1∶10 000、1∶50 000、1∶100 000 、1∶200 000稀释),37 ℃孵育1 h;PBST 洗涤 3 次,加入 1∶8 000稀释HRP-羊抗兔 IgG,37 ℃孵育1 h;每孔加入100 μL TMB显色液,室温暗处放置15 min,加入 50 μL终止液,拍照记录。抗血清用HSPKSPVWPTFPFHREGSR-C 作抗原亲和纯化得到浓缩后的抗体,标记为E1。
1.5 抗体特异性的检测
采集处于绒山羊生长期的皮肤组织(7月),在羊体右侧肩胛骨后沿背中线与腹中线的上1/3处剪去绒和毛,裸露的皮肤用75%酒精消毒,使用无菌医用手术剪剪取1 cm2皮肤组织,迅速置于液氮中保存备用。
将皮肤组织样本使用RIPA裂解液(含 1 μL PMSF)于冰上提取总蛋白,每 10 min 摇匀 1 次,共 3 次;放入 4 ℃离心机 12 000 g离心10 min,取上清。SDS-PAGE电泳浓缩胶浓度5%,电压80 V;分离胶浓度12%,恒定电压150 V。使用0.45 μm 孔径的 PVDF 膜恒流 200 mA湿转30 min,含 5%(W/V)脱脂牛奶 TBST室温封闭4 h。以制备的兔抗CSDC2蛋白多克隆抗体(稀释比1∶1 000)为一抗4 ℃过夜孵育,HRP-羊抗兔 IgG (稀释比1∶8 000)作为二抗37 ℃孵育1 h,ECL显色后拍照保存。
2 结果
2.1 CSDC2蛋白结构的预测
CSDC2蛋白由153个氨基酸构成,相对分子质量为16 757.86,等电点(PI)为7.01,氨基酸序列如图1。CSDC2蛋白的N末端是Met,在体外培养的哺乳动物网织红细胞中的半衰期为30 h,在酵母中大于20 h,在大肠杆菌中大于10 h。

图1 CSDC2 蛋白的氨基酸序列
蛋白二级结构预测分析软件SOPMA和Predictprotein预测结果如图2所示,可以看出无规则卷曲在该蛋白质中占比最高,α-螺旋和β-折叠相对较少。使用SOPMA(图2A)预测α-螺旋13(8.5%)、β-折叠14(9.15%)、无规则卷曲92(60.13%)、延伸链34(22.22%)。使用Predictprotein(图2B)预测α-螺旋6(3.9%)、β-折叠39(25.5%)、无规则卷曲108(70.5%)。取两种方法中预测一致的重叠区,无规则卷曲主要分布于N-端氨基酸序列的第1~58、146~153位。三级结构SWISS-MODEL预测结果见图2C。

A:SOPMA预测结果,h为α-螺旋,t为β-折叠,c为无规则卷曲,e为延伸链;B:Predictprotein预测结果;C:CSDC2蛋白的三级结构。图2 CSDC2的蛋白结构
2.2 CSDC2蛋白的理化性质
利用ProtParam分析得出CSDC2蛋白的脂溶指数为61.63,平均亲水系数为 -0.493,亲/疏水性图谱如图3A所示,第33位(精氨酸,Arg)为CSDC2蛋白中最亲水的氨基酸位点,得分为 -2.044,第131位(谷氨酸,Glu)为该蛋白中最疏水的位点,得分为1.478,说明CSDC2蛋白属于亲水性蛋白。CSDC2蛋白的抗原指数、表面可及性、柔韧性分析结果见图3B,该蛋白的柔性区域主要集中于氨基酸序列的12-53 aa,在5-9 aa、12-22 aa、29-34 aa、36-57 aa、65-68 aa、76-82 aa、86-93 aa、100-104 aa、109-113 aa、121-126 aa、141-150 aa散在分布。抗原指数评分较高的区域为第1-9、14-21、27-57、61-67、72-82、86-95、99-115、120-130、140-148位氨基酸,柔性较高的区域与抗原指数得分高的区域基本一致。表面可及性得分较高的区域为2-7 aa、14-18 aa、27-31 aa、42-57 aa、76-81 aa、121-126 aa、140-145 aa。使用TMHHM 2.0预测CSDC2跨膜结构如图3C所示,无跨膜结构域并完全位于膜内。
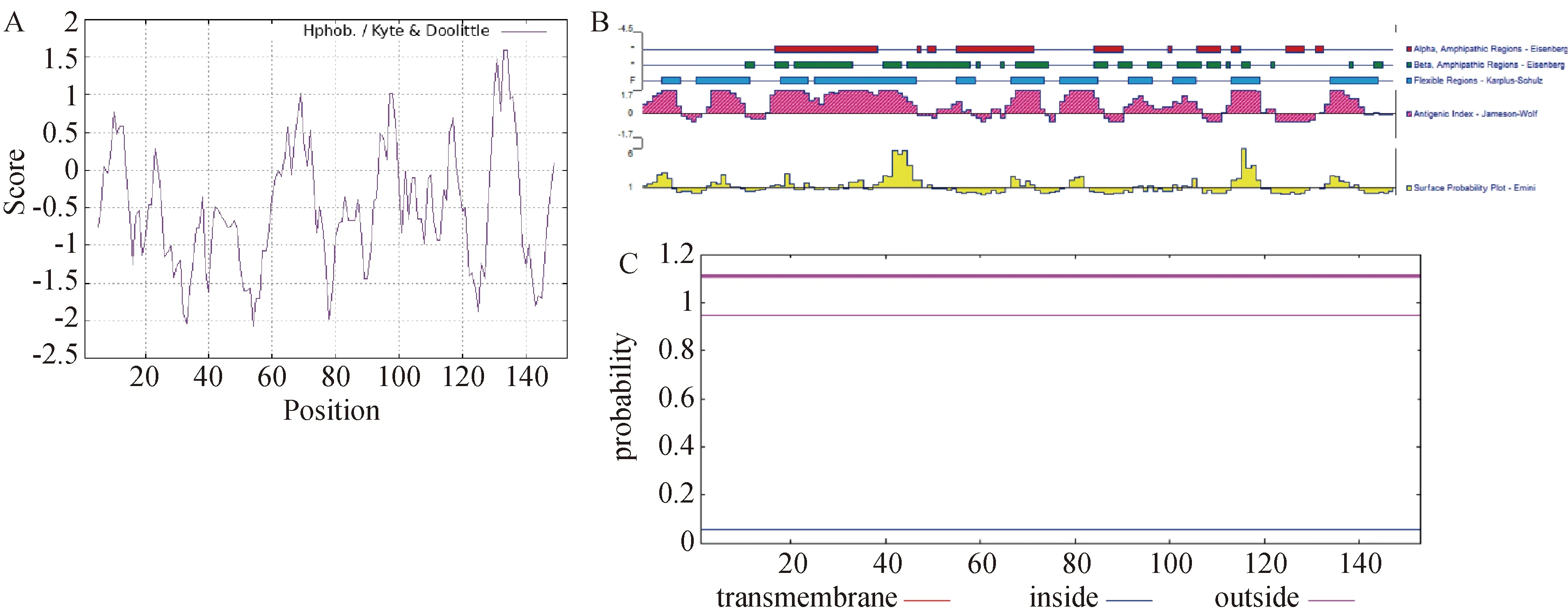
A:ProtParam的疏水性分析结果;B:Protean的理化性质分析结果,蓝色条为柔韧性较高的区域,粉色峰为抗原指数,黄色峰为表面可及性;C:CSDC2的跨膜结构分析。图3 CSDC2的亲疏水性、抗原指数、表面可及性、柔韧性及跨膜结构
2.3 信号肽及磷酸化位点预测
信号肽及磷酸化位点预测见图4。
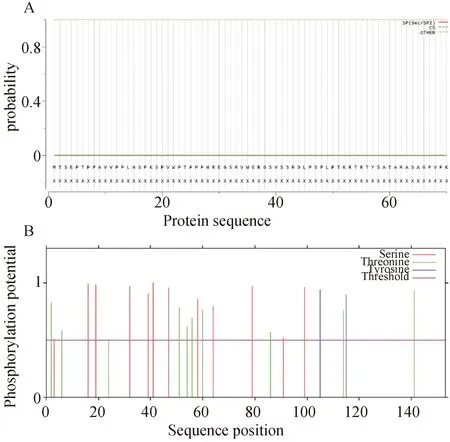
A:SignalP 5.0的信号肽预测结果;B:NetPhos 3.1的磷酸化位点预测结果。图4 CSDC2的信号肽及磷酸化位点
SignalP 5.0在线软件预测显示CSDC2无信号肽,应用NetPhos 3.1在线软件预测CSDC2蛋白的磷酸化位点,设置阈值高于0.5的为潜在磷酸化位点,该蛋白在第3、16、19、32、39、41、47、58、64、79位丝氨酸处,第2、6、24、51、54、56、60、86、114、141位苏氨酸处,第105、115位酪氨酸处发生磷酸化,结果见图4。
2.4 CSDC2蛋白抗原表位的预测
使用SVMTriP在线分析软件预测CSDC2的抗原表位,表位长度设置为20 aa,结果见表1。综合二级结构预测结果、基本理化性质及抗原表位预测结果,选择蛋白-N端15-33 aa(HSPKSPVWPTFPFHREGSR)合成多肽HSPKSPVWPTFPFHREGSR-C。

表1 SVMTriP预测CSDC2抗原表位得分表
2.5 抗血清ELISA检测、纯化
浓缩后抗体浓度为2.70 mg·mL-1,间接ELISA检测结果见图5,每行包被100 μg·μL-1的五免血清,抗体浓度正常,效价良好。
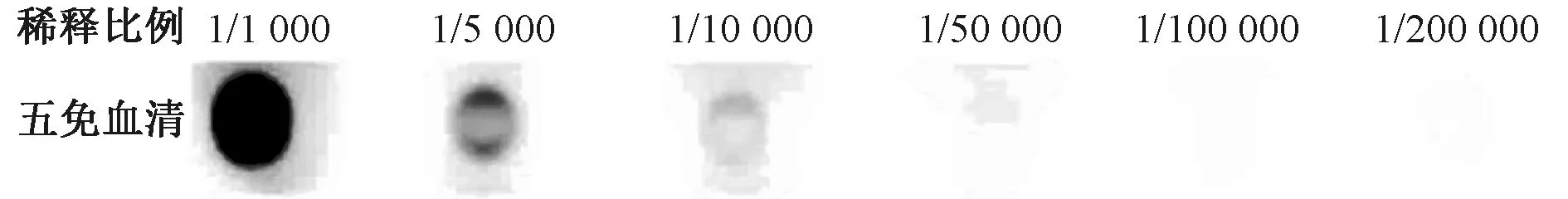
图5 抗血清ELISA检测
2.6 抗体特异性检测结果
为确定抗体是否可以用于ChIP实验,使用从绒山羊皮肤组织中提取的总蛋白,以纯化后的抗体作为一抗检测抗体的特异性,Western blot结果见图6。CSDC2蛋白的相对分子质量约为17 kD,在15 ~ 20 kD处有条带。

M: 蛋白分子量标准; 1: CSDC2蛋白的ECL显色。图6 绒山羊皮肤组织蛋白的western blot鉴定
3 讨论
特异性抗体在人类和动物的功能基因研究中被广泛应用并具有重要作用,但获得特异性强、高效价的抗体一直较为困难,而多克隆抗体以方法简单、成本低成为抗体制备的首选[16-17]。CSDC2由一个含有RNP1和RNP2基序的CSD以及两个能够结合双链RNA的结构域构成,目前国内外对于CSDC2的功能研究仍较少,有研究表明CSDC2在锥体神经元的终末分化中起到促进作用,同时CSDC2是造成小鼠子宫UIII细胞蜕膜的主要调节因子,在卵巢激素的作用下参与胚胎与子宫内膜的信号交流[18-19],说明CSDC2在细胞增殖分化过程中具有重要作用。前期研究发现,CSDC2作为重要的转录因子在绒山羊皮肤组织中随绒毛生长呈周期性表达,且发现生长期高表达,休止期地表达,说明CSDC2在绒山羊绒毛周期性调控中其重要作用,本研究推测CSDC2通过调控细胞核内靶基因的表达在绒山羊毛囊周期性生长中参与调控。
为制备绒山羊CSDC2特异性抗体,本研究通过在线分析软件分别对CSDC2蛋白的结构、亲/疏水性、抗原指数、表面可及性、柔韧性、跨膜结构、信号肽、磷酸化位点、抗原决定簇和抗原表位进行预测,结果显示CSDC2 蛋白编码157个氨基酸且无跨膜结构域和信号肽,同时CSDC2蛋白的不稳定系数为51.65,大于阈值40,说明CSDC2属于不稳定蛋白质,而该蛋白的平均亲水系数为 -0.493,表明CSDC2蛋白是一个位于细胞核内,在细胞质中作用的不稳定亲水蛋白。CSDC2具有22处磷酸化位点,根据抗原表位的得分并结合抗理化性质的分析,CSDC2蛋白在第15-33位氨基酸显示出良好的柔韧性、抗原性、表面可及性和亲水性,在二级结构上该段氨基酸位于无规则卷曲区域内,推测是可能的 B 细胞线性肽段位置,因此本研究将该段氨基酸选为免疫试验兔的优势肽段。本研究得到的抗血清的效价较好,同时通过Western blot检测抗体的特异性,选取CSDC2高表达的绒山羊皮肤组织提取总蛋白后进行抗体孵育,结果显示条带大约在17 kD处,即说明本研究制备的多克隆抗体具有一定准确性和生物学效价,可以与CSDC2蛋白特异性结合。
CSDC2作为转录因子中的重要一员,关于其转录调控的研究几乎为空白,其特异性调控绒山羊绒毛周期性生长过程中的靶基因仍不明确。目前研究转录因子分子机制的研究方法包括ChIP-Seq,EMSA等,作为寻找转录因子的靶基因的有效手段,ChIP通过特异性抗体捕获蛋白质与DNA的复合物,是目前研究蛋白质和DNA互作的主流技术[20-21]。随着家畜功能基因和后基因组学的研究不断深入,商业化抗体的种类逐渐增多,但多数抗体仅可用于人类或模式动物如小鼠的研究,国内外在家畜的目的蛋白商业化特异性抗体制备方面依然不够丰富[22],因此如何设计制作符合要求的特异性抗体从而验证目的基因和蛋白在家畜重要表型性状中的作用机制是十分重要的。本研究选择合适的多肽片段免疫试验兔并最终得到为后续免疫共沉淀实验所用的多克隆抗体,为CSDC2基因功能的深入研究奠定了基础。
由此可知,本研究得出绒山羊CSDC2的免疫优势肽段为15~33 aa(HSPKSPVWPTFPFHREGSR)并免疫试验兔制备了多克隆抗体,进一步实验证明该抗体具有较好生物学效价,为后续深入研究CSDC2在绒山羊绒毛周期性生长调控的作用奠定了理论基础。
