硒化甘草多糖对产志贺毒性大肠杆菌抑菌机制以及抗氧化作用探究
2023-06-12王燕张梦圆王蒙蒙杨慧莹刘雨然孙国结朱晓庆谷新利
王燕,张梦圆,王蒙蒙,杨慧莹,刘雨然,孙国结,朱晓庆,谷新利
(石河子大学动物科技学院,新疆 石河子 832003)
抗菌药物的大量使用导致细菌耐药性增加,畜产品药物残留,对畜牧业发展和人类健康造成极大危害,迫切需要研制安全、有效并能减缓细菌耐药性产生的抗菌制剂。目前,中药抗菌制剂已成为研究热点。
产志贺毒性大肠杆菌(Shiga toxin-producingE.coli,STEC)是重要的食源性人畜共患病病原,可导致人类腹泻,出血性大肠炎,溶血性尿毒综合征等,也是畜牧业以及动物产品中常见的致病菌[1]。
甘草味甘,易助湿壅气,具有益气补中,祛痰止咳,解毒等功效。从甘草中提取得到的甘草多糖(GUP),具有抗氧化、抗菌、调节免疫、抗炎等作用[2-5]。硒作为人体必须微量元素之一,具有抗氧化、免疫调节、抗衰老、抗肿瘤等作用[6],在预防和治疗人体各种疾病方面发挥着重要的作用。将GUP与硒经化学反应合成的有机硒化物—硒化甘草多糖(SeGUP),兼具GUP和硒的免疫调节、抗氧化等作用,并能增强SeGUP的抑菌效果。王丹阳等[4]的研究发现,SeGUP对大肠杆菌和金黄色葡萄球菌均有较好体外抑菌效果。而关于SeGUP、GUP抑菌机制以及抗氧化作用得相关研究较少。因此,本文拟通过测定SeGUP、GUP对STEC半数抑制率(Half maximal inhibitory concentration,IC50)、生长曲线、细胞壁通透性、细胞膜完整性、生物被膜形成,以及对试验动物的抗氧化作用来探究SeGUP、GUP抑菌活性、抑菌机制以及抗氧化效果,为进一步开发利用天然中草药以及研发新型植物多糖抑菌剂提供理论基础,为SeGUP、GUP在缓解畜牧业氧化应激方面提供科学依据。
1 材料与方法
1.1 材料
1.1.1 菌株与试剂
新疆乌拉尔甘草购自石河子市国浩中草药公司;BHI、营养肉汁琼脂均购自青岛高科技园海博生物技术有限公司;产志贺毒性大肠杆菌(EscherichiacoliSTEC,菌株编号为BNCC186737)购自BeNa Culture Collection;碱性磷酸酶(AKP)试剂盒、BCA法蛋白含量测定试剂盒、β-半乳糖苷酶(β-gal)、小鼠过氧化氢酶(CAT)试剂盒均购自上海酶联生物科技有限公司;超氧化物歧化酶(SOD)试剂盒购自南京建成生物工程研究所;丙二醛(MDA)含量检测试剂盒购自北京索莱宝科技有限公司;环磷酰胺(CY)购自上海源叶生物科技有限公司。
1.1.2 仪器与设备
Biotek SynergeyTM2多功能酶标仪购自美国伯腾仪器有限公司;高速冷冻离心机购自赛默飞世尔科技(中国)有限公司;HVA-85高压蒸汽灭菌锅购自华粤行仪器有限公司;单道排枪移液器、多道排枪移液器均购自德国Transferpette公司。
1.1.3 试验动物
洁净级昆明小鼠,40只,雌雄对半,体重(20±2)g,购自新疆医科大学医学实验动物中心。
1.2 方法
1.2.1 硒化甘草多糖(SeGUP)、甘草多糖(GUP)制备
根据本实验室连科迅[7]的制备方法,成功制备了SeGUP、GUP。
1.2.2 STEC菌液制备
将复苏的STEC接种到营养肉汁琼脂平板上,放置37 ℃恒温培养箱中培养12~18 h,取大小均一的菌落接种至BHI液体培养基中,放置37 ℃恒温震荡培养箱中振荡培养6~8 h,所得菌液8 000 r·min-1离心5 min,弃去上清液用PBS洗涤两次,离心同上,将菌液用PBS重悬并混匀,制成活菌数为108CFU·mL-1菌液,备用。
1.2.3 半数抑制浓度(IC50)的测定
参考林震等[8]以及实验室前期方法并稍作改进。使用PBS将SeGUP、GUP调整成浓度为50、100、150、200、250、300、350、400、450 mg·mL-1各5 mL的溶液,装入高压灭菌过的小锥形瓶,115 ℃高压灭菌5 min,无菌密封4 ℃保存,短期使用。在超净工作台中将与STEC菌液同等体积的SeGUP、GUP溶液分别加入装有STEC菌液试管中,使SeGUP、GUP终浓度分别为25、50、75、100、125、150、175、200、225 mg·mL-1,同时设置对照组只加入与STEC菌液同等体积的PBS(只含STEC菌液),在37 ℃恒温培养箱震荡培养18 h后吸取200 μL加入到96孔板,测其在D600nm处吸光度值,通过Graphpad prism 7 计算SeGUP、GUPIC50。试验重复3次。
1.2.4 SeGUP、GUP对STEC生长曲线的影响
参考Liu[9]以及实验室前期方法适当修改,采用二倍稀释法,SeGUP、GUP以及STEC菌液处理同1.2.3,37 ℃恒温培养箱震荡培养24 h,每隔2 h吸取200 μL加入到96孔板,测其在D600nm处吸光度值,以时间为横坐标,D值为纵坐标,绘制细菌生长曲线。每个时间段做3个平行组,取平均值。
1.2.5 SeGUP、GUP对培养液中AKP、β-gal、蛋白质含量影响
在超净工作台中将与STEC菌液同等体积的SeGUP、GUP溶液分别加入装有STEC菌液试管中,使SeGUP、GUP溶液浓度分别为150 mg·mL-1、200 mg·mL-1,同时设置对照组只加入与STEC菌液同等体积的PBS(只含STEC菌液),在37 ℃恒温培养箱震荡培养12 h,定时于2、4、6、8、10、12 h无菌取样1 mL于高压灭菌过的EP管中,7 000 r·min-1离心10 min,取上清液待测,根据AKP、β-gal、蛋白质试剂盒说明书操作,测量其在D450nm、D562nm吸光度值,计算样品中AKP、β-gal、蛋白质含量。每个样品做3个平行组,取平均值。
1.2.6 SeGUP、GUP对STEC生物膜的影响
参考温燕龙[10]和Djordjevic[11]方法稍作改进。在超净工作台中将与STEC菌液同等体积的SeGUP、GUP溶液分别加入装有STEC菌液试管中,使SeGUP、GUP溶液浓度分别为150、200 mg·mL-1,同时设置对照组只加入与STEC菌液同等体积的PBS(只含STEC菌液),震荡混匀,吸取200 μL的SeGUP、GUP与STEC菌液混合液到96孔板中,37 ℃培养24 h,弃去每孔中的混合液,使用PBS漂洗3次,再取200 μL结晶紫染液加到每孔中,37 ℃染色1 h,弃去每孔中的染色液,使用PBS漂洗3次,再吸取200 μL的95%乙醇加入每孔中,37 ℃脱色8 h后在D595nm处测其吸光度值。每个样品做3个平行组,取平均值。
1.2.7 抗氧化试验
将40只清洁级昆明小鼠适应性饲养7 d后随机分为对照组、模型组、SeGUP组(100 mg·kg-1)、GUP组(100 mg·kg-1),每组10只。第一天~第四天,模型组、SeGUP组、GUP组小鼠腹腔注射80 mg·kg-1CY,复制氧化应激模型。第5天起,对照组、模型组小鼠灌胃0.3 mL生理盐水,SeGUP组、GUP组灌胃100 mg·kg-1SeGUP、GUP溶液,连续14 d,于末次给药2 h后采用眼球摘除法采集小鼠血液,血液室温下放置2 h,3 500 r·min-1离心10 min收集血清,按照SOD、CAT、MDA试剂盒说明书检测SOD、CAT、MDA含量变化。
1.3 数据分析
采用SPSS 21.0软件对试验数据进行单因素方差分析(One-Way ANOVA),方差显著或有影响趋势者采用Duncan’s法进行多重比较,P<0.01表示差异极显著,P>0.05表示差异不显著。通过Graphpad prism 7绘制生长曲线图。
2 结果
2.1 SeGUP、GUP的IC50
SeGUP IC50、95%CI分别为55.58 mg.mL-1、47.71~63.73 mg.mL-1,均小于GUPIC50、95%CI,说明SeGUP的抑菌效果优于GUP。结果见表1。

表1 SeGUP、GUP的IC50以及95%CI
2.2 SeGUP、GUP对STEC生长曲线的影响
由图1、图2可知,对照组中的STEC在8 h之前完成迟缓期与对数期,在8~24 h完成稳定期与衰亡期;25~125 mg·mL-1SeGUP则可以使STEC提前进入稳定期和衰亡期,且呈现剂量依赖趋势;25~175 mg·mL-1GUP可以使STEC提前进入稳定期与衰亡期,但抑制细菌生长效果不稳定,曲线会出现反增现象,GUP抑制STEC增殖效果不如SeGUP。

图1 各浓度SeGUP对STEC的生长曲线的影响

图2 各浓度GUP对STEC的生长曲线的影响
另外,与对照组相比较,各浓度的SeGUP、GUP均有抑制STEC生长趋势,且随着浓度的增加抑制效果越强,呈现剂量依赖趋势。SeGUP在150、175、200、225 mg·mL-1时对STEC抑制效果最强,STEC呈现不增殖状态;GUP在200、225 mg·mL-1时对STEC抑制效果最强,STEC呈现不增殖状态,在进行抑菌机制研究时,SeGUP、GUP选取150、200 mg·mL-1浓度来进行抑菌机制试验。
2.3 SeGUP、GUP对STEC培养液中AKP、β-gal、蛋白质含量的影响
AKP是细胞壁完整性指标之一。由表2可知,0~12 h,随着培养时间的增加,SeGUP组、GUP组、对照组3组中STEC细胞外液中AKP含量也逐渐增加,提示SeGUP、GUP对STEC细胞壁破坏程度呈现时间依赖趋势。
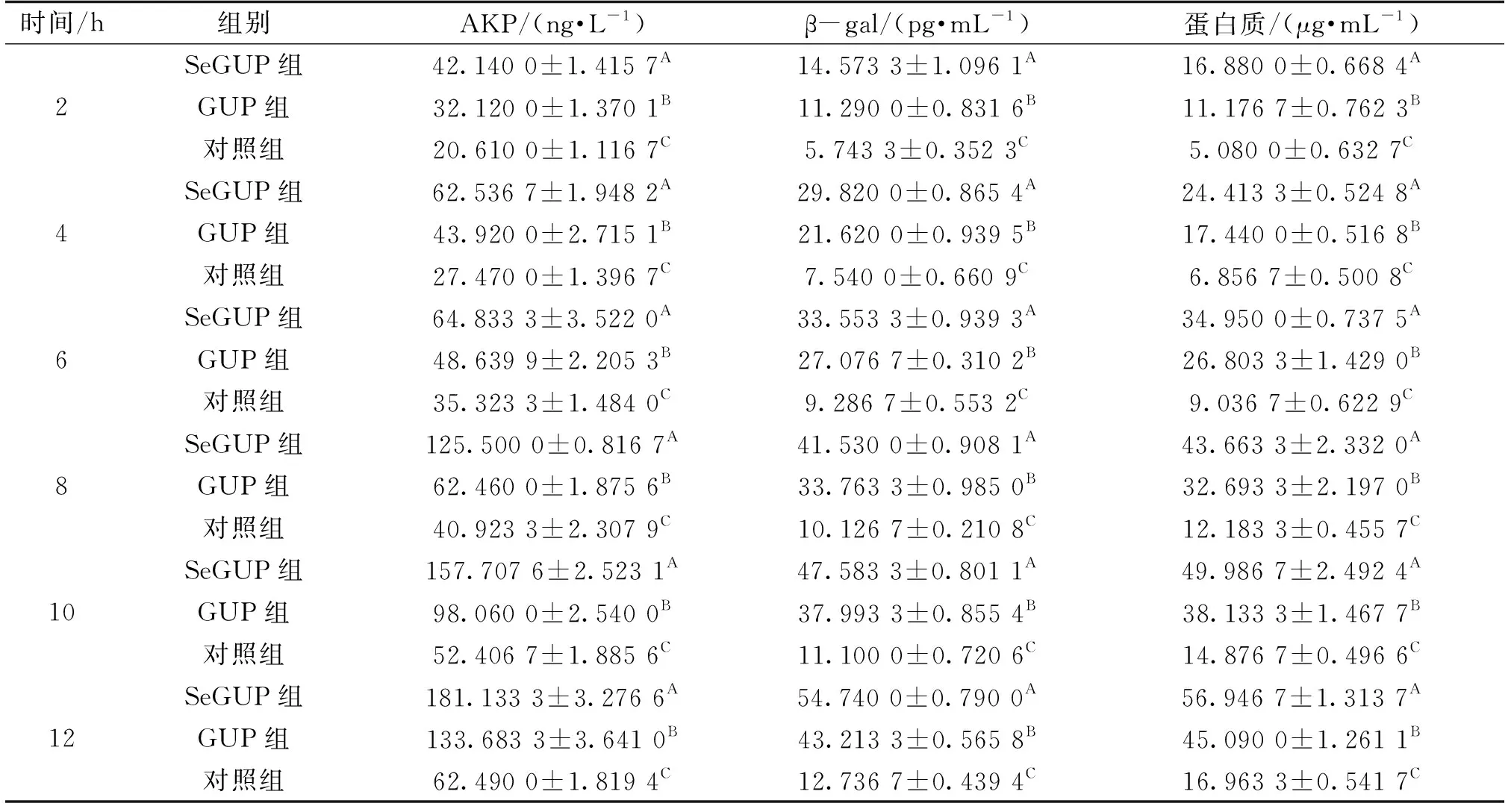
表2 各组STEC培养液中不同时间AKP、β-gal、蛋白质含量
其中,SeGUP组在STEC生长的2~6 h AKP含量变化不大,而6~8 h AKP含量突然增大,说明在6~8 h SeGUP使STEC菌体细胞壁完全破裂,AKP开始大量泄露;2~8 h GUP组AKP含量变化不大,8~10 h AKP含量突然增大,说明在8~10 h GUP能有效使STEC菌体细胞壁破裂,AKP开始大量泄露。在同一时间内,SeGUP组AKP含量极显著高于GUP组(P<0.01),GUP组AKP含量极显著高于与对照组(P<0.01),说明SeGUP、GUP能有效破坏细胞壁,SeGUP效果优于GUP。
β-gal、蛋白质是细胞膜通透性指标。SeGUP、GUP处理过的STEC培养液中β-gal、蛋白质外漏严重,说明SeGUP、GUP能有效破坏STEC细胞膜,也呈现时间依赖趋势。同一时间内SeGUP组β-gal、蛋白质含量极显著高于GUP组、对照组含量(P<0.01),GUP组β-gal、蛋白质含量极显著高于对照组(P<0.01)。
2.4 SeGUP、GUP对STEC生物被膜形成的影响
由表3可知,与对照组相比,SeGUP、GUP均能有效抑制生物被膜形成(P<0.01),SeGUP组抑制生物被膜的效果与GUP组抑制效果相比差异极显著(P<0.01),且SeGUP组抑制生物被膜的效果优于GUP组。

表3 各组对STEC生物被膜形成的影响
2.5 SeGUP、GUP对SOD、CAT、MDA含量的影响
由表4可知,模型组SOD、CAT含量极显著低于其他组(P<0.01);SeGUP组SOD、CAT含量极显著高于GUP组、对照组(P<0.01),GUP组SOD、CAT含量极显著高于对照组(P<0.01)。SeGUP组中SOD、CAT含量最高。模型组MDA含量极显著高于其他组(P<0.01),SeGUP组MDA含量极显著低于GUP组、对照组,P<0.01。GUP组MDA含量极显著低于对照组,P<0.01。SeGUP组MDA含量最低。

表4 各组血清中SOD、CAT、MDA含量
3 讨论
半数抑制浓度(IC50)值常用来评估抑制剂的抑制效率[12]。本试验通过SeGUP、GUP分别对STEC进行体外抑菌试验,发现SeGUP不论是IC50还是抑制STEC增殖上效果均优于GUP,这与田艳花、张百刚等[3,13]研究GUP能有效抑制大肠杆菌和肺炎克雷伯菌的生长,王丹阳[4]使用SeGUP能有效抑制大肠杆菌和金黄色葡萄球菌增殖结果一致。
菌体最外侧层有一层坚韧的结构—细胞壁,最基本功能就是维持菌体形态,还参与了物质运输,起到保护菌体内容物、减少菌体水分蒸发等作用。AKP是存在细胞壁与细胞膜之间的物质,可作为细胞壁完整性的指标之一[14]。本次试验中,150 mg·mL-1SeGUP、200 mg·mL-1GUP有效提高培养液中AKP含量,提示SeGUP、GUP均能破坏STEC细胞壁结构导致菌体死亡。Zhang等[15]得出蝉虫草多糖可以破坏大肠杆菌的细胞壁以及细胞膜,菌液中AKP、β-gal含量均增加。细胞膜是稳定菌体内环境的重要结构,能筛选物质进出菌体,维持菌体有利的生存状态。若细胞膜破裂,内容物外漏,外部环境中其他物质随意进出,菌体遭到破坏,细菌无法继续生存[16]。150 mg·mL-1SeGUP、200 mg·mL-1GUP作用于STEC,培养液中β-gal、蛋白质含量均呈现时间依赖趋势,说明SeGUP、GUP能有效破坏STEC细胞膜,造成菌体内物质外漏,SeGUP不但破坏细菌细胞膜浓度低且破坏细胞膜程度也强于GUP。Zhou等[17]以ONPG为指标检测β-gal活性,得出绿茶多糖能破坏大肠杆菌细胞膜。Meng等[18]使用核桃分心木多糖提高大肠杆菌细胞膜通透性,导致水溶性蛋白增加而影响其他物质进出菌体,造成菌体代谢紊乱,从而达到抑菌效果。细菌生物膜是一类粘附在生物与非生物表面的胞外蛋白、多糖等聚合物,只有迅速清洗才能去除生物膜,细菌在生物膜“庇护”下游走自由,一旦形成生物膜细菌将更难消除[19-21],本试验SeGUP、GUP均可抑制STEC菌体生物膜形成,SeGUP比GUP更能降低生物膜形成,更好达到抑菌效果。
CY作为一种临床常用的烷化剂,主要是通过干扰健康免疫细胞增殖、遗传物质功能等途径导致免疫抑制和骨髓抑制[22],又可引起机体氧化应激。CY对小鼠抗氧化系统产生负面影响,主要降低小鼠血清中抗氧化物酶活性[23]。SOD、CAT是机体重要抗氧化的酶,可将自由基分解为分子氧和过氧化氢,降低极端氧水平,形成抵抗氧化应激第一道防线[24]。MDA是机体内氧化产物和细胞膜上不饱和脂肪酸发生脂质过氧化反应生成的产物,MDA含量侧面反映体内过氧化物产物含量,也是代表细胞受过氧化物等损伤程度。因此,MDA含量越低机体抗氧化损伤能力越强[25]。Luo等[26]研究了番石榴叶多糖的抗氧化活性,表明番石榴叶多糖能有效清除自由基,显著降低MDA、升高SOD活性。本文中SeGUP、GUP能提高SOD、CAT活力,降低MDA含量,提高抗氧化酶的活性,增强机体细胞抗氧化能力,且SeGUP效果优于GUP。姚万玲[27]研究表明硒化党参多糖与党参多糖比较能显著提高小鼠体内CAT含量、降低MDA含量,硒化党参多糖抗氧化能力优于党参多糖。张阳等[28]研究硒化修饰白术多糖能显著提高小鼠体内SOD活力、降低MDA含量,效果优于未修饰的白术多糖,均与本试验结果一致,能为临床开发抗氧化剂提供理论思路。
4 结论
(1)SeGUP、GUP对STEC均有较好的体外抑菌效果,SeGUP不但抑制STEC增殖浓度低于GUP,且体外抑菌效果也优于GUP。
(2)SeGUP、GUP能有效破坏STEC膜结构,AKP、β-gal、蛋白质含量、生物膜形成比较均有统计学差异,具有良好的抑菌效果,且SeGUP对STEC膜结构的破坏力强于GUP。
(3)SeGUP、GUP均提高了抗氧化能力,且硒化修饰的GUP抗氧化能力优于GUP。
