LC-MS/MS法测定黄柏碱及其葡萄糖醛酸结合物在大鼠中的组织分布研究
2023-06-10王浩刘晓丽林爱华刘奕明
王浩,刘晓丽,林爱华,刘奕明,3
(1.广州中医药大学第二附属医院Ⅰ期临床研究室,广东 广州 510120;2.广州中医药大学第二附属医院珠海医院,广东 珠海 519000;3.广东省中医证候临床研究重点实验室,广东 广州 510120)
黄柏是芸香科黄皮树的内皮,具有清热、滋阴、润燥的作用,其主要化学成分为生物碱和黄酮类化合物,具有降血糖、降压和免疫抑制等药理作用[1-2]。黄柏碱(Phellodendrine,PHE)是黄柏的特征成分和主要有效成分之一。研究表明,PHE能抑制肝脏糖异生和α-葡萄糖苷酶活性,改善糖脂代谢紊乱,从而达到降血糖和抗糖尿病的目的[3-5]。本课题组前期对PHE在大鼠体内的药代动力学进行了研究,发现代谢产物黄柏碱-11-O-β-D-葡萄糖醛酸苷(Phellodendrine-11-O-β-D-glucuronide,M1)和黄柏碱-2,11-O-β-D-二葡萄糖醛酸苷(Phellodendrine-2,11-di-O-β-D-glucuronide,M2)血药浓度显著高于原型药物,提示PHE在体内主要以葡萄糖醛酸结合物的形式存在并发挥药理作用[6-7]。通常药物在组织中,特别是在靶组织中的浓度是决定药理作用的最直接因素,但是PHE及其葡萄糖醛酸结合物在大鼠体内各脏器的分布含量等组织分布特征如何,目前尚不清楚。因此,本研究建立了一种快速、灵敏、准确的液相色谱-质谱(LC-MS/MS)方法,测定大鼠组织中PHE、M1和M2的含量,考察3种成分在大鼠体内的分布特征,为进一步明确和解释PHE的药理作用提供新的依据。PHE、M1和M2的分子结构式、质谱、1H-NMR和HPLC谱,见图1~3。

图1 PHE、M1、M2的分子结构式Fig.1 Structure diagram of PHE, M1, M2
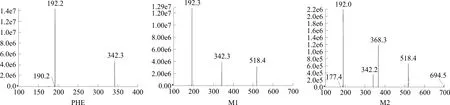
图2 PHE、M1、M2的二级扫描质谱图Fig.2 Secondary scanning mass spectrum of PHE, M1, M2

图3 M1、M2的1H-NMR、HPLC谱图Fig.3 1H-NMR and HPLC spectrum of M1, M2
1 材料
1.1 药品与试剂
PHE对照品(纯度>99.35%,批号:MUST-21082104)和乌头碱对照品(内标,纯度≥98%,批号:17110910)均购自成都曼思特生物科技有限公司;M1(HPLC纯度≥98%,实验室自制);M2(HPLC纯度≥99%,实验室自制);甲醇为色谱级(德国Merck公司);甲酸为色谱级(上海麦克林生化科技有限公司);超纯水由Milli-Q系统制备。
1.2 仪器和设备
AB SCIEX API 4000+型液相色谱-三重四级杆质谱联用仪,配备Turbo Ionspray离子源(ESI)、SHIMADZU LC-20A型高效液相色谱仪(日本岛津公司)以及用Analyst1.6系统进行仪器控制、数据采集和分析;IKA-MS3基本型旋涡混匀器(德国IKA公司);MS105DU十万分之一型电子天平(瑞士Mettler Toledo公司);高速冷冻离心机/5418R(德国Eppendorf公司);N-EVAP24氮气吹干仪(美国Organomation公司);TARGINVX-Ⅱ多管涡旋振荡器(北京踏锦科技有限公司);IKA-T10匀浆机(德国IKA公司)。
1.3 实验动物
SPF级SD大鼠35只,雄性,180~240 g,由广东省医学实验动物中心提供,许可证编号:SCXK(粤)2022-0002,动物合格证号:44002100028394。动物饲养于广东省中医院实验动物中心屏障区,使用许可证编号:SYXK(粤)2018-0094。所有动物均经3 d检疫,在温度(20±2)℃,湿度40%~60%,光暗循环12 h条件下适应性喂养普通饲料7 d,期间自由饮水和摄食。动物实验按照广东省中医院实验动物中心指南进行,并经广东省中医院动物伦理委员会批准,伦理编号:2019007。
2 方法
2.1 色谱与质谱条件
2.1.1 色谱条件 色谱柱为ZORBAX Eclipse XDB-C18柱(150 mm×2.1 mm,3.5 μm);流动相A为0.1%甲酸水,流动相B为甲醇,梯度洗脱:0~1 min,5%B;1~6 min,5%~95%B;6~8 min,95%B;8~8.5 min,95%~5%B;8.5~10 min,5%B。流速:0.3 mL·min-1;柱温:35 ℃;进样量:2 μL;进样器温度:4 ℃。
2.1.2 质谱条件 电喷雾正离子模式运行,多反应监测(MRM)分析,雾化温度:600 ℃;喷雾电压(IS):5 000 V;碰撞气(CAD):12 psi;气帘气(CUR):25 psi;氮气1(GS1):60 psi;氮气2(GS2):70 psi。用于定量的离子对PHE为m/z342.2→192.1;M1为m/z518.2→192.1;M2为m/z694.4→192.1;内标乌头碱为m/z646.4→586.3。
2.2 溶液的制备
精密称取PHE 1 mg,M1 1 mg,M2 0.76 mg,内标乌头碱1 mg,置于10 mL棕色容量瓶中,用甲醇定容并超声溶解,配成浓度分别为0.1、0.1、0.076、0.1 mg·mL-1的对照品储备液,-30 ℃保存备用,使用时分别以40%甲醇水逐级稀释得到系列浓度的工作液。
2.3 组织标准曲线样品及质控样品的制备
分别精密吸取PHE、M1和M2储备液适量,40%甲醇水逐级稀释,配制系列标准工作液。加入不同浓度的各成分工作溶液各20 μL至空白组织匀浆(940 μL),得到终浓度为PHE:800、400、200、100、50、20、10、1 ng·mL-1;M1:1 000、800、400、200、100、20、10、1 ng·mL-1;M2:1 000、800、400、200、100、20、10、5 ng·mL-1的组织混合标准溶液。同样方法制备定量下限、低、中、高(PHE、M1和M2浓度分别为1、2、350、750 ng·mL-1,1、2、400、800 ng·mL-1,5、8、400、800 ng·mL-1)4个浓度的质控样品。
2.4 组织样品前处理
组织样本用生理盐水漂洗,滤纸吸干水分,剪碎,称质量,以生理盐水(质量∶体积=1∶3)冰浴匀浆,得到组织匀浆液。匀浆液在3 000 r·min-1的条件下离心10 min,取上清分装,-80 ℃保存。取100 μL组织匀浆液,加入20 μL乌头碱内标(1 μg·mL-1),用400 μL甲醇沉淀蛋白,在4 ℃,13 000 r·min-1下旋涡离心15 min,转移全部上清液N2吹干,残留物用200 μL 40%甲醇重新溶解,旋涡震荡2 min,过滤膜离心后进样2 μL。
2.5 给药与组织样品采集
SD大鼠随机分为7组,每组5只,实验前禁食12 h,自由饮水。称取适量PHE,超纯水超声溶解30 min,配制成4 mg·mL-1的水溶液,以40 mg·kg-1的剂量灌胃给药。大鼠分别在灌胃给药后的0.117、0.167、0.5、1、2、3、4 h(n=5),经10%水合氯醛麻醉,先腹主动脉采血;随后采集组织(心、肝、脾、肺、肾、大脑、肌肉、胰腺和小肠),用生理盐水冲洗以去除血液和内容物,滤纸吸干水分,置于液氮中快速冷却,转移至-80 ℃冰箱保存。
2.6 数据处理与统计分析
实验数据用DAS 2.1.1软件处理,根据非房室模型计算药代动力学参数;SPSS 25.0软件(SPSS Institute,Chicago,USA)通过单因素方差分析进行统计分析。
3 结果
3.1 方法学考察
3.1.1 专属性 将大鼠空白组织匀浆、含有分析物及内标的组织匀浆、大鼠口服PHE水溶液后的含药组织匀浆进行处理,按照“2.4”项操作,在选定的检测条件下考察3种分析成分。获得每种组织中3种成分及内标的MRM扫描色谱图,如图4(以肾组织为例),PHE、M1、M2和内标乌头碱的保留时间分别为5.34、4.66、4.44、6.97 min,待测物质的峰形良好,分离完整,测定不受组织中内源性物质的干扰。
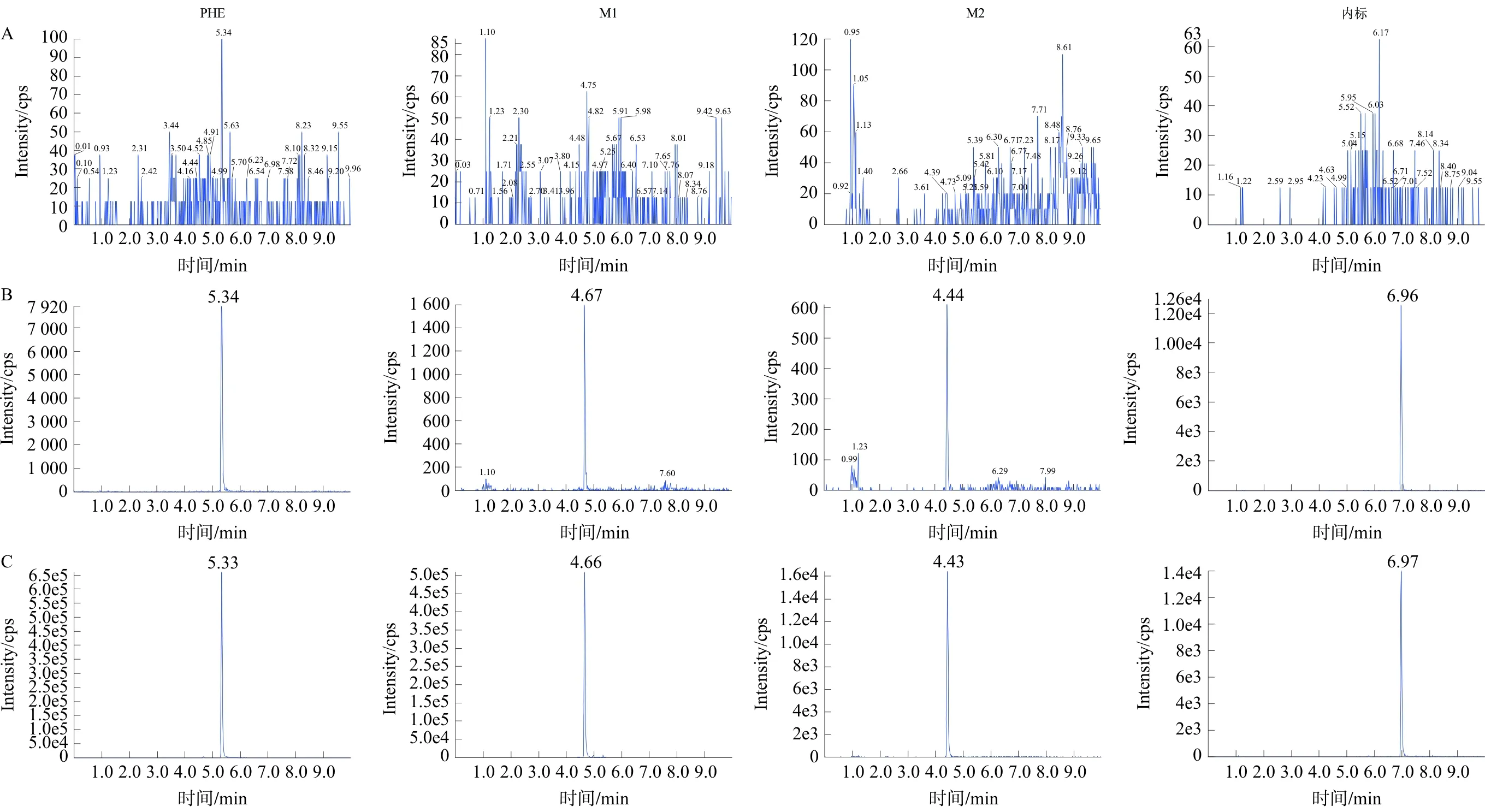
注:A.空白肾脏组织匀浆;B.含有分析物及内标的肾脏组织匀浆(定量下限);C.大鼠灌胃PHE 2 h的肾脏组织匀浆图4 PHE、M1、M2在大鼠组织匀浆中的LC-MS/MS色谱图Fig.4 LC-MS/MS chromatogram of PHE, M1, M2 in rat tissue homogenate
3.1.2 标准曲线与定量下限 按“2.3”“2.4”项下操作制备标曲样品,以实际测得PHE、M1、M2浓度为横坐标,被测物质的峰面积与内标物乌头碱的峰面积之比为纵坐标,进行线性回归计算,得到标准曲线方程。定量下限为标准曲线的最低浓度,3种成分的定量下限准确度均在(94.54±5.05)%~(109.89±6.25)%,日内精密度RSD≤8.61%,日间精密度RSD≤11.07%,均符合方法学要求,结果见表1。

表1 PHE、M1、M2在组织中的标准曲线Table 1 Standard Curves of PHE, M1, M2 in tissues
3.1.3 精密度与准确度 配制低、中、高浓度的质控样品,每浓度6份样品,以“2.4”项下方法前处理,同1 d内制备并测定,计算日内精密度;连续测定3 d,计算日间精密度。其中以日内和日间RSD为精密度,实测浓度与真实浓度的比值计算准确度。结果3个质控浓度:PHE准确度为(95.13±8.17)%~(109.90±5.56)%,日内RSD均≤8.03%,日间RSD均≤10.65%;M1准确度为(93.39±5.02)%~(110.33±2.7)%,日内RSD均≤10.22%,日间RSD均≤9.24%;M2准确度为(91.58±1.84)%~(110.67±5.20)%,日内RSD均≤9.83%,日间RSD均≤10.46%,均符合生物样品分析方法学要求。
3.1.4 提取回收率与基质效应 按照“2.3”中所述方法配制低、中、高浓度的质控样品,每浓度平行6份,根据“2.4”中描述的方法处理样品,进样分析,得峰面积为A1;取100 μL空白组织匀浆液按“2.4”项下方法处理后,残留物用含有分析物的混合对照品溶液(3个成分浓度分别为PHE:1、175、375 ng·mL-1;M1:1、200、400 ng·mL-1;M2:4、200、400 ng·mL-1)200 μL复溶,进样分析得峰面积A2;测A2中用于复溶的混合对照品溶液直接进样分析得峰面积A3。以A1与A2的比值计算提取回收率,A2与A3比值计算基质效应。结果显示PHE在大鼠各组织的提取回收率为(55.29±5.09)%~(77.89±11.71)%,基质效应为(94.59±6.75)%~(106.33±5.07)%;M1提取回收率为(52.38±4.63)%~(79.04±4.26)%,基质效应为(88.66±5.35)%~(112.5±5.82)%;M2提取回收率为(61.14±8.75)%~(75.51±5.30)%,基质效应为(85.97±3.35)%~(109.21±9.18)%;RSD均在15%以下,未发现基质成分对离子的显著抑制或增强。
3.1.5 稳定性 分别取低、中、高浓度质控样品,按“2.4”项方法处理,每种浓度6份,在以下条件下考察各组分的稳定性:组织匀浆在室温下放置4 h后进行处理和测定;组织样品在-80 ℃反复冻融3次后进行处理和测定;配制好的待测溶液在4 ℃样品进样盘中放置24 h后进行测定;在-80 ℃冰箱中放置30 d后处理并测定。根据当天的标准曲线计算各质控样品的测定浓度,以测定浓度与标示值的百分比来表示准确度,其均在(84.37±3.68)%~(110.37±5.25)%,表明PHE、M1、M2在上述条件下均稳定。
3.1.6 稀释效应 在测定组织样品时,发现部分小肠和肾脏样品中PHE、M1、M2的浓度超过标准曲线的范围,因此测试了PHE、M1、M2在小肠和肾脏匀浆中的稀释效果。制备PHE:4 000、10 000 ng·mL-1;M1:4 000、10 000 ng·mL-1;M2:4 000、10 000 ng·mL-1浓度的小肠和肾脏匀浆样品,并用相应的空白基质稀释10倍、25倍(每个基质每个浓度设置6个平行样品),最终均得到浓度为400 ng·mL-1的标准样品,按照“2.3”方法进行处理并进样分析,结果表明稀释后测定的RSD均≤8.00%,小肠组织匀浆液测定的准确度:PHE为96.2%~106%,M1为87.2%~107%,M2为90.1%~110.%;肾脏组织匀浆液准确度:PHE为87.6%~109%,M1为91.7%~105%,M2为85.2%~94.8%,该方法采用的稀释方式可行。
3.2 组织分布
大鼠灌胃给药后,均可在心、肝、脾、肺、肾、大脑、肌肉、胰腺和小肠中检测到PHE、M1和M2。除小肠、肾脏和肝脏外,其他脏器中的分析物含量很低。PHE在各组织中的峰值为0.167 h,随着时间的推移浓度逐渐降低。M1在给药后1 h内基本达到峰值,其在肾脏中的浓度随时间逐渐升高,1 h后浓度趋于稳定;M2的分布与M1的分布大致相同,如图5所示。比较其组织暴露量,PHE为小肠>肝>肾>肺>胰腺>肌肉>脾>心>脑;M1和M2为小肠>肾>肝>心>肺>胰腺>肌肉>脾>脑,结果见表2。

表2 大鼠单次灌胃给药后PHE、M1、M2在各组织中的暴露量Table 2 Exposure amount of PHE, M1, M2 in various tissues of rats after single intragastric administration

图5 大鼠单次灌胃PHE单体水溶液后PHE、M1、M2在各组织分布图Fig.5 Distribution of PHE, M1, M2 in various tissues after single gavage of aqueous solution of PHE monomer in rats
4 讨论
PHE可抑制α-葡萄糖苷酶活性、抑制肝脏总糖异生,改善IR-HepG2细胞糖脂代谢紊乱,达到降糖目的[3-5,8-9]。在以往PHE的药代动力学研究中,课题组发现糖尿病组PHE的AUC0-t和Cmax值明显高于正常组,PHE进入大鼠后主要以葡萄糖醛酸结合物的形式存在于血浆中,且其含量显著高于原型成分[7]。研究表明,许多药物的葡萄糖醛酸化合物具有抗糖尿病作用,例如小檗碱的Ⅱ期代谢产物小檗碱-9-O-β-D-葡萄糖醛酸盐显示出良好的降血糖作用[10];山柰酚-3-O-葡萄糖醛酸苷可改善HepG2细胞胰岛素抵抗模型的葡萄糖消耗[11];槲皮素-3-O-β-D-葡萄糖醛酸苷和芹菜素-7-O-葡萄糖醛酸苷对α-葡萄糖苷酶具有显著的抑制活性,可作为有效的α-葡萄糖苷酶抑制剂和胰岛素增敏剂[12-13],猜测PHE葡萄糖醛酸结合物可能是PHE抗糖尿病的药效物质基础。PHE吸收入血后,进入体循环,随着血液向机体各组织脏器进行转运分布,由于PHE的理化性质以及体内各种组织的生理特性不同,在体内的分布也有所不同,这将直接影响PHE的抗糖尿病作用。因此,通过比较PHE、M1、M2在不同组织中的分布含量,了解其组织分布特点,有助于推测PHE抗糖尿病作用的靶器官,也为探索其药理学机制提供一定参考。糖尿病是一种由胰岛素分泌减少或胰岛素功能障碍引起的慢性代谢性疾病。一旦产生胰岛素的胰岛β细胞功能受损,胰岛素分泌就会减少,导致胰源性糖尿病[14],故本文也对PHE在胰腺组织中的分布进行了研究。
目前关于药物组织分布的研究主要为体内研究和体外研究,体外研究常用平衡透析法、超滤法等测定药物的血浆蛋白结合率等[15],而在体内研究中多采用LC-MS/MS测定不同时间点各组织中药物的浓度以及计算其暴露量等[16],可以更直观地描述药物在各组织中的具体分布情况。为了优化分析性能,本研究使用了2种不同的流动相系统:甲醇-水和乙腈-水。结果表明,甲醇作为有机相,在实验过程中表现出好的峰形和较高的分辨率,甲酸的加入可以改善样品峰的拖尾现象;考虑到离子响应强度、峰形状和色谱柱的耐酸性,最终选择0.1%甲酸水-甲醇体系作为流动相。对于组织样品的预处理,采用蛋白质沉淀法提取分析物,研究了4种不同比例的提取剂,即甲醇、乙腈、甲醇∶甲酸(9∶1)、甲醇∶甲酸(99∶1);结合每个目标化合物的峰形状和离子响应强度,发现甲醇提取更好,分析物受内源物质干扰较少,峰形状对称。甲醇和甲酸以99∶1的比例组合有利于提高目标离子的响应,但蛋白质沉淀的效果不好,内源性物质干扰较大,因此本研究使用甲醇作为提取剂。
PHE、M1和M2在各组织中的存在说明口服PHE水溶液后,PHE、M2和M1可广泛分布于大鼠组织中。在给药0.117 h时,PHE在组织中的浓度迅速下降,给药2 h后基本低于定量下限,说明PHE在大多数组织中分布迅速,没有长期积累。M1和M2浓度在给药后0.5~2 h达到峰值,之后逐渐下降。除小肠分布最高外,3种成分均较多分布于肝、肾组织。肠道菌群可以产生多种酶,如β-葡萄糖醛酸酶[17]和硝酸还原酶[18];肠道肠黏膜细胞[19]中存在葡萄糖醛酸转移酶、α-葡萄糖苷酶等多种代谢酶,研究发现葡萄糖醛酸转移酶UGT1A8和UGT1A10仅存在于胃肠道中[20],提示PHE可能通过肠道菌群或肠黏膜上皮快速代谢成高比例的葡萄糖醛酸苷。肝脏不仅被认为是整个药物生物转化的主要贡献者,也是葡萄糖醛酸化反应最重要的器官[21],而肝外组织(尤其是肾脏)在人体的整体生物转化中也起着重要作用[22]。从组织分布的结果来看,M1和M2在服用PHE后0.5~2 h后均能在肾脏中保持较长的滞留时间,而药物的葡萄糖醛酸代谢几乎是通过增加分子的水溶性来促进分子通过肾脏或胃肠道的排泄[23],提示肾脏可能是PHE的代谢器官之一,也是PHE的主要排泄器官。从各组织中的暴露量来看,M1与PHE在肝脏、脾脏、肌肉、胰腺和脑中的浓度无显著性差异,M1在心、肺、肾等大血流组织中的浓度明显高于PHE,M2在所有组织中暴露量较低,推测PHE和M1均可发挥降糖疗效。
综上所述,本研究首次研究了大鼠口服PHE后体内PHE、M1、M2的组织分布,建立了特异、灵敏、可靠的LC-MS/MS测定大鼠组织中PHE、M1、M2的方法;探讨了PHE、M1、M2在不同组织中的分布特征,为寻找PHE的药效靶点,分析PHE降糖作用的物质基础提供理论参考。
