环状RNA ATP2B1靶向miR-452-5p降低胃癌细胞系的增殖和侵袭
2023-06-05郑彬彬林淑莹李德隆黄子成
郑彬彬,林淑莹,李德隆,陈 杰,黄子成*
1.福建医科大学附属泉州第一医院 胃肠消化内科,福建 泉州 476100;2.复旦大学附属金山医院 消化内科,上海 200540
胃癌起源于胃黏膜上皮细胞,是消化系统最常见的恶性肿瘤之一,中国胃癌的发病率和病死率逐年上升[1]。胃癌早期即易转移,多数患者确诊时已处于中晚期,导致预后较差[2]。寻找新的肿瘤标志物和治疗靶点是胃癌临床诊治亟待解决的问题。随着肿瘤测序技术的高速发展,非编码RNA在肿瘤中的生物学功能日益得到重视[3]。环状RNA(circular RNA,circRNA)属于非编码RNA,通过RNA的3′端和5′端磷酸基团共价偶联形成的闭环RNA,具有高度的稳定性和进化保守性[4]。circRNA可以通过表观遗传调控、转录水平调控、转录后水平调控等多种方式调节基因的表达,在肿瘤的发生、发展过程发挥关键作用[5]。circATP2B1可抑制肾透明细胞癌细胞的侵袭,发挥重要的抑癌功能[6]。目前有关circATP2B1在胃癌中的表达和作用机制尚不明确。本研究检测circATP2B1在胃癌组织和细胞株中的表达水平,探讨circATP2B1对胃癌细胞增殖和侵袭的影响及其可能的分子机制,以期为胃癌的分子靶向治疗提供一定的实验基础。
1 材料与方法
1.1 材料
1.1.1 组织标本:选取2018年7月至2021年2月福建医科大学附属泉州第一医院胃肠肝胆外科行手术切除并病理学诊断的44例胃癌组织标本及癌旁组织标本(距肿瘤边缘>5 cm),组织标本均置于液氮罐中保存。男性25例,女性19例,年龄(58.5±7.3)岁。高分化10例,中分化11例,低分化23例。Ⅰ期2例,Ⅱ期有22例,Ⅲ期20例。所有患者术前均未接受放射治疗或化学治疗。本研究经本院伦理委员会批准(2018012),所有患者均签署知情同意书。
1.1.2 细胞系与主要试剂:正常人胃黏膜上皮细胞系(GES-1)、人胃癌细胞系(SGC7901、HS-746T、MGC803、BGC823)(中国科学院细胞所);DMEM培养基、胎牛血清和RPMI-1640培养基(HyClone公司);Matrigel基质胶(BD公司);反转录试剂盒和实时定量聚合酶链反应(RT-qPCR)试剂盒(TaKaRa公司);Lipofectamine 3000转染试剂(Thermo Fisher Scientific公司);Transwell小室(Corning公司);双荧光素酶报告基因检测试剂盒(Promega公司);MTT试剂盒和辣根过氧化物酶标记的二抗(武汉博士德生物科技有限公司);circATP2B1过表达质粒、阴性对照质粒、miR-452-5p模拟物、miR-NC、circATP2B1荧光素酶载体(Wt-circATP2B1、Mut-circATP2B1)、PCDH9荧光素酶载体(Wt-PCDH9、Mut-PCDH9)(广州锐博生物科技有限公司);一抗GAPDH、PCDH9、Cyclin D2、CDK6、N-cadherin和Vimentin(CST公司)。
1.2 方法
1.2.1 细胞的分组及处理:采用含10%胎牛血清DMEM培养基培养SGC7901、HS-746T细胞,采用含10%胎牛血清RPMI-1640培养基培养GES-1、MGC803、BGC823细胞,常规培养和传代。取对数增殖期的HS-746T细胞接种至6孔板,细胞汇合度50%时进行细胞转染,使用Lipofectamine 3000试剂按照说明书进行转染,将HS-746T细胞分为对照组(转染阴性对照质粒)和实验组(转染circATP2B1过表达质粒)。转染48 h后进行后续实验。
1.2.2 RT-qPCR检测circATP2B1、miR-452-5p和PCDH9 mRNA的表达:采用Trizol法提取组织和细胞总RNA,根据反转录试剂盒说明书反转录RNA为cDNA。按照RT-qPCR试剂盒说明书进行扩增,以GAPDH为内参检测circATP2B1和PCDH9 mRNA的相对表达;以U6为内参检测miR-452-5p的相对表达,采用2-△△Ct方法计算相对表达。circATP2B1正向引物序列5′-GGCGACATGGCAAAC AACTC-3′,反向引物序列5′-ATGCATCTGTGGACC TGAGC-3′;PCDH9上游引物:5′-CTGCTCTGATTGC CTGTTTAAGG-3′,下游引物5′-ACCAGTCTGTAGA CAAGGCTG-3′;U6上游引物:5′-CTCGCTTCGGCAG CACA-3′,下游引物5′-AACGCTTCACGAATTTGC GT-3′;miR-452-5p上游引物:5′-AGCGCGAACTG TTTGCAGAGGA-3′,下游引物5′-ATCCAGTGCAGG GTCCGAGG-3′;GAPDH上游引物:5′-GGAGCGAGA TCCCTCCAAAAT-3′,下游引物5′-GGCTGTTGTC ATACTTCTCATGG-3′。
1.2.3 MTT法检测HS-746T细胞增殖活性:将HS-746T细胞分别以2×103个/孔均匀接种于96 孔板,培养1、2、3、4、5 d,相同时间点,每孔加入20 μL MTT试剂(浓度为5 g/L),培养箱培养4 h,吸去培养基,每孔加入120 μL DMSO,室温下振荡15 min,采用酶标仪检测490 nm波长每孔的吸光度(A490)值,绘制HS-746T细胞增殖曲线。
1.2.4 Transwell小室法检测HS-746T细胞侵袭能力:在Transwell小室上室预铺Matrigel基质胶,培养箱内凝固。将对照组和实验组HS-746T细胞分别采用无血清培养基重悬,以2×104个/孔均匀接种于Transwell小室上室,加入600 μL含10%胎牛血清DMEM培养基至Transwell小室下室。培养24 h后,取出Transwell小室上室并采用PBS溶液清洗,室温下4%多聚甲醛固定15 min,0.1%结晶紫染液染色15 min。采用PBS溶液清洗3次,倒置显微镜下每孔随机选4个视野拍照和统计。
1.2.5 生物信息学预测circATP2B1可能的分子机制:用starBase v2.0(http://starbase.sysu.edu.cn)预测circATP2B1潜在靶向miRNA,用TargetScan 3.1(http://www.targetscan.org/mamm_31/)预测miRNA潜在靶向基因mRNA。
1.2.6 双荧光素酶报告基因实验验证circATP2B1与miR-452-5p的靶向关系:分别将荧光素酶载体(Wt-circATP2B1、Mut-circATP2B1)分别和miR-NC或miR-452-5p模拟物转染至HS-746T细胞(分别设为Wt-circATP2B1/miR-NC组,Mut-circATP2B1/miR-NC组,Wt-circATP2B1/miR-452-5p组,Mut-circATP2B1/miR-452-5p组),分别将荧光素酶载体(Wt-PCDH9、Mut-PCDH9)分别和miR-NC或miR-452-5p模拟物转染至HS-746T细胞(分别设为Wt-PCDH9/miR-NC组,Mut-PCDH9/miR-NC组,Wt-PCDH9/miR-452-5p组,Mut-PCDH9/miR-452-5p组)。48 h后根据双荧光素酶报告基因检测试剂盒说明书检测每组HS-746T细胞的相对荧光素酶活性。
1.2.7 Western blot检测靶基因蛋白表达:加入细胞裂解液提取总蛋白。蛋白变性后,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转至聚偏二氟乙烯膜,封闭液封闭后,加入一抗PCDH9(稀释比为1∶3 000)、cyclin D2(稀释比为1∶3 000)、CDK6(稀释比为1∶3 000)、N-cadherin(稀释比为1∶2 000)、Vimentin(稀释比为1∶2 000)和GAPDH(稀释比为1∶2 000),在4 ℃下孵育过夜。次日采用辣根过氧化物酶标记的二抗(稀释比为1∶10 000)孵育2 h。采用ECL法曝光、显影、定影,比较HS-746T细胞靶基因蛋白表达。
1.3 统计学分析
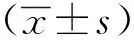
2 结果
2.1 胃癌组织和胃癌细胞系circATP2B1的表达
胃癌组织circATP2B1相对表达量0.92±0.08显著低于癌旁组织circATP2B1相对表达量3.62±0.23(P<0.01)。胃癌细胞系SGC7901、HS-746T、MGC803、BGC823中circATP2B1表达量均显著低于正常胃黏膜上皮细胞GES-1(P<0.01),其中以HS-746T细胞circATP2B1的表达量最低(P<0.01)(图1),故采用HS-746T细胞进行后续实验。

*P<0.01 compared with GES-1 cells.图1 胃癌细胞和正常胃黏膜上皮细胞中circATP2B1的表达Fig 1 Expression of circATP2B1 in gastric cancer cells and normal gastric mucosal epithelial cells
2.2 胃癌组织中circATP2B1的表达与临床病理特征的关系
以44例胃癌组织中circATP2B1表达水平的均数0.92为界值,circATP2B1表达水平≥0.92为高表达,<0.92为低表达。通过统计分析(表1),circATP2B1的表达与胃癌的TNM分期、分化程度及淋巴结转移有关(均P<0.01)。

表1 circATP2B1的表达与胃癌患者临床病理特征的关系Table 1 The relationship between the expression of circATP2B1 and the clinicopathological features of gastric cancer patients
2.3 circATP2B1过表达质粒转染效率检测
胃癌HS-746T细胞转染circATP2B1过表达质粒后, 对照组和实验组circATP2B1相对表达量分别为1.00±0.05和10.54±0.88,实验组circATP2B1表达量是较对照组显著提高(P<0.01)。
2.4 过表达circATP2B1可抑制HS-746T细胞增殖活性
与对照组相比,转染circATP2B1过表达质粒的实验组HS-746T细胞在第2、3、4、5天的吸光度A值显著降低(P<0.05或P<0.01)(图2)。

*P<0.05,**P<0.01 compared with control.图2 过表达circATP2B1抑制HS-746T细胞增殖活性Fig 2 Over-expression of circATP2B1 inhibited the proliferation activity of HS-746T cells
2.5 过表达circATP2B1可抑制HS-746T细胞侵袭能力
与对照组相比,实验组HS-746T细胞侵袭能力显著下降(P<0.01)(图3)。

*P<0.01 compared with control.图3 过表达circATP2B1抑制HS-746T细胞侵袭能力Fig 3 Over-expression of circATP2B1 inhibited the invasion ability of HS-746T cells(×100, crystal violet staining)
2.6 生物信息学预测circATP2B1可能的分子机制
用starBase v2.0(http://starbase.sysu.edu.cn)预测circATP2B1潜在靶向miRNA是miR-452-5p,用TargetScan 3.1(http://www.targetscan.org/mamm_31/)预测miR-452-5p潜在靶向基因是PCDH9(图4)。

图4 circATP2B1与miR-452-5p结合位点及miR-452-5p与PCDH9 mRNA结合位点Fig 4 Binding site of circATP2B1 and miR-452-5p and the binding site of miR-452-5p and PCDH9 mRNA
2.7 双荧光素酶报告基因实验验证circATP2B1可能的分子机制
Wt-circATP2B1/miR-452-5p组的相对荧光素酶活性较Wt-circATP2B1/miR-NC组相对荧光素酶活性明显下降(P<0.01),证实circATP2B1和miR-452-5p可以靶向结合。Wt-PCDH9/miR-452-5p组的相对荧光素酶活性较Wt-PCDH9/miR-NC组相对荧光素酶活性明显下降(P<0.01),证实miR-452-5p和PCDH9 mRNA可以靶向结合(图5)。

*P<0.01 compared with the Wt-circATP2B1 or Wt-PCDH9.图5 双荧光素酶报告基因实验Fig 5 Dual-luciferase reporter gene assay
2.8 circATP2B1对miR-452-5p和PCDH9 mRNA表达的影响
实验组HS-746T细胞中miR-452-5p表达量0.24±0.05显著低于对照组miR-452-5p表达量1.00±0.04(P<0.01),实验组HS-746T细胞中PCDH9 mRNA表达量6.12±0.94显著高于对照组PCDH9 mRNA表达量1.00±0.02(P<0.01)。
2.9 PCDH9蛋白和增殖及侵袭相关蛋白的表达
实验组HS-746T细胞PCDH9蛋白表达增加,HS-746T细胞增殖蛋白cyclin D2和CDK6表达降低,HS-746T细胞侵袭蛋白N-cadherin和vimentin表达降低(图6)。

*P<0.01 compared with control.图6 circATP2B1对PCDH9蛋白和增殖、侵袭相关蛋白表达的影响Fig 6 Effects of circATP2B1 on the expression of PCDH9 protein, proliferation and invasion-related proteins
3 讨论
circRNA是由共价键形成的环状RNA, 对RNA核酸外切酶具有耐受性,相较线性RNA更加稳定[7]。越来越多的研究显示,胃癌组织和癌旁组织存在显著差异的circRNA谱,circRNA在胃癌的发生、进展中发挥关键作用,可能成为胃癌诊断的分子标志物和治疗靶点[5]。有研究显示[8],circRNA_0005075在胃癌组织和细胞系中表达显著上调,circRNA_0005075表达较高的胃癌患者预后较差;下调circRNA_0005075可显著抑制胃癌细胞增殖和转移,miR-431是circRNA_0005075的靶基因。有研究显示[9],circSMC3在胃癌组织中高表达, Kaplan-Meier生存分析表明circSMC3表达水平高的患者总体生存率较差,circSMC3通过充当miRNA海绵来降低miR-4720-3p表达,促进胃癌细胞的增殖和转移。有研究表明circATP2B1可明显抑制肾透明细胞癌的恶性表型[6]。circATP2B1在胃癌细胞中的表达及调控机制尚不清楚。本研究证实胃癌组织和细胞株circATP2B1表达显著降低,circATP2B1的表达与胃癌的TNM分期、分化程度及淋巴结转移明显相关,过表达circATP2B1能抑制胃癌HS-746T细胞的增殖和侵袭,提示circATP2B1是一种抑癌的circRNA,在胃癌的发生、发展中扮演重要角色。
circRNA发挥作用的主要机制之一是作为微小(RNA)的竞争性内源RNA[8]。本研究通过starBase v2.0软件预测circATP2B1潜在靶向miRNA是miR-452-5p。miR-452-5p在肝癌、肺鳞状细胞癌、胃癌中表达上调,可促进肿瘤细胞的增殖和转移,与患者的临床分期及预后相关[10]。目前miR-452-5p被认为是一个促癌的miRNA,下调miR-452-5p可抑制胃癌的进展[11]。本研究通过双荧光素酶报告基因实验证实circATP2B1能够特异性结合miR-452-5p。过表达circATP2B1后,miR-452-5p表达显著下降,从而证明circATP2B1可作为胃癌细胞miR-452-5p的竞争性内源RNA产生作用。miRNA主要通过配对结合靶基因mRNA,诱导其降解或者直接抑制靶基因的蛋白翻译[12]。本研究通过TargetScan 3.1软件预测miR-452-5p潜在靶向基因是原钙黏附蛋白9(PCDH9)。PCDH9基因定位于人染色体13q21,属于非集簇原钙黏蛋白家族[13]。PCDH9是一种细胞黏附分子,其在卵巢癌、肝癌、前列腺癌等多种肿瘤组织中低表达,PCDH9蛋白可抑制肿瘤细胞的恶性增殖和转移[14]。PCDH9蛋白在胃癌组织中下调,其表达与胃癌大小、分化程度、肿瘤浸润、淋巴结转移等负相关,是胃癌的独立预后因素[15]。本研究通过双荧光素酶报告基因实验证实miR-452-5p能够特异性结合PCDH9 mRNA。miR-452-5p表达下调后,PCDH9基因表达显著增加,从而证明miR-452-5p可抑制胃癌细胞PCDH9基因的表达。Western blot结果显示,PCDH9蛋白表达增加后,HS-746T细胞增殖蛋白cyclin D2和CDK6表达降低,HS-746T细胞侵袭蛋白N-cadherin和Vimentin表达降低,提示HS-746T细胞增殖和侵袭能力降低。
综上所述,circATP2B1在胃癌组织和细胞系中低表达,circATP2B1通过靶向结合miR-452-5p 间接促进PCDH9基因表达,从而抑制胃癌HS-746T细胞的增殖和侵袭能力。circATP2B1有望成为胃癌诊断的分子标志物和治疗靶点。
