基于TLR4/NF-κB通路探讨泊马度胺对帕金森病小鼠的作用机制
2023-05-30王梦涵
王梦涵 卢 宏
郑州大学第一附属医院,河南 郑州 450052
帕金森病(Parkinson’s disease,PD)是常见的神 经系统退行性疾病,其病理机制是中脑黑质多巴胺能神经元丢失以及细胞内蛋白(α-突触核蛋白)的积聚及路易小体的形成[1]。PD 病理过程中,神经炎症作为关键的因素参与其中,在PD的发生及进展中有着重要的作用[2]。
神经炎症主要由中枢神经系统的小胶质细胞介导,过度活化的小胶质细胞导致炎症和氧化应激的发生从而损伤多巴胺能神经元,是PD的重要发病机制。因此,明确PD中神经炎症发生发展的机制并采取积极有效的干预措施,可有效改善PD的诊断及治疗。
在缺血性脑血管疾病、骨髓瘤等疾病的研究中发现,泊马度胺(pomalidomide,Pom)是具有抗炎作用的新型免疫调节药物[3]。TLR4/NF-κB通路是经典的炎症通路,其表达变化在机体炎性反应发生发展过程中发挥重要作用[4]。本实验观察泊马度胺是否通过TLR4/NF-κB通路改善帕金森模型的炎症反应,从而发挥神经保护作用。
1 材料和方法
1.1 实验动物分组及构建模型体质量18~22 g 的清洁雄性C57/BL6 小鼠,饲养于标准实验环境中自由食水。遵循随机盲法的原则将实验动物分为Con⁃trol 组、MPTP 组、Pom 组各12 只,于造模成功后进行神经功能学评价、免疫荧光染色。小鼠造模成功后采用Western blotting 方法检测脑组织炎症因子、TLR4、NF-κB等的表达情况。连续7 d 给MPTP组和Pom组实验小鼠腹腔注射MPTP(30 mg/kg)[5-6],1次/d,Control 组腹腔注射等体积的0.9%氯化钠液,通过小鼠行为学评估判断是否造模成功。造模完成后,从第8 天开始Pom 组隔日腹腔注射泊马度胺30 d[20 mg/(kg·d)][7],Control组和MPTP组给予等体积0.9%氯化钠液腹腔注射。
1.2 主要试剂兔抗TNF-α、兔抗IL-1β、过氧化物酶(HRP)标记的山羊抗兔IgG(上海生工);兔抗IBA1(日本Wako);羊抗兔FITC(美国Abcam)。
1.3 实验方法
1.3.1 神经行为学评价
1.3.1.1 悬挂实验:在距地面约30 cm水平放置金属丝,实验小鼠前爪悬吊其上,收集实验小鼠距离落地之前的时间。
1.3.1.2 爬杆实验:准备高度60 cm直径0.8 cm的直杆,其顶端有一直径50 mm木球,为防止实验小鼠打滑外层覆盖方纱。掉头时间:记录实验小鼠从运动开始至转头向下爬行的时间;爬下时间:记录实验小鼠从头完全向下直到其沿杆爬至杆底的时间。
1.3.2 免疫荧光染色
1.3.2.1 制备实验小鼠脑切片:麻醉实验小鼠暴露其心脏,插入穿刺针经过左心室至升主动脉处,先后采用PBS 溶液、4%多聚甲醛进行灌注,用4%多聚甲醛固定脑组织24 h。将脑组织置于蔗糖溶液中脱水沉底后,冰冻切片机冠状位连续切10 μm的切片,于防冻液中—80 ℃保存。
1.3.2.2 实验小鼠脑切片荧光染色:应用4%的多聚甲醛固定实验小鼠脑切片10 min,后进行5 min 的PBS溶液漂洗,共3次;脑切片于5%山羊血清封闭1 h后甩去血清,加入一抗过夜。切片再次进行5 min的PBS溶液漂洗,共3次。避光加入二抗共同孵育2 h,抗荧光剂封片后显微镜观察。
1.3.3 实验小鼠黑质小胶质细胞数量评估分析:采用图像分析软件Imaging-Pro-Plus(OLYMUPS)处理系统分析测量实验组小鼠黑质内小胶质细胞Iba1阳性数量。
1.3.4 Western blotting检测
1.3.4.1 制备蛋白样品:取实验小鼠中脑黑质约50~60 mg。按0.06 mL 的RIPA 裂解液裂解1 g 脑组织的比例加入裂解液于冰上充分匀浆。在4 ℃、12 000 r/min条件下离心20 min,上清即为样品蛋白。
1.3.4.2 SDS-PAGE电泳、转膜、免疫反应:用去离子水封闭浓度为12%分离胶,约30 min后应用15%压缩胶取代去离子水并插入梳子。将压缩胶聚合凝固置于电泳槽中,等剂量按顺序加样。设定电泳设备电压跑胶至底部。将滤纸、膜、胶按照顺序排列至转膜仪上,在电流100 mA 50 min条件下进行转膜。将PVDF膜置于5%脱脂奶粉中封闭2 h,取出后加一抗过夜。过夜后,用TBST液将PVDF膜清洗后加入二抗孵育2 h。
1.3.4.3 显像分析:将扫描仪事先加入ECL 发光液,清洗后的PVDF 膜置于其中进行扫描。软件分析内参、目的条带的光密度值。
1.4 统计分析数据采用SPSS 21.0 软件分析实验的数据,以均数±标准差(±s)表示,组内、组间分别采用采用单因素方差分析、LSD 法进行比较,以P<0.05为差异有统计学意义。
2 结果
2.1 泊马度胺改善帕金森病小鼠行为学功能MPTP组小鼠较Control 组悬挂时间减少(P<0.05),POM 组小鼠较MPTP组悬挂时间增加(P<0.05)。MPTP组小鼠较Control 组爬杆时间增加(P<0.05),POM 组小鼠爬杆时间较MPTP组显著下降(P<0.05)。见图1。

图1 实验小鼠神经功能的评分Figure 1 Neurological function score of experimental mice
2.2 泊马度胺抑制帕金森病小鼠脑内胶质细胞激活与Control 组相比,MPTP 组脑内活化小胶质细
2.3 泊马度胺抑制帕金森小鼠脑内炎症因子的表达采用Western blotting 技术测定黑质周围炎症因子IL-1β、TNF-α表达水平。Control 组小鼠脑组织内胞明显增加,Pom 组活化的小胶质细胞数目较Con⁃trol组明显减少(P<0.05)。见图2、图3。IL-1β和TNF-α表达处于低水平;与MPTP 组脑组织的TNF-α、IL-1β表达水平相比,Pom 组表达显著降低,差异有统计学意义(P<0.01)。见图4、表1。
表1 实验小鼠黑质内TNF-α、IL-1β的Western blotting结果 (±s)Table 1 Western blotting results of TNF-α and IL-1β in the substantia nigra of experimental mice (±s)
注:与Control组和MPTP组相比,*P<0.05
指标TNF-α IL-1β Control组0.147±0.026 0.246±0.029 MPTP组0.472±0.034 0.711±0.042 Pom组0.343±0.044*0.423±0.031*

图4 Pom对实验小鼠脑内TNF-α和IL-1β的影响Figure 4 The effect of Pom on TNF-α and IL-1β in the brains of experimental mice.
2.4 泊马度胺对帕金森小鼠TLR4/NF-κB通路蛋白表达的影响与Control组相比,MPTP组和Pom组小鼠TLR4 /NF-κB 通路蛋白TLR4、NF-κB、p38MAPK表达较高,差异有统计学意义(P<0.05);与MPTP组相比,Pom组小鼠TLR4、NF-κB、p38MAPK 表达低降低,差异均有统计学意义(P<0.05)。见图5、表2。
表2 实验小鼠黑质内TLR4、NF-κB、p38MAPK的Western blotting结果 (±s)Table 2 Western blotting results of TLR4、NF-κB、p38MAPK in the substantia nigra of experimental mice (±s)

表2 实验小鼠黑质内TLR4、NF-κB、p38MAPK的Western blotting结果 (±s)Table 2 Western blotting results of TLR4、NF-κB、p38MAPK in the substantia nigra of experimental mice (±s)
注:与MPTP组相比,*P<0.05
指标TLR4 NF-κB p38MAPK Pom组1.343±0.193*1.221±0.174*1.301±0.183*Control组1.311±0.162 1.152±0.183 1.214±0.198 MPTP组1.693±0.184 1.691±0.214 1.598±0.203
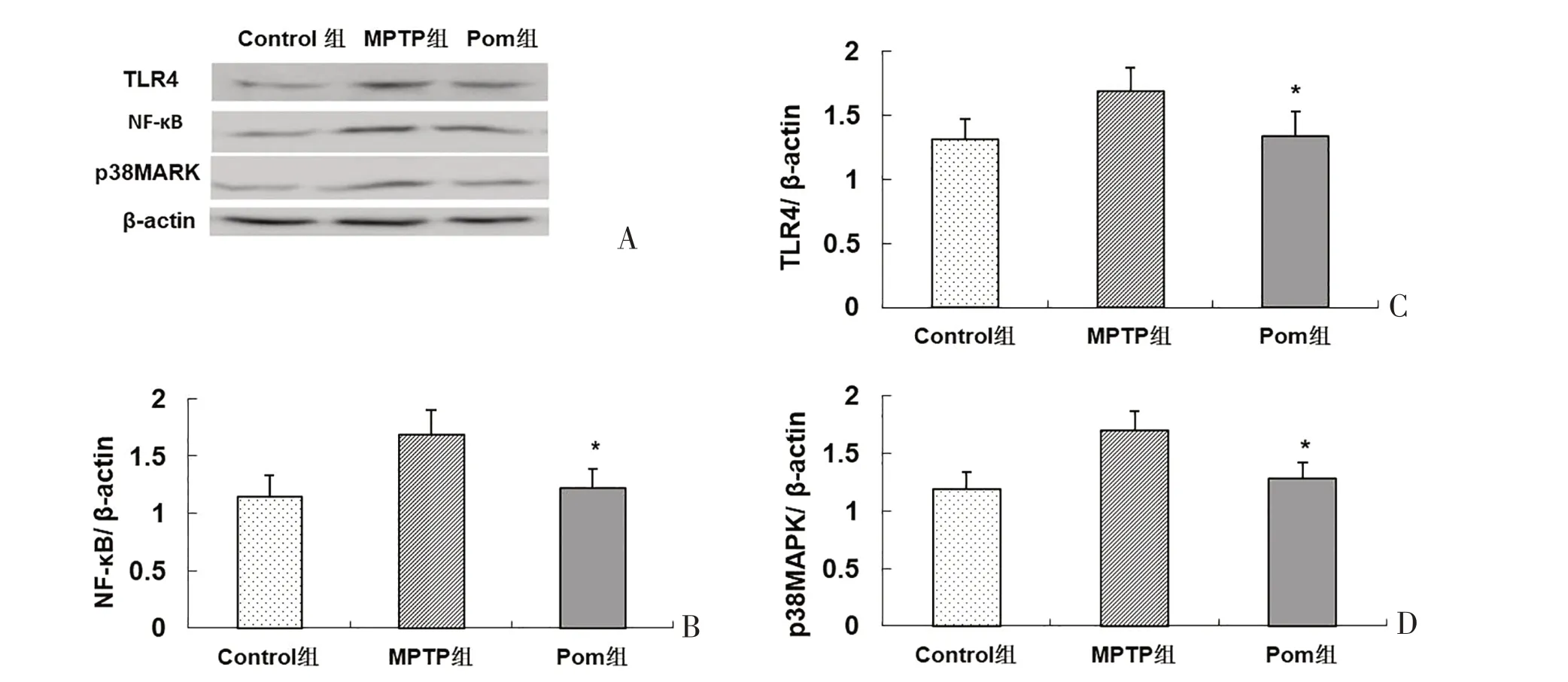
图5 Pom对实验小鼠脑内TLR4/NF-κB通路的影响Figure 5 The effect of Pom on TLR4/NF-κB pathway in the brain of experimental mice.
3 讨论
PD是典型的神经系统退行性疾病,其特点是中脑黑质(substantia nigra,SN)多巴胺能神经元选择性变性、黑质纹状体环路受损、多巴胺能耗竭等[8]。神经退行性疾病以细胞毒性反应、神经免疫炎症、氧化应激等为发病机制[9]。神经炎症参与PD的多巴胺能神经元的进行性退化[10];小胶质细胞受体识别PD神经细胞或少突胶质细胞释放的错误折叠的a-syn[11],发生瀑布样级联反应,下游炎症因子被激活后参与神经炎症,导致中枢神经系统发生退行性变。因此,小胶质细胞参与帕金森变性病的发病机制,影响帕金森病的进展。
泊马度胺具有抗炎作用,但在神经变性病中未见研究。在MPTP诱导的PD动物模型中,中脑SN的活化的小胶质细胞与多巴胺能神经元丢失先后发生,在此时间窗内阻断活化的小胶质细胞也能有效降低多巴胺能神经元的死亡的数目[12]。在缺血性脑血管病动物模型的研究中,活化的小胶质细胞促进炎症因子的释放,加重了动物模型的功能障碍[13-15]。本研究也发现,泊马度胺可以有效抑制PD病理过程中小胶质细胞产生的炎症反应。
小胶质细胞表面分布的Toll样受体(Toll-like re⁃ceptor,TLR)在神经免疫炎症中具有非常重要的意义[16-17]。在α⁃突触核蛋白介导黑质纹状体损伤的过程中,TLR的激活是关键的环节。激活TLR4受体通过信号传导激活NF-κB从而调节炎症介质和细胞因子的表达[18],起到免疫调节的作用。本实验发现,泊马度胺抑制PD模型小鼠脑内小胶质细胞中TLR4受体的表达,有效减少NF-κB的激活,减少下游炎症相关蛋白的表达和炎症因子的生成。
泊马度胺可以有效抑制神经炎症反应,减轻帕金森模型小鼠症状,这可能是通过TLR4/NF-κB通路来实现的。
