尿流式细胞术在快速筛查及鉴别尿路感染病原菌中的应用*
2023-05-30钱景荣张艳丽郭爱萍庄学伟
钱景荣,张艳丽,郭爱萍,庄学伟
山东大学附属山东省立第三医院检验科,山东济南 250031
尿路感染(UTI)是全球范围内较为常见的感染性疾病,每年约有1.5亿病例,其中多为女性和老年人[1]。虽然UTI的病死率约为2.3%,但如果合并菌血症或感染性休克,病死率将升至26.0%[2]。目前,尿培养是确定和量化尿液中是否存在细菌的金标准,基于微生物学培养,可明确菌株及抗菌药物的灵敏度,以合理使用抗菌药物。然而,尿培养结果通常需要24~48 h,大量标本中也会出现无细菌生长的情况,临床医生往往根据患者症状经验性使用抗菌药物,疑似UTI患者使用的抗菌药物约15%为处方类抗菌药物,8%~65%患者治疗无效[3],UTI已是经验性使用抗菌药物第二大常见疾病,而抗菌药物的大量使用也导致近年来抗菌药物耐药发生率和多重耐药菌数量持续上升[4]。因此,预防、诊断、治疗及监测UTI十分重要。
有研究表明,尿培养与通过不同方法获得的尿液分析结果之间可能存在关联[5]。为预测阳性培养及排除阴性培养,研究报道评估各种检测技术:尿干化学分析(白细胞和亚硝酸盐)、尿有形成分分析(显微镜或细胞计数)以及包括患者信息和 UTI 风险因素在内的复杂算法。有研究表明,将 UF-5000尿有形成分分析仪检测结果与尿液培养结果比较,尿流式细胞术筛查可在尿培养前检测菌尿,具有良好的灵敏度,研究因组别大小、疑似UTI 诊断标准、菌尿定义及采用cut-off值而略有不同[6]。本研究旨在分析尿有形成分分析仪检测结果与尿培养结果的差异,建立白细胞、细菌定量计数及细菌鉴别分类在UTI筛查方面的最佳cut-off值,特别是老年人群,以减少不必要的尿培养和抗菌药物使用。
1 资料与方法
1.1一般资料 选取2022年1-8月在本院就诊或住院的1 221例疑似UTI患者;其中,男754例,女467例;年龄0~90岁,中位年龄59岁;合并泌尿系结石403例,合并前列腺增生79例,合并泌尿系肿瘤27例。本研究已排除临床检验数据不全患者及导尿患者。本研究遵循《赫尔辛基宣言》概述中的伦理原则,伦理审查号为KYLL-2023017。
1.2仪器与试剂 UF-5000尿有形成分分析仪及配套试剂、质控品(日本希森美康Sysmex公司);全自动细菌鉴定及药敏分析仪(法国生物梅里埃公司);血琼脂培养基、麦康凯琼脂平板(法国生物梅里埃公司)。
1.3方法
1.3.1尿液标本留取 所有患者留取清晨首次清洁的中段尿液2份,每份10 mL;嘱男性患者在取样前先清洁尿道口,女性患者取样前先清洗外阴;将一份尿液收集至一次性尿液采集管,另一份尿液收集至一次性无菌螺旋盖尿杯,1 h内送检。
1.3.2尿有形成分分析结果 使用UF-5000尿有形成分分析仪分别对低值、高值质控物进行检测,分析质控结果在控后,将尿液采集管标本放置标本架进行上机检测,检测指标包括尿白细胞计数(WBC)、红细胞计数(RBC)、细菌计数(BACT)、上皮细胞计数、酵母菌计数及细菌分类信息[革兰阳性菌(Gram Positive ?,GP)、革兰阴性菌(Gram Negative ?,GN)、革兰阳性/阴性菌(Gram Pos/Neg ?,GP/GN)和未分类(unclassified)]。若触犯复检规则,则需要进一步人工显微镜镜检复核。
1.3.3尿培养 充分混匀标本后,采用10 μL接种环取无菌尿杯标本,分别接种于血琼脂平板、麦康凯琼脂平板,在37 ℃恒温箱中进行培养,24 h后观察细菌生长情况并计数菌落。若出现细菌生长(革兰阳性菌>104CFU/mL,革兰阴性菌>105CFU/mL),则判定培养阳性,进一步选取优势菌进行分离纯化、鉴定以及药敏试验等;若平板无出现细菌生长或细菌生长<104CFU/mL,则判定为无菌。此外,尿培养出3种以上的细菌且无优势菌生长考虑为污染,指导其重新留样检测。
1.4统计学处理 将UF-5000尿有形成分分析仪检测数据与尿培养结果进行分析比较,以尿培养结果为金标准。采用SPSS22.0统计软件对数据进行分析,计数资料以频数或率表示,采用χ2检验;符合正态分布或近似正态分布的计量资料以均值(最小值,最大值)表示,非正态分布资料统计描述以中位数(最小值,最大值)表示,采用Mann-WhitneyU检验和Kruskal-WallisH检验。采用受试者工作特征(ROC)曲线及曲线下面积(AUC)评估UF-5000尿有形成分分析仪的筛查及诊断性能,根据约登指数选取最佳cut-off值,获得灵敏度、特异度、阳性预测值、阴性预测值、真阳性率、假阳性率、假阴性率、真阴性率。采用Kappa值评估一致性。以P<0.05为差异有统计学意义。
2 结 果
2.1尿培养结果 在纳入1 221例患者中,386例患者尿培养阳性(31.6%),835例患者尿培养阴性(68.4%)。在386例患者尿培养阳性标本中,24例患者尿标本分离培养出2种细菌,48例患者尿标本分离出真菌。UTI病原菌中最常见细菌是革兰阴性菌,占所有分离菌种的64.5%,主要为肠杆菌科。病原菌感染情况依次为:大肠埃希菌(123株),肺炎克雷伯菌(69株),屎肠球菌D群(33株),粪肠球菌D群(29株),铜绿假单胞菌(19株),奇异变形杆菌(15株),鲍曼不动杆菌(10株),革兰阳性棒杆菌(8株),金黄色葡萄球菌(6株),表皮葡萄球菌(5株),摩氏摩根菌(5株),草绿色链球菌(4株),弗氏柠檬酸杆菌(2株),腐生葡萄球菌(1株),鹑鸡肠球菌(1株),恶臭假单胞菌(1株),腔隙莫拉菌(1株),人葡萄球菌人亚种(1株),斯氏普罗威登斯菌(1株),雷氏普罗维登斯菌(1株),无乳链球菌(1株),阴沟肠杆菌复合菌(1株),黏质沙雷菌(1株)。其中,产超广谱β-内酰胺酶(ESBL)菌共检出79株,大肠埃希菌占43.9%,肺炎克雷伯菌占36.2%。真菌感染占所有分离菌种的12.4%,分别为白假丝酵母菌(21株),热带假丝酵母菌(13株),近平滑白假丝酵母菌(9株),光滑假丝酵母菌(4株),季也蒙假丝酵母(1株)。
2.2细菌种类和BACT 与感染大肠杆菌UTI患者BACT、WBC和RBC比较,感染肺炎克雷伯菌UTI患者的WBC和RBC升高(P=0.008、0.026),感染鲍曼不动杆菌UTI患者的BACT降低(P=0.005),感染肠球菌属UTI患者的WBC降低(P=0.003),而RBC略有升高(P<0.001)。此外,感染葡萄球菌属和(或)假丝酵母菌属UTI患者的RBC均显著升高(P=0.006、0.008),BACT显著降低(P=0.005、<0.001),特别是假丝酵母菌。UF-5000尿有形成分分析结果见表1。

表1 UF-5000尿有形成分分析结果
2.3明确UTI诊断的cut-off值 以尿培养阳性为诊断标准,绘制BACT 和WBC诊断UTI的ROC曲线,BACT诊断UTI的AUC为0.888(95%CI:0.865~0.912,P<0.001),大于WBC的AUC(0.788,95%CI:0.759~0.818,P<0.001),见图1。根据约登指数,BACT的最佳cut-off值为972.8 /μL,其灵敏度为73.1%,特异度为92.0%;WBC的最佳cut-off值为86.1 /μL,其灵敏度为73.7%,特异度为73.6%;联合采用BACT>972.8 /μL且WBC>86.1 /μL时,灵敏度为60.1%,特异度高达95.9%。结果表明,在明确UTI诊断方面,BACT优于WBC,二者联合检测有助于提高特异度。
考虑本研究人群中位年龄大及性别差异等因素,从中选取60岁以上的老年人共617例,其中男359例(58.2%),女性258例(41.8%),对该人群BACT、WBC对UTI的诊断价值分别进行ROC曲线分析。研究发现,老年男性BACT诊断UTI的AUC为0.901(95%CI:0.859~0.942,P<0.001),WBC诊断UTI的AUC为0.806(95%CI:0.754~0.858,P<0.001)。根据约登指数,BACT最佳cut-off值和WBC分别为1 091.65 /μL和98.3 /μL;女性BACT诊断UTI的AUC为0.923(95%CI:0.888~0.958,P<0.001),大于WBC诊断UTI的AUC为0.743,95%CI:0.683~0.804,P<0.001),BACT的最佳cut-off值为475.15 /μL,WBC的最佳cut-off值为85.95 /μL。结果表明,在诊断UTI方面,对于BACT,老年女性优于老年男性,对于WBC,老年男性优于老年女性,老年男性最佳cut-off值略高于老年女性。见图2。
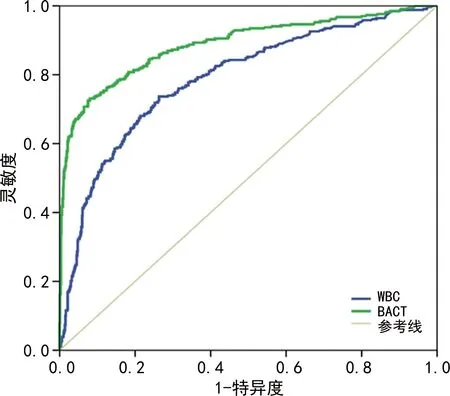
图1 BACT、WBC与尿培养结果的ROC曲线
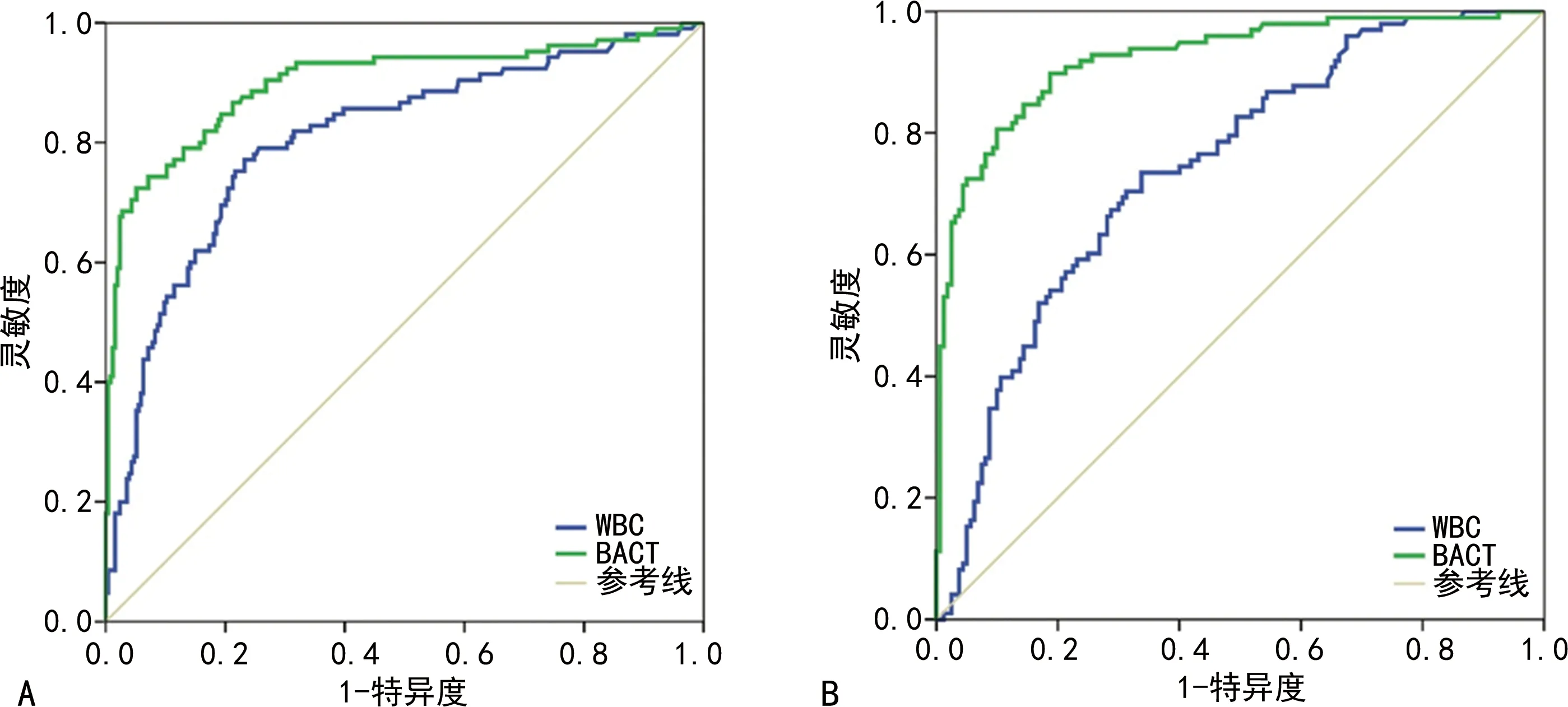
注:A为老年男性;B为老年女性。
2.4明确尿培养阴性的cut-off值 在筛查试验中,灵敏度是最重要的衡量指标,为减少不必要的尿培养,应选取较高灵敏度评估BACT的最佳cut-off值。当采用灵敏度分别为98.5%、95.3%、90.0%时,BACT的cut-off值为15.65、60.85、170.30 /μL,同时根据假阴性个数较小、阴性预测值较大、综合特异度的原则,最佳BACT cut-off值为60.85 /μL,与BACT的cut-off值(15.65 /μL)相比,具有相对较高的阴性预测值(94.2%)。见表2。
在60岁以上的老年人群中,男性BACT的最佳cut-off值为156.40 /μL,灵敏度93.3%,阴性预测值最高为95.2%,女性BACT的最佳cut-off值为134.70 /μL,灵敏度95.9%,阴性预测值95.1%,与BACT cut-off值(87.25 /μL)相比,假阴性例数仅增加3例,真阴性例数增加到77例。见表3、4。

表2 不同BACT cut-off值的筛查分析

表3 老年男性的不同BACT cut-off值的筛查分析
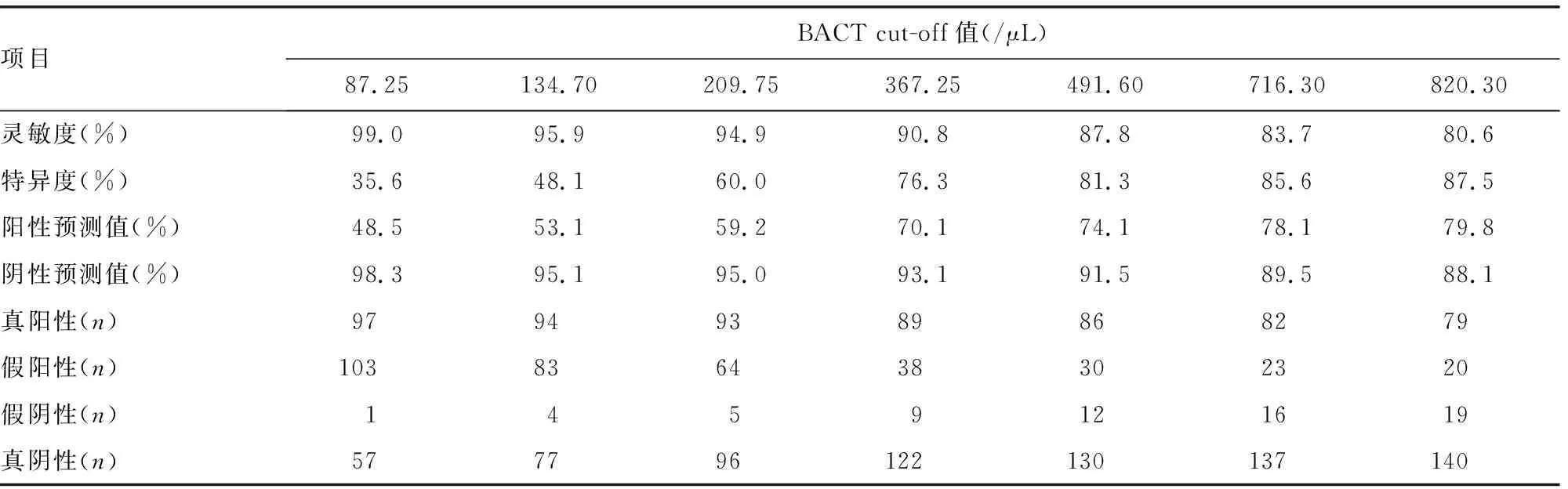
表4 老年女性的不同BACT cut-off值的筛查分析
WBC也是UTI筛查的重要因素。将BACT的最佳cut-off值与不同WBC的cut-off值结合,计算灵敏度、特异度、阳性预测值、阴性预测值、真阳性、真阴性、假阳性及假阴性。采用灵敏度和阴性预测值最大、假阴性个数最小及整合特异度等原则,得出WBC的最佳cut-off值。研究发现,当满足BACT<60.85 /μL或WBC<15.00 /μL时,灵敏度最高(为89.3%),阴性预测值最高(为92.2%)。在老年男性人群中,发现当满足BACT<156.40 /μL或WBC<15.00 /μL时,灵敏度最高(为88.6%),阴性预测值最高(为93.4%),与尿培养一致率(为73.0%),可减少47.1%不必要的尿培养;在老年女性人群中,发现当满足BACT<134.70 /μL或WBC<15 /μL时,灵敏度最高(为90.8%),阴性预测值高达91.3%,与尿培养一致率(为71.3%)。见表5。

表5 BACT最佳cut-off值结合不同WBC cut-off值性能分析
2.5判读革兰阳性/阴性菌 在184例尿培养阳性标本中,51例细菌分类信息标记为GP,81例标记为GN,47例标记为GP/GN,5例标记为unclassified。在47例标记为GP/GN中,22例培养为革兰阳性/阴性菌,22例培养为革兰阴性菌,3例培养为革兰阳性菌。使用UF-5000尿有形成分分析仪正确识别140例(76.1%),与尿培养结果的一致性Cohen′s Kappa值为0.764(χ2=81.625,P<0.001)。见表6。
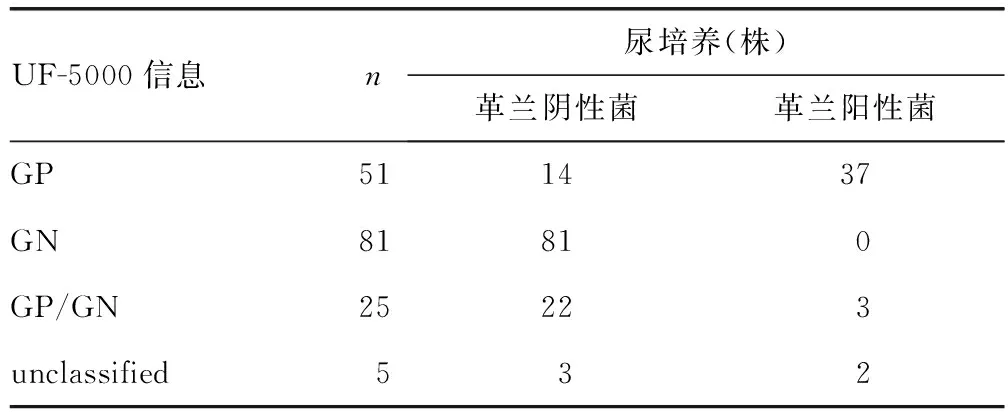
表6 细菌分类信息评估
3 讨 论
快速筛查病原菌为革兰阳性/阴性菌能更迅速地帮助临床医生对患者给予恰当处理及治疗,并减少不必要的尿培养。对本研究纳入1 173例疑似UTI患者分析发现,BACT诊断效能高于WBC,这与之前研究报道一致[7]。HAUGUM等[8]单独或组合WBC 和 BACT并考虑了性别差异,2个参数的 cut-off值均调整为30 /mL,菌尿定义为104CFU/mL,其灵敏度为96.6%,特异度为55.5%,阴性预测值为92.3%,阳性预测值为74.7%,略低于SEMULIK等[9]研究结果(WBC≥40 /μL或BACT≥300 /μL,灵敏度为100.0%,特异度为83.7%,阴性预测值为100.0%及阳性预测值为75.0%[9],与本研究结果相似,采用BACT<60.85 /μL或WBC<15 /μL时,灵敏度为89.3%,特异度51.1%,阴性预测值为92.2%。HAUGUM等[8]还发现,联合检测的阴性预测值低于WBC或BACT单独检测(分别为69.9%和91.2%)。GARCIA-COCA等[10]建议调整使用“或”而不是“和”选择 cut-off值。KIM等[11]研究报道,仅采用BACT cut-off值为15 /μL时,具有更高的筛选率(50.9%)和阴性预测值(99.5%)。此外,对免疫功能低下患者亚组(399例)分析发现,BACT≥267 /μL,灵敏度为90%和特异度为93%,而BACT≥ 27 /μL时,灵敏度为99%,特异度为77%[10]。针对UF-5000在筛查阴性尿培养性能的研究表明,由于研究纳入的患者人群和对菌尿的分类及定义不同,不同实验室应用cut-off值略有差别。
通常老年人群具有较高的UTI的患病率,据报道15%~50%就诊的老年人发生无症状菌尿[12],尿培养的适应证更为宽泛。ALENKAER 等[13]研究显示,针对就诊于急诊科的老年人(544例),分别采取BACT≥10×106/L或YLC≥25×106/L;BACT≥20×106/L或YLC ≥ 25×106/L;BACT ≥ 50×106/L或YLC ≥ 25×106/L时,灵敏度分别为95%、98%、100%,阴性预测值分别为87%、97%、100%。考虑到性别因素,本研究发现,在老年男性人群的cut-off值(BACT<156.4 /μL或WBC<15 /μL)要高于老年女性人群(BACT<134.7 /μL或WBC<15 /μL)。由于老年人自我保健能力下降、卫生条件差、粪便污染和认知障碍,这类人群尿培养经常发生污染。IPPOLITI等[14]基于WBC、鳞状细胞(与受污染的标本有关)和电导率(与尿液浓度相关的研究参数)等参数,采用鳞状细胞>30 /mL或电导率<6 mS/cm或WBC<5 /mL预测阴性培养,其灵敏度达100%,特异度为94%,阳性预测值为72%,阴性预测值达100%。在老年人群中,结合酵母菌计数、鳞状细胞及电导率似乎更有助于排除污染的干扰,提高阴性预测。
此前,UF-1000i 将细菌分类为“棒状”或“球菌/混合”,而不是革兰阳性/阴性菌,细菌分类性能不令人满意且不满足临床使用[15],UF-5000的改进提高了革兰阳性/阴性菌的分类性能。REN等[16]报道,UF-5000的BACT信息可正确识别67.7%标本,与尿培养一致性为0.775。本研究中,UF-5000的BACT信息可正确识别76.1%,一致性为0.764。KIM等[11]研究表明,在细菌生长为105CFU/mL 的UTI中,使用GN标记(包括GP/GN标记),革兰阴性菌的灵敏度和特异度约为90%,阳性预测值较高(为95.4%);使用GP标记(包括GP/GN标记),革兰阳性菌的灵敏度和特异度比例略低(均约为80%),这些结果可能反映所包含细菌的特征差异。KIM等[11]研究通过对患者进一步随访发现,UF-5000和细菌培养之间的BACT变化和细菌分类结果大致匹配,表明UF-5000 提供的快速和定量的参数信息更有助于患者随访、检测细菌种类及监测BACT的变化。
总之,UF-5000在筛查尿培养阳性、阴性标本及革兰阴阳性菌鉴定方面表现出较好的性能,特别是针对老年人群,因其UTI情况复杂,采用UF-5000可优化cut-off值,有利于规范抗菌药物使用,以及减少不必要的尿培养。目前,仍需扩大研究人群优化cut-off值,开发将快速筛查仪器应用于诊断和治疗决策过程的算法或与其他检测方式(如质谱和分子生物学方法)相结合,以更有效地应用于临床实践。
