雷帕霉素诱导急性T 淋巴白血病细胞自噬分子机制的研究
2023-05-23黄笠纹肖亦舒刘春亚任立成
许 兰,黄笠纹,肖亦舒,刘春亚,杜 乐,任立成
(海南医学院生物学教研室,海南 海口,571199)
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路是细胞生长和代谢的主要调节器。mTOR 通路和自噬之间的功能关系涉及复杂的调控网络。在哺乳动物细胞中,自噬反应由ULK 复合体启动。ULK1 通常与ATG13、FIP200 和ATG101 结合形成复合物参与自噬前体形成的启动过程。一方面,腺苷酸活化蛋白激酶(AMPK)可以激活ULK/AGT1 复合物直接激活细胞自噬。另一方面,AMPK 也可以通过磷酸化Raptor 间接激活细胞自噬,从而抑制mTOR 的活性。同时,由空泡分选蛋白34、Beclin1、Vps15 和ATG14组成的磷脂酰肌醇-3-激酶(PI3K)复合体也可以被ULK 募集,使磷脂酰肌醇磷酸化,形成磷脂酰肌醇三磷酸,在自噬过程中发挥重要作用[1-3]。
mTOR 是调节自噬的关键分子,参与了生物过程各个方面的调控,包括细胞的生存、死亡、增殖、分化和衰老。近年来,大量证据表明自噬的失调与致癌有关。自噬在癌症治疗中起着双重作用,它既可以抑制肿瘤细胞生长,也可以促进肿瘤细胞存活[4,5]。
据报道,在血液系统恶性肿瘤中,PI3K-Akt-mTOR 信号通路在大约50%~80%的急性髓性白血病(AML)和约87.5%的 T 细胞急性淋巴细胞白血病(T-ALL)患者中异常激活[6]。雷帕霉素作为mTOR 的有效抑制剂,可以减缓癌细胞的生长和增殖。促进ALL 细胞的自噬。越来越多的临床数据表明,雷帕霉素及其衍生物成为潜在的抗癌药物。将自噬抑制策略与当前的细胞毒性化疗方案相结合,可以为白血病患者提供新的治疗机会[7-9]。本研究以人急性白血病CD4+T-Jurkat 细胞为实验材料,探究不同浓度雷帕霉素作用下,mTOR 信号通路中部分自噬基因表达水平变化,为治疗相关疾病的分子机制提供理论依据。
1 材料与方法
1.1 材料
人类急性T 淋巴细胞白血病(Jurkat)细胞株购自中国典型培养物保藏中心(武汉);雷帕霉素(Rapamycin,RAPA)购自Macklin 公司;MTT 购自Biosharp 生物科技公司;总RNA 提取试剂盒、反转录试剂盒Fasting RT Kit、DNA 纯化试剂盒均购自天根生化科技有限公司;TB Green®Premix Dimer Eraser™(RR091A)购自宝日医生物技术有限公司;ATG16L2 抗体、ATG13 抗体、ULK1 抗体、PI3K3R1 抗体、MAPK1 抗体、Raptor 抗体、
GAPDH 抗体均购自博士德生物技术有限公司;辣根过氧化物酶标记山羊抗兔IgG(H+L)、特超敏ECL 化学发光试剂盒购自碧云天生物技术有限公司;Cell Cycle and Apoptosis Analysis Kit、Annexin V-FITC/PI 细胞凋亡检测试剂盒均购自上海翊圣生物科技公司。
1.2 方法
1.2.1 细胞培养 将Jurkat 细胞接种于含10%胎牛血清和1%青霉素/链霉素的RPMI-1640 培养基中,置于37 ℃、5% CO2的恒温培养箱中进行培养,当处在指数期的细胞密度达到80%时,用终浓度为10 nmol/L、20 nmol/L、50 nmol/L 的RAPA 处理细胞48 h,即可收集细胞,用于后续实验。
1.2.2 MTT 法检测细胞增殖抑制率 将处在指数生长期的Jurkat 细胞接种于96 孔板中,每孔加入100 μL(1×106个细胞)细胞培养液进行铺板,分别加入不同终浓度的RAPA,每组设3 个复孔,置于37 ℃、5% CO2的培养箱中分别培养24、48、72 h。到时间点后,每孔加入10 μL MTT 溶液(5 mg/mL),继续培养4 h。水平离心吸掉上清后,每孔加入150 μL 二甲基亚砜(DMSO),置于摇床上低速振荡10 min。于酶标仪490 nm 处测其光密度(OD)值。按以下公式计算细胞增殖抑制率:细胞增殖抑制率=(对照组OD 值-实验组OD 值)/对照组OD值×100%。
1.2.3 流式细胞术检测细胞凋亡率和细胞周期将指数期生长的细胞接种于6 孔板中,用不同浓度的RAPA 处理,于培养箱中继续培养48 h 后收集1×106个细胞。预冷的PBS 洗涤2 次,低速离心后,弃上清。取一部分用100 μL 1xBinding Buffer 重悬细胞沉淀,依次加入5 μL Annexin V-FITC 染料和10 μL PI 染料,轻轻混匀后室温避光反应15 min,再补加400 uL 1×Binding buffer,用流式细胞仪检测细胞的凋亡率。另一部分用70%预冷的无水乙醇重悬,4 ℃静置过夜。预冷的PBS 洗涤2 次,加入500 μL 染色缓冲液重悬,再加入10 μL RNaseA 和10 μL PI 染料轻轻混匀后,室温避光染色30 min,用流式细胞仪进行细胞周期检测。
1.2.4 吖啶橙荧光染色检测细胞自噬 Jurkat 细胞用不同浓度RAPA 处理48 h 后,各取300 μL 细胞悬液加入3 μL 吖啶橙染液,室温固定15 min,PBS 洗涤3 次。移至荧光显微镜下,选用蓝色激发滤片进行形态结构的观察。
1.2.5 RT-qPCR 及Western Blot 分析 收集不同药物浓度处理的细胞悬液,按照细胞总RNA 提取试剂盒的说明提取RNA,并反转录合成cDNA。反应程序设置为:95 ℃ 30 s,95 ℃ 5 s,55 ℃ 30 s,72 ℃30 s,40 个循环。以GAPDH 作为内参基因,采用2-ΔΔCT公式计算mRNA 相对表达量,不同处理组设置3 个重复。引物序列由Primer 3 在线设计,如表1 所示。相关蛋白表达水平通过Western Blot 分析,各组细胞加入RIPA 裂解液,冰上裂解30 min,提取总蛋白并用BCA 试剂盒检测蛋白浓度。蛋白质变性处理后,样品经SDS-PAGE 分离,转移至PVDF 膜,于摇床上封闭1 h,一抗4 °C 过夜,二抗室温孵育1 h,ECL 发光试剂盒显影,Image J 软件分析条带灰度值。

表1 qPCR 引物序列Tab 1 Primer information for RT-qPCR
1.2.6 转录组测序分析 收集0 nmol/L~50 nmol/L RAPA 处理48 h 后的细胞悬液,每个浓度设置3个重复,提取细胞总RNA,用1.5%琼脂糖凝胶电泳分析样品RNA 的完整性,分光光度计测其RNA 纯度,样品检测合格后,送至诺禾致源科技股份有限公司进行测序及分析。
1.2.7 甲醛辅助分离调控元件(FAIRE)分析FAIRE 样品制备方法参考Simon 等[10,11]报道的方法。在细胞培养液中加入甲醛溶液,使其终浓度为1%,室温下交联固定10 min,加入终浓度为0.125 M 的甘氨酸,室温振荡5 min,淬灭甲醛。PBS 洗涤3 次,加入5 mL NP-40 细胞裂解液,在冰上裂解1.5 h,离心收集交联的细胞核,每管约含107个细胞。对样品进行超声波打短处理,将其剪切到200~300 bp的平均大小。取上述样品的10%作为Input 分析。剩余样品4 ℃离心,去除细胞碎片后,通过酚氯仿抽提纯化DNA,即可获得FAIRE 样品。qPCR 实验分析FAIRE 样品中的DNA 富集效率。反应程序为:95 ℃ 30s,95 ℃ 5s,60 ℃ 25s,72 ℃ 20 s,40 个循环。定量PCR 引物序列如表2 所示。

表2 FAIRE 引物序列Tab 2 Primer sequences for FAIRE
1.3 统计学处理
采用GraphPad Prism 8.0 软件进行统计学分析并作图,以平均值±标准差(±s)表示实验结果,采用t检验进行两组间数据比较,P<0.05 具有统计学意义。
2 结果
2.1 RAPA 抑制Jurkat 细胞的生长
分别用0、5、10、20、40、80、100 nmol/L 浓度的RAPA 处理Jurkat 细胞24 h、48 h 和72 h 后,MTT法检测波长在490 nm 处的OD 值,计算细胞的增殖抑制率。随着药物处理时间和浓度的增加,RAPA对Jurkat 细胞的增殖抑制作用也随之提高。RAPA呈浓度和时间依赖性方式抑制Jurkat 细胞的增殖(图1)。采用GraphPad Prism 8.0 软件绘制其增殖抑制曲线并计算出RAPA 作用于Jurkat 细胞24 h、48 h 和72 h 的半抑制浓度(half maximal inhibitory concentration,IC50)分别为507.20 nmol/L、89.51 nmol/L、12.01 nmol/L。与正常对照组相比,RAPA处理Jurkat 细胞48 h 时,其增殖抑制率从(22.96±13.48)%提高到(53.80±9.90)%,具有显著的统计学差异义(P<0.05)。因此,本实验选择浓度为10 nmol/L、20 nmol/L 和50 nmol/L 浓度的RAPA 处理Jurkat 细胞48 h 作为后续实验的基础条件。

图1 RAPA 对Jurkat 细胞增殖的影响Fig 1 Effect of RAPA on the proliferation of Jurkat cells
2.2 RAPA 不能有效诱导Jurkat 细胞发生凋亡
用Annexin VFITC 和PI 双标记细胞后,通过流式细胞仪检测0 nmol/L、10 nmol/L 和50 nmol/L RAPA 处理Jurkat 细胞48 h 后的凋亡细胞比例。检测结果如图2 所示,10 nmol/L 和50 nmol/L 浓度的RAPA 作用于Jurkat 细胞48 h 后,细胞早期凋亡率(Q3)分别为(0.06 ± 0.01)%、(0.14 ± 0.04)%;晚期凋亡率(Q2)分别为(6.13 ± 0.24)%、(6.78 ±0.03)%。细胞总凋亡率(Q2+Q3)分别为(6.18 ±0.25)%、(6.92 ± 0.02)%。与未处理组(0 nmol/L)(5.65 ± 0.18)%相比,各组细胞的总凋亡率升高不明显(P>0.05)。说明在50 nmol/L 浓度内,RAPA不能有效地诱导Jurkat 细胞发生凋亡。

图2 RAPA 处理Jurkat 细胞48 h 的凋亡情况Fig 2 Apoptosis of Jurkat cells treated with RAPA for 48 h
2.3 RAPA 阻滞Jurkat 细胞周期
为进一步确定RAPA 对Jurkat 细胞周期的影响。本实验采用PI 单染法检测10 nmol/L 和50 nmol/L RAPA 处理Jurkat 细胞48 h 后的周期变化情况。检测结果表明(图3),与空白对照组相比,G1期细胞占比从32.74%上升至44.81%,S 期细胞占比从48.96%下降至35.22%。Jurkat 细胞在G1 期的比例显著增加,S 期比例明显降低(P<0.05);且随着药物处理浓度的增加,G1 期细胞比例逐渐增加。表明RAPA 能够将Jurkat 细胞周期阻滞在G1期,并且具有药物浓度依赖性。

图3 RAPA 对Jurkat 细胞周期的影响Fig 3 Effect of RAPA on Jurkat cell cycle
2.4 RAPA 诱导Jurkat 细胞自噬
吖啶橙染料可以渗透进入到自噬溶酶体中,经荧光激发后呈现红黄色点状体,能够间接反应细胞的自噬水平。为了探究RAPA 对Jurkat 细胞自噬水平的影响,本实验用吖啶橙染色观察细胞形态(图4)。经蓝光激发后,在荧光显微镜下可观察到对照组(0 nmol/L)细胞呈圆球形,发绿色荧光,胞质均匀;给予10 nmol/L 浓度药物处理后,染色质DNA开始凝缩,胞质内出现红黄色荧光(白色箭头所示),表明有自噬溶酶体产生。与空白组相比,50 nmol/L 处理组的红黄色荧光最为显著。由此可见,自噬溶酶体的数量呈剂量依赖性增加。

图4 吖啶橙荧光染色检测细胞自噬(×400)Fig 4 Autophagy was detected by acridine orange fluorescence staining(×400)
2.5 自噬相关基因转录组数据统计
0~50nmol/L RAPA 处理Jurkat 细胞48 h 后,提取细胞总RNA 进行转录组测序。测序数据按照“|log2 Fold Change | >0,P-value <0.05”的标准筛选出差异表达的自噬相关基因(图5)。共筛选出27个表达基因,包括ATG 基因家族(8 个)、MAPK 基因家族(10 个)、PI3K 激酶家族(6 个)和ULK 激酶家族(3 个)。其中上调的基因共有17 个,下调基因有10 个。在ATG 基因家族中,ATG3/7/10/13/16L2 这5 个基因经RAPA 诱导后被上调,ATG12/14/16L1 这3 个基因下调;MAPK 基因家族中,MAPK1/6/8/9/13 这5 个基因下调,MAPK3/7/11/12/14 这5 个基因上调;PI3K 激酶家族中,PIK3R1/3/4/6 这4 个基因上调,PIK3R2/5 下调;ULK 激酶家族(ULK1/2/3)经RAPA 诱导后全部上调。综上所述,通过转录组数据分析,RAPA 作为mTOR 的天然抑制剂,可以调控自噬基因的表达,改变基因的转录水平,进而影响自噬通路在细胞中所发挥的作用。
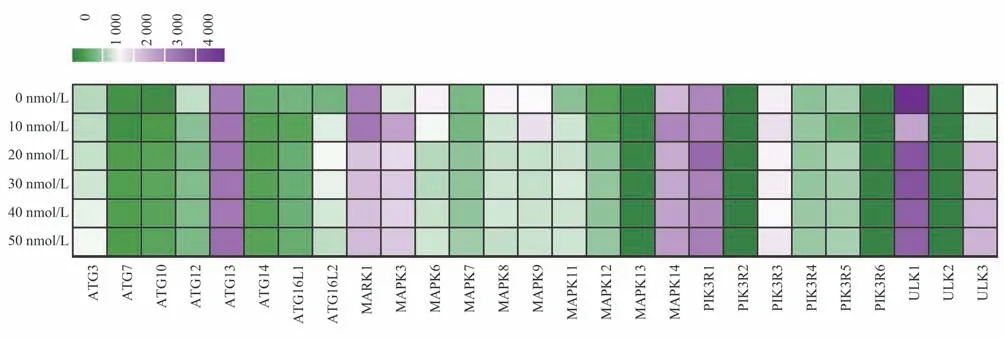
图5 自噬相关基因差异表达热图Fig 5 Heatmap of the differential expression of autophagy related genes
2.6 RAPA 影响自噬相关基因的转录水平
采用终浓度为10 nmol/L、20 nmol/L 和50 nmol/L 的RAPA 处理细胞48 h 后,qPCR 检测自噬基因ULK1、ATG13、ATG16L2、MPKA1、PIK3R1、Raptor 在Jurkat 细胞中的转录水平。结果显示(图6),经不同浓度RAPA 处理后,除MPKA1 基因的转录水平呈明显下降趋势外,低浓度(10 nmol/L、20 nmol/L)的RAPA 可上调基因ULK1、ATG13、ATG16L2、PIK3R1、Raptor 的表达,上调约2~3 倍,具有浓度依赖性。其中,ULK1 和TG16L2 基因表达尤其显著,上调约4~6 倍;高浓度(50 nmol/L)时,转录水平开始下调。这说明低浓度的RAPA 抑制mTOR 信号通路后,会促进部分自噬相关基因的表达,从而诱导细胞自噬;高浓度的RAPA 则会抑制自噬相关基因的表达,从而阻断细胞自噬。

图6 RAPA 诱导后自噬基因的转录水平变化Fig 6 Transcript level changes of autophagy genes after RAPA induction
2.7 RAPA 影响自噬相关基因的蛋白质水平
Jurkat 细胞经10 nmol/L、20 nmol/L 和50 nmol/L RAPA 处理48 h 后收集细胞样品,通过Western Blot 实验进一步分析自噬基因蛋白质表达水平的变化趋势(图7)。与对照组相比,在10 nmol/L 和20 nmol/L 浓度诱导下,ULK1、ATG13、ATG16L2、PIK3R1、Raptor 基因的蛋白质表达水平逐渐上升,50 nmol/L 时,表达水平开始下降;MPKA1 基因的蛋白质表达水平随着药物浓度的增加而下降。从整体趋势分析,蛋白质表达水平与qPCR 结果趋势基本一致。Western Blot 实验结果进一步说明,低浓度的RAPA 可以诱导ULK1、ATG13、ATG16L2、PIK3R1、Raptor 蛋白质的表达;高浓度则会降低蛋白质表达水平。
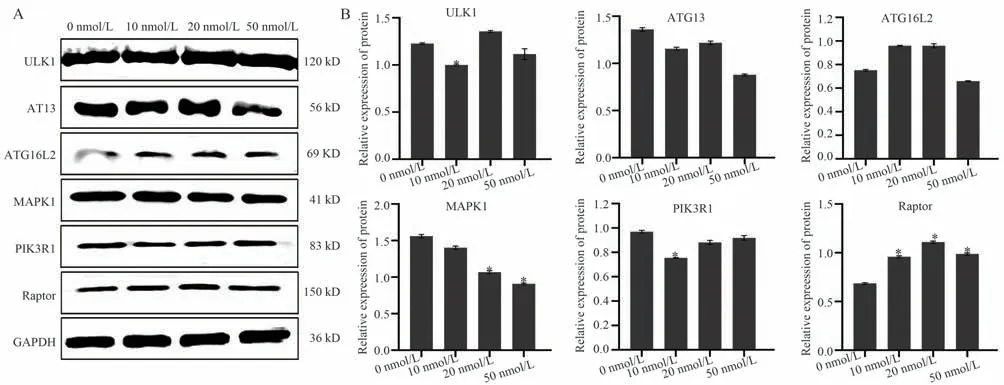
图7 RAPA 对自噬蛋白表达的影响Fig 7 Effect of RAPA on autophagy protein expression
2.8 RAPA 诱导自噬相关基因染色质可及性改变
基因表达是一个高度调控的过程,可以从多个水平上进行调节。转录是这一复杂过程的第一步。染色质在转录过程中扮演着重要的角色,其DNA与核小体之间相互作用的动态改变影响细胞转录程序的调控[12,13]。为了进一步研究自噬相关基因表达调控的分子机制,本文通过FAIRE-qPCR 技术对自噬基因启动子区域染色质的开放状态进行分析(图8)。与对照组相比,10 nmol/L 和20 nmol/L RAPA 处理48 h 后,ULK1、ATG13、ATG16L2、PIK3R1、Raptor 基因的染色质可及性增加,MAPK基因的染色质可及性降低,随着药物处理浓度的增加,染色质可及性也呈现梯度变化;50 nmol/L 时,由于药物处理浓度过高使细胞发生自噬,染色质结构松散,从而导致实验结果虚高。整体来看,自噬基因启动子区域染色质可及性变化趋势基本与基因表达的变化趋势一致。结果表明,RAPA 可以影响自噬基因染色质的开放状态,改变细胞内的表观遗传环境,进而调控基因的表达。

图8 自噬基因启动子区域染色质可及性分析Fig 8 Analysis of chromatin accessibility in the promoter region of autophagy gene
3 讨论
mTOR 通过参与体内多种信号通路来调节细胞增殖、自噬和凋亡。研究表明,mTOR 信号在高达80 %的人类癌症中被过度活跃,并且在维持癌细胞生长和肿瘤代谢方面发挥着重要作用。癌症是与自噬调节失调有关的主要疾病之一。与正常细胞相比,肿瘤细胞更依赖于自噬生存。通过自噬循环过程,癌细胞在快速增殖过程中克服了新陈代谢压力。此外,自噬在肿瘤中起着“双刃剑”的作用。它在癌症早期抑制肿瘤的形成,而在晚期,则促进肿瘤发展。由于其在癌症发病机制中的动态和双重作用,自噬为开发新型有效的癌症疗法提供了很好的机会[14-17]。
抑制自噬成为一种新兴的治疗选择,通过药理学手段抑制自噬可以促进癌症细胞死亡。众所周知的mTOR 抑制剂RAPA 具有有效的自噬激活作用。多项研究表明,多种新型mTOR 抑制剂在临床研究中表现出较高的抗肿瘤活性,与其他抗肿瘤药物联合使用效果显著。然而,mTOR 信号通路的作用尚未被明确研究,许多自噬相关基因在各种癌细胞中的分子调控机制也尚未完全破译。肿瘤的发生机制复杂,涉及多条信号通路。抑制某些信号通路可能会导致其他信号通路的反馈激活。尽管联合治疗更有效,但其诱导肿瘤细胞死亡的能力有限。因此,了解肿瘤微环境与自噬之间的相互作用至关重要,通过对mTOR 信号通路作用机制的研究,开发选择性的mTOR 抑制剂,有利于阻止肿瘤的发展和对抗治疗耐药性[18-20]。
本研究使用天然化合物-RAPA 作为目标分子,研究其诱导自噬基因潜在的分子机制。通过MTT和流式细胞仪检测发现,RAPA 对Jurkat 细胞有明显的增殖抑制作用,且抑制程度与药物浓度呈正相关。通过研究发现,10 nmol/L 和20 nmol/L 的RAPA 能够提高自噬相关基因ULK1、Atg13、Atg16L、PIK3R 和Raptor 的表达,50 nmol/L 则会下调自噬基因的表达,推测在细胞自噬进程中,自噬体的水解和来自溶酶体的氨基酸外排导致细胞内氨基酸增加,受到其最终产物的抑制,使得相关基因的转录水平呈现下调的现象。
综上所述,RAPA 能够抑制Jurkat细胞的增殖,诱导细胞发生自噬。从分子机制上看,RAPA 改变了自噬基因启动子区染色质的开放状态,进而影响了基因的表观遗传环境,这种空间结构的变化在功能上调控了基因的表达。
作者贡献度说明:
许兰:参与部分实验操作,分析数据,撰写文章;黄笠纹、肖亦舒:进行RT-qPCR 及Western Blot 实验;刘春亚:培养细胞和MTT 法测定细胞增殖抑制率实验;杜乐:对实验工作进行技术指导;任立成:提供技术支持和指导,并负责文章的修改指正。
所有作者声明不存在利益冲突关系。
