哈茨木霉配施高碳基肥对植烟土壤理化性质和细菌群落结构的影响
2023-05-23任志超穆耀辉匡志豪李淑娥张永峰任天宝殷全玉刘国顺
任志超 穆耀辉 匡志豪 李淑娥 张永峰 任天宝 殷全玉 刘国顺









摘要:探究哈茨木霉配施高碳基肥对根际土壤细菌群落结构及理化性质的影响,为调控烟草微环境及改善土壤提供理论依据。采用大田试验方法,设置4个处理:T1(哈茨木霉菌剂750 kg/hm2+常规施肥)、T2(高碳基肥 750 kg/hm2+常规施肥)、T3(哈茨木霉菌剂750 kg/hm2+高碳基肥750 kg/hm2+常规施肥)和CK(常规施肥),通过高通量测序技术探究哈茨木霉配施高碳基肥对根际土的细菌群落结构和土壤理化性质的影响。结果表明:(1)不同施肥处理改善根际土壤理化性质的效果总体表现为T3处理>T1处理>T2处理,T3处理显著提高了土壤的pH值、全氮含量、全碳含量、硝态氮含量、铵态氮含量、速效磷含量和速效鉀含量(P<0.05),增幅分别为7.63%、41.67%、20.80%、63.70%、28.98%、15.07%和9.51%;(2)烤烟根际土细菌群落结构α多样性指数在哈茨木霉菌剂和高碳基肥间存在显著互作效应,哈茨木霉菌剂处理的根际土细菌多样性指数相对较低,而CK较高且与T2处理和T3处理差异不显著;(3)LefSe分析结果表明,不同施肥处理的根际土关键微生物类群存在明显差异,且对不同施肥处理的响应也存在差异;(4)β多样性分析结果表明,3个施肥处理的根际土细菌群落结构与对照组土壤呈现明显的分离效应,高碳基肥处理的响应模式与T3处理相似,但响应程度不及后者。说明哈茨木霉菌剂和高碳基肥间存在显著互作效应。在生产中,可利用哈茨木霉配施高碳基肥改良土壤和烟草微生态环境。
关键词:哈茨木霉;高碳基肥料;植烟土壤;理化性质;细菌群落结构
中图分类号:S572.06 文献标志码:A
文章编号:1002-1302(2023)08-0223-09
基金项目:中国烟草总公司陕西省公司科技项目(编号:2021611000270042)。
作者简介:任志超(1998—),男,黑龙江绥化人,硕士研究生,主要从事烟草栽培与生理研究。E-mail:1132007123@qq.com。
通信作者:殷全玉,博士,副教授,主要从事烟草资源微生物利用与土壤保育研究。E-mail:quanyuy@126.com。
土壤作为自然界最为复杂的生态系统之一,是影响植物生长发育的关键因素[1]。大量的微生物存在于土壤之中,它们在土壤中的分布特征和组成多样性不仅反映了土壤质量的好坏,还具有维持能量流动、物质循环、信息交换、土壤修复及各种土传病害的防治等功能[2-5]。有研究证明,生物炭是一种很有应用前景的土壤改良剂,可以有效改良土壤的微环境[6-7]。生物炭是各种固体农林废弃物在厌氧条件下热解碳化产生的高度芳香化的富碳有机产物[8-10]。相关研究表明,生物炭可以用来抑制病原菌的繁殖,改善土壤理化性质,促进作物生长及调节土壤微生态环境[11-13]。Shen等对患病烤烟施加生物炭后发现,生物炭的施用可有效提高土壤中细菌的群落结构及多样性,并降低致病细菌的丰度,从而有效降低烤烟的发病率[14]。Rose等的研究表明,在甘蔗中添加生物炭可提高土壤的pH值和水分含量,同时还会降低甘蔗红腐病的发病率[15]。而高碳基肥作为以生物炭为核心原料的新型有机肥料,同时也具有改善土壤理化性质、调节土壤微生态环境等积极作用[16-17]。苏梦迪等在植烟土壤中施加高碳基肥有效改善了土壤的理化性质和植烟土壤的微生物群落结构和多样性[18]。李怡博等研究发现,高碳基肥与微生物肥料配施可提高植烟土壤中微生物的数量和土壤pH值、碱解氮含量、速效磷含量、速效钾含量等理化指标[19]。
木霉是自然界中的一类有益生防菌,据统计,木霉对18个属30种植物病原菌具有良好的生防效果,并且具有分布广、适应性强、繁殖快等特点[20-21]。它不仅可以改善土壤的理化性质,同时对作物根际土微生物的群落结构及多样性具有积极影响[22-23]。Fu等在种植玉米时施加木霉菌剂发现,经木霉菌剂处理后玉米根际土壤的养分含量、酶活性和生长特性有明显的改善,从而优化了根际土壤的细菌群落结构及多样性[24]。Pang等研究发现,在番茄土壤中施加富含木霉的有机肥可以抑制番茄土壤微生物群落退化从而维持番茄的健康发育[25]。目前,木霉菌剂和高碳基肥在植烟土壤保育和微生态环境领域的研究广泛[26-28],而对于有关两者配施的研究鲜有报道。鉴于此,本试验通过高通量测序的方法对哈茨木霉配施高碳基肥的植烟土壤理化性质和细菌群落结构进行分析,探究哈茨木霉配施高碳基肥对植烟土壤理化性质和细菌多样性的影响,以期为哈茨木霉配施高碳基肥在烟草生产上的应用提供依据。
1 材料与方法
1.1 试验设计
于2020年 2—10月在陕西省商洛市洛南县(108°34′20″~111°1′25″E,33°2′30″~34°24′40″N之间)设置田间试验。试验区属暖温带季风性湿润气候,海拔在800~1 200 m之间,年平均气温 11.5 ℃,年平均降水量为700~850 mm,年均日照时数 2 045 h。土壤质地为黏壤土,试验开始前耕层(0~20 cm)土壤的基本理化性质:有机质含量 11.21 g/kg、pH值5.45、全氮含量0.10%、全碳含量1.13%、速效钾含量147.42 mg/kg、速效磷含量21.52 mg/kg。
供试烟草品种为云烟99,由商洛市洛南县烟草公司统一漂浮育苗,于3月15日播种,5月1日移栽;供试哈茨木霉Z-19菌剂由笔者所在实验室提供和保存,有效活菌数为10×109 CFU/mL;供试高碳基肥由河南惠农土质保育研发有限公司提供,其有效成分含量分别为总碳含量27.09%、总氮含量1.74%、磷含量1.28%、钾含量0.86%、含水率26.36%、pH值8.19;蚯蚓粪由当地烟草公司提供。
试验处理分别为CK[常规施肥:烟草专用肥(N、P2O5、K2O含量分别为12%、10%、23%) 750 kg/hm2+蚯蚓粪1 t/hm2+西洋复合肥(N、P2O5、K2O含量分别为16%、6%、23%)150 kg/hm2]、T1处理(哈茨木霉菌剂750 kg/hm2+常规施肥)、T2处理(高碳基肥750 kg/hm2+常规施肥)和T3处理(哈茨木霉菌剂750 kg/hm2+高碳基肥 750 kg/hm2+常规施肥)。试验采用随机区组排列方法,5次重复,设保护行。行距为1.2 m,株距为0.5 m,小区面积为66.7 m2。高碳基土壤修复肥全部用作基肥条施,哈茨木霉菌剂与移栽水混匀后灌根即可,其他田间管理措施按照当地生产技术规范进行。
1.2 样本采集
在烟草移栽75 d时,避开雨天和过度干旱期。取样方法参照文献[29],按照五点取样法在每个处理选取20个取样点,即每个处理重复5个取样点,利用铲子将烟株周围10 cm的土壤挖至30 cm深,挖出烟株的整个根部放于盆中,摇动根部并用铲子从根部去除土壤置于盆中,采集2份盆中的土壤,一部分除去各种杂质后混匀过2 mm筛并取5 g于 10 mL 无菌离心管中直接用干冰运送到上海美吉生物医药科技有限公司进行土壤细菌多样性检测,剩余部分土壤置于密封袋内快速运回实验室,-80 ℃保存并进行理化性质分析。
1.3 试验方法
1.3.1 土壤理化性質分析
测定方法参照文献[30],土壤全氮、全碳含量用全自动碳氮分析仪(vario MAX CN,德国)测定;硝态氮和铵态氮含量用全自动化学分析仪(Smartchem140)测定;土壤pH值用电位法测定;速效磷含量采用 0.5 mol/L NaHCO3浸提-钼锑抗比色法测定;速效钾含量采用1 mol/L乙酸铵浸提-火焰光度计法测定。
1.3.2 土壤DNA提取和聚合酶链式反应(PCR)扩增方法
使用土壤基因组DNA快速抽提试剂盒提取土壤微生物群落DNA,并利用上海美吉生物医药科技有限公司进行高通量测序。测序流程分为PCR扩增、PCR产物的混样与纯化、文库的构建3个部分。对细菌V3~V4可变区进行PCR扩增,其引物为338F(5′-[JP9]ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-[JP9]GGACTACHVGGGTWTCTAAT-3′)。扩增程序为:95 ℃预变性3 min;95 ℃ 变性 30 s,55 ℃退火30 s,72 ℃延伸30 s,27个循环;之后72 ℃稳定延伸10 min,最后在4 ℃保存。
1.3.3 Illumina Miseq 测序
将同一样本PCR产物混合后用2%琼脂糖凝胶回收PCR产物,用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences,Union City,CA,USA)纯化回收产物,用2%琼脂糖凝胶电泳检测,并用QuantusTM Fluorometer (Promega,USA) 对回收产物进行检测定量。使用NEXTFLEX Rapid DNA-Seq Kit进行建库:(1)接头链接;(2)使用磁珠筛选去除接头自连片段;(3)利用PCR扩增进行文库模板的富集;(4)磁珠回收PCR产物得到最终的文库。利用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)。原始数据上传至NCBI SRA数据库。
1.4 数据分析
采用Excel 2019和 DPS 7.0 软件分析处理数据,用R语言工具制图。
2 结果与分析
2.1 不同施肥处理对根际土壤理化性质的影响
对不同施肥处理的根际土壤中的pH值、全氮含量、全碳含量、硝态氮含量、铵态氮含量、速效磷含量和速效钾等含量指标进行测定。从表1可以看出,不同施肥处理后植烟土壤的理化性质表现为T3处理>T1和T2处理>CK,T1处理显著提高了根际土壤的硝态氮、速效磷、速效钾的含量(P<0.05),增幅分别为50.23%、12.18%、7.31%;T2处理显著提高了pH值及全氮、速效磷、速效钾的含量,增幅分别为4.01%、25.00%、6.69%、5.12%;T3处理显著提高了pH值及全氮、全碳、硝态氮、铵态氮、速效磷、速效钾的含量,增幅分别为7.63%、41.67%、20.80%、63.70%、28.98%、15.07%、9.51%。不同施肥处理的其他指标虽未达到显著水平,但均有不同程度增加。不同施肥处理改善根际土壤理化性质的效果总体表现为T3处理>T1处理>T2处理。可见,哈茨木霉菌剂和高碳基肥料均能不同程度地改善根际土壤理化性质,而哈茨木霉菌剂配施高碳基肥会显著优化高碳基肥料对土壤的改良效果。
2.2 样品脱机测序数据统计
表2为高通量测序后各处理土壤样本脱机数据的统计结果,按照97%的相似性阈值聚类后,该试验土壤样本的平均有效序列数为47 393条,平均序列长度为414 bp,平均最短序列长度为245 bp,平均最长序列长度为479 bp。说明该试验通过高通量测序获取了足够的有效数据量,可以进行后续分析。
2.3 α多样性分析
2.3.1 样本OTU测序分析
图1为各处理土壤样本的Pan曲线(左)与Core曲线(右),随着测序样本量的增大,Pan曲线斜率逐渐升高,各处理样本包含的OTU总和不断增加并趋于平缓,表明该试验土壤样本的测序评估质量达到了后续分析要求。其中,CK组总OTU数最高,T1组的总OTU数最低,T2组和T3组的总OTU数在CK组和T1组之间。Core曲线反映了所有样本的核心OTU数变化情况,这里观察到Core曲线的斜率逐渐下降,各个样本间共有的OTU数量逐渐减少并达到平稳,物种测序评估质量达到了后续分析要求。
2.3.2 α多样性指数分析
依据最小样本序列数进行抽平,用于分析各样本的有效序列数量为 28 693 条,各处理土壤样本经过97%的相似性阈值划分及OTU聚类后可归类为36门、102纲、237目、378科、748属、1 415种以及3 187个OTU。
α多样性指数分析是通过一些统计学指数来分析并评估细菌群落结构的丰度与多样性。从表3可以看出,不同施肥处理的序列观测值表现为CK>T2处理>T3处理>T1处理,Shannon指数和Chao1指数表现为CK>T3处理>T2处理>T1处理,Simpson指数中哈茨木霉菌剂处理显著高于其余处理。可以看出,不同施肥处理均不同程度地降低了植烟土壤细菌群落结构的丰度和均匀性,且哈茨木霉菌剂处理的α多样性指数显著低于其化各处理(Simpson指数除外),其余处理虽不存在显著差异,但是数值上还是出现了差距,T2处理和T3处理的α多样性指数均有不同程度的降低,说明不同肥料的施用影响了土壤的细菌群落结构多样性。
2.4 细菌群落组成与结构分析
2.4.1 门水平细菌群落分布
图2为各处理细菌在门水平上的相对丰度,可以看出,各处理土壤样本与常规施肥的土壤根际细菌群落结构在门水平上基本一致,但相对丰度含量存在差异,供试土壤样本的主要优势细菌为放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteriota),主要优势细菌的丰度之和占细菌总丰度的80%以上。相比于常规施肥处理,放线菌门在施用哈茨木霉菌剂后的相对丰度提高了9.37百分点,在施用高碳基肥料后的相对丰度降低了3.19百分点,在T3处理后的相对丰度降低了5.43百分点;变形菌门在3个处理中的相对丰度分别表现为降低0.31百分点、增加3.85百分点、增加6.19百分点;绿弯菌门在3个处理中的相对丰度分别降低2.28、1.25、1.07百分点;酸杆菌门在3个处理中的相对丰度分别降低了3.16、1.06、3.15百分点。
图3为各处理在门水平上存在极显著或显著性差异的细菌,相比于常规施肥处理,T1处理的土壤根际细菌群落结构中放线菌门的相对丰度显著升高,酸杆菌门和芽单胞菌门(Gemmatimonadota)的相对丰度显著降低;T2处理的土壤根际细菌群落结构中,放线菌门和芽单胞菌门的相对丰度显著降低,而变形菌门、拟杆菌门(Bacteroidota)和髌骨细菌门 (Patescibacteria)的相对丰度显著升高;T3处理的土壤根际细菌群落结构中,放线菌门、酸杆菌门、芽单胞菌门的相对丰度显著降低,变形菌门、厚壁菌门、拟杆菌门、髌骨细菌门的相对丰度显著升高。由此可知,不同的施肥处理均改变了根际土的细菌群落结构,且施肥不同根际土的细菌群落结构改变程度也有所不同,同时,T3处理可显著提高高碳基肥对土壤根际细菌群落结构的优化效果。
2.4.2 属水平细菌群落分布
图4为各处理细菌属水平上的相对丰度,总共检测到18个属,其相对丰度在不同施肥处理间存在差异。施用不同肥料后,18个属的总丰度在T2处理组中表现为降低,在T1处理组和T3处理组中表现为增加。与常规施肥处理相比,T1处理组的18个属中,有9个属的占比表现为升高,9个属表现为下降;在T2处理组中,有7个属的占比表现为升高,11个属表现为下降;在T3处理组中,有9个属的占比表现为升高,9个属表现为下降。同时,不同施肥处理所改变的细菌种类也并不完全相同。表明不同的施肥处理均改变了根际土属水平上的细菌群落结构,且施肥不同,根际土的细菌群落结构改变程度也有所不同。
2.4.3 不同施肥处理对烤烟根际土关键微生物的影响
鉴于土壤中微生物的数量之多,丰度差别之大,因此有必要明确不同施肥处理对烤烟根际土壤微生物的影响。以线性判别分析(LDA)值≥4为标准进行LefSe分析,以明确不同施肥处理的差异微生物以及它们在不同分组中的富集情况。图5是不同施肥处理烤烟根际土壤中关键微生物的多级物种层次树图,其中在常规施肥土壤中高度富集的微生物包括酸杆菌门和嗜热油菌纲(Thermoleophilia);在施用哈茨木霉菌剂后,根际土壤中高度富集的微生物包括放线菌纲(Actinobacteria)、微球菌目(Micrococcales)和节杆菌属(Arthrobacter)等;施入高碳基肥料处理后伯克氏菌目 (Burkholderiales)和α-变形菌纲(Alphaproteobacteria)显著富集;在T3处理后,根际土壤中高度富集的微生物包括罗丹诺杆菌科(Rhodanobacteraceae)、黄单胞菌目(Xanthomonadales)、变形菌门和γ-变形菌纲(Gammaproteobacteria)等,说明不同施肥处理根际土壤关键微生物的种群类别不同,以上微生物对土壤生物功能调节起到重要作用。
2.5 细菌群落组成的层级聚类及主坐标分析(PCoA)
2.5.1 细菌物种丰度聚类图分析
根据物种注释信息和丰度信息,在门水平上选取排名前35位的物种绘制热图(图6)。可以看出,不同施肥处理间的细菌群落结构相似性不存在明显差异。同时,不同处理之间的主要细菌门类相对丰度差别也不大。具体处理间层次聚类结果表明,T1处理与其余处理相距较远,T2处理和CK距离最近,CK、T2、T3处理相对距离较近,聚成一组。
图7是属水平上前35位物种组成的层次聚类热图分析结果,不同施肥处理呈现出和门水平物种相同的分离效应。不同处理间主要优势属的相对丰度没有得到很好的区分,说明通过层次聚类分析的方法可以体现出主要优势物种的丰度分布,但是不同处理间彼此的丰度差异没有很好地表现出来。
2.5.2 样本群落比较分析
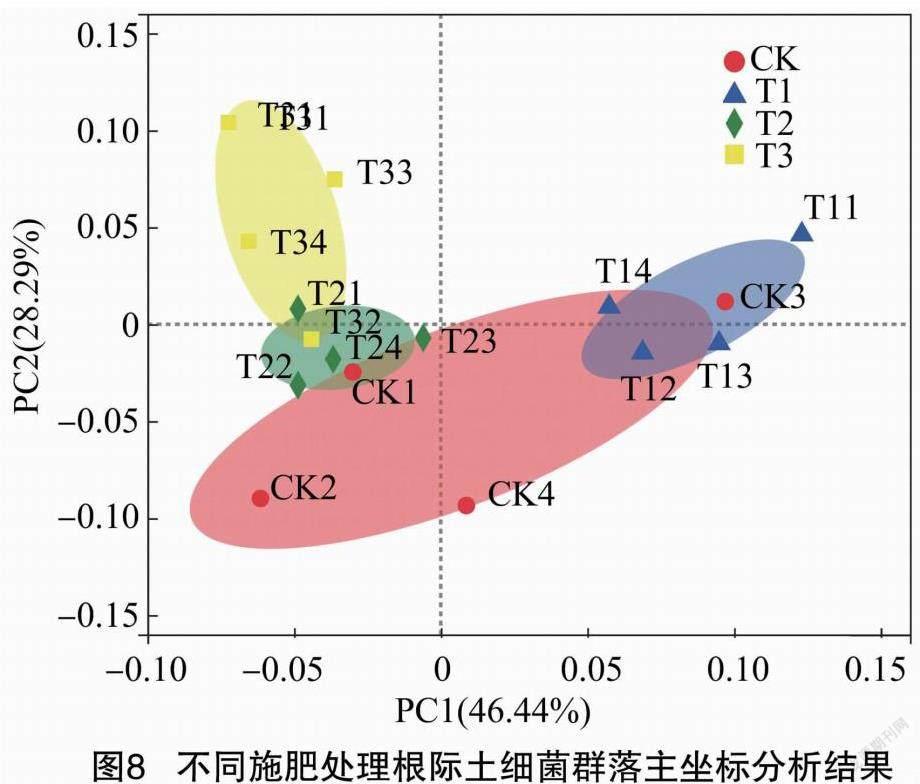
基于门水平对不同施肥处理的根际土壤细菌群落进行主坐标分析(图8),组间差异达到显著水平(P=0.001),主成分1(PC1)和主成分2(PC2)是降维提取出的对细菌群落结构作用最大的前2个主成分,贡献率分别达到46.44%和28.29%。同CK的土壤样本点相比,其余3个施肥处理的样本点与其呈现不同程度的分离,T1、T2处理与CK的根际土细菌群落结构具有一定的相似性,T3处理的根际土细菌群落结构与常规施肥处理发生明显的分离效应。对于T1处理,土壤样本的分布态势向PC1轴右上方向分布;根际土壤细菌群落结构对于T3处理和T2处理的响应模式是不同的,土壤样本点沿着PC1轴左上移动分布,且T3处理的分布态势更加明显。这些结果表明,不同肥料的施用均不同程度改变了土壤细菌的群落结构,同时哈茨木霉菌剂配施高碳基肥优化了高碳基肥对根际土细菌群落结构的改善效果。
3 讨论与结论
本研究发现,施加哈茨木霉菌剂和高碳基肥均可不同程度改善植烟土壤的理化性质,还会显著提高高碳基肥料的效果。木霉菌可在土壤中传播和作物根系中定殖,能够有效改善土壤理化性质[23]。有研究报道,木霉菌会与土壤中的微生物互作,从而导致土壤中的氮、磷、钾得以释放和稳固[31]。高碳基肥为碱性肥料,其中有机质和生物炭占比较大,富含作物生长发育所需的各种营养成分,同时生物炭的多孔结构可吸附土壤中的營养成分,使其养分固持能力得到增强[18,32]。高碳基肥料中的生物炭可为土壤中的木霉菌提供繁殖发育的栖息地,同时木霉菌在土壤中促进某些微生物大量增殖后反过来作用于高碳基肥料,使土壤中的高碳基肥料得到充分吸收,促进了土壤中的信息交换和养分循环。所以,T3处理的效果最优,明显高于其余处理水平。
不同施肥处理的根际土细菌群落结构α多样性的变化趋势不同。统计分析结果显示,T1处理组的根际土细菌多样性相对较低,其余处理均高于T1处理组且存在显著差异,说明根际微生物的多样性受到哈茨木霉菌剂的影响,这是因为哈茨木霉促进某些细菌的生长发育,导致细菌群落个体大小或数量差异增大,群落均匀度降低,进而导致多样性指数减小[33]。T2处理组与CK虽无显著性差异,但还是稍有降低,这与范声浓等的研究结果[34]相似,说明高碳基肥料的施入对烤烟根际土细菌多样性指数无显著影响。哈茨木霉菌剂配施高碳基肥后与对照组仍无显著性差异,这就说明根际细菌群落结构α多样性指数在高碳基肥和哈茨木霉菌剂间存在互作效应。
烟草根际土中,门水平上相对丰度发生明显改变的细菌在不同施肥处理间表现不同。烟草根际土门水平的优势细菌依次为放线菌门、变形菌门、绿弯菌门和酸杆菌门,它们的丰度占细菌总丰度的80%以上,这与杨焕焕等在烟草中的研究结果[35]一致。施用哈茨木霉菌剂后放线菌门、酸杆菌门和芽单胞菌门的相对丰度发生显著或极显著的改变;施用高碳基肥料和哈茨木霉菌剂配施高碳基肥后放线菌门、酸杆菌门、变形菌门、拟杆菌门、髌骨细菌门和厚壁菌门的相对丰度发生显著或极显著的改变,而且哈茨木霉菌剂配施高碳基肥的改变效果高于单独施用高碳基肥料。通过LefSe分析计算可知,不同施肥处理根际土壤关键微生物的种群类别不同,且对不同施肥处理的响应也存在差异,这和以往的研究结果[36]有相似之处。生物炭影响细菌菌群相对丰度变化的原因复杂且各不相同,还需更进一步研究。
由β多样性分析结果可知,不同施肥处理的根际细菌群落结构间存在明显差异,与对照组的土壤样本相比,3个施肥处理的根际细菌群落结构呈现明显的分离,且T3处理的根际土细菌群落结构呈完全分離效应,T2处理的响应模式与T3处理相似,但响应程度不及T3处理。说明哈茨木霉菌剂与高碳基肥可发生互作,哈茨木霉菌剂配施高碳基肥可优化提高高碳基肥对根际土细菌群落结构的改善效果。
综上可知,哈茨木霉菌剂配施高碳基肥可显著改良烤烟土壤的理化性质。根际土细菌群落结构α多样性指数在哈茨木霉菌剂和高碳基肥间存在互作效应。同时,不同施肥处理根际土壤关键微生物的种群类别不同且对不同施肥处理的响应也存在差异。哈茨木霉菌剂和高碳基肥的根际土细菌群落结构明显不同,其二者之间的响应模式也不同,哈茨木霉菌剂与高碳基肥可发生互作,且互作效果更佳。
参考文献:
[1]冯 林,申 涛,徐一飞,等. 土壤微生物对植物生长的作用[J]. 种子科技,2019,37(15):110,112.
[2]朱永官,沈仁芳,贺纪正,等. 中国土壤微生物组:进展与展望[J]. 中国科学院院刊,2017,32(6):554-565,542.
[3]黄新琦,蔡祖聪. 土壤微生物与作物土传病害控制[J]. 中国科学院院刊,2017,32(6):593-600.
[4]Frc M,Hannula S E,Beka M,et al. Fungal biodiversity and their role in soil health[J]. Frontiers in Microbiology,2018,9:707.
[5]Chen S C,Sun G X,Yan Y,et al. The Great Oxidation Event expanded the genetic repertoire of arsenic metabolism and cycling[J]. Proceedings of the National Academy of Sciences of the United States of America,2020,117(19):10414-10421.
[6]Diatta A A,Fike J H,Battaglia M L,et al. Effects of biochar on soil fertility and crop productivity in arid regions:a review[J]. Arabian Journal of Geosciences,2020,13(14):1-17.
[7]Yao Q,Liu J J,Yu Z H,et al. Three years of biochar amendment alters soil physiochemical properties and fungal community composition in a black soil of northeast China[J]. Soil Biology and Biochemistry,2017,110:56-67.
[8]Dai Z M,Xiong X Q,Zhu H,et al. Association of biochar properties with changes in soil bacterial,fungal and fauna communities and nutrient cycling processes[J]. Biochar,2021,3(3):239-254.
[9]Yu X N,Zhou H J,Ye X F,et al. From hazardous agriculture waste to hazardous metal scavenger:tobacco stalk biochar-mediated sequestration of Cd leads to enhanced tobacco productivity[J]. Journal of Hazardous Materials,2021,413:125303.
[10]Yan T T,Xue J H,Zhou Z D,et al. Biochar-based fertilizer amendments improve the soil microbial community structure in a karst mountainous area[J]. The Science of the Total Environment,2021,794:148757.
[11]Zhang Y,Zhao C C,Chen G L,et al. Response of soil microbial communities to additions of straw biochar,iron oxide,and iron oxide-modified straw biochar in an arsenic-contaminated soil[J]. Environmental Science and Pollution Research International,2020,27(19):23761-23768.
[12]Alaylar B,Güllüce M,Egamberdieva D,et al. Biochar mediated control of soil-borne phytopathogens[J]. Environmental Sustainability,2021,4(2):329-334.
[13]Cao H,Jia M F,Xun M,et al. Nitrogen transformation and microbial community structure varied in apple rhizosphere and rhizoplane soils under biochar amendment[J]. Journal of Soils and Sediments,2021,21(2):853-868.
[14]Shen G H,Zhang S T,Liu X J,et al. Soil acidification amendments change the rhizosphere bacterial community of tobacco in a bacterial wilt affected field[J]. Applied Microbiology and Biotechnology,2018,102(22):9781-9791.
[15]Rose D,Sharma G,Rawat S. Impact of rice-husk biochar on Colletotrichum falcatum,the pathogen of sugarcane red rot disease[J]. Indian Phytopathology,2022,75(2):325-329.
[16]楊永锋,张子颖,刘国顺,等. 高碳基肥料配施绿色木霉对烤烟香气品质的影响[J]. 烟草科技,2020,53(3):27-35.
[17]方 明,殷全玉,吴文信,等. 高碳基肥料配施微生物菌剂对烟叶综合性状的影响[J]. 现代农业科技,2021(12):12-14,18.
[18]苏梦迪,马 啸,胡丽涛,等. 高碳基肥减氮施用对土壤肥力和细菌多样性的影响[J]. 农业生物技术学报,2022,30(6):1174-1185.
[19]李怡博,翟春贺,苏梦迪,等. 微生物肥与高碳基肥配施对植烟土壤微生物数量和土壤肥力的影响[J]. 烟草科技,2021,54(4):23-32.
[20]孟素玲,田彦梅,顾 欣,等. 木霉的协同防病作用研究进展[J]. 中国生物防治学报,2022,38(3):739-747.
[21]祝 静,于 存. 长枝木霉菌肥对玉米生长、土壤肥力和根际微生物的影响[J]. 生物技术通报,2022,38(4):230-241.
[22]Cao X,Zhang N,Zeng X Y,et al. Effects of biochar and Trichoderma on bacterial community diversity in continuous cropping soil[J]. Horticulture,Environment,and Biotechnology,2022,63(1):1-12.
[23]Sarangi S,Swain H,Adak T,et al. Trichoderma-mediated rice straw compost promotes plant growth and imparts stress tolerance[J]. Environmental Science and Pollution Research,2021,28(32):44014-44027.
[24]Fu J,Xiao Y,Wang Y F,et al. Trichoderma affects the physiochemical characteristics and bacterial community composition of saline-alkaline maize rhizosphere soils in the cold-region of Heilongjiang Province[J]. Plant and Soil,2019,436(1/2):211-227.
[25]Pang G,Cai F,Li R X,et al. Trichoderma-enriched organic fertilizer can mitigate microbiome degeneration of monocropped soil to maintain better plant growth[J]. Plant and Soil,2017,416(1/2):181-192.
[26]Zhang F G,Huo Y Q,Xu X X,et al. Trichoderma improves the growth of Leymus chinensis[J]. Biology and Fertility of Soils,2018,54(6):685-696.
[27]Cai F,Chen W,Wei Z,et al. Colonization of Trichoderma harzianum strain SQR-T037 on tomato roots and its relationship to plant growth,nutrient availability and soil microflora[J]. Plant and Soil,2015,388(1/2):337-350.
[28]张 珂,刘国顺,王国峰,等. 高碳基肥对舞阳烟区土壤特性和烟叶品质形成的影响[J]. 江西农业学报,2016,28(12):52-56.
[29]冯慧琳,徐辰生,何欢辉,等. 生物炭对土壤酶活和细菌群落的影响及其作用机制[J]. 环境科学,2021,42(1):422-432.
[30]鲁如坤. 土壤农业化学分析方法[M]. 北京:中国农业科学技术出版社,2000.
[31]赵忠娟,杨 凯,扈进冬,等. 盐胁迫条件下哈茨木霉ST02对椒样薄荷生长及根区土壤理化性质的影响[J]. 生物技术通报,2022,38(7):224-235.
[32]Warnock D D,Lehmann J,Kuyper T W,et al. Mycorrhizal responses to biochar in soil-concepts and mechanisms[J]. Plant and Soil,2007,300(1/2):9-20.
[33]烏英嗄,张贵龙,赖 欣,等. 生物炭施用对华北潮土土壤细菌多样性的影响[J]. 农业环境科学学报,2014,33(5):965-971.
[34]范声浓,王烁衡,于良君,等. 生物炭对杧果根系生长、土壤养分和微生物群落的影响[J]. 云南农业大学学报(自然科学版),2022,37(4):692-702.
[35]杨焕焕,李茂森,王丽渊,等. 生物炭对烤烟成熟期土壤养分及根际细菌群落结构的影响[J]. 华中农业大学学报,2021,40(5):62-71.
[36]殷全玉,刘健豪,方 明,等. 高碳基肥配施菌剂对植烟土壤化学性质及微生物的影响[J]. 湖南农业大学学报(自然科学版),2019,45(5):501-506.
