西瓜葫芦素E变化规律及其相关基因关联分析
2023-05-22栾非时曹瀚澜刘树森宋正峰刘宏宇
栾非时 ,曹瀚澜 ,高 鹏 ,刘 识 ,刘树森 ,刘 钊,宋正峰,刘宏宇
(1.农业农村部东北地区园艺作物生物学与种质创制重点实验室,哈尔滨 150030;2.东北农业大学园艺园林学院,哈尔滨 150030;3.山东省寿光市三木种苗有限公司,山东 寿光 262704;4.潍坊科技学院农学与环境学院,山东 寿光 262799)
西瓜(Citrullus lanatus)作为一种重要水果型蔬菜作物,在世界园艺产业中占有重要地位。苦味是影响西瓜品质重要因素之一,在西瓜生长过程中,高温、干旱、虫害及自身遗传因素均可使其果实变苦,这种苦味是由一种名为葫芦素(Cucurbitacin)的四环三萜类化学物质导致[1]。除西瓜外,在葫芦科甜瓜[2]、籽瓜[3]和南瓜[4]中均发现葫芦素。葫芦科植物相关研究发现,葫芦素作为一种苦味源,可抵御不良环境侵害,增强植物抗虫性,也与植物响应机械损伤有关[5]。苦味影响西瓜商品价值,但在医学方面,葫芦素E 表现出良好药用潜力。现代研究表明,葫芦素E具有抗肿瘤和保肝消炎等多种生物学活性[6]。
西瓜苦味主要集中在根、茎蔓和果实中,Rehm 等对葫芦科植物种子发芽后各部位进行葫芦素定性分析,发现西瓜幼苗中主要含有的葫芦素为葫芦素E[7];Lavie等发现西瓜属药西瓜果实中葫芦素主要为E、I、L[8],同属西瓜属的籽瓜浓缩汁中含有葫芦素E[3],Zhou 等研究也表明,西瓜果实中主要含有的葫芦素为葫芦素E[9]。
在葫芦素合成代谢途径上较为重要的酶包括氧化角鲨烯环化酶基因、细胞色素P450 基因家族和乙酰转移酶基因。目前细胞色素P450 基因和乙酰转移酶基因在南瓜[10]、柑橘[11]、甜瓜[12]和大豆[13]中被广泛研究。学者在西瓜基因组中鉴定得到一个MATE转运蛋白基因ClMATE1,该基因与葫芦素合成基因成簇分布,且被已发现的葫芦素调控因子直接调控,其产生的蛋白可运输葫芦素E[14];Gurudeeban等在苦味药西瓜(Citrullus colocynthis)材料根中发现葫芦二烯醇合成酶相关合成代谢基因表达[15],杨铭慧在西瓜属药西瓜叶片中克隆出与葫芦素E生物合成相关的乙酰转移酶基因[16];黄三文发现在西瓜1号染色体上控制葫芦素E合成的两个bHLH 转 录 因 子 基 因ClBr(Cla011510)和ClBt(Cla011508),其中ClBr 在西瓜根中表达,ClBt 在西瓜果实中表达[17]。研究葫芦素合成和调控对提高蔬菜作物经济价值和深入研究葫芦素医用价值具有重要理论与实践意义。
本研究通过高效液相色谱法测定西瓜不同发育时期果实、叶片和茎蔓中葫芦素E含量,确定葫芦素E积累关键时期。结合葫芦科基因组数据库挖掘西瓜葫芦素E 合成代谢相关基因,利用前期构建的西瓜转录组数据结合qPCR对葫芦素合成代谢通路上的氧化角鲨烯环化酶(OSC)基因(Cla007080),细 胞 色 素P450 基 因(Cla007077、 Cla007078、Cla007079、Cla007082、Cla008354、Cla008355),乙酰转移酶(ACT)基因(Cla007081)和参与调控西瓜苦味素合成的转录因子基因ClBt(Cla011508)分析不同时期表达量,确定影响西瓜葫芦素E积累及代谢关键基因,为阐明西瓜苦味形成机理、选育果实无苦味西瓜品种及后续分子设计育种奠定基础。
1 材料与方法
1.1 植物材料
1.1.1 材料来源
本试验选择3个田间苦味鉴定结果不同西瓜纯合品系材料:①苦味西瓜(“PI 186490”),为黏籽西瓜品系,果实圆形,果皮为深绿色,白色果肉具有极端苦味,果肉及果皮致密硬实,由美国农业部农业研究属南部研究中心提供;②甜味西瓜(Cream of Saskatchewan,“COS”),浅黄色果肉具有甜味,外皮绿色具深绿色条纹,果实球形,果实质地疏松;③无味西瓜(“1553”),橙色果肉,外皮浅绿色无条纹,果肉无明显风味,质地较为坚硬。为保持果实生长趋势一致,所有品系材料统一定植于黑龙江省哈尔滨市东北农业大学向阳试验示范基地,将每个西瓜品种5周苗龄幼苗同时移植至塑料大棚内。
本试验结合前期通过其他西瓜材料构建的转录组数据挖掘葫芦素E代谢相关关键基因以进一步探究其表达水平变化规律,其他西瓜材料来源如下:①三白瓜,果实为长圆形,白色果肉味甜,果肉较软,果皮呈白色;②“W1-1”,果实圆形,果皮浅绿色覆深绿色条纹,果肉红色味甜;③“W1-92”,果实圆形,果皮深绿色,果实质地疏松,果肉味甜。
以上西瓜材料均由东北农业大学西甜瓜分子遗传育种实验室提供。
1.1.2 田间试验设计
试验采用随机区组设计,共分3个小区,总种植面积为90 m2。每份材料种植3 次重复,每个重复20 株,株距70 cm,行距60 cm。每个小区两侧设20 cm保护行。采用常规方式进行田间管理,整枝方式采用双蔓整枝法,每株留1个瓜,采用统一栽培管理措施及水肥供给。
自授粉后第10、18、26、34、42 及50 天设置6个采样时期分别取果肉样品,在每个品种每个发育阶段收集3个具有相似发育状态且无机械损伤西瓜果实,用于后续试验使用。将收获果实横切,从果实横切面中心及四周共5个部位混合采取果肉样品,共5 g,再取果实下方功能叶2 g和果柄处茎蔓材料2 g用锡箔纸包裹立即在液氮中冷冻,储存在-80 ℃下用于葫芦素测定。在另一半果实相同位置选取相同位置及重量果肉冻干后用于总核糖核酸(RNA)测定。
1.2 葫芦素含量测定
葫芦素含量测定依据张雅男等方法并加以改进[18]。本试验采用高效液相色谱系统,检测果肉样品中葫芦素E 含量,流动相为水(溶剂A)和乙腈(溶剂B),乙腈-水-冰醋酸(50:50:0.01,V/V)。紫外波长为234 nm。流速为0.5 mL·min-1,进样量为10 μL,葫芦素E 标准品购自Sigma 公司。研磨2 g样品后,将其溶解于5 mL 甲醇中,超声溶解30 min,在注入前通过0.45 μm 滤膜过滤溶液,以上所有试剂均为色谱纯。采用zorbaxsb-C18 色谱柱(5 μm,4.6 mm×100 mm,Agilent)在高效液相色谱系统(Waters 公司)上作色谱分析,柱温保持在室温。每个平行试验3次,每个色谱峰峰面积代表葫芦素E相对含量,配制不同浓度梯度葫芦素E标准品溶液,获取不同浓度标准品所对应的色谱峰强度数据,以对照品含量为横坐标(X),对照品色谱峰积分面积为纵坐标(Y),得葫芦素E 回归方程Y=2.47×107X-22543.52,r=0.9998,线性关系良好。将所有检测到的葫芦素E 峰面积代入回归方程,计算每个样品中葫芦素E绝对含量。根据3次独立生物学试验平均值计算样品中葫芦素E 含量,试验误差<10%,试验结果使用SPSS 26.0数据统计分析软件分析显著性,得出最终结论。
1.3 实时荧光定量PCR
1.3.1 RNA提取及cDNA合成
RNA 提取使用诺禾致源(Novogene,北京)RNA 提取试剂盒,参照说明书操作。提取后总RNA 用1%(W/V)琼脂糖凝胶电泳检测,使用Rever Tra Ace qPCR 反转录试剂盒(TOYOBO,大阪,日本)合成cDNA。将制备反应体系在37 ℃下孵育15 min,在98 ℃酶失活。反转录之后cDNA置于-20 ℃冰箱用于实时荧光定量PCR。
1.3.2 qRT-PCR表达量分析
9个与葫芦素E合成代谢相关酶基因(Cla007077、Cla007078、Cla007079、Cla007080、Cla007081、Cla007082、Cla011508、Cla008354、Cla008355)实时荧光定量PCR(qRT-PCR)引物根据Grassi 等由Primer 6.0 软件设计[19],经上海生工生物工程公司合成。引物序列、CuGenDB(Cucurbit Genomics Database:葫芦科基因组数据库)登录号见表1。

表1 qPCR 反应所用引物序列Table 1 Primer sequence for qPCR reaction
荧光数据统计用Microsoft®Excel 2016 软件,以西瓜Actin(Cla020175)为内参,所有材料荧光定量分析以其授粉后第10天表达量作为参照,相对表达量计算用2-△△CT法计算[20],每个目的基因分别进行3 次生物和技术重复,采用Orign 8.6 作图,使用Graphpad prism 9 作单因素方差分析(ANOVA)以分析显著性。
1.4 分子进化树构建
利用葫芦科数据库(http://cucurbitgenomics.org/),搜索葫芦科不同物种中西瓜葫芦素E代谢合成相关基因同源基因氨基酸序列,运用MEGA 7.0软件,通过Maximum-Likelihood 法构建分子进化树,Bootstrap值设为1 000。
2 结果与分析
2.1 西瓜材料中葫芦素E定量分析
本研究中所采用西瓜材料在成熟期表现出显著不同的葫芦素E含量,在3个西瓜材料不同部位(果实、叶片和茎蔓)中,仅有“PI 186490”西瓜果肉和叶片中检测到葫芦素E(见图1),其他西瓜材料果肉、叶片和茎蔓中均未检测到葫芦素E。“PI 186490”在授粉后不同时期西瓜果实中葫芦素E含量差异较大,授粉后10 d时西瓜果实中葫芦素E含量显著高于授粉后18 d,授粉后10~26 d西瓜果实中葫芦素E含量急剧下降。在授粉后34~50 d,葫芦素E含量逐渐上升,最终接近授粉后10 d时葫芦素E含量。西瓜叶片中葫芦素E 含量同样具有明显差异,授粉后10 d 时葫芦素E 含量显著高于授粉后18 d,自授粉后10 d至授粉后34 d达到最低值,但在授粉后42 d时叶片中葫芦素E含量显著升高。授粉后18 d西瓜材料果实和叶片中葫芦素E含量变化相比于授粉后10 d均显著下降,但授粉后26~34 d果实葫芦素E含量显著升高,叶片中葫芦素E含量显著降低,授粉后34 d可能是西瓜果实中葫芦素E积累关键时期。
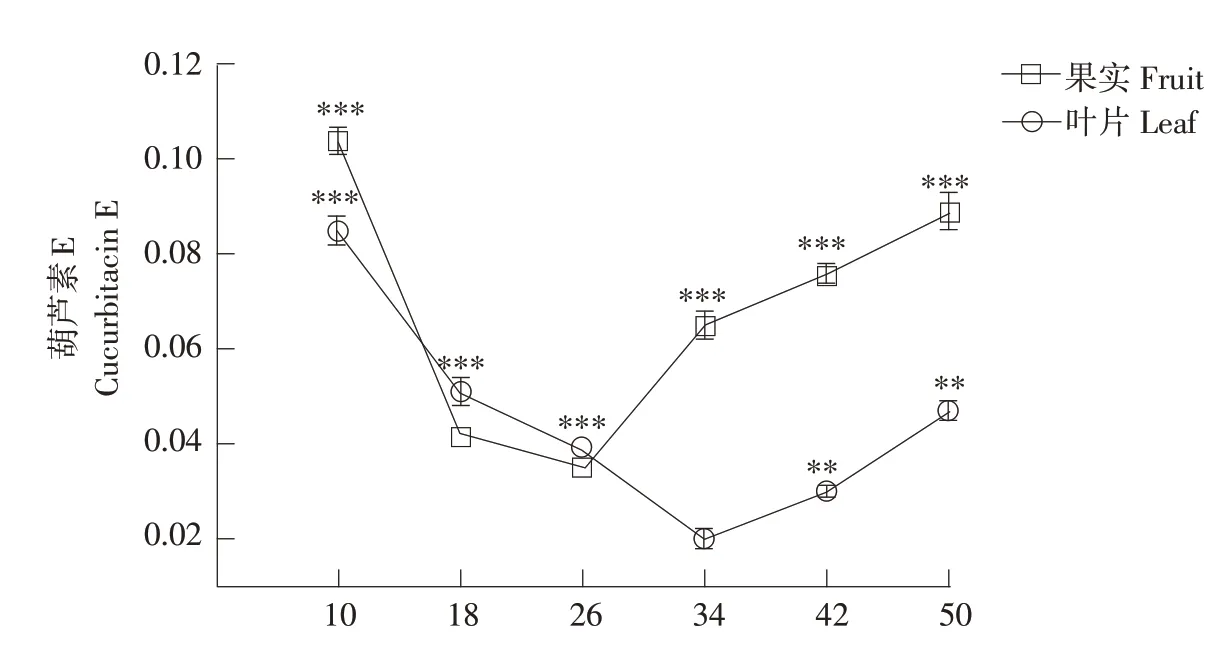
图1 “PI 186490”不同部位葫芦素E含量Fig.1 Content of cucurbitacin E in different parts of"PI 186490"
2.2 葫芦素E代谢过程中关键基因表达分析
本研究在6 个不同发育时期(授粉后10、18、26、34、42 和50 d)对3 份苦味鉴定结果不同西瓜材料进行取样,选取参与葫芦素E合成代谢相关酶的9 个基因:氧化角鲨烯环化酶OSC基因(Cla007080),细胞色素P450 基因(Cla007077、Cla007078、Cla007079、Cla007082、Cla008354、Cla008355),乙酰转移酶ACT基因(Cla007081)和参与调控西瓜苦味素合成的转录因子基因ClBt(Cla011508)进行实时荧光定量PCR分析。
随授粉后西瓜果实不断发育(见图2~3),在甜味瓜“COS”中OSC基因Cla007080 表达水平在授粉后10~18 d 显著下调表达,在无味瓜“1553”中OSC基因在发育初期表达水平显著高于成熟期。在苦味瓜“PI 186490”中OSC基因在授粉后34 和50 d 表达水平显著高于其他时期,授粉后34 和50 d 可能是葫芦素E积累相关基因表达调控关键时期。

图2 葫芦素E合成代谢酶相关基因在“COS”和“1533”中不同发育时间点表达量变化Fig.2 Expression of cucurbitacin E anabolic enzyme related genes in"COS"and"1553"
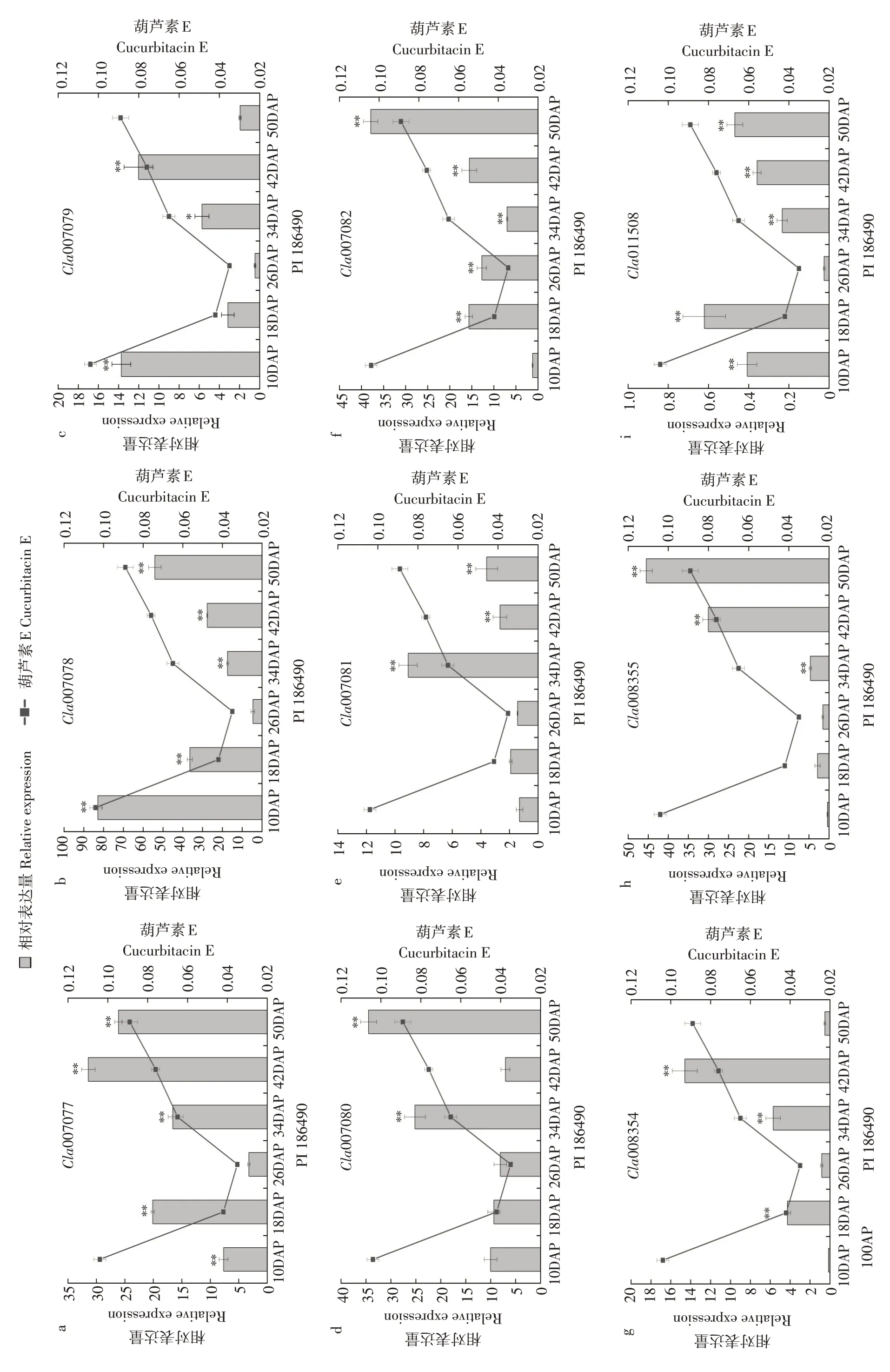
图3 葫芦素E合成代谢酶相关基因在“PI 186490”中不同发育时间点表达量和葫芦素E含量变化对比分析Fig.3 Comparative analysis of the expression of cucurbitacin E anabolic enzyme related genes and content of cucurbitacin E at different developmental time points in"PI 186490"
在CYP450家族各基因中,Cla007077、Cla007078、Cla007079 和Cla007082 在苦味瓜“PI 186490”中表达水平趋势与其果实中葫芦素E积累水平趋势呈较好相关性,在甜味瓜“COS”中该家族基因与ACT基因Cla007081表达水平趋势相似,在发育初期表达水平高于发育后期。在苦味瓜中Cla007078表达水平趋势与葫芦素E 积累水平趋势一致,且ACT基因在授粉后34 d 表达水平远高于其他发育时期,进一步验证授粉后34 d 可能是葫芦素E 积累关键时期。
在甜味瓜“COS”和无味瓜“1553”中,Cla008354和Cla008355两个同源基因表达水平趋势相似,在授粉后10~26 d表达水平逐渐降低,随后直到果实成熟期间表达水平逐渐升高。但在苦味瓜“PI 186490”中Cla008355 在成熟期的表达水平显著高于Cla008354,Cla008355的表达水平从授粉后26 d到授粉后50 d期间表达显著上调,最终达到峰值。
在苦味瓜“PI 186490”中,参与调控西瓜葫芦素E 合成的转录因子基因ClBt(Cla011508)表达水平趋势和葫芦素E积累水平趋势相同,区别为ClBt在授粉后10~18 d 表达水平上调。在甜味瓜“COS”中ClBt在发育初期和发育后期表达水平显著高于发育中期,ClBt表达水平峰值在授粉后42 d 出现。在无味瓜“1553”中转录因子基因ClBt、ACT基因和CYP450家族基因在不同发育时期规律不明显。
2.3 葫芦素E 合成代谢相关酶基因在其他西瓜果肉材料中的表达分析
随着技术进步,转录组技术已被广泛应用于西瓜果肉材料基因表达调控研究中,葫芦素E合成代谢相关酶基因在其他西瓜果肉材料中表达水平趋势也有助于分析目的基因,本研究结合前期通过其他西瓜材料构建的转录组数据挖掘葫芦素E代谢相关酶基因进一步探究其表达水平变化规律。
本研究在转录组数据中抽取葫芦素E合成代谢相关酶基因信息[21],分析其在“PI 186490”和“三白瓜”中表达情况,结果如图4 所示。在苦味瓜“PI 186490”中,除Cla008355 和转录因子基因ClBt外其他基因表达水平趋势一致,授粉后14~35 d表达量下调,至授粉后49 d 显著上升至峰值,上调趋势迅速,这一结果同本研究中苦味瓜葫芦素E含量变化趋势一致。Cla008355 和ClBt随果实成熟表达量逐渐上调,授粉后14~35 d表达水平上调趋势缓慢,在发育后期即授粉后35~49 d上调迅速。所有葫芦素E 合成代谢相关酶基因在“PI 186490”的表达水平均显著高于非苦味的“三白瓜”。“三白瓜”中细胞色素P450 基因Cla007077、Cla007078 和Cla007079 在果实发育初期即授粉后14 d 表达水平显著高于发育后期,其他基因则相反,发育后期基因表达水平较高,转录因子基因ClBt在“三白瓜”中不表达。
本研究在转录组数据中重点查看葫芦素E合成代谢相关酶基因在“PI 186490”和“W1-1”中表达情况[22],结果如图5 所示。CYP450 基因(Cla007077、Cla007078、Cla007079、Cla007082 和Cla008354)和ACT基因Cla007081在苦味瓜“PI 186490”中表达水平趋势同本研究中苦味瓜葫芦素E 的含量变化趋势相同,授粉后7 d表达水平远高于其他发育时期,授粉后7~14 d 显著下降,授粉后14 d 随果实发育表达水平逐渐升高,在发育后期到达峰值。9个和葫芦素E 合成代谢相关酶基因在“PI 186490”的表达量远高于“W1-1”。在甜味瓜“W1-1”中,所有基因除Cla008355外在发育初期均显著高于发育后期。转录因子基因ClBt未在甜味瓜中检测出表达。

图5 葫芦素E合成代谢酶相关基因在“W1-1”与“PI 186490”中不同发育时间点表达量变化Fig.5 Expression changes of cucurbitacin E anabolic enzyme related genes at different developmental time points in"W1-1"and"PI 186490"
本研究利用该转录组数据重点分析葫芦素E合成代谢相关酶基因在“PI 186490”“COS”和“W1-92”中表达情况[23],结果如图6 所示。苦味瓜“PI 186490”中除Cla008355 和转录因子基因ClBt(Cla011508)外,所有葫芦素E 合成代谢酶相关基因的表达水平趋势均与本研究中苦味瓜葫芦素E积累趋势相似,发育初期基因表达水平较高,在发育中期下调,随后在发育后期上调。ClBt的表达水平自授粉后随着果实成熟表达量逐渐上调,在成熟期达到峰值。在甜味瓜“COS”中葫芦素E 合成代谢酶相关基因表现出与本研究相同的基因表达水平趋势,在发育初期表达水平远高于发育后期。在甜味瓜“W1-92”中,OSC基因Cla007080和 部 分CYP450 基 因(Cla007077、Cla007078、Cla007079 和Cla007082)同甜味瓜“COS”表达水平趋势相似,其他基因则无明显规律。转录因子基因ClBt同样未在两个甜味瓜材料中检测到表达。
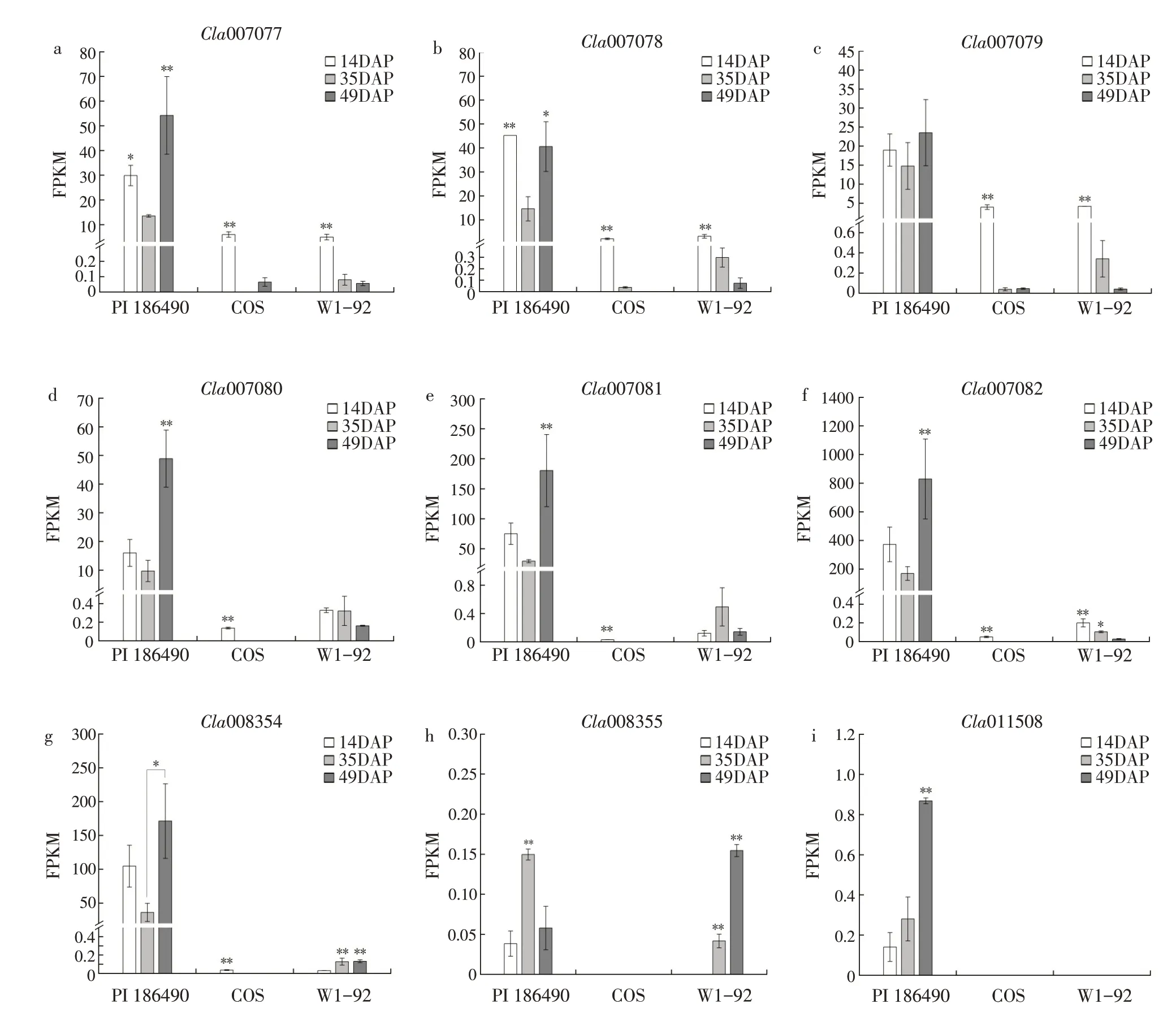
图6 葫芦素E合成代谢酶相关基因在“PI 186490”“COS”和“W1-92”中不同发育时间点的表达量变化Fig.6 Expression changes of cucurbitacin E anabolic enzyme related genes at different developmental time points in"PI 186490""COS"and"W1-92"
2.4 葫芦科不同物种葫芦素E 代谢酶相关基因分子进化树构建
将筛选得到的葫芦科不同物种葫芦素E代谢酶相关基因蛋白质,运用MEGA 7.0 软件,通过Maximum-Likelihood法作序列比对分析且构建分子进化树。如图7 所示,葫芦科植物中葫芦素E合成代谢相关基因同源基因可分为3类。

图7 葫芦科不同物种中葫芦素E合成代谢酶相关基因氨基酸序列发育树Fig.7 Developmental tree of cucurbitacin E anabolic enzyme related genes amino acid sequence in different species of Cucurbitaceae
在第1 类中,西瓜OSC基因Cla007080、南瓜CmaCh17G013880和甜瓜MELO3C022374所表达蛋白质氨基酸序列高度相似,西瓜ACT基因Cla007081、冬瓜Bhi12G002104 和南瓜CmaCh08G000350 所表达蛋白质序列也高度相似,说明这些基因在葫芦科各物种间存在高度同源关系。在第2 类中,西瓜细胞色素P450 基因(Cla007078、Cla008354、Cla008355)与甜瓜、黄瓜和冬瓜中的同源基因蛋白质氨基酸序列高度相似,说明其蛋白质功能相似。在第3类中,西瓜Cla007082与南瓜CmaCh08G000340所表达蛋白质亲缘关系最近。
2.5 葫芦素E 合成代谢酶相关基因在西瓜材料中序列比对
前期本课题组已对西瓜核心种质进行重测序,为探索苦味瓜“PI 186490”和非苦味瓜“COS”中葫芦素E 合成代谢酶相关基因单核苷酸多态性(SNP)位点突变情况,本研究抽取“PI 186490”和“COS”中相关基因重测序数据并与参考基因组作比对(见图8)。
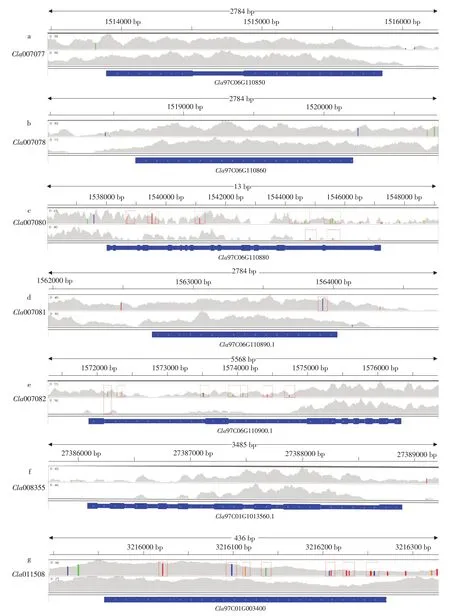
图8 葫芦素E合成代谢酶相关基因在西瓜材料中SNP位点突变情况Fig.8 Mutation of cucurbitacin E anabolic enzyme related gene at SNP site in watermelon materials
其中Cla008354 和Cla007079 未比对成功,Cla007077、Cla007078和Cla008355在西瓜材料中未发生突变,而Cla007080、Cla007081 和Cla007082存在少数杂合突变和纯合突变。Cla011508在苦味瓜“PI 186490”中存在较多突变,但在“COS”中未存在突变情况。
3 讨论
3.1 葫芦素E合成代谢途径
通过研究不同葫芦科作物中葫芦素合成代谢关键酶基因,发现葫芦素生物合成主要是通过甲经戊酸(MVA)合成途径[24],首先MVA 经一系列合成代谢生成角鲨烯(SQ),SQ 通过角鲨烯环氧化酶(SE)生成2,3-氧化角鲨烯(OSQ)。在葫芦素生物合成中第一个重要酶是氧化角鲨烯环化酶(OSC),其催化葫芦素生物合成第一步,葫芦素生物合成中2,3-氧化角鲨烯受OSC催化而形成三萜类化合物基本骨架葫芦二烯醇,该途径可通过OSC 基因家族不同成员的表达用于产生其他三萜类化合物[25]。在基本骨架形成以后,还需经过羟基化、乙酰化和葡萄糖基化等步骤,最后葫芦二烯醇经由细胞色素P450 基因家族及ACT 基因等基因作用下,经不同氧化和异构生成结构不同的葫芦素[26]。
3.2 葫芦素E变化规律
研究发现,西瓜中主要葫芦素是葫芦素E[7-9],葫芦素E 在西瓜植株内积累的关键时期尚不明晰。本研究对3种苦味鉴定结果不同的西瓜材料测定葫芦素E,由图1 可知,西瓜不同部位中葫芦素E 含量呈相似积累趋势,在苦味西瓜“PI 186490”发育初期西瓜果实和叶片中葫芦素E 含量较高,在发育中期骤然减少后随发育时期逐渐增加直至峰值,授粉34 d 可能是西瓜果实中葫芦素E 积累关键时期。在甜味西瓜“COS”和无味西瓜“1553”果实和叶片中未检测到葫芦素E,3 种西瓜材料茎蔓中不含葫芦素E。周渊研究表明[27],ACT 基因产物以葫芦素Ⅰ作底物,乙酰辅酶A 为乙酰基供体,催化生成葫芦素E,证明在西瓜植株内不同发育时期可能存在多种互相转化的葫芦素及其糖苷,本研究在苦味西瓜发育中期葫芦素E含量骤减可能是此原因造成的。因此推测在苦味西瓜发育中期,果实中葫芦素E随果实发育和相关基因催化形成葫芦素E 糖苷、其他种类葫芦素或其他三萜类化合物。另一种推测为在果实发育中期西瓜植株从根部向土壤中外排葫芦素E以增强抗病性及为避免合成的葫芦素E过度积累对植株本身产生毒性[14],尚待进一步证实。
3.3 葫芦素E相关基因表达量分析
在葫芦科黄瓜属中关于葫芦素分子标记及精细定位的相关报道较多,研究也较为深入。研究发现,黄瓜苦味由黄瓜中葫芦素C引起。李宗扬研究发现黄瓜果实苦味基因Bt被定位在黄瓜5号染色体上,控制植株苦味物质合成[28]。Shang等通过研究发现一个由9个基因组成的葫芦素C生物合成模块,分析其中4种相关代谢合成酶,但葫芦素多样性遗传基础尚不清楚[29]。马永硕揭示9个基因负责黄瓜苦味物质葫芦素C 生物合成代谢路径[1]。前人研究表明,除Cla011508、Cla008355 和其同源基因Cla008354 在西瓜1号染色体上,其余CYP450基因家族、OSC 基因和ACT 基因均在6 号染色体上;成功验证西瓜中1个OSC基因(Cla007080)、3个细胞色素P450基因(Cla007077、Cla007079、Cla008355)和1 个乙酰转移酶基因ACT基因(Cla007081)的功能,但并未研究葫芦素E积累关键时期[27]。
苦味瓜“PI 186490”中葫芦素E 合成代谢酶相关基因表达模式与其果实及叶片中葫芦素E积累趋势一致。ClBt 基因(Cla011508)和细胞色素P450 基因(Cla007077、Cla007078、Cla007079、Cla007082)表达水平在苦味瓜果实发育初期较高,发育中期逐渐降低,然后从中期逐渐上升达到峰值。OSC(Cla007080)和ACT 基因(Cla007081)在授粉后35 d表达量高于其他时期,Cla008355 和其同源基因Cla008354(氨基酸相似度87%)随果实发育表达水平逐渐上调,葫芦素E合成代谢酶相关基因表达在果实发育周期中存在规律。本研究筛选的基因中,Cla007078 表达水平与葫芦素E 变化规律一致,其余基因表达水平与葫芦素E变化规律也表现出一定相似性。本研究对无味瓜和甜味瓜葫芦素E代谢关键基因表达进行检测,发现非苦味西瓜果实发育初期关键基因表达水平相对发育后期较高,明显低于苦味瓜葫芦素E代谢关键基因表达水平。葫芦素E代谢关键基因表达水平趋势与葫芦素E积累趋势吻合,从而验证研究结论。
本研究结合前期通过其他西瓜材料构建的转录组数据挖掘葫芦素E代谢相关酶基因表达水平变化规律,发现葫芦素E合成代谢相关酶基因表达水平规律与前人转录组数据吻合,苦味西瓜“PI 186490”基因表达水平在发育初期较高,在发育中期下调后随发育直至果实成熟期间逐渐上调至峰值,甜味瓜在发育初期基因表达量远高于发育后期。表达水平在整个发育周期中呈现规律性,进一步证实本研究所筛选的该组基因可能是造成葫芦素E含量差异的主效基因。
4 结 论
本研究中,西瓜果实中葫芦素E积累关键时期为授粉后26~34 d。试验中所筛选的Cla007078 表达水平与葫芦素E含量变化规律一致,ACT和OSC基因在西瓜果实中葫芦素E积累关键时期表达量高于其他时期,故本研究初步推测Cla007078、ACT和OSC 基因为西瓜葫芦素E 合成代谢相关候选基因。细胞色素P450 酶基因家族、氧化角鲨烯环化酶基因、转录因子基因ClBt 和乙酰转移酶基因上调表达与西瓜果实中葫芦素E积累相关,基因表达水平与葫芦素E变化规律具有一定相关性。研究结果为进一步探索西瓜葫芦素E 积累相关基因功能,葫芦素药用潜力开发和西瓜果实无苦味品种选育奠定基础。
