中肋骨条藻和赫氏圆石藻生长过程中低分子量有机酸的产生动力学及其影响因素❋
2023-05-22刘晓娜李戈辉杨桂朋丁海兵
刘晓娜, 李戈辉, 陈 颖, 杨桂朋, 丁海兵❋❋
(1. 中国海洋大学化学化工学院, 海洋化学理论与工程技术教育部重点实验室, 山东 青岛 266100; 2. 青岛海洋科学与技术试点国家实验室 海洋生态 与环境科学功能实验室, 山东 青岛 266237; 3. 中国船舶工业系统工程研究院, 北京 100094)
低分子量有机酸(LMWOAs, low-molecular weight-organic acids)是海洋溶解有机物的重要组成部分[1],能够调节海水的pH值,海洋生物也将其作为可吸收利用的主要碳源之一[2]。其来源广泛,包括陆源输入、大气沉降、海洋生物的生产释放等[3]。藻类和微生物是水体中LMWOAs主要生产者。藻类在生长初期能够释放一些容易被生物体吸收的低分子量物质,如LMWOAs、氨基酸等[4];蓝藻在厌氧环境下能够产生乳酸、乙酸等LMWOAs[5];在沉积物间隙水中检测到较高浓度乙酸,主要源于微生物的厌氧呼吸和发酵等过程[6];缺氧海水中的产甲烷菌和还原产乙酸菌也可以产生LMWOAs[7]。海洋中LMWOAs浓度低、消耗速度快,且产生和消耗机制较为复杂,目前相关研究十分匮乏,特别是海洋藻类生长对海水LMWOAs影响的研究未见文献报道。藻类是海洋生态系统赖以生存的基础,探究海洋藻类生长与海水环境中LMWOAs的关系,有助于更深入地了解海洋有机碳循环及海洋酸化等过程。
颗石藻(Coccolithophore)隶属定鞭藻门(Haptophyta)、定鞭藻纲(Prymnesiophyceae),目前发现并记录在册的颗石藻有400多种[16],广泛分布在全球海域[17]。现在所见的大多数颗石藻属于异晶颗石藻,赫氏圆石藻(Emilianiahuxleyi)是其中的典型代表,其耐受海水压力和酸性的特点导致其在海底化石也较为常见[18]。赫氏圆石藻作为现代海洋中占主导地位的颗石藻[19],适宜生长在18~23 ℃,正常盐度的海水中[20]。研究表明,热带、温带及近岸海域,海水经过季节变化的垂直混合、海水层化、中心环流等过程,形成有利于颗石藻生长的环境,可使赫氏圆石藻形成优势藻种[21-23],容易形成藻华[24]。目前,赫氏圆石藻已经成为研究海洋碳循环的模式生物之一[25]。颗石藻不易溶解的碳酸钙(CaCO3)结构是深海碳酸盐的主要来源之一,对海洋中CaCO3生产量贡献约50%[26],在全球钙循环和碳循环中起重要作用[27-29]。赫氏圆石藻也被认为是海洋环境主要的方解石生产者[19],它们还能合成长链烯酮,指示其生长时期的水体温度,在古海洋学和古气候学研究中具有重要意义[30-31]。然而,到目前为止,赫氏圆石藻生长过程对海水LMWOAs影响的相关研究几乎没有文献报道。
本论文以海洋中两种代表性藻类中肋骨条藻和赫氏圆石藻为研究对象,通过设置不同灭菌状态和光暗周期,考察细菌共存和光照条件对它们生长过程的影响,追踪不同生长条件下两种藻生长过程中培养液LMWOAs含量、pH、叶绿素含量等参数的变化情况,探究藻类生长过程中LMWOAs的产生动力学及其影响因素。本研究有助于进一步了解海洋浮游微藻生命活动与海洋环境相互作用情况,为更加深入地掌握不同藻类大量繁殖形成的藻华,特别是赤潮等有害藻华对海水CO2系统和海洋有机碳组成的影响提供数据支持。
1 材料与方法
1.1 藻种和培养液
实验所用中肋骨条藻和赫氏圆石藻由中国海洋大学化学化工学院海洋界面化学实验室提供。用f/2培养液[32-33]对两种藻进行培养,培养液中所用海水采集自青岛石老人海域,并用0.45 μm醋酸纤维滤膜过滤,培养液用0.22 μm滤膜过滤。
1.2 藻类培养实验
1.2.1 藻类培养预实验 两种藻的生长状况、生长周期通过预实验确定,以便更好地计划正式的培养实验。预实验中,将中肋骨条藻分别接种至灭菌和未灭菌培养液中,分别设置3种光照条件进行培养,每日记录其生长状况,以掌握两种藻的生长周期。
灭菌组所用海水用手提式压力蒸汽灭菌锅(YXQ-SG46-280S,上海博迅)121 ℃高温灭菌30 min后加入灭菌的f/2培养液;未灭菌组海水直接加入f/2培养液。
设置培养箱(GXZ-250A,宁波江南仪器厂)光照强度4 000 Lx(冷白光源),温度(22±1) ℃。实验设置3种光暗周期,光暗比(L∶D)分别为18 h∶6 h,12 h∶12 h,6 h∶18 h。培养条件分别以A、B、C、D、E、F表示,如表1所示。
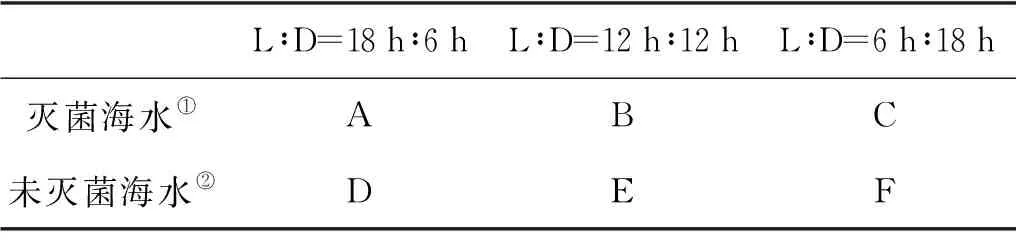
表1 中肋骨条藻和赫氏圆石藻的培养参数
取处于指数生长中期的中肋骨条藻藻液约1.5 mL接种到含培养液350 mL的锥形瓶(规格为500 mL)中,初始细胞密度约为1.25×104个·mL-1。每日定时摇藻,隔日定时取样,用血球计数板计数。25×16型血球计数板(型号:XB-K-25)规格为0.002 5 mm2,计数公式为:
细胞个数(mL-1)=(80个小方格细胞总数/80)×104×稀释倍数
根据每日统计的藻细胞数目计算细胞密度,并绘制生长曲线。
赫氏圆石藻培养方法同上,初始细胞密度约为1.00×104个·mL-1。
1.2.2 藻类连续培养实验 根据1.2.1中预实验的结果,设计连续培养实验。根据预实验确定的生长周期,对中肋骨条藻培养组设定取样时间为第2、6、10、14、18、21、25天,对赫氏圆石藻培养组取样时间设定为第2、6、10、14、17、21天。在相应的天数从对应的培养瓶中采集10 mL培养液于棕色玻璃瓶中,用0.22 μm的聚醚砜滤膜过滤后,于-20 ℃冷冻保存,以便后续测定培养液LMWOAs的浓度。
1.3 低分子量有机酸含量测定
本研究培养液中的LMWOAs的测定方法采用的是改进的衍生化高效液相色谱(HPLC)法[34]。
1.3.1 绘制LMWOAs标准曲线 配置浓度均为0.10 mol·L-1的甲酸钠、乙酸钠、乳酸钠混合标准溶液作为原始储备液。对原始储备液进行稀释,配制成浓度为0.00,1.00,5.00,10.00,20.00,30.00,40.00,50.00,60.00,80.00,100.00 μmol·L-1的低浓度LMWOAs标准溶液。经后续衍生化过程处理,通过HPLC分析,绘制标准曲线。以上试剂均为分析纯,来自国药集团。
1.3.2 样品衍生化 取2 mL过滤后的藻类培养液至4 mL棕色硼硅酸盐玻璃瓶中,加入200 μL体积比为1∶1的盐酸吡啶溶液(吡啶纯度≥99.99%,Sigma公司),通高纯氮气约5 min(排除CO2),依次加入0.1 mol·L-12-硝基苯肼(NPH,纯度≥97%,Sigma公司)溶液和0.3 mol·L-12-二甲基氨丙基碳化二亚胺(EDC,纯度≥99.99%,Sigma公司)溶液各200 μL,轻晃摇匀,室温避光静置2.5 h。待衍生化反应完成,加入200 μL 40%(w/v)的KOH溶液,混匀于70 ℃恒温金属浴中(HB120-S,大龙兴创)加热10 min,随后用0.45 μm聚醚砜滤膜过滤,取上清液100 μL通过HPLC进行定量分析。
1.3.3 LMWOAs测定 本研究所使用的HPLC为Agilent-1100(美国安捷伦科技公司),用于分析的色谱柱是Agilent Eclipse XDB-C8(4.6 mm × 150 mm × 5 μm)。流动相A:50 nmol·L-1乙酸钠、2 mmol·L-1四丁基氢氧化铵(纯度≥99.99%,Sigma公司)溶液、2.5%正丁醇溶液和2 mmol·L-1溴化十四烷基甲胺(TDTMABr,纯度≥99.99%,Sigma公司)溶液,用色谱纯磷酸调节pH至4.5左右;流动相B:50 mmol·L-1TDTMABr溶液。以上未注明的其他试剂均为分析纯,来自国药集团。HPLC洗脱程序如表2所示。

表2 洗脱程序
使用该方法检测到培养液中含有三种LMWOAs:乳酸(LA)、乙酸(AA)和甲酸(FA),其保留时间分别为7,9和10 min;检出限分别为0.13,0.32和0.12 μmol·L-1[35]。根据1.3.1绘制出的标准曲线与样品峰面积,计算出培养液中LMWOAs的浓度。
1.4 pH值测定
本研究采用分光光度法测定pH[36]。以2 mmol·L-1间甲酚紫钠盐溶液为指示剂,调节指示剂在578和434 nm处的吸光度比值约为1.6。测定样品在730,578和434 nm处的吸光度值,再向该样品中加入80 μL指示剂,混合均匀后再测定730,578和434 nm处的吸光度值。将测得的荧光信号值代入以下公式:
(A1/A2)corr= (A1/A2) -0.08[0.125- 0.147(A1/A2)];
(293≤T/K≤303,30≤S≤37);
计算即可得到样品的pH值。该方法的精密度优于0.001pH[36]。
1.5 叶绿素a含量测定
本实验采用荧光分光光度法分析样品的叶绿素a(Chla)浓度[37]。在设定的培养天数取藻类培养液4 mL,经0.77 μm孔径玻璃纤维滤膜过滤(<15 kPa),之后将滤膜对折放入离心管中,低温避光条件下用8 mL 90%的丙酮-水溶液萃取24 h,将萃取液放入冷冻离心机(GTR16-2型,北京时代北利离心机有限公司),以4 000 r·min-1的转速离心10 min,取离心后的上清液用荧光分析仪(F-4500,株式会社日立制作所)分析样品的荧光信号值。根据叶绿素a标准曲线,计算出样品的叶绿素a含量。此方法检测限为0.01 μg·L-1[37]。
1.6 数据的统计分析
本研究中,根据表1的光暗周期设计6个系列的连续培养实验,每个系列设置两组平行试验。使用SPSS24.0(SPSS Inc.,Chicago,USA)相关性分析软件测试了藻类细胞密度、培养液中LMWOAs、叶绿素a、pH之间的关系。
2 结果
2.1 两种藻类细胞生长曲线变化特征
两种藻类生长曲线如图1所示。对中肋骨条藻共计培养25天,灭菌组中肋骨条藻生长速度较未灭菌组快。灭菌组中肋骨条藻在培养第4天,便进入指数增长期,光照充足的中肋骨条藻生长速度更快,18 h光照组培养液细胞密度在第12天达到最大值,为1.50×106个·mL-1,12、6 h光照组培养液细胞密度在第14天达到最大值,分别为1.52×106和1.40×106个·mL-1。灭菌组不同光照培养条件下中肋骨条藻的衰亡期从培养第14天起几乎同步开始,但较长光照时间培养条件下的中肋骨条藻衰亡速度较快。未灭菌培养液中的中肋骨条藻在培养前10天生长速度一直较缓,培养10天后,18、12 h光照组培养液中的中肋骨条藻开始进入指数生长期,在第14天左右同时达到最大密度,均为0.55×106个·mL-1,其生长趋势变化非常接近。未灭菌条件下6 h光照组的培养液中,中肋骨条藻生长受到限制,未出现明显的指数生长期。总体上,灭菌条件较未灭菌条件对中肋骨条藻生长有明显优势,表明培养液中微生物的存在对中肋骨条藻的生长有显著抑制。
对赫氏圆石藻共计培养21天,灭菌组赫氏圆石藻在不同光照条件下生长有所差异。在培养第4天左右,灭菌组赫氏圆石藻开始进入指数增长期,18、12 h光照组培养液细胞密度在第17天达到最高,分别为1.68×106个·mL-1,1.11×106个·mL-1,随后培养液细胞密度逐渐下降,开始进入衰亡期。6 h光照组培养液细胞密度在第14天达到最大值,为1.28×106个·mL-1,之后细胞密度迅速下降。总体上,灭菌组赫氏圆石藻接受光照时间越长,细胞生长越旺盛。未灭菌培养条件下,赫氏圆石藻的生长速度明显慢于灭菌组。18 h光照条件下的细胞在第4天进入指数增长期,12 和6 h光照条件下赫氏圆石藻生长趋势基本一致,在第10天左右进入指数增长期。三种光照条件下,培养液的赫氏圆石藻均在第17天达到最大密度,分别为0.76×106,0.68×106和0.65×106个·mL-1,随后进入衰亡期。整体上赫氏圆石藻接受光照时间越长,生长速度越快,最大密度值越高。与灭菌组相比,赫氏圆石藻在含有细菌等微生物的培养液中生长受到明显抑制。
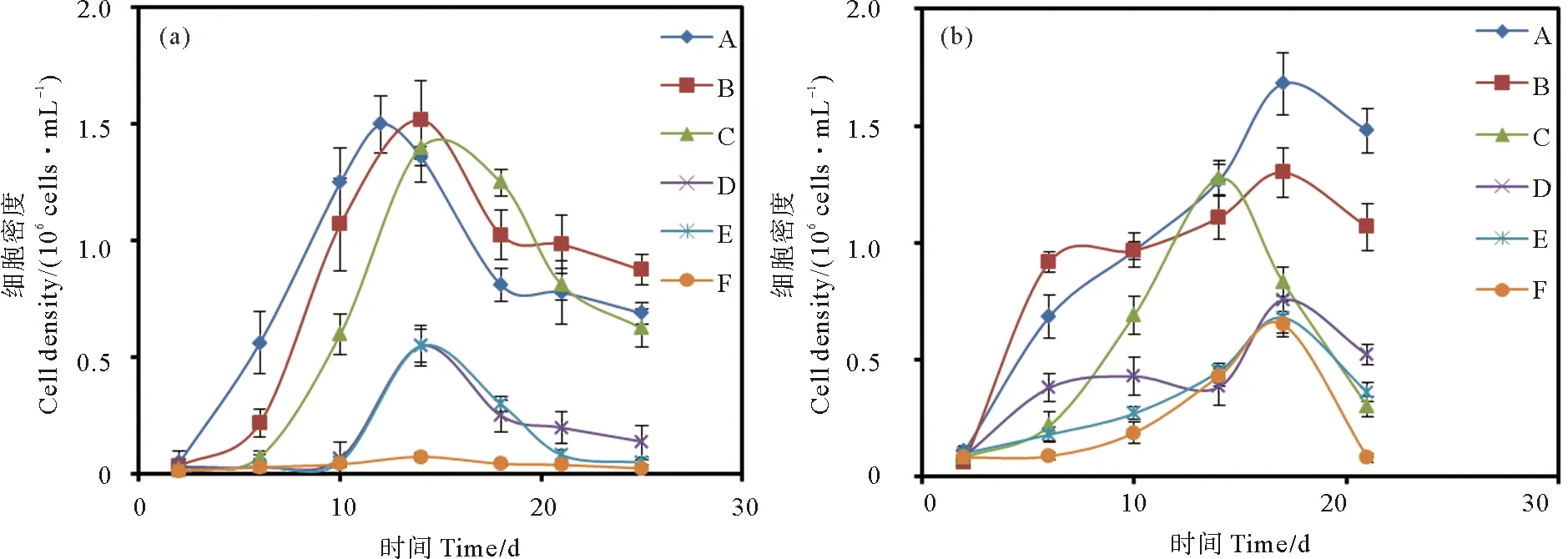
((a)中肋骨条藻;(b)赫氏圆石藻。(a) Skeletonema costatum; (b) Emiliania huxleyi.)
2.2 两种藻类生长过程中培养液LMWOAs浓度的变化
本研究所采集的原始海水未检测到乳酸。中肋骨条藻生长过程中培养液乳酸浓度随培养时间变化如图2(a)所示,一直呈上升趋势。灭菌条件比未灭菌条件能够积累更多的乳酸,且接受的光照时间越长,乳酸积累越多。灭菌组的培养液到中肋骨条藻的衰亡期最多可累积乳酸浓度为5.42 μmol·L-1;而未灭菌组培养液最多只能积累乳酸浓度至2.21 μmol·L-1。赫氏圆石藻在生长初期和指数生长期产生乳酸,在指数生长末期或衰亡期将乳酸完全消耗,如图2(b)所示。灭菌组培养液乳酸浓度最大值6 h光照组>12 h光照组>18 h光照组。在未灭菌组培养液中,12 h光照组培养液在培养6天后,乳酸浓度达到最大值,为0.62 μmol·L-1,之后乳酸消耗速度也最快,在指数生长期第14天之前均全部消耗完,以后的生长过程培养液不再积累乳酸;18 h光照组培养液积累乳酸持续时间最长,直到第21天衰亡期乳酸才被完全消耗;6 h光照组赫氏圆石藻产生乳酸很少,培养液乳酸最大浓度出现在第6天为0.15 μmol·L-1,在第14天被完全消耗完,之后培养液便不再积累乳酸。
本研究所采集的原始海水乙酸初始浓度较高,为92.00 μmol·L-1。两种藻类生长过程中培养液乙酸浓度随时间呈现复杂的变化趋势,如图2(c)、2(d)所示。不同生长阶段培养液的乙酸含量均出现较大波动,乙酸消耗和积累交替发生。中肋骨条藻灭菌培养液中,18 、12和6 h光照组的乙酸含量波动范围分别为70.10~138.40,43.52~142.00,97.80~123.70 μmol·L-1;未灭菌培养液中乙酸含量波动范围分别为45.00~122.00,43.16~121.50,57.29~116.70 μmol·L-1。赫氏圆石藻灭菌培养液中,3种光照条件下,前10天培养液乙酸浓度呈升高趋势,在随后的培养过程中乙酸浓度呈明显波动,整体上灭菌培养液18,12,6 h光照组的乙酸波动范围分别为96.52~145.90,92.95~156.70和95.95~176.82 μmol·L-1;到衰亡期末,18、6 h光照组培养液中乙酸含量高于初始值,12 h光照组乙酸含量比初始值略低。在未灭菌培养组,赫氏圆石藻18,12,6 h光照组培养液乙酸变化范围分别为93.77~141.00,83.79~157.80,99.00~172.78 μmol·L-1,到衰亡期,3种光照条件下培养液中乙酸浓度均高于初始值。
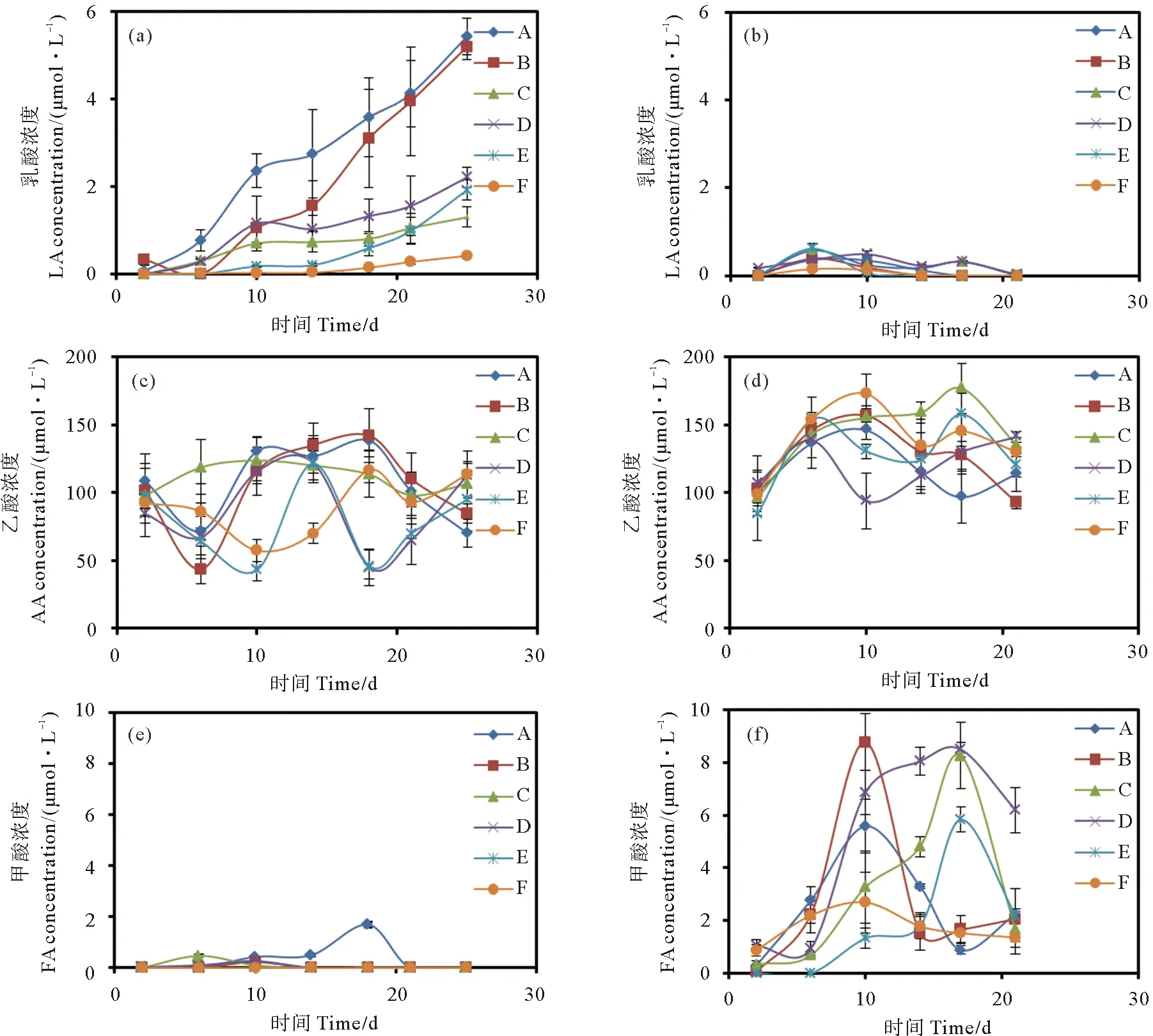
((a),(c),(e)中肋骨条藻;(b),(d),(f)赫氏圆石藻。(a), (c), (e) Skeletonema costatum; (b), (d), (f) Emiliania huxleyi.)
本研究所采集的原始海水中不含甲酸。中肋骨条藻在生长过程中会产生少量甲酸,到培养后期甲酸均被消耗,如图2(e)所示。中肋骨条藻灭菌培养过程中,6 h光照组培养液在其生长初期最早出现甲酸积累,于第6天达到最高值0.47 μmol·L-1,在衰亡期前被全部消耗;18、12 h光照组培养液在第6天开始积累甲酸,18 h光照条件下培养液中的甲酸于第18天浓度达到最高值1.69 μmol·L-1,于第21天被完全消耗,12 h光照条件下培养液甲酸含量于第10天达到最高值0.22 μmol·L-1,到第14天甲酸均被消耗。整体上,中肋骨条藻未灭菌组培养液中积累的甲酸少于灭菌组,未灭菌组中肋骨条藻培养液中12、6 h光照条件不积累甲酸,18 h光照组培养液出现少量甲酸积累,在第10天其浓度达到最高值0.26 μmol·L-1。赫氏圆石藻生长过程中培养液中积累的甲酸量明显高于中肋骨条藻,且在生长过程的各个阶段都出现积累。在灭菌培养液中,18、12 h光照组培养液出现甲酸积累的时间较早,在第10天的培养液中甲酸浓度达到最大,分别为5.58和8.77 μmol·L-1;6 h光照组培养液在培养第17天甲酸积累最多,浓度高达8.26 μmol·L-1。灭菌组中不同光照条件下的赫氏圆石藻在衰亡期到来之前或在衰亡期均能够消耗掉大部分甲酸。未灭菌组中,18和12 h光照组的培养液均在第17天积累甲酸至最高浓度,分别为8.49和5.83 μmol·L-1;6 h光照组培养液甲酸积累较少,在第10天积累量最高仅为2.70 μmol·L-1。
由于原始海水不含乳酸,甲酸,所以原始海水LMWOAs总浓度即为原始海水乙酸浓度92.00 μmol·L-1。两种藻类培养过程中培养液总LMWOAs浓度变化如图3所示。在灭菌18和12 h光照组中,中肋骨条藻培养液总LMWOAs浓度均在第18天达到最值,分别为143.67和145.11 μmol·L-1,6 h光照组整个培养周期培养液中总LMWOAs浓度均高于海水初始浓度,在第10天达到最高值124.50 μmol·L-1。未灭菌培养液中,18和12 h光照组其总LMWOAs浓度范围分别为46.32~123.03 、43.38~121.71 μmol·L-1;6 h光照组培养液总LMWOAs最高浓度出现在第18天,为116.85 μmol·L-1。整体上,赫氏圆石藻无论在灭菌还是未灭菌培养过程中,培养液中总LMWOAs浓度均高于原始海水中总LMWOAs浓度。赫氏圆石藻在灭菌条件下,18、12和6 h光照组培养液总LMWOAs浓度最大值分别为151.82、165.66和185.39 μmol·L-1;在未灭菌条件下,18,12和6 h光照组培养液中总LMWOAs浓度最大值分别为147.22、163.63和175.60 μmol·L-1。
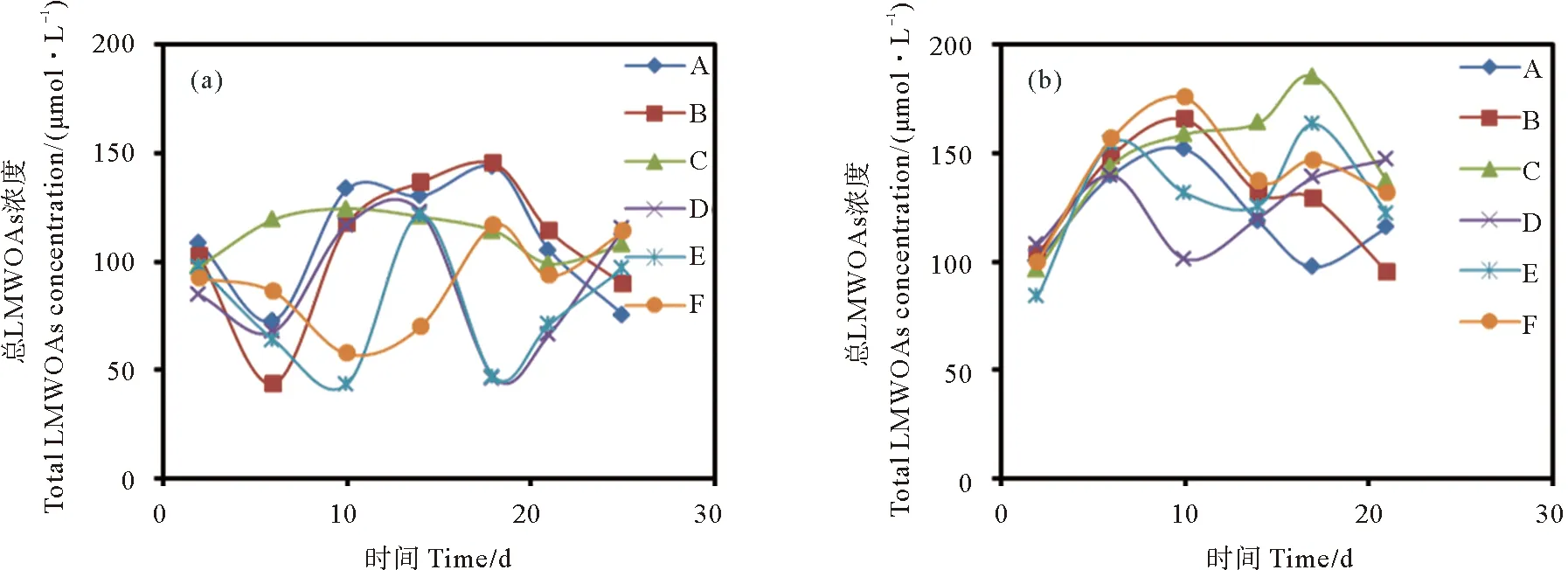
((a)中肋骨条藻;(b)赫氏圆石藻。(a) Skeletonema costatum; (b) Emiliania huxleyi.)
2.3 两种藻类生长过程中培养液pH值的变化
本研究所使用的原始海水初始pH值为8.17。中肋骨条藻生长过程中培养液pH值变化如图4(a)所示。在指数生长期灭菌培养液中的pH值呈现上升趋势,衰亡期pH值呈下降趋势。未灭菌组培养液中的pH值变化较为复杂,不断波动,到衰亡期,12 和6 h光照组培养液的pH值随培养时间均呈先上升后下降趋势,18 h光照组培养液pH值有所上升。整体上,中肋骨条藻各个生长阶段培养液的pH值在灭菌和未灭菌状态均高于海水初始pH值。
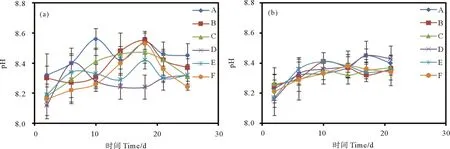
((a)中肋骨条藻;(b)赫氏圆石藻。(a) Skeletonema costatum; (b) Emiliania huxleyi.)
赫氏圆石藻生长过程中培养液pH值变化如图4(b)所示。灭菌组培养液中pH值在不同光照条件下均呈现逐渐升高趋势;到培养结束,受18 h光照的培养液pH值最高,为8.40,其他两组培养液pH值接近,分别为8.36和8.37。未灭菌组中,18 h光照组培养液pH值随培养时间波动上升,12 h、6 h光照组培养液中的pH值在指数生长期呈上升趋势,至衰亡期趋于稳定;培养结束,18 h光照组培养液pH值最高,为8.43,其余两组培养液pH值分别为8.35和8.34。整体上,灭菌和未灭菌培养液的pH值总体上呈上升趋势,且均在18 h光照组中达到最高。
2.4 两种藻类生长过程中培养液Chl a浓度的变化
中肋骨条藻在两种培养液中Chla浓度随培养时间变化曲线如图5(a)所示。Chla浓度在两种培养液中均随培养时间呈现上升趋势,且灭菌组较未灭菌组积累更快。灭菌组与未灭菌组3种光照条件下的Chla积累速度均为:12 h光照组>18 h光照组>6 h光照组。中肋骨条藻Chla浓度随时间变化与细胞密度明显不同,Chla浓度在中肋骨条藻衰亡期仍然呈现上升趋势,表明单个细胞的Chla含量在不断上升。
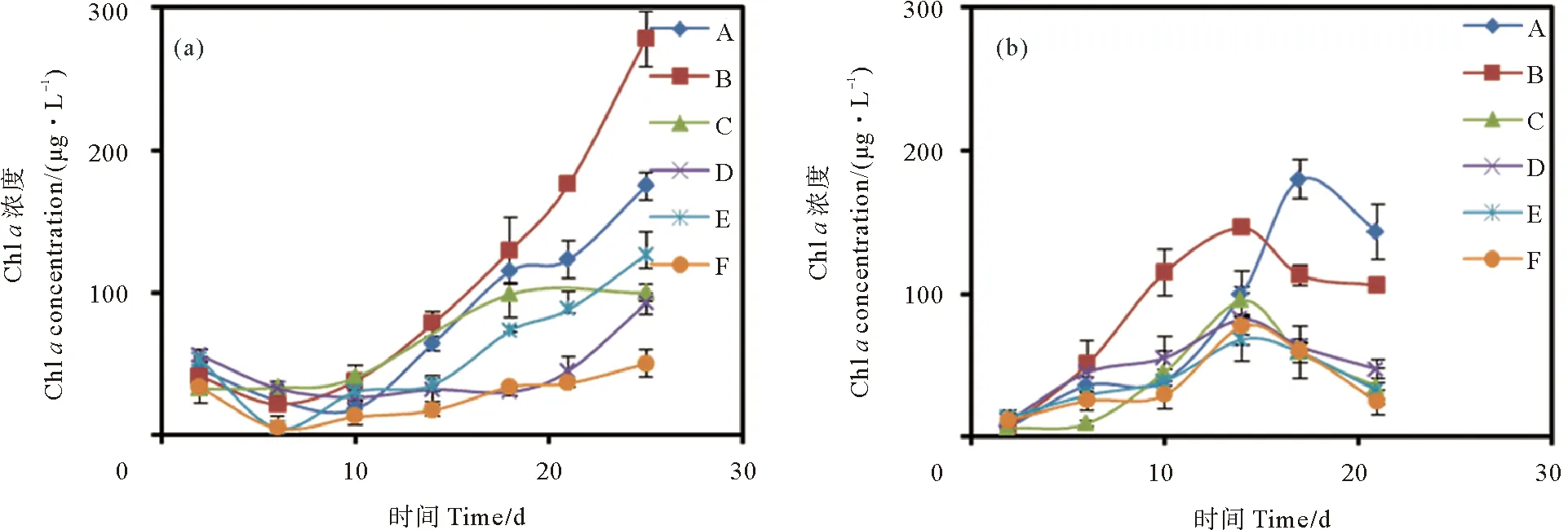
((a)中肋骨条藻;(b)赫氏圆石藻。(a) Skeletonema costatum; (b) Emiliania huxleyi.)
两种赫氏圆石藻培养液中Chla浓度随培养时间变化曲线如图5(b)所示。灭菌组培养液中Chla含量整体上高于未灭菌组,且呈现接受光照时间越长,Chla浓度越高的特征。赫氏圆石藻灭菌和未灭菌培养液中的Chla浓度均呈现在指数生长期逐渐增长,衰亡期呈逐渐下降的趋势,这与赫氏圆石藻细胞生长曲线较为相似。
3 讨论
未灭菌环境更接近中肋骨条藻和赫氏圆石藻在海洋中的生长环境,在未灭菌条件下,至培养期结束,三种光照条件下两种藻培养液中的总LMWOAs均有所积累,因此这两种藻生长过程释放的LMWOAs均是海洋中LMWOAs的来源。
两种微藻释放LMWOAs的状况与其生长阶段密切相关,在藻类生长过程中,有机酸的产生与消耗是同时发生的。前期研究表明,一般藻类在生长初期,藻类细胞更倾向于释放易溶解、易利用的小分子物质,如氨基酸、小分子糖类和有机酸等[4],使有机酸的生产大于消耗,培养液LMWOAs的浓度呈增加趋势。生长后期至衰亡期,藻细胞多分泌大分子物质,如多糖,蛋白质等[39],这些大分子物质被生物体作为碳源和能量来源分解利用,也能成为海水有机酸的重要来源。另一方面,与微生物共存条件下,藻类对有机酸的产生和利用受到多种生物与化学过程的控制,加之藻类产生的一些物质可能存在趋化性[40],导致培养体系中LMWOAs的浓度呈现复杂的变化趋势。
3.1 影响中肋骨条藻培养液中LMWOAs浓度的因素
本研究中,灭菌和未灭菌培养条件下中肋骨条藻的生长曲线有明显差异,整体上,灭菌培养的中肋骨条藻在生长速度和积累LMWOAs方面更有优势。随着中肋骨条藻的生长,乳酸在培养液中逐渐积累,表明其生长过程会持续产生乳酸并释放到培养液中。灭菌组乳酸的积累量显著高于未灭菌组,表明培养液中的细菌等微生物能够以乳酸为碳源进行新陈代谢,消耗乳酸,细菌等微生物对藻类生长的抑制和对乳酸的消耗是造成这种差异的重要原因。此外,即使在中肋骨条藻生长的衰亡期,灭菌和未灭菌培养体系乳酸浓度仍然继续增加,表明中肋骨条藻可能无法以乳酸为碳源进行异养生长。
中肋骨条藻灭菌和未灭菌培养液中的乙酸浓度随时间均呈现出较为复杂的变化,与藻类和水体中细菌存在的复杂相互作用有关[41]。细菌可以吸收利用藻类分泌的有机物质,并为藻类提供必要的维生素等促生长因子,或通过再矿化作用溶解有机质[42],水体中的微生物能够利用有机物的矿化产物生存;水体中多种细菌通过竞争营养物质等方式抑制藻类生长,这些相互作用有助于保持水体生态系统的平衡[43]。本研究的结果表明,在实验室培养下,由于生长空间有限,培养液中的微藻和细菌等微生物都会利用其中的营养盐、微量元素等进行自身的生命活动,形成竞争关系。与灭菌条件相比,未灭菌条件下中肋骨条藻生长受到一定程度的抑制,降低了其产生、释放LMWOAs的能力,从而导致未灭菌组培养液LMWOAs积累量低于灭菌组。
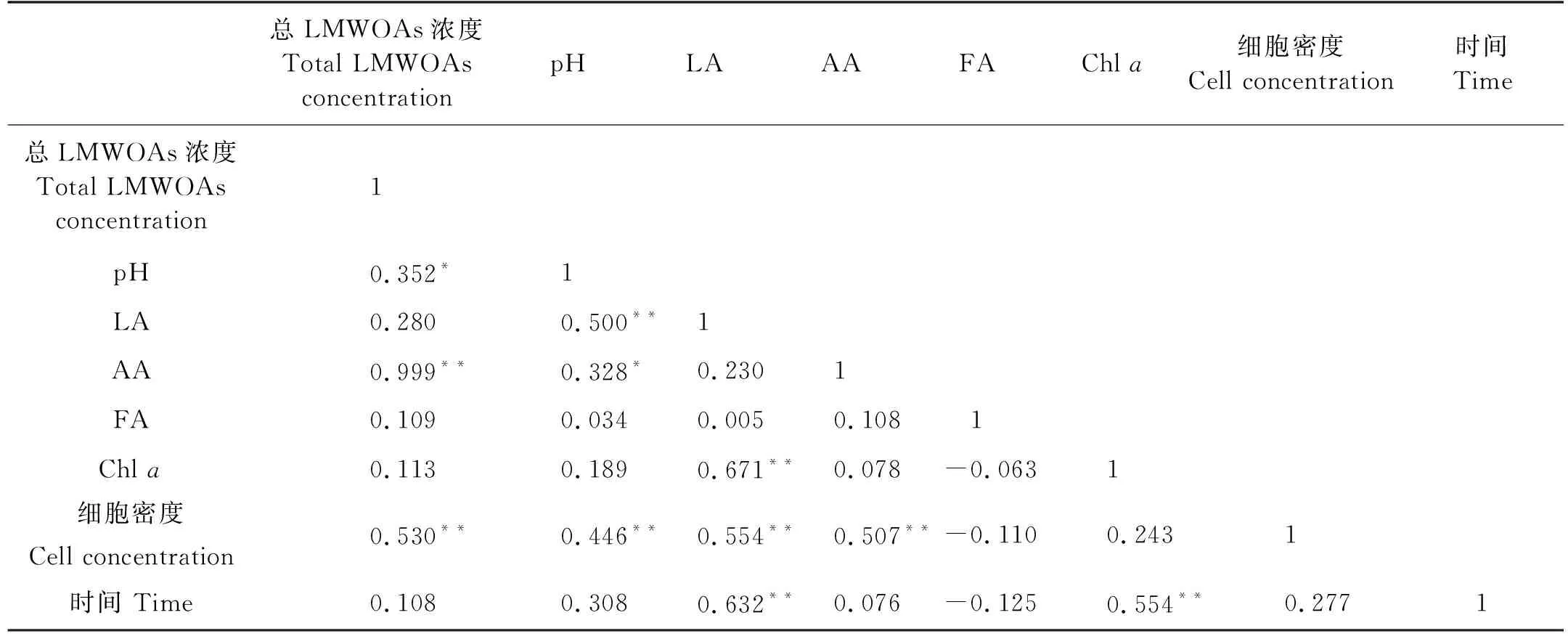
表3 中肋骨条藻培养液样品中各参数的相关性分析
3.2 影响赫氏圆石藻培养液中LMWOAs的因素
赫氏圆石藻的生长曲线符合藻类光照时间越长,生长速度越快,密度最大值越高的特点。与中肋骨条藻相似,水体中的细菌和赫氏圆石藻同样存在竞争关系。赫氏圆石藻对外部变化响应较为灵敏,多数研究认为,海洋酸化会使此类藻的光合作用增强[45]。在如今海洋趋向酸化的情况下,藻类光合作用的增强会导致其大量繁殖,从而向海水中释放LMWOAs,影响海水中LMWOAs的含量。
赫氏圆石藻生长中会产生少量乳酸,在衰亡期将其全部消耗,表明乳酸很有可能是赫氏圆石藻生长过程中的碳源。赫氏圆石藻培养液中LMWOAs总浓度与3种LMWOAs浓度均为显著正相关,乙酸与总LMWOAs的相关系数高达0.995,说明二者之间关系非常密切,这种密切关系与乙酸在总LMWOAs中占较大比例有关。赫氏圆石藻产生和消耗乙酸的情况比较复杂,衰亡期培养液中乙酸的含量高于生长初期。灭菌和未灭菌条件下,均在6 h光照组培养液乙酸含量最高,短时间光照,长时间的黑暗环境有利于培养液中乙酸积累,表明赫氏圆石藻的呼吸作用有利于乙酸的产生。此外,灭菌组和未灭菌组的培养液中乳酸和乙酸浓度显著相关(P<0.05),表明二者在赫氏圆石藻的新陈代谢过程中可能存在某种相互转化机制。赫氏圆石藻在生长初期、指数生长期都产生一定量的甲酸,在衰亡期消耗部分甲酸,培养液甲酸浓度与培养天数存在显著相关(P<0.05),其产生消耗甲酸的机理需要进一步研究。赫氏圆石藻培养过程中培养液的pH值与LMWOAs总浓度显著相关(P<0.05),与甲酸浓度、Chla浓度、细胞密度和培养天数也显著相关(P<0.01)。随着藻细胞密度、Chla含量增加,光合作用增强等生化过程消耗更多CO2等物质,培养液的pH值升高。在赫氏圆石藻的培养周期里,总体上LMWOAs的积累大于消耗,LMWOAs总浓度随培养时间的增加而升高。赫氏圆石藻在灭菌和未灭菌的培养液中均能积累一定的甲酸,也能同时产生乳酸,但这些乳酸会被完全消耗;中肋骨条藻与之相反,在灭菌和未灭菌的培养液中出现持续的乳酸积累,但只产生少量甲酸。表明这两种藻在生产LMWOAs的机制上有一定的差异。
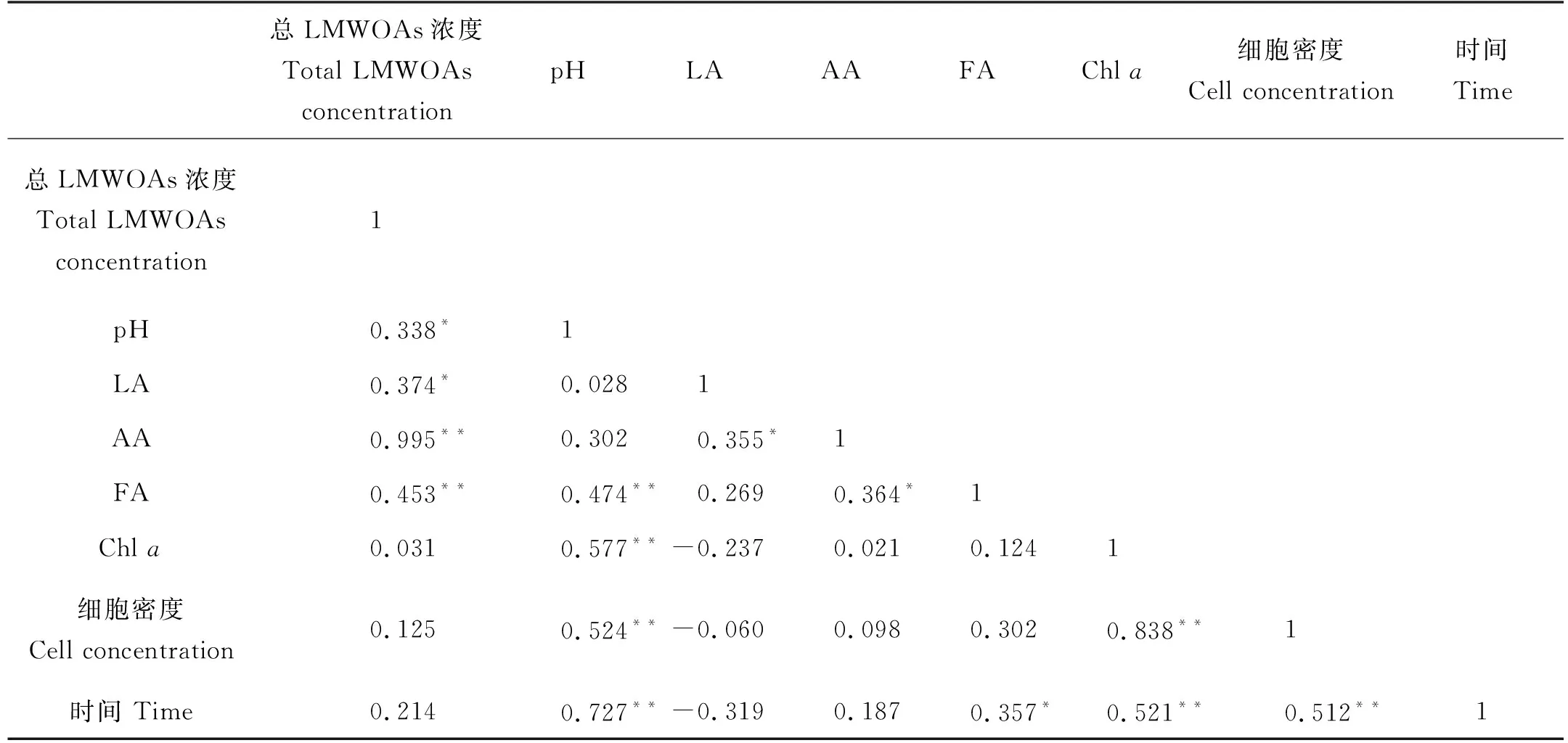
表4 赫氏圆石藻培养液样品中各参数的相关性分析
4 结论
本研究以海洋中具有代表性的中肋骨条藻和赫氏圆石藻为研究对象,在不同的培养条件下考察藻类生长过程不同阶段培养液中的LMWOAs浓度变化,探究了藻类生长与海水LMWOAs的关系。
(1) 中肋骨条藻和赫氏圆石藻生长过程均能释放乳酸、乙酸、甲酸3种LMWOAs,且生长过程中总LMWOAs的产生量大于消耗量,这两种藻类是海水中LMWOAs的重要来源。
(2) 在中肋骨条藻生长周期中,培养液中乳酸含量持续增加,乙酸含量呈波动趋势,甲酸产量较低并最终完全消耗。赫氏圆石藻在生长周期中产生少量乳酸,至衰亡期被全部消耗,培养液中乙酸含量呈波动趋势,甲酸含量先升高后下降,最终出现少量积累。灭菌环境均有利于中肋骨条藻和赫氏圆石藻LMWOAs的积累。
(3) 两种藻类生长过程培养液中的pH值和总LMWOAs浓度、细胞密度均呈正相关,它们的生长过程通过产生LMWOAs和消耗无机碳影响海水pH值。
