海泡石改性制备磁性纳米复合材料对Pb(II)去除的研究
2023-05-20于生慧王翼远胡小敏姜铭峰
于生慧, 王翼远, 王 艳, 胡小敏, 姜铭峰
(陕西科技大学 环境科学与工程学院, 陕西 西安 710021)
0 引言
Pb作为一种在生产生活中重要的金属元素,其常见于电池、金属电镀和精加工领域,并且也用作生产汽油的添加剂等[1],同时,Pb(II)的高毒性也会对人体健康和自然环境造成严重的威胁.根据世界卫生组织标准,饮用水中允许的Pb(II)浓度限制在0.01 mg/L以内,而根据美国环境保护署的调查显示,即使在低浓度Pb(II)存在下,依然对人性会产生毒性[2].饮用水中Pb(II) 浓度过高可能导致多种疾病,包括脑病、贫血和肝炎.由于Pb(II)的不可降解性并会在生物体中积累,因而必须从水体和废水中去除Pb(II)[3].目前,去除废水中Pb(II)的方法主要有混凝-絮凝法[4]、膜过滤[5]、吸附[6]和离子交换[7].其中吸附法因有着方便、简单、优异的去除能力和较低的经济成本而被广泛利用[8,9].生物炭和粘土矿物是常用的重金属吸附剂受到广泛研究[10].例如,Zhao等[11]制备出了一种绿色磁性生物炭用于吸附Pb(II),最大吸附容量可达196.91 mg/g;Yang等[12]通过热解空心莲子草合成了一种新型生物炭吸附剂(APB),结果也表明使用低成本的 APB 吸附剂处理重金属污染水可能具有重要的生态和环境意义;Huang等[13]和Dinh等[14]则分别对凹凸棒石和膨润土进行了改性,提高了粘土矿物对Pb(II)的吸附性能.
近些年来,由于纳米材料特殊的性质,其开始在环境修复领域受到关注.特别是在水体中重金属的处理方面,纳米材料具有较大的比表面积和大量的表面活性位点,展现出巨大的应用潜力[15].纳米水镁石[Mg(OH)2]是一种优异的吸附剂,引发广泛的研究兴趣[16,17].例如,Liu等[18]探索了Mg(OH)2纳米吸附剂在处理低浓度Cr(VI)时的循环回收方法;Liu等[19]研究表明Mg(OH)2负载纳米级零价铁后,对水溶液中Pb(II)的去除能力显著增强;Zhang等[20]成功合成了磁性 Ni@Mg(OH)2纳米复合材料,其对目标金属的首次去除效率几乎为100%,并且经过5次循环后,吸附容量仍保持在95%.
粘土矿物作为一种广泛存在天然矿物,其主要为层状硅酸盐结构,由一个或两个二氧化硅四面体围绕八面体铝片组成层状结构单元[21],具备复杂多孔结构和较高比表面积,可与溶解物质发生强烈的物理、化学相互作用[22,23].通常情况下,粘土矿物去除水体中重金属的方式一般有两种:一是离子交换作用;二是与表面的硅氧基团和铝氧基团与重金属离子形成配合物[24,25].海泡石(Mg8Si12O30(OH)4(H2O)4·8H2O),是一种多孔纤维状水合硅酸镁,由两个四面体二氧化硅中间夹着一个八面体氧化镁组成的层链状结构[26],从而具备较大的比表面积和孔体积,由于其特殊的纳米棒状形态,海泡石在环境修复中常被用作金属离子的吸附剂[27,28].然而,天然海泡石对重金属的去除容量较低,限制了其在重金属去除中的应用,通过不同的物理、化学等手段对海泡石改性,能够一定程度上提高其对重金属处理的性能.
例如,Xu等[29]使用水热反应改性海泡石,发现合成的海泡石/β-FeOOH催化剂在一定pH范围内对Cr(VI)的光还原具有很好的催化性能;Xie等[30]利用羟基铁结合酸碱改性海泡石去除水和土壤中的Cd,在298 K时,吸附量提升为220.9 mg/g.此外,由于海石体积小、密度低,从水溶液中难于分离.当外界环境发生改变时,吸附了重金属的海泡石容易再次释放重金属造成二次污染.因此,如何有效分离环境中的吸附材料是促进纳米吸附材料应用的重要课题.
近年来,磁性吸附剂由于使用后易于分离,其应用受到了广泛的关注[31,32].在环境污染清理应用中,磁性吸附剂可以通过磁性过程从水溶液中分离和回收,且不会造成污染,目前粘土负载磁性材料的技术已有一定进展.Fayazi等[33]合成了海泡石-氧化铁-二氧化锰 (Sep-Fe3O4-MnO2) 纳米复合材料,并将其用于水中Pb(II)的去除,研究表明Sep-Fe3O4-MnO2可用作循环使用的吸附材料,并且被成功应用于工程实践.Yu等[34]成功合成磁铁矿/海泡石复合材料,其对Co(II)和Cd(II)的吸附容量分别为18.85 mg/g和14.15 mg/g.Zhou等[35]以表面聚吡咯(PPy)功能化海泡石纤维(SEP)为基础,成功制备了一种具有磁性和浮选性能的新型吸附剂,在循环使用过程中,吸附剂的吸附能力保持在58.36~87.93 mg/g.Shen等[36]采用微波水热法制备了新型尖晶石-NiFe2O4/天然矿物(海泡石、硅藻土和高岭石)磁性复合材料,并用于催化降解有机物.
在本研究中,将通过将磁铁矿负载到基于海泡石制备的SiO2-Mg(OH)2复合材料上,制备出一种新型的含镁纳米复合材料(SiO2-Mg(OH)2-Fe3O4).将制备出的SiO2-Mg(OH)2-Fe3O4用于去除水体中的Pb(II),并通过控制pH、反应时间、Pb(II)的初始浓度等单因素来研究其对吸附性能的影响.利用TEM、XPS、XRD、BET等技术分析复合材料的形貌结构和成分等特性以及对Pb(II)的吸附机理.研究表明基于海泡石改性制备的SiO2-Mg(OH)2-Fe3O4复合材料对水体中的Pb(II)具有良好吸附性能,有着较大的应用前景.
1 实验部分
1.1 实验试剂
本研究中所用的实验药品均为分析纯(AR),海泡石购于西格玛公司,水合三氯化铁(FeCl3·6H2O)、氯化亚铁 (FeCl2·4H2O)、氢氧化钠 (NaOH)等药品购于国药集团.
1.2 材料的制备
首先采用Yao等[37]所报道的方法以海泡石为原料制备SiO2-Mg(OH)2纳米复合材料,具体步骤如下:配置50 mL浓度为0.6 mol/L的HCI溶液,称取2.0 g海泡石加入其中,在60 ℃下搅拌12 h,然后向溶液中缓慢滴加NH3·H2O,直至溶液pH到10.0左右,继续搅拌2 h.反应结束后,将产物离心并用蒸馏水洗涤直至pH=7.0~8.0,最后将固体沉淀放入60 ℃干燥箱中,烘干后研磨、备用.
SiO2-Mg(OH)2-Fe3O4的制备:称取0.27 g的FeCl3·6H2O和0.10 g的FeCl2·4H2O,加入到20 mL的乙二醇溶液中,再加入0.25 g SiO2-Mg(OH)2复合材料,在超声机(额定功率100 W)99%功率下超声30 min,然后将溶液转移到100 mL的圆底烧瓶中并加入5 mL浓度为0.8 mol/L的NaOH溶液,使溶液充分混匀.将混合溶液置于微波反应器(额定功率650 W)中,在80%的功率条件下反应20 min.反应完成后将产物以8 000 r/min的速度离心,并用无水乙醇洗涤3~4次,然后将固体沉淀放入真空干燥箱中烘干,研磨、备用.
1.3 仪器与样品表征
通过场发射扫描电镜(SEM,型号:ZEISS Gemini 300)和透射电子显微镜(TEM,型号:H-800)分析复合材料的形貌特征;通过X射线衍射仪(XRD,型号:Rigaku Smartlab)对产物进行物相的分析;通过比表面积仪分析并计算出材料的比表面积和孔体积(BET,型号:Micromertics 2010);通过光电子能谱仪分析材料的元素及价态(XPS,型号:ESCALAB 250).
1.4 Pb(II)吸附实验
通过溶解Pb(NO3)2制备含Pb(II)的贮备液,然后用去离子水稀释到实验所需的浓度.在Pb(II)的吸附实验过程中,称取50 mg所制备的吸附材料加入50 mL的含Pb(II)溶液中,调节到特定pH搅拌一定时间,在吸附剂加入前使用0.1 mol/L的HCI和NaOH溶液将溶液体系pH,吸附实验结束后,静置、磁分离,然后将上清液通过0.22 μm孔径滤膜过滤.采用ICP-AES测量Pb(II)浓度,并用公式(1)、(2)计算吸附量qe(mg/g)和去除率U%:
(1)
(2)
式(1)、(2)中:Co(mg/L)是Pb(II)的初始浓度,Ct(mg/L)和Ce(mg/L)分别为任意时间和平衡时Pb(II)的浓度,V(mL)是溶液的体积,W(mg)是材料的投加量.
1.5 吸附动力学模拟和吸附热力学模拟
本实验中分别使用准一级模型(3)和准二级模型(4)对反应数据进行吸附动力学拟合;采用Freundlich模型(5)和Langmuir模型(6)对反应体系进行吸附热力学拟合,线性方程如下所示:
ln(qe-qt)=lnqe-k1t
(3)
(4)
lnqe=lnKF+(1/n)lnCe
(5)
(6)
式(3)~(6)中:qe和qt分别为在平衡时间和任意时间复合材料对Pb(II)的吸附量,k1为准一级模型的速率常数,k2为准二级模型的速率常数,t是吸附时间,Ce是吸附达到平衡时Pb(II)的浓度,1/n是经验常数,qm是Pb(II)的最大吸附量,KF是Freundlich方程常数,KL是Langmuir方程常数.
准一级模型根据t和ln(qe-qt)进行线性拟合,准二级模型根据t和t/qt进行线性拟合;Freundlich模型根据lnCe和lnqe进行线性拟合,Langmuir模型根据Ce和Ce/qe进行线性拟合.
2 结果和讨论
2.1 复合材料的表征
对海泡石原样和改性后所得的复合材料通过SEM和TEM观察形貌结构.如图1(a)、(b)所示,海泡石是纳米级别的棒状结构,4~5 μm长,50 nm宽.通过能谱分析可知海泡石中主要以Mg、Si、O三种元素为主.由图1(c)、(d)可知,海泡石经过酸碱改性后,样品出现团聚现象,纳米棒状结构依然存在,但与海泡石原样相比,改性后海泡石表面更加粗糙,孔隙增多,表明海泡石原样中的晶体结构中的O-Mg八面体遭到破坏,非晶SiO2作为更加稳定的结构出现,由于非晶SiO2为胶体,容易发生团聚.酸碱化的样品经负载后,从宏观来看,其结构特点与酸碱化样品没有特多差异(图1 (e)),可以在团聚体中观测到纳米棒状结构;然而,其高分辨扫描照片显示,复合材料表面出现许多纳米颗粒(图1 (f)),表明通过微波辅助回流法,纳米磁铁矿成功地负载于复合材料表面.

图1 材料的SEM和TEM图
图2是磁铁矿负载后材料在TEM场景下的能谱分析.可以清晰地看到,样品中除了Mg、Si、O元素外,出现了Fe元素,并且铁元素均匀分布于复合材料表面,含量约为10.33%.结合SEM和Mapping分析可以推断,纳米级磁铁矿通过微波辅助回流反应被成功负载到酸碱化海泡石所制备的SiO2-Mg(OH)2复合材料的表面.

图2 SiO2-Mg(OH)2-Fe3O4的TEM和MAPPING分析图
图3是为以海泡石为原料制备的SiO2-Mg(OH)2和SiO2-Mg(OH)2-Fe3O4纳米复合材料的XRD图谱.从图3可以看到,海泡石原材料经过酸碱改性后,已无明显的海泡石特征峰,所得结果与Yao等[37]所报道相一致;在通过进一步负载磁铁矿后,复合材料XRD图谱在35.5°、56.9°和62.5°处出现了磁铁矿的特征峰.
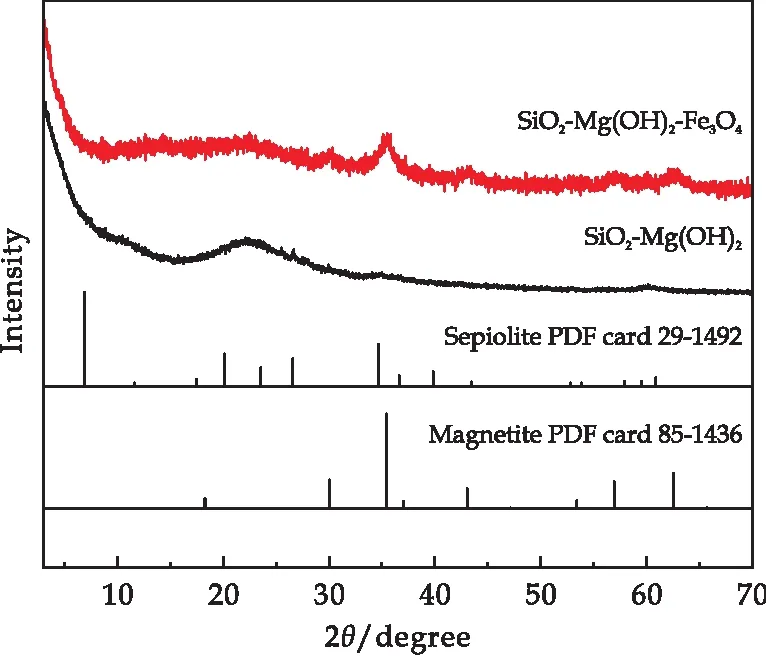
图3 复合材料的XRD谱图
由于Fe3O4和γ-Fe2O3两者的XRD衍射图近似,为进一步鉴别复合材料的组成,对材料进一步做了XPS光谱分析,结果如图4所示.
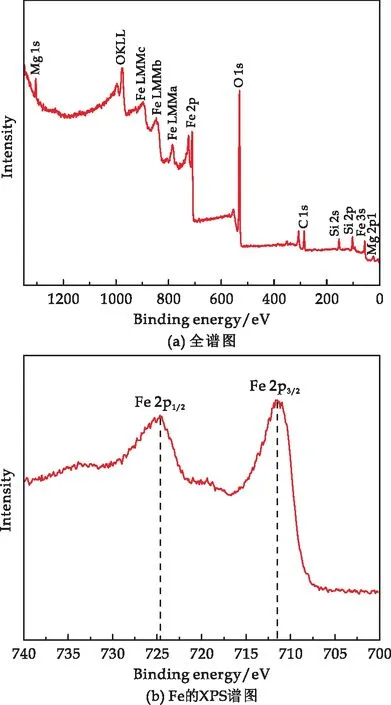
图4 复合材料的XPS图谱
复合材料的XPS全谱图(图4(a))显示复合材料主要含有O、Mg、Si、Fe等元素,进一步证明了有含Fe化合物的存在,Fe的2p1/2和2p3/2的结合能(图4(b))分别在724.7 eV和710.5 eV的位置,该结果与Fe3O4的XPS一致[38],且图谱中未出现磁赤铁矿所特有的卫星峰.样品的XRD和XPS结果进一步证实,通过微波冷却回流法,成功制备了SiO2-Mg(OH)2-Fe3O4磁性纳米复合材料.
SiO2-Mg(OH)2-Fe3O4磁性纳米复合材料的氮气吸附等温线和孔径分布如图5所示.由图可以看到,复合材料的氮气吸附解吸等温线具有明显的滞后回环,表现为IV类吸附型,说明样品中存在介孔,材料的孔径分布2~10 nm之间.所制备磁性复合材料的BET比表面积为544.9 m2/g,孔容积为0.52 cm3/g,其比表面积远高于海泡石原样(263.4 m2/g)和海泡石酸碱化处理所制备的SiO2-Mg(OH)2(364.3 m2/g)的比表面积[37].所制备复合材料比表面积的增大可归结于纳米磁铁矿成功负载于SiO2-Mg(OH)2复合材料表面,使其具备更加复杂的空间结构.SiO2-Mg(OH)2-Fe3O4磁性纳米复合材料具有大的比表面积和高的孔容积,有利于其对重金属离子的吸附作用.
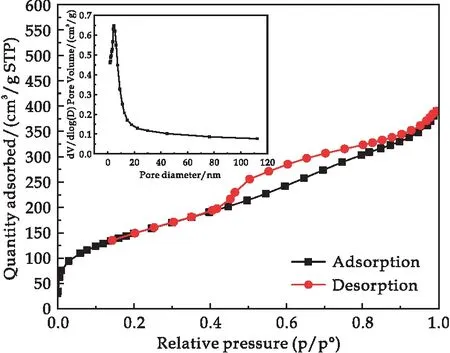
图5 复合材料氮气吸附等温线及孔径分布
2.2 磁性纳米复合材料对Pb(II)的去除
所制备纳米磁性复合材料对重金属Pb(II)的吸附情况如图6所示.反应体系的pH是影响吸附材料对重金属吸附性能的重要因素,因此实验中首先研究了溶液pH对Pb(II)的吸附影响.为了防止复合材料的溶解,同时避免Pb(II)沉淀的产生(Ksp[Pb(OH)2]=1.2×10-15),依据Pb(II)的初始浓度(300 mg/L),因此在本实验中pH控制在2.0~6.0.溶液的初始pH在加入吸附剂之前通过0.1 mol/L的HCI和NaOH溶液调节,搅拌时间为12 h.
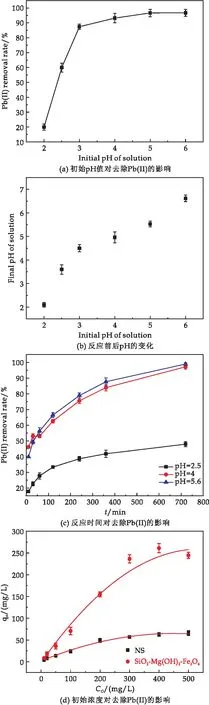
图6 复合材料对Pb(II)的去除
图6(a)是pH对吸附过程的影响.如图所示,随着溶液pH的升高,Pb(II)的去除率也逐渐提高.当pH在2~3范围内时,去除率的上升非常显著,pH超过3后,去除率的增加逐渐趋于平缓并在pH为5~6之间达到顶峰,约为96.7%.这是因为随着溶液pH的升高,溶液中H+浓度降低,OH-浓度增加,SiO2-Mg(OH)2-Fe3O4表面的负电荷逐渐增加,使得重金属离子与吸附剂之间的静电吸引力增大,促进了材料对Pb(II)的吸附.结果表明当pH为5和6时,SiO2-Mg(OH)2-Fe3O4对Pb(II)的吸附效果基本一致,为模拟所合成材料对自然水体中重金属去除情况,后续实验选用5.6作为pH设定条件之一.同时,由图6(b)可知,不同初始pH条件下的溶液在反应结束后,溶液的pH值都略微上升,这是由于复合材料中的水镁石(Mg(OH)2)溶解所致,水镁石溶解导致体系pH升高,使复合材料表面带有更多的负电荷,有利于吸附材料对重金属阳离子的吸附[37].
为了进一步研究反应时间对Pb(II)的去除效果的影响,将体系的pH值分别调节至2.5、4.0和5.6,在反应进行到10 min、30 min、60 min、120 min、240 min、360 min、720 min时取样分析,Pb(II)的初始浓度为300 mg/L.如图6(c)所示,在pH=2.5,反应时间为12 h时,SiO2-Mg(OH)2-Fe3O4对Pb(II)的去除率只有47.91%;在pH=4.0时,反应1 h后,溶液中Pb(II)的浓度下降了约53%,并在12 h后Pb(II)的去除率达到97.15%;在pH=5.6时,体系反应1 h后也能去除约56.2%的Pb(II),12 h后溶液中只残留了约1%的Pb(II).这表明实验所制备的SiO2-Mg(OH)2-Fe3O4纳米复合材料在广泛的pH条件下对Pb(II)有着较优异的去除效果;在pH=4~6下,反应时间为60 min时即可达到50%以上的去除率,并且随着反应时间的增加,Pb(II)的去除率进一步提高,当pH=4和5.6,反应12 h后,去除率基本可达95%以上.刘崇敏等[39]和周佳松等[40]研究发现,天然海泡石、硝酸钠改性海泡石、巯基乙酸改性海泡石、硫酸亚铁改性海泡石和热处理改性海泡石对Pb(II)的吸附平衡时间基本要在24 h 达到平衡,通过海泡石改性制备的SiO2-Mg(OH)2-Fe3O4复合材料提高了对Pb(II)的吸附效率.
图6(d)反映了Pb(II)的初始浓度对去除效果的影响,Pb(II)的初始浓度分别为10 mg/L、20 mg/L、50 mg/L、100 mg/L、200 mg/L、300 mg/L、400 mg/L、500 mg/L,体系pH为5.6,作用时间为12 h.结果显示,海泡石改性制备的磁性复合材料对Pb(II)的最大吸附量约为257.6 mg/g.比较而言,天然海泡石(NS)对Pb(II)的最大吸附量为65.6 mg/g,所制备的磁性复合材料SiO2-Mg(OH)2-Fe3O4对Pb(II)的去容量相较于海泡石对Pb(II)的去除容量大幅度提升.
2.3 SiO2-Mg(OH)2-Fe3O4磁性纳米复合材料对Pb(II)的吸附动力学模拟
分别使用准一级动力学(公式(3))和准二级动力学模型(公式(4))对数据进行拟合,线性拟合结果如图7所示,表1为拟合的相关参数.拟合结果及相关参数表明,准一级动力学的R2为0.995,准二级动力学的R2为0.988,这说明磁性纳米复合材料对Pb(II)的吸附更符合准一级动力学,表明该吸附过程以物理吸附为主.

表1 复合材料对Pb(II)吸附的准一级、准二级拟合参数
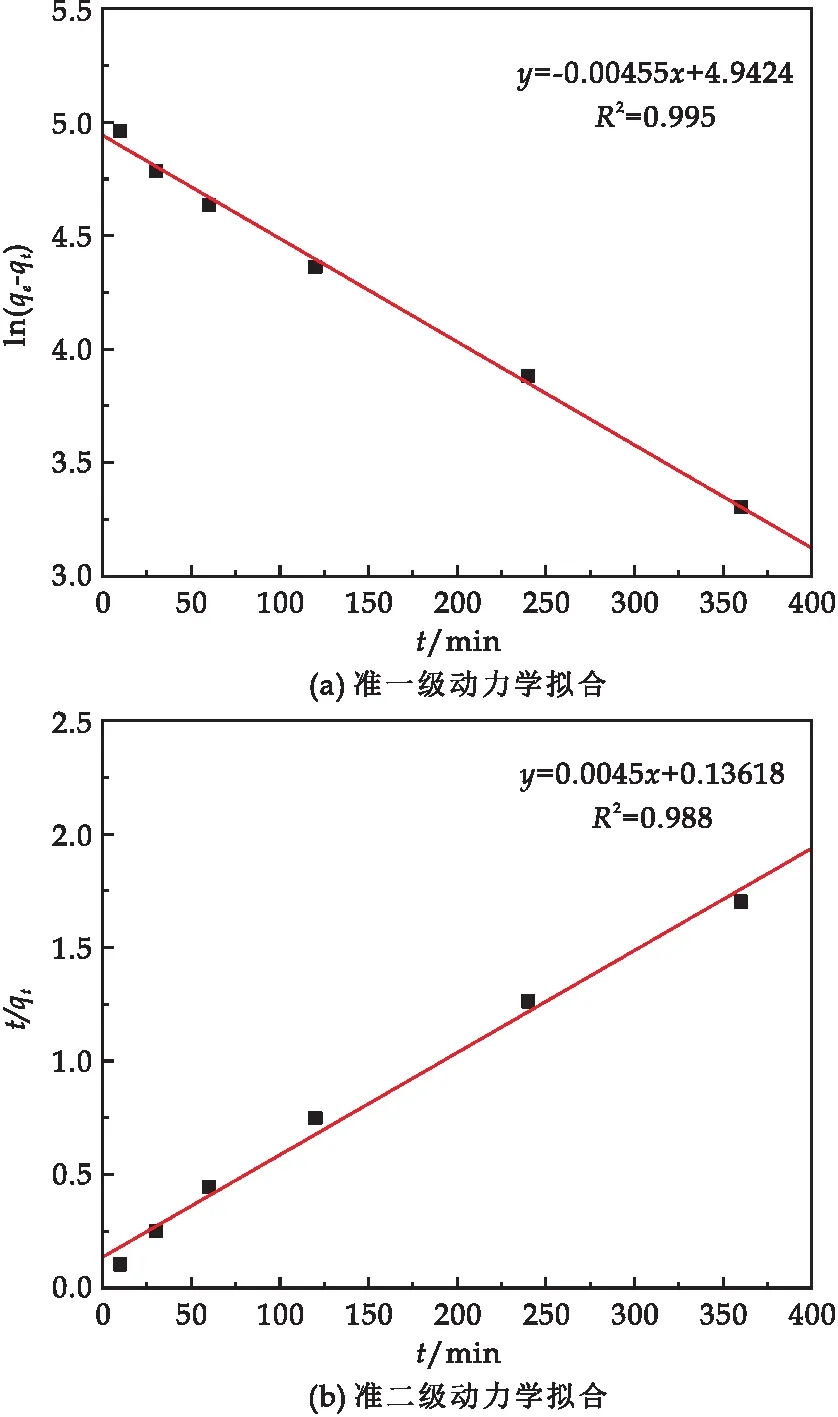
图7 复合材料对Pb(II)吸附的动力学拟合
2.4 SiO2-Mg(OH)2-Fe3O4磁性纳米复合材料对Pb(II)的吸附热力学模拟
分别使用Freundlich模型(公式(5))和Langmuir模型(公式(6))对数据进行拟合,线性拟合结果如图8所示.拟合结果及相关参数(表2)显示, Freundlich模型的R2为0.997 9,而Langmuir模型的R2仅为0.579 5,因此SiO2-Mg(OH)2-Fe3O4对Pb(II)的吸附更符合Freundlich模型,表明该吸附过程以多分子层吸附为主.

表2 Freundlich和 Langmuir拟合参数
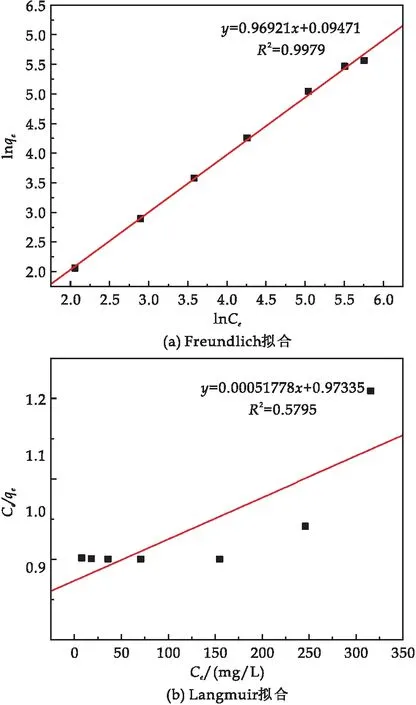
图8 复合材料对Pb(II)吸附的热力学拟合
2.5 吸附后材料的表征
对吸附Pb(II)之后的复合材料进行XRD和SEM分析.如图9所示,吸附前后材料的XRD谱图并无明显变化,并没有检测到Pb(OH)2和Pb的化合物的相关特征峰, SEM结果显示(图10(a)),吸附后材料仍为棒状结构,吸附并不会对材料的微观结构产生显著影响.Mapping分析结果表明,Pb元素富集于材料表面,证实海泡石改性制备的磁性复合材料对Pb的良好吸附性.
以上结果显示,海泡石制备的磁性纳米复合材料主要通过吸附对Pb(II)进行去除.其对Pb(II)优异的吸附效果可归结为: (1) 纳米级别的磁铁矿被负载到材料表面,增大了材料的比表面积,促进其对Pb(II)的吸附;(2)通过酸碱改性,海泡石中结晶态的Mg变成了Mg(OH)2,而Mg(OH)2在水中会释放OH-,增加溶液的pH值,提高SiO2-Mg(OH)2-Fe3O4对Pb(II)的去除率[37].
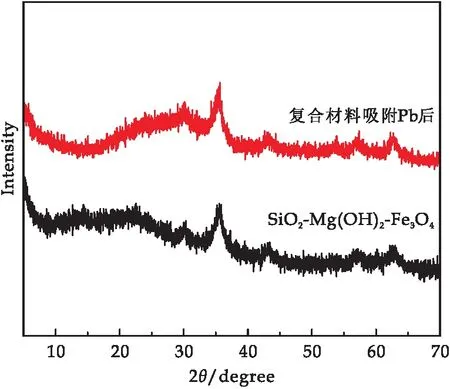
图9 复合材料吸附Pb后的XRD谱图

图10 复合材料吸附Pb后的SEM和Mapping分析
3 结论
本研究中,以海泡石为原料,首先通过酸碱改性制备SiO2-Mg(OH)2,在此基础上负载磁铁矿,制备出具有更大比表面积的SiO2-Mg(OH)2-Fe3O4含镁纳米磁性复合材料.所制备的材料SiO2-Mg(OH)2-Fe3O4在广泛的pH条件下对Pb(II)展现出良好的吸附效果,最大吸附量可达257.6 mg/g.同时,磁性纳米复合材料对低浓度的Pb(II)处理后,Pb(II)的残留浓度低于美国环保局(EPA)饮用水标准.吸附过程动力学中符合准一级动力学模型,在吸附热力学过程更符合Freundlich吸附模型,纳米磁性复合材料对Pb(II)的吸附过程以物理吸附为主.
由于所制备纳米磁性复合材料对重金属Pb(II)有着较为优秀的去除性能,同时天然粘土矿物来源丰富,改性方法简捷,并且吸附剂容易通过磁分离技术与溶液分离,由海泡石改性制备的磁性纳米复合材料在水体重金属处理领域将有着较大的应用潜力.
