一种基于1,5-萘二胺的席夫碱荧光探针的合成及其对Cd2+的荧光识别
2023-05-20边永军渠星宇
边永军, 渠星宇
(晋中学院 化学化工系, 山西 晋中 030619)
0 引言
镉是一种应用广泛的过渡金属,可以被应用到电镀、冶金、农业和核工业等领域[1].但是,废弃的镉化合物又是重要的污染源,会对环境和人体健康造成损害[2,3].例如,在人体内富集过量的镉会导致肺癌、肾功能紊乱及钙代谢失调等生理疾病[4-6].因此,定量的检测镉含量有着重要的意义.
传统的原子吸收光谱[7]、原子荧光光谱[8]以及质谱[9]等检测方法都可以用来精确测试镉离子含量,但这些传统的方法还是有着许多缺点,比如在测试前需要复杂的预处理、昂贵的设备及较长的测试时间,限制了在实际中的应用.近年来兴起的基于有机小分子荧光探针的荧光分析法很好地避免了上述缺点,而且还具有种类丰富、灵敏度高、选择性好等特点,能够用于各种分析物的检测[10,11],被越来越多的化学家所青睐,其研究一直处于方兴未艾的阶段.
目前,已有许多基于不同荧光团构建的有机小分子荧光探针被开发,并应用于各种离子的检测,其中也有许多探针被应用于Cd2+的检测[12-18].在众多荧光探针中,基于稠环类的席夫碱探针由于结构易修饰、荧光量子产率高和摩尔吸光系数大等优良的光物理性质,是应用最为广泛的一类[19-21].本文基于1,5-萘二胺合成了一个席夫碱型的荧光探针1(N,N-二(2-甲基-吲哚-3亚甲基)-1,5-萘二胺),该探针通过Cd2+诱导聚集抑制C=N双键异构化导致荧光增强,从而选择性地识别Cd2+.探针1的合成路线如图1所示.
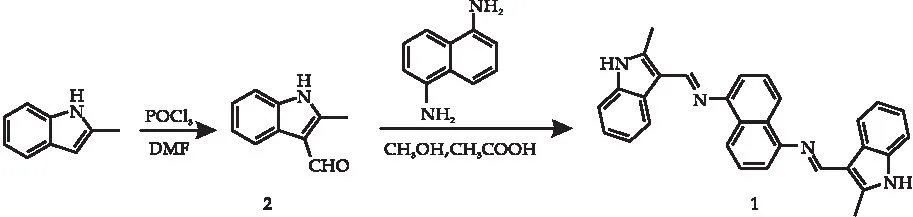
图1 探针1的合成路线
1 实验部分
1.1 主要仪器与试剂
所用仪器有:TU-1901紫外光谱仪、Cary Eclips型荧光光谱仪、Bruker AV600核磁共振仪、WQF-510A傅里叶变换红外光谱仪、Thermo Scientific LTQ Orbitrap XL高分辨质谱仪、X-5T精密显微熔点测定仪等.
所用试剂均为分析纯,2-甲基吲哚(分析纯,天津希恩思生化仪器有限公司),1,5-萘二胺(分析纯,百灵威试剂有限公司).金属离子Na+、K+、Ca2+、Mg2+、Cd2+、Zn2+、Ni2+、Co2+、Fe3+、Al3+等溶液所用金属盐均为氯化盐或水合物,金属Cu2+溶液用CuSO4·5H2O配制.
1.2 实验方法
1.2.1 2-甲基吲哚-3-甲醛(2)的合成
在50 mL圆底烧瓶中加入5.0 mL DMF(N,N-二甲基甲酰胺),冰浴冷却下逐滴加入1.73 mL POCl3.在1 ℃~5 ℃维持20 min后,滴加 5.0 mL 2-甲基吲哚(2.033 g,15.5 mmol)的DMF溶液,缓慢升温至35 ℃反应40 min.待反应完全后,冷却至室温,依次加入10 g碎冰和31 mL 5 mol/L NaOH溶液,然后加热至95 ℃反应30 min.反应结束后,冷却、过滤、用水洗涤、干燥,得到2-甲基吲哚-3-甲醛(棕色固体),2.18 g,产率88%.m.p.205 ℃~206 ℃,Rf=0.46 (展开剂:V(二氯甲烷)∶V(甲醇)=40∶1).1H NMR (CDCl3,600 MHz),δ:10.18 (s,1H),8.69 (br s,1H),8.26 (d,J=12 Hz,1H),7.37 (d,J=12 Hz,1H),7.31-7.26 (m,2H),2.78 (s,3H); IR(KBr,cm-1):3 188,2 361,1 624,1 582,1 463,1 371,1 239,1 157,747.
1.2.2N,N-二(2-甲基-吲哚-3亚甲基)-1,5-萘二胺(1)的合成
在50 mL圆底烧瓶中加入20 mL无水乙醇,加热至60 ℃,搅拌下将2-甲基吲哚-3-甲醛(0.318 4 g,2 mmol)分批加入烧瓶中,待2-甲基吲哚-3-甲醛溶解完全,加入45 μL冰乙酸,再加入1,5-萘二胺(0.158 g,1 mmol),然后将温度升至85 ℃回流3 h.反应结束后,冷却、浓缩,用乙酸乙酯与水进行萃取,有机层用无水硫酸钠干燥,过滤、旋蒸得浅粉色固体,用石油醚和乙酸乙酯进行重结晶,得N,N-二(2-甲基-吲哚-3亚甲基)-1,5-萘二胺0.39 g,产率84%.m.p.308 ℃~310 ℃,Rf=0.32(展开剂:V(二氯甲烷)∶V(甲醇)=40∶1).1H NMR (DMSO-d6,600 MHz),δ:11.73 (s,2H),8.87(s,2H),8.51 (d,J=12 Hz,2H),8.28 (d,J=12 Hz,2H),7.55 (t,J=18 Hz,2H),7.42 (t,J=6 Hz,2H),7.25-7.18(m,6H),2.71(s,6H);13C NMR(DMSO-d6,150 MHz),δ:154.83,150.78,144.25,136.21,129.99,126.64,126.37,122.54,121.49,121.43,120.49,113.26,111.72,111.53; IR(KBr)ν,cm-1:3 359,2 923,2 849,2 361,1 606,1 458,1 389,1 249,1 151,961,753; HR-MS(ESI,C30H25N4,[M+H]+),计算值441.207 37;实验值441.207 46.
1.2.3 金属离子的识别
金属离子(Na+、K+、Ca2+、Mg2+、Zn2+、Ni2+、Co2+,Cu2+、Fe3+、Al3+)溶解到蒸馏水中,浓度为0.1 mol·L-1.Cd2+溶解到蒸馏水中,浓度为0.01 mol·L-1.探针1溶解到DMSO和醋酸与醋酸钠缓冲溶液 (4∶1,V/V,pH=5.00),浓度为10 μmol·L-1.探针1对常见金属离子选择性实验中,取用2.5 mL的探针1到比色皿中,依次分别加入125 μL 0.01 mol·L-1的Cd2+离子和250 μL 0.1 mol·L-1的其它常见金属离子,测定368 nm处的荧光强度.Cd2+识别实验中,取用2.5 mL的探针1到比色皿中,用微量进样器不断加入Cd2+溶液,测定368 nm处的荧光强度.
2 结果与讨论
2.1 探针1的光谱学性质
探针1能够溶解到常见的有机溶剂中,如二甲基亚砜(DMSO)、甲醇(CH3OH)、乙酸乙酯(CH3COOC2H5)、乙腈(CH3CN)、正己烷(n-Hexane)、二氯甲烷(CH2Cl2)等.探针1溶解到常见的不同极性溶剂中的紫外可见吸收光谱图(如图2(a)所示)和荧光光谱图(如图2(b)所示).

图2 探针1的光谱性质
探针1在不同溶剂中吸收峰位于230 nm和365 nm左右,365 nm处的吸收峰归属于萘环与1,5-位C=N键形成大共轭的π→π*跃迁.探针1的吸收光谱在不同溶剂中显示出明显的规律,随着溶剂极性的增大而红移.探针1在甲醇和二氯甲烷溶液中荧光比较弱,在乙酸乙酯、乙腈、正己烷中荧光发射峰位于330 nm左右,在二甲亚砜溶剂中荧光发射峰位于368 nm,溶剂的极性对探针1的荧光发射峰没有表现出明显的规律.探针1对离子的识别选用了DMSO作为有机溶剂.
2.2 DMSO与水的混合比、溶液pH对探针1荧光的影响
为了选取合适的DMSO和水的混合溶剂,测试了探针1溶解到不同比例DMSO和水溶液,在368 nm处的荧光强度随混合比变化的曲线(如图3(a)所示).当混合溶液中水的比例增大到20%,探针1在368 nm处的荧光强度基本不变,当水的比例大于20%,探针1在368 nm处的荧光强度有明显的下降.因此,探针1识别金属离子选用的混合溶剂中水的比例为20%.同时研究了溶液pH对探针1荧光强度的影响(如图3(b)所示).
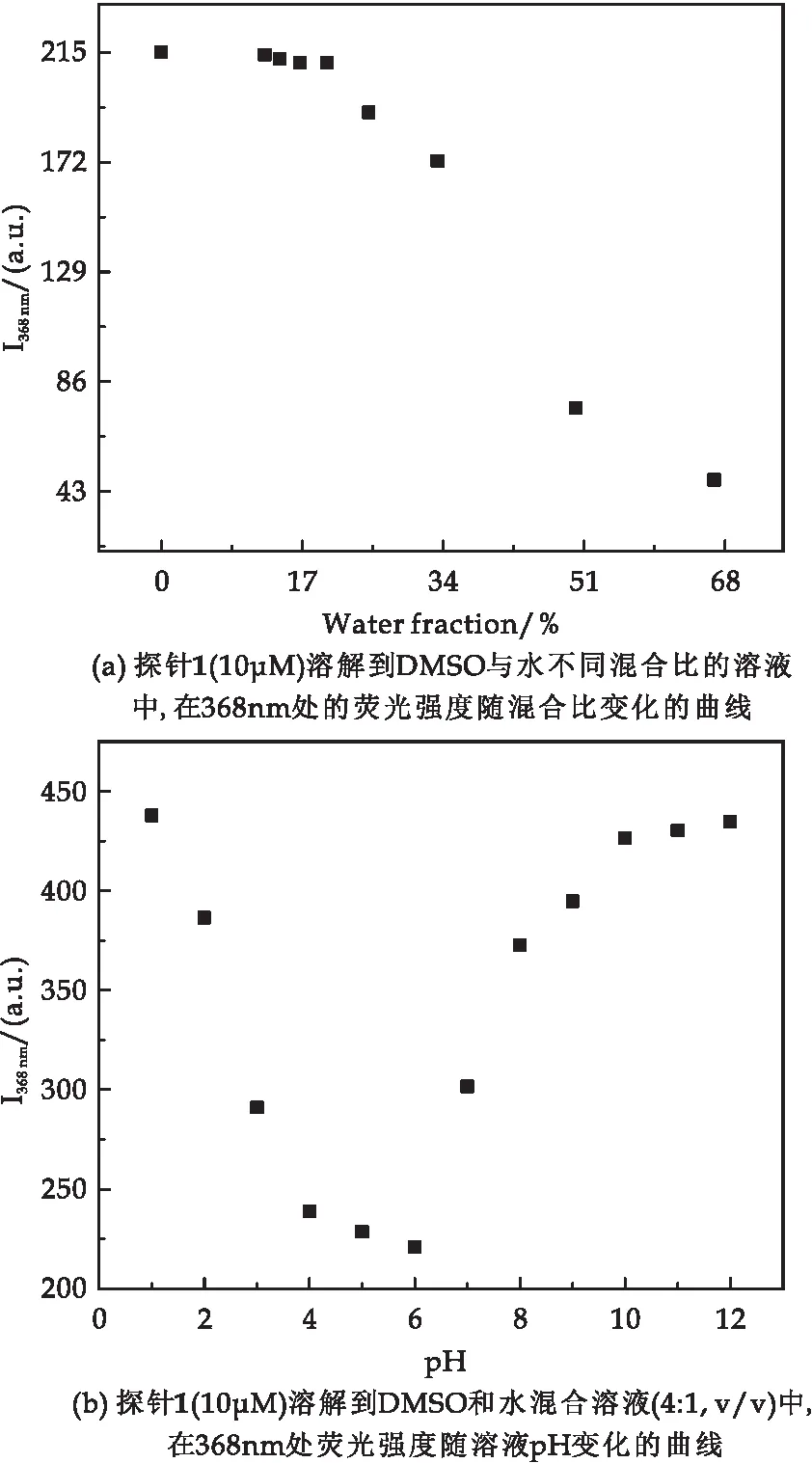
图3 溶剂混合比和溶液pH对探针1的荧光影响
探针1溶解到DMSO与水的混合溶液(VDMSO∶V水=4∶1),测试了探针1在不同pH溶液中368 nm处的荧光强度.实验结果表明,探针1在酸性(pH为4~6)溶液中荧光强度变化不大,在强酸性(pH<3)、弱酸性溶液(pH为6~7)和碱性溶液中荧光强度上升.故而在研究探针1对镉离子识别实验中采用了DMSO和醋酸与醋酸钠缓冲溶液(4∶1,v/v,pH=5.00).
2.3 探针1对常见金属离子识别
探针1对Cd2+具有高效的选择性,测定了探针1与Cd2+的反应时间和探针1与常见金属离子的荧光响应.首先测定了探针1与Cd2+的反应时间(如图4(a)所示).实验结果显示,探针1溶解到DMSO和醋酸与醋酸钠缓冲溶液(4∶1,v/v,pH=5.00)中,368 nm处的荧光强度不随时间的增加而改变;在相同的条件下,探针1溶液中加入0.5 mmol·L-1的Cd2+溶液,1 min后368 nm处的荧光强度随时间的增加发生明显的上升,25 min后荧光强度保持不变.因此,探针1和探针1与Cd2+反应物在DMSO和醋酸与醋酸钠缓冲溶液(4∶1,v/v,pH=5.00)中能够稳定存在,同时探针1与Cd2+反应时间为1 min.
其次,测定了探针1与常见金属离子的荧光响应(如图4(b)所示).探针1溶解到DMSO和醋酸与醋酸钠缓冲溶液(4∶1,v/v,pH=5.00),分别加入10 mmol·L-1常见金属离子(Na+、K+、Ca2+、Mg2+、Zn2+、Ni2+、Co2+、Cu2+、Fe3+、Al3+)和0.5 mmol·L-1Cd2+,静置1 min,测试了溶液在368 nm处的荧光强度.荧光测试结果表明,加入50倍的Cd2+使探针1在368 nm处的荧光强度增大3.58倍;加入1 000倍的其它常见金属离子使探针1在368 nm处的荧光强均发生下降,具体下降的数值为:Ca2+、Cu2+、Mg2+、Co2+、Al3+、K+、Ni2+、Zn2+、Na+、Fe3+分别为11%、21%、22%、22%、32%、36%、37%、37%、45%、61%.因此探针1对Cd2+的检测具有选择性,可以作为荧光增强型的镉离子荧光探针.

图4 金属离子对探针1的荧光影响
2.4 探针1对溶液中的镉离子的识别
探针1对Cd2+识别的灵敏度高.测试了探针1的荧光光谱随着Cd2+加入量不同的变化曲线,其结果如图5(a)所示.

图5 探针1对Cd2+的荧光响应
荧光光谱图及动力学曲线表明,随着Cd2+加入量的增大,探针1在368 nm处的荧光峰强度增强,当加入20倍的Cd2+时,368 nm处的荧光强度增加到最大.测试了探针1与Cd2+的荧光动力学曲线,其结果如图5(b)所示.由荧光动力学曲线得到溶液荧光强度和Cd2+浓度的线性关系为y=3 437x-269,线性相关系数为0.922 4,计算出探针1检测Cd2+的最低检出限为0.26 μmol·L-1.因此探针1可以在溶液中检测Cd2+的存在,是荧光增强型的镉离子荧光探针.
2.5 探针1对Cd2+的识别机理研究
为了探究探针1对Cd2+的识别机理,本文对探针1进行了1H NMR测定实验.实验结果显示,探针1在加入Cd2+(5 eqv)后,1H NMR谱中所有峰的化学位移值均向高场发生了微小的移动(约0.01 ppm),表明探针1与Cd2+发生了微弱的配位.根据相关文献[21],推测探针1对Cd2+的识别机理为Cd2+对探针1发生诱导聚体,抑制了亚胺C=N双键旋转异构化,导致荧光增强(如图6所示).
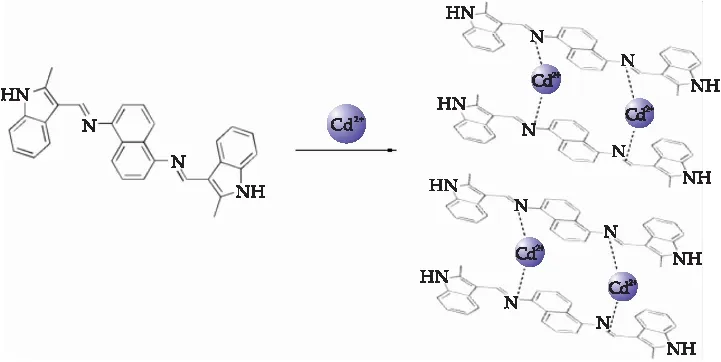
图6 探针1对Cd2+的可能识别机理
3 结论
本文合成一个基于萘二胺类的探针,在萘二胺的1,5-位通过席夫碱引入吲哚基团,得到探针1,并进行了相应的表征.探针1能够在DMSO和缓冲溶液(pH=5.00)中高灵敏度的检测Cd2+,检出限为0.26 μmol·L-1.同时探针1对镉离子检测的选择性非常好,常见的金属离子均不干扰.探针1能够作为一种荧光增强型的Cd2+荧光探针,可用于检测水溶液体系中镉离子的含量.
