18种观赏植物F3′5′H基因生物信息学分析
2023-05-19曾慧兰高阳卢毅
曾慧兰 高阳 卢毅







摘要 采用生物信息学方法对18种观赏植物类黄酮-3′5′-羟化酶基因(flavonoid-3′5′-hydroxylase,F3′5′H)的mRNA和氨基酸序列的理化性质、跨膜结构域、保守结构域、亚细胞定位、二级结构、三级结构和同源性进行预测与分析。结果表明,绝大多数观赏植物的F3′5′H为亲水性稳定蛋白质,以α 螺旋为主、无信号肽的跨膜蛋白质;大多数定位于内质网膜上;其三级结构模型为5ylw.1.A 铁锈醇合成酶,为单链蛋白,属于细胞色素P450基因家族;同源保守氨基酸序列为“LPPGP”“AGTDTS”和“PFGAGRRICAG”。
关键词 生物信息学;观赏植物;氨基酸序列;类黄酮-3′5′-羟化酶
中图分类号 S 68 文献标识码 A 文章编号 0517-6611(2023)07-0103-07
doi:10.3969/j.issn.0517-6611.2023.07.026
Bioinformatical Analysis of Flavonoid-3′5′-Hydroxylase Genes Originated from 18 Ornamental Plants
ZENG Hui-lan1,2,GAO Yang1,LU Yi1
(1.College of Life Science and Resources and Environment,Yichun University,Yichun,Jiangxi 336000; 2. Key Laboratory of Crop Growth,Development and Regulation,Yichun University,Yichun,Jiangxi 336000)
Abstract Predictive analyses of the mRNA sequence or amino acid sequences of the flavonoid 3′5′-hydroxylase gene (F3′5′H) originated from 18 ornamental plants and their physical and chemical parameters,transmembrane domains,conserved domains,subcellular localizations,secondary structure,tertiary structure and evolutionary relationships were explored using bioinformatics method.The results suggested that most F3′5′H of the 18 ornamental plants are hydrophilic stable proteins and transmembrane proteins ,which are mainly made of alpha-helix and no signal peptides; they are mostly located on endoplasmic reticulum membrane and assigned to 5ylw.1.A,which belongs to cytochrome P450 superfamily and is a monomer named ferruginol synthase in tertiary structure analysis;the Homologous conserved amino acid sequences are “LPPGP” “AGTDTS” and “PFGAGRRICAG”.
Key words Bioinformatical;Ornamental plants;Amino acid sequence;Flavonoid-3′5′-hydroxylase
基金项目 江西省作物生长发育调控实验室开放课题项目(KFJJ-201704);宜春学院博士科研启动项目(2103360117013)。
作者简介 曾慧兰(1986—),女,江西宜春人,讲师,博士,从事花色机理和园艺植物病害研究。
收稿日期 2022-04-12
花色是观赏植物的重要性状,植物的花色主要是由黄酮类化合物、类胡萝卜素和生物碱3类物质含量决定的[1],而花色苷是黄酮类化合物的主要组成之一,能控制花的橙红到蓝紫等颜色[2]。类黄酮-3′5′-羟化酶 (flavonoid -3′5′ -hydroxylase,F3′5′H) 是花色苷代谢途径中的关键酶之一[3]。F3′5′H催化花色素母体B环3′、5′位形成羟基集团,最终形成使花变蓝的飞燕草色素,被称为“蓝色基因”[4],所以它對蓝色花的育种具有非常重要的作用[5]。
目前,已从鹤望兰(Strelitzia reginae)、矮牵牛 (Petunia hybrida)、非洲堇 (Saintpaulia spp.)、细茎石斛 (Dendrobium moniliforme) 等多种植物中分离出F3′5′H基因并对其功能进行了深入研究[6-9]。黄敏玲等[8]采用RT-PCR和RACE方法从鹤望兰(Strelitzia reginae)黄色花萼中克隆到类黄酮生物合成途径关键基因SrF3′5′H,并分析了其在鹤望兰不同花期和花瓣中的表达含量。Qi 等[10]利用转基因技术和qRT-PCR验证了蝴蝶兰属(Phalaenopsis) PhF3′5′H在花色中的功能。严黎等[11]通过利用PCR方法扩增了丹参 (Salvia miltiorrhiza Bunge) 中的F3′5′H基因全长,并对该基因编码蛋白质的理化定性、亚细胞定位、结构域等进行了分析。方颖等[12]以华丽龙胆 (Gentiana sino-ornata) 为材料利用RT-PCR技术克隆了GsF3′5′H全长,并进行了生物信息学分析。也有不少研究利用转录组测序技术关注不同花色植物中F3′5′H的表达与功能,并进行生物信息学分析[2,13-14]。虽然当前植物中F3′5′H基因功能和表达情况的研究不少,但目前对各植物中F3′5′H进行系统比较生物信息学相关的详细分析鲜有报道。
该研究利用生物信息学原理和软件,对NCBI GenBank 数据库中已正式发表的18种观赏植物的F3′5′H基因全长mRNA和氨基酸序列进行理化性质、亚细胞定位、跨膜结构、保守区域、二级结构、三级结构和同源性进行分析,旨在为蓝色花卉的分子育种提供理论参考依据。
1 材料与方法
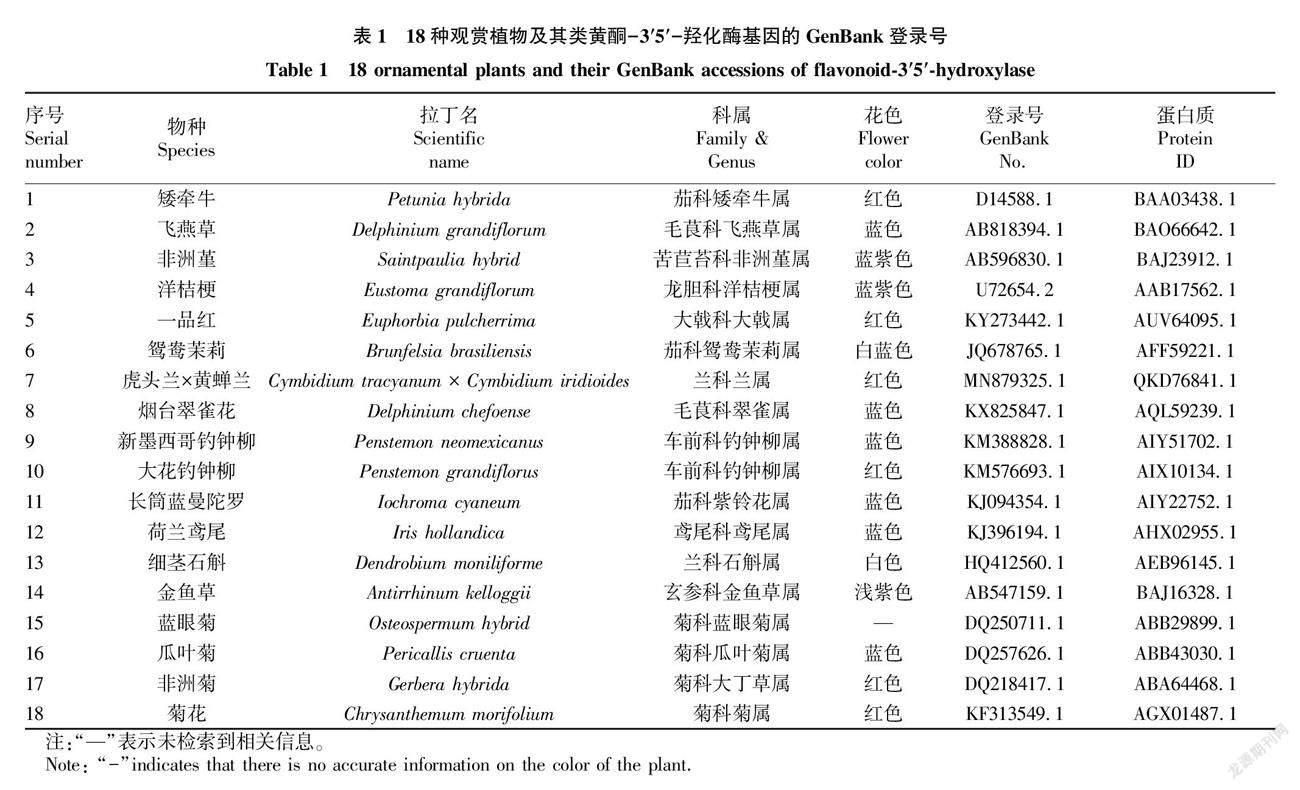
1.1 材料 从美国国家生物技术信息中心 (National Center for Biotechnology Information,NCBI) GenBank数据库中检索已正式注册、物种来源明确的18种观赏植物的F3′5′H基因全长mRNA核酸序列及其编码的氨基酸序列 (表1)。在这18种观赏植物中,蓝紫色系花卉有10种,红色系有6种,其他色系2种。
1.2 分析方法
運用ProtParam[15](https://web.expasy.org/protparam/) 对氨基酸的基本理化性质即氨基酸数、分子式、相对分子量、理论等电点、稳定性系数、带负电残基总数 (Asp+Glu)、带正电残基总数 (Arg+Lys)、亲疏水性和脂肪族氨基酸指数进行在线分析;通过SignalP 4.1[16](https://services.healthtech.dtu.dk/service.php?SignalP-4.1) 和SignalP 5.0[17] (https://services.healthtech.dtu.dk/service.php?SignalP-5.0) 对各序列的信号肽进行预测;利用TMHMM 2.0[18] (https://services.healthtech.dtu.dk/service.php?TMHMM-2.0) 分析氨基酸序列的跨膜结构域,并通过SMART[19] (http://smart.embl.de/smart/change_mode.pl) 验证跨膜区域;运用PSORT[20] (http://psort1.hgc.jp/form.html)在线软件对氨基酸序列进行亚细胞定位分析;利用WebLogo 3[21] (http://weblogo.threeplusone.com/create.cgi) 进行保守区域分析;利用SOPMA[22] (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html) 进行氨基酸序列的二级结构分析;利用SWISS-MODEL[23] (https://swissmodel.expasy.org/) 进行氨基酸序列的三级结构分析;利用MEGA 11[24] (https://www.megasoftware.net/) 进行上述序列的多重比对,寻找保守区域,并采用邻接法 (Neighbor-Joining,NJ) 迭代数为999次建立系统发育树,分析其在遗传学上的亲缘关系。
2 结果与分析
2.1 F3′5′H理化性质分析
通过ProtParam 在线软件对18种观赏植物F3′5′H基因所编码蛋白质的理化性质进行分析 (表2),结果表明,18种观赏植物F3′5′H基因编码的氨基酸数为502~535,平均为510.1;相对分子量为55 827.39~58 080.35,平均为56 737.91;理论等电点为6.52~9.31,平均为8.39;不稳定性系数为28.58~47.99,平均为38.365;带负电残基总数 (Asp+Glu)为49~60,平均为54.5;带正电残基总数 (Arg+Lys) 为52~66,平均为58.9;亲水性平均系数为-0.146~0.085,平均为-0.041;脂肪族氨基酸指数为90.22~106.54,平均为96.42。从表2可知,有11种观赏植物的F3′5′H为稳定的亲水性蛋白质,占比61.11%;有4种观赏植物的F3′5′H为不稳定的亲水性蛋白质,占比22.22%;有2种观赏植物的F3′5′H为稳定的疏水性蛋白质,占比11.11%;有1种观赏植物的F3′5′H为不稳定的疏水性蛋白质,占比5.56%。
2.2 F3′5′H信号肽和跨膜区域分析
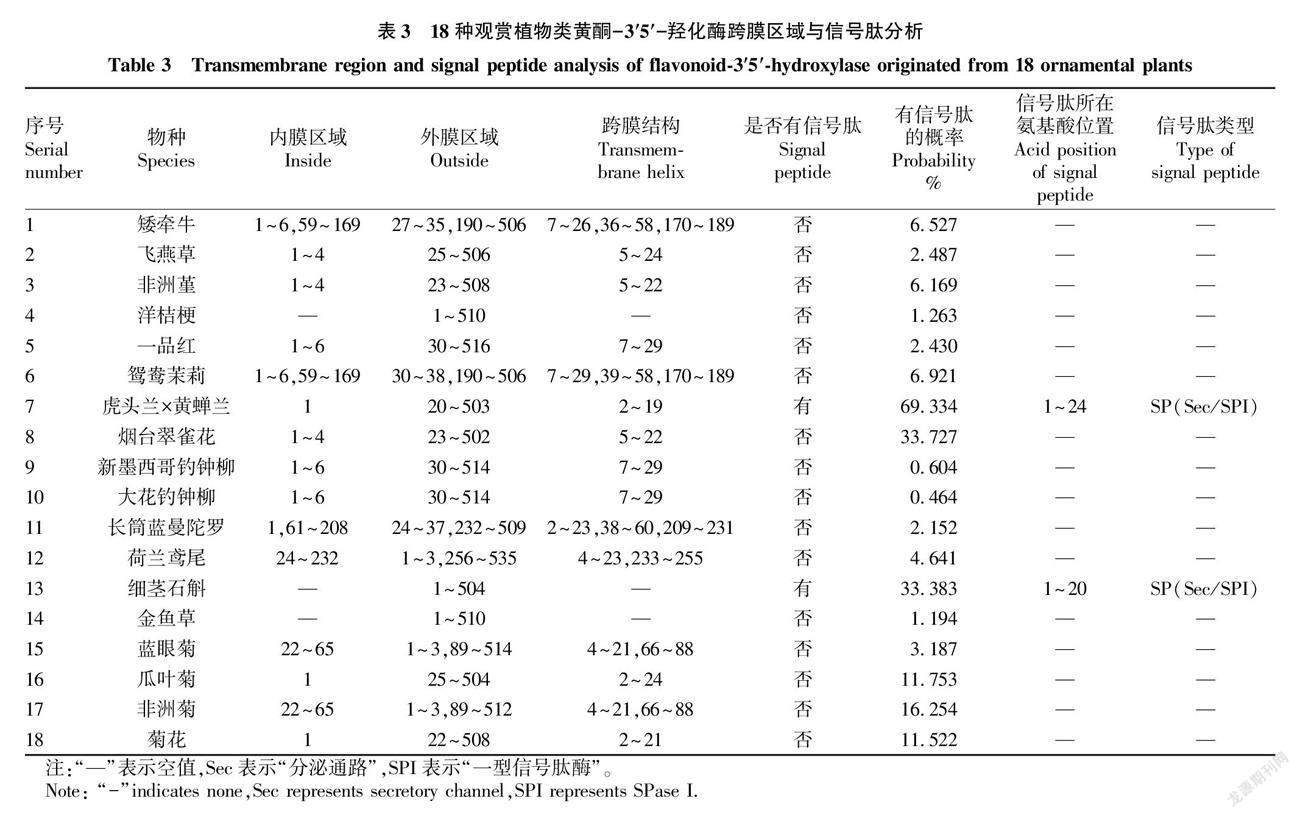
信号肽的主要作用是促进蛋白分泌到胞外,通常位于氨基酸序列的N端,是引导新合成的蛋白质向分泌通路转移的短肽链[25],一般长度为5~30个氨基酸。通过SignalP 4.1和5.0对F3′5′H编码的蛋白质进行信号肽分析 (表3),结果表明,所测的16种观赏植物的F3′5′H均无信号肽,只有虎头兰×黄蝉兰和细茎石斛具有信号肽,信号肽所在位置分别为1~24位和1~20位氨基酸,且都与分泌 (Sec/secretory) 通路相关的能被一型信号肽酶 (SPI) 切除的信号肽。从表3可知,有15种植物的F3′5′H为跨膜蛋白,具有内膜区域、外膜区域和跨膜区域;有3种植物的F3′5′H无跨膜区域,只有外膜区域。经SMART分析验证,TMHMM 2.0所测的跨膜区域与SMART分析的结构域一致。
2.3 F3′5′H亚细胞定位分析
通过PSORT在线分析了8种观赏植物F3′5′H的亚细胞定位 (表4),根据定位频率和可靠性可知,该类蛋白位于内质网膜的可能性最大,为0.640~0.820,平均可靠性为0.786;其次为质膜、内质网腔、细胞核、过氧化物酶体、细胞外、高尔基体,最后为线粒体基质空间和叶绿体类囊体膜上。结合细胞生物学知识,可预测得F3′5′H可能有以下几类运输方式来行使催化功能:一类是F3′5′H蛋白在游离核糖体中合成后,通过信号肽锚定于内质网膜上,通过跨膜运输和膜泡方式分选到过氧化物酶体等细胞器行使催化功能,如虎头兰×黄蝉兰;第二类是在游离核糖体中合成后,通过信号肽锚定于内质网膜上,通过分泌方式分选到过氧化物酶体等细胞器行使催化功能,如细茎石斛;第三类是在游离核糖体中合成后转移至内质网膜上,以跨膜运输方式经内质网腔再直接运输到胞外行使催化功能,如飞燕草、一品红、烟台翠雀花、新墨西哥钓钟柳、大花钓钟柳、荷兰鸢尾;第四类是在游离核糖体中合成后转移至内质网膜上,通过跨膜运输方式分选到线粒体、叶绿体、高尔基体、过氧化物酶体等细胞器后行使催化功能,如非洲堇、长筒蓝曼陀罗、蓝眼菊、瓜叶菊、菊花;第五类是直接由细胞核内合成,不经跨膜方式,可能直接在细胞质中的线粒体、叶绿体等细胞器的特定部位中行使催化功能,如洋桔梗。
2.4 F3′5′H二级结构和三级结构分析
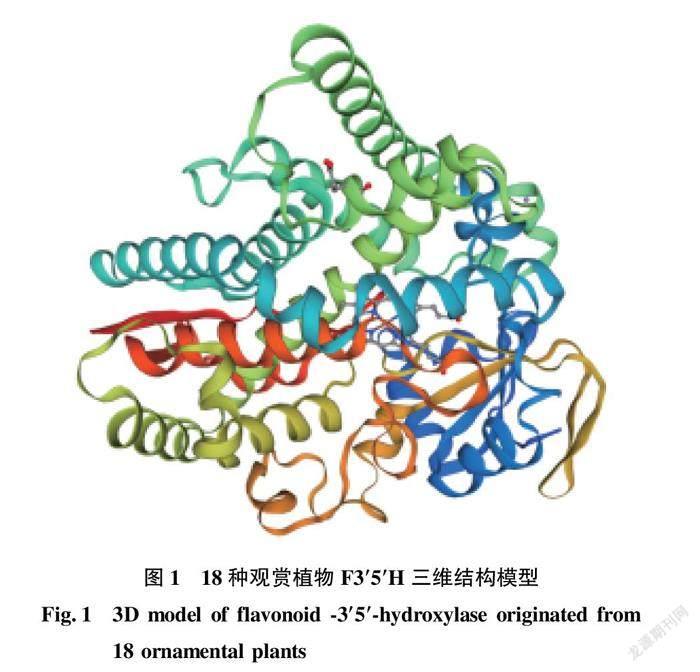
通过SOPMA软件在线预测了18种观赏植物F3′5′H的二级结构 (表5),表明F3′5′H主二级结构主要以 α 螺旋为主,其次为无规则卷曲、延伸主链,最少的二级结构是β转角。通过SWISS-MODEL同源建模预测结果中可知 (表6),所测的所有蛋白质序列一致度均大于30%,适合用同源建模法进行三级结构预测,即符合SWISS-MODEL建模质量评估条件,同时质量评估系数 GMQE和QMEAND值均较大(取值范围为0~1),建模可靠。从表6可知,所测的18种观赏植物F3′5′H的三级结构均建模至同一蛋白模型 5ylw.1.A 铁锈醇合成酶 (图1),为单链蛋白,属于细胞色素P450基因家族。
2.5 F3′5′H同源比对和系统发育分析
经MEGA 11中ClustalW比对分析,18种F3′5′H 编码氨基酸的保守位点总计121个,明显的保守序列有起始于48位的“LPPGP”序列、起始于334位的“AGTDTS”序列和起始于469位的“PFGAGRRICAG”序列。从WebLogo 3结果可知 (图2),保守序列和ClustalW分析序列基本一致。
从构建的系统发育树 (图3) 可知,属于同科植物的F3′5′H 其亲缘关系较近,分属茄科、菊科、兰科、毛茛科、车前科的13种观赏植物在科内F3′5′H亲缘关系近。在不同科属间,茄科与龙胆科的洋桔梗和大戟科的一品红F3′5′H亲缘关系近;车前科与玄参科的金鱼草和苦苣苔科的非洲堇F3′5′H亲缘关系较近;鸢尾科的荷兰鸢尾与菊科F3′5′H亲缘关系较近。
3 结论与讨论
观赏植物的类黄酮-3′5′-羟基化酶 (F3′5′H) 是花青苷代谢途径中重要的关键酶,对蓝紫色花色的形成有重要的作用。目前越来越多的研究关注F3′5′H的基因功能,并对其功能进行验证[3,10,14],但国内外极少数研究从生物信息学角度关注各种观赏植物F3′5′H基因和蛋白质序列的差异。该研究从GenBank中搜索已发表的F3′5′H全长mRNA序列及其编码的蛋白质,共筛选出18种观赏植物的核酸和蛋白质序列,从理化性质、亚细胞定位、保守序列、二级结构、三级结构、同源性等方面进行分析。
从理化性质和二级结构来看,虽然不同物种间的F3′5′H蛋白质理化性质略有差异,但大部分物种的不稳定性系数为小于40,亲水性平均系数为负值,且二级结构均以α螺旋为主,表明该类酶为以α螺旋为主的稳定亲水性单链蛋白,这与杨晓娜等[26]分析结果相一致。从三级结构来看,所测18种观赏植物均建模至蛋白模型 5ylw.1.A 铁锈醇合成酶,由此可推断,在所有的分析指标中,三维结构可能是与其功能密切相关的一个指标,为有待进一步挖掘的功能指标。跨膜结构域、信号肽和亚细胞定位分析表明,15种植物的F3′5′H为P450基因家族跨膜蛋白,具有内膜區域、外膜区域和跨膜区域,也进一步说明了该蛋白的形成是经过了跨膜运输加工后行使功能,且虎头兰×黄蝉兰和细茎石斛有信号肽指引蛋白质通过分泌通路进行转移,这与杨晓娜等[26]分析结果基本一致。从序列同源性特征来看,F3′5′H有3个较保守的序列,分别是起始于48位的“LPPGP”序列连接膜锚定位点和酶蛋白球体部分的结合域、起始于334位的“AGTDTS”序列氧分子形成结合域和起始于469位的“PFGAGRRICAG”序列血红素结合域,这与杨晓娜等[26]分析结果一致。从系统发育树来看,F3′5′H蛋白质序列可明显表示出不同植物间的亲缘关系,保守性较高,有利于区分不同物种间的亲缘关系,该特性可能使其用于物种间的鉴定,提高物种分辨率。
近期虽然已有研究进行了高等植物F3′5′H基因cDNA及其氨基酸序列的生物学分析[26],但从该分析来看并未将所列植物的具体信息进行详细剖析,且多数植物的信息不够具体全面,甚至有些序列与该研究相同,但得出了不同的结果。原因可能为在线软件的版本问题,或者虽然杨晓娜等[26]的研究列出23种高等植物的信息,但并未将该23种植物的全部信息详细列出,而是进行了概述与总结。
生物信息学是采用数学、统计学和计算机等方法分析生物学、生物化学等数据的一门综合性学科。当前基因组学、转录组学和蛋白质组学测序技术的发展,促进了生物信息学的发展,而生物信息学也从各方面更好地辅助了生物学和育种技术的发展。利用生物信息学分析了18种观赏植物F3′5′H蛋白质序列的基本信息并做了详细的剖析,可为后期蓝色花的育种技术提供理论依据。
参考文献
[1] TANAKA Y,BRUGLIERA F,CHANDLER S.Recent progress of flower colour modification by biotechnology[J].International journal of molecular sciences,2009,10(12):5350-5369.
[2] GUO L P,WANG Y J,DA SILVA J A T,et al.Transcriptome and chemical analysis reveal putative genes involved in flower color change in Paeonia ‘Coral Sunset’[J].Plant physiology and biochemistry,2019,138:130-139.
[3] HUANG H,HU K,HAN K T,et al.Flower colour modification of chrysanthemum by suppression of F3′H and overexpression of the exogenous Senecio cruentus F3′5′H gene[J].PLoS One,2013,8(11):1-12.
[4] TANAKA Y,BRUGLIERA F.Flower colour and cytochromes P450[J].Philosophical transactions of the royal society B:Biological sciences,2013,368:1-14.
[5] 张泰然,张和臣,武荣花.蓝色花形成分子机理研究进展[J].植物学报,2020,55(2):216-227.
[6] SATO M,KAWABE T,HOSOKAWA M,et al.Tissue culture-induced flower-color changes in Saintpaulia caused by excision of the transposon inserted in the flavonoid 3′,5′ hydroxylase (F3′5′H) promoter[J].Plant cell reports,2011,30(5):929-939.
[7] 李莉,祁银燕,解燕,等.矮牵牛编码 F3′5′H 的蓝色基因表达载体构建及转化[J].西北植物学报,2011,31(6):1090-1096.
[8] 黄敏玲,樊荣辉.鹤望兰类黄酮3′,5′-羟化酶基因 SrF3′5′H 的克隆及表达分析[J].中国细胞生物学学报,2012,34(11):1117-1122.
[9] WHANG S S,UM W S,SONG I J,et al.Molecular analysis of anthocyanin biosynthetic genes and control of flower coloration by flavonoid 3′,5′-hydroxylase (F3′5′H) in Dendrobium moniliforme[J].Journal of plant biology,2011,54(3):209-218.
[10] QI Y Y,LOU Q,QUAN Y H,et al.Flower-specific expression of the Phalaenopsis flavonoid 3′,5′-hydoxylase modifies flower color pigmentation in Petunia and Lilium[J].Plant cell,tissue and organ culture,2013,115(2):263-273.
[11] 严黎,刘琬菁,杨成民,等.丹参 F3′5′H 基因克隆及其序列分析[J].世界中醫药,2020,15(5):689-695,701.
[12] 方颖,黄启群,金雪花. 华丽龙胆GsF3′5′H和GsFNS基因的克隆及表达分析[J].西北植物学报. 2020,40(12): 2023-2030.
[13] LIANG C Y,RENGASAMY K P,HUANG L M,et al.Assessment of violet-blue color formation in Phalaenopsis orchids[J].BMC plant biology,2020,20(1):1-16.
[14] LU C F,LI Y J,CUI Y M,et al.Isolation and functional analysis of genes involved in polyacylated anthocyanin biosynthesis in blue Senecio cruentus[J].Frontiers in pant science,2021,12:1-20.
[15]
GASTEIGER E,HOOGLAND C,GATTIKER A.Protein identification and analysis tools on the ExPASy server[M]//WALKER J M.The proteomics protocols handbook.Totowa,NJ:Humana Press,2005:571-607.
[16] PETERSEN T N,BRUNAK S,VON HEIJNE G,et al.SignalP 4.0:Discriminating signal peptides from transmembrane regions[J].Nature methods,2011,8(10):785-786.
[17] ALMAGRO ARMENTEROS J J,TSIRIGOS K D,SNDERBY C K,et al.SignalP 5.0 improves signal peptide predictions using deep neural networks[J].Nature biotechnology,2019,37(4):420-423.
[18] MLLER S,CRONING M D,APWEILER R.Evaluation of methods for the prediction of membrane spanning regions[J].Bioinformatics,2001,17(7):646-653.
[19] LETUNIC I,KHEDKAR S,BORK P.SMART:Recent updates,new developments and status in 2020[J].Nucleic acids research,2021,49:D458-D460.
[20] NAKAI K,KANEHISA M.Expert system for predicting protein localization sites in gram-negative bacteria[J].Proteins-structure function and bioinformatics,1991,11(2):95-110.
[21] CROOKS G E,HON G,CHANDONIA J M,et al.WebLogo: A sequence logo generator[J].Genome research,2004,14(6):1188-1190.
[22] GEOURJON C,DELAGE G.SOPMA:Significant improvements in protein secondary structure prediction by consensus prediction from multiple alignments[J].Computer applications in the biosciences,1995,11(6):681-684.
[23] WATERHOUSE A,BERTONI M,BIENERT S,et al.SWISS-MODEL:Homology modelling of protein structures and complexes[J].Nucleic acids research,2018,46(W1):W296-W303.
[24] TAMURA K,STECHER G,KUMAR S.MEGA11: Molecular evolutionary genetics analysis version 11[J].Molecular biology and evolution,2021,38(7):3022-3027.
[25] 郑斌,詹希美.信号肽序列及其在蛋白质表达中的应用[J].生物技术通讯,2005,16(3):296-298.
[26] 杨晓娜,陈自宏,陈宏艳,等.高等植物类黄酮3′5′-羟化酶基因cDNA及其氨基酸序列的生物信息学分析[J].保山学院学报,2021,40(2):24-32.
