基于RPA技术对转CP4-EPSPS基因产品的快速检测
2023-05-17胡秀文邓波王金斌刘华唐雪明王宇曾海娟蒋玮李红
胡秀文, 邓波, 王金斌, 刘华*, 唐雪明, 王宇,曾海娟, 蒋玮, 李红
(1.上海海洋大学食品学院,上海 201306; 2.上海市农产品质量安全中心,上海 201708; 3.上海农业科学院生物技术研究所,上海 201106; 4.上海交通大学农业与生物学院,上海 200240; 5.兰州理工大学生命科学与工程学院,兰州 730050; 6.上海市农业科学院畜牧兽医研究所,上海 201106)
2019 年,全世界转基因作物(genetically modified crops,GMC)的种植面积约27 亿 hm2,比1996 年增加了约112 倍[1-2]。据统计,全球五大种植国的转基因作物应用率已经接近饱和,如美国(大豆、玉米和油菜的平均应用率95%)、巴西(94%)、阿根廷(约100%)、加拿大(90%)和印度(94%)。目前,抗虫和抗除草剂作物是最重要的2 种转基因作物[3]。其中,转基因抗草甘膦除草剂作物是将CP4-5-烯醇丙酮酸酯-3-磷酸合酶基因(CP4-5-enol acetate-3-phosphate synthase gene,CP4-EPSPS)[4]转入作物基因组中[5-6],该基因表达的CP4-EPSPS 蛋白表现出对草甘膦较强的耐受性[7]。抗除草剂转基因作物的种植面积约占43%,而具有抗除草剂和其他性状的复合性状占比约为45%。转基因作物广泛种植对环境的风险引起了公众的极大关注,因此,研究转入CP4-EPSPS基因的转基因产品及其制品对于食品安全和预防生态潜在风险具有重要意义。全球用于食品、饲料、加工和种植用途的转基因作物转化体的批准数目越来越多,其中占比最高的是大豆、玉米、棉花和油菜。由于转基因作物的迅速推广,一些非法转基因作物逐渐显现。2020年12月欧盟食品和饲料类快速预警系统(Rapid Alert System for Food and Feed,RASFF)对华食品通报中指出,非法转基因问题是我国食品出口贸易的主要问题[8]。尽管许多国家已经实施了严格的转基因标签规定,但未经授权和不受控制的转基因作物种植依然被发现。因此,对转基因作物的检测在农产品安全监管中至关重要,迫切需要一种快速、灵敏、便携、低成本和易操作的检测技术对转基因作物进行检测。
目前,聚合酶链式反应(polymerase chain reaction,PCR)、酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)和蛋白质测试条是检测转基因作物最常用的方法[9]。基于蛋白质水平的检测方法,如ELISA或胶体金试纸条,获得转基因抗原的抗体较难,且制备过程耗时又昂贵,故基于蛋白质水平的检测方法适用的转基因作物靶标蛋白有限。PCR技术是核酸检测水平上最常用的方法,然而,由于检测时间长和需要热循环仪等限制因素,无法做到现场速测。近年来出现的等温扩增方法[10-11],如 环 介 导 等 温 扩 增[12](loop-mediated isothermal amplification,LAMP)、交叉引物扩增[13](cross-priming amplification,CPA)和 滚 环 扩 增[14](rolling circle amplification,RCA),虽已克服热循环仪的限制,但多数仍需要长达1 h才能完成DNA扩增。
自2006 年以来,省时和方便的重组酶聚合酶扩 增(recombinase polymerase amplification,RPA)[15-16]技术成为广泛应用于病毒检测的等温核酸检测技术之一,该系统识别度高且速度快,能够将靶标片段快速扩增至可检测水平[17-18],主要由3种核心酶组成,包括重组酶、单链DNA结合蛋白(single-stranded DNA-binding protein,SSB)和链状聚合酶。在反应开始时,引物定位于同源序列,进行链交换反应以形成和启动DNA 合成,并以指数扩增模板上的靶标区域,其扩增产物在10 min 内便可达到检测水平;反应结束后,采用琼脂糖凝胶电泳检测扩增产物。与传统PCR 相比,RPA 因其所需时间短、且实现等温(37~42 ℃)扩增而广受欢迎[19],已广泛应用于病毒或细菌的检测[20-22]。食品安全问题与民生息息相关,为有效防控食品安全风险,开展特异、灵敏、快速的食源性致病菌及转基因作物核酸检测是关键。为实现转CP4-EPSPS基因作物的快速检测,本研究采用RPA 技术建立了一种快速、灵敏度高、特异强的转基因产品及其制品的检测方法,该方法利用一对特异性引物,在恒温条件下,可快速扩增出特异性DNA片段,并对该反应体系进行优化,选取最佳反应温度。该方法符合转基因作物的快速检测要求,缩短了扩增时间,为大规模筛查CP4-EPSPS基因提供了一种新的途径。
1 材料与方法
1.1 试验材料
以转基因玉米(NK603)、转基因苜蓿(J101)、转基因油菜(GT73)、转基因甜菜(H7-1)、转基因大 豆(MON89788)、转 基 因 棉 花(Mon1445 和Mon88913)和非转基因玉米为试验材料。其中,转基因玉米、转基因苜蓿、转基因油菜和转基因甜菜购买于美国石油化学学会(American Oil Chemists' Society,AOCS)及标准物质与测量研究所(Institute of Reference Materialsand Metrology,IRMM);转基因棉花、大豆和非转基因玉米由农业部作物生态与环境安全监测中心提供;转基因大豆MON89788 由本实验室提供。材料列表如表1所示。选取转基因棉花MON88913 作为CP4-EPSPS特异性、灵敏度及条件优化的研究对象。
表1 试验材料Table 1 Experimental materials
1.2 试验试剂
RPA 引物、ssDNA 和CrRNA 由生物工程有限公司(中国上海)合成;RNase抑制剂购自生物工程有限公司;RPA检测试剂盒购自TwistDx有限公司;植物基因组提取试剂盒购自天根生化科技(北京)有限公司。
1.3 DNA提取
将转基因材料种子用研磨机粉碎,称取0.1 g,利用基因组提取试剂盒提取并纯化植物基因组DNA,使用NanoDrop 1000 UV/Vis 分光光度计(Thermo Scientific)和1%琼脂糖凝胶电泳测定DNA样品的质量和浓度,备用。
1.4 RPA引物设计
依据RPA引物设计原则,包括长度30~35个碱基,最好不要超过45 个碱基,以形成最佳的重组酶-引物聚合体;适宜的GC 含量(30%~70%),避免过低或过高;扩增产物大小为80~400 bp(最佳为150~350 bp)。因此,根据设计原则采用Primer Premier 5.0 软件对抗草甘膦基因CP4-EPSPS设计引物,序列详见表2。

表2 RPA引物Table 2 RPA primers
1.5 RPA扩增及条件优化
为了选择最佳的反应温度,根据试剂盒的建议,RPA 反应温度分别设置为35、36、37、38、39、40、41 和42 ℃。除反应温度外,还对RPA 体系进行优化,总反应体系分别设置为50、25、20 和15 μL,具体各成分加入量如表3所示。
表3 RPA体系优化Table 3 RPA system optimization
RPA 扩增使用TwistAmp basic 试剂盒(TwistDX,Cambridge,UK)进行。选取转基因棉花MON88913 基因组进行扩增,首先,反应物平均分配到每个含有冻干颗粒的反应管中,并充分混合;其次,将相应的MgOAc 放在试管的盖子上,将反应混合物管倒置10 次以确保混合良好后,短暂离心后在恒温扩增仪上进行反应;15 min后取出,短暂离心,然后加入50 μL 苯酚-氯仿,充分混匀后以12 000 r·min-1离心10 min,留上清(有RPA 扩增产物);最后用3%琼脂糖凝胶电泳进行检测。
1.6 RPA反应的特异性与灵敏性
将扩增产物片段进行克隆,获得质粒,测定质粒浓度并计算拷贝数。将获得的MON88913棉花质粒进行连续稀释,稀释浓度至每微升为10~100个拷贝(108~100),以10倍稀释梯度进行灵敏度检测试验。
2 结果分析
2.1 RPA引物筛选
由图1 可知,RPA 获得了长度为140~204 bp的特异性条带,5 对引物均能成功扩增得到目标条带,而阴性对照无可见条带。引物RPA-CP4-3、RPA-CP4-4和RPA-CP4-5出现扩增条带,其中引物RPA-CP4-4的扩增效果最优。因此引物RPACP4-4的特异性强,扩增产物片段为167 bp,适合于RPA扩增。
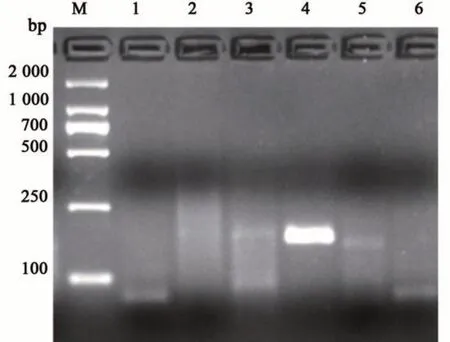
图1 RPA-CP4-1~RPA-CP4-5的扩增产物Fig. 1 Amplification products of RPA-CP4-1~RPA-CP4-5
2.2 RPA体系优化
为降低试验成本,对RPA 反应体系进行优化,结果(图2)表明,随着整个反应体系不断缩小,反应稳定性逐渐降低。当反应体系为50、25和20 μL,琼脂糖凝胶电泳检测结果间无显著差异;当反应体系为15 μL时,条带模糊。因此,20 μL的RPA 反应体系为最佳反应体系,在保证体系扩增稳定性的基础上,降低了每份样品的检测成本,可用于后续试验。
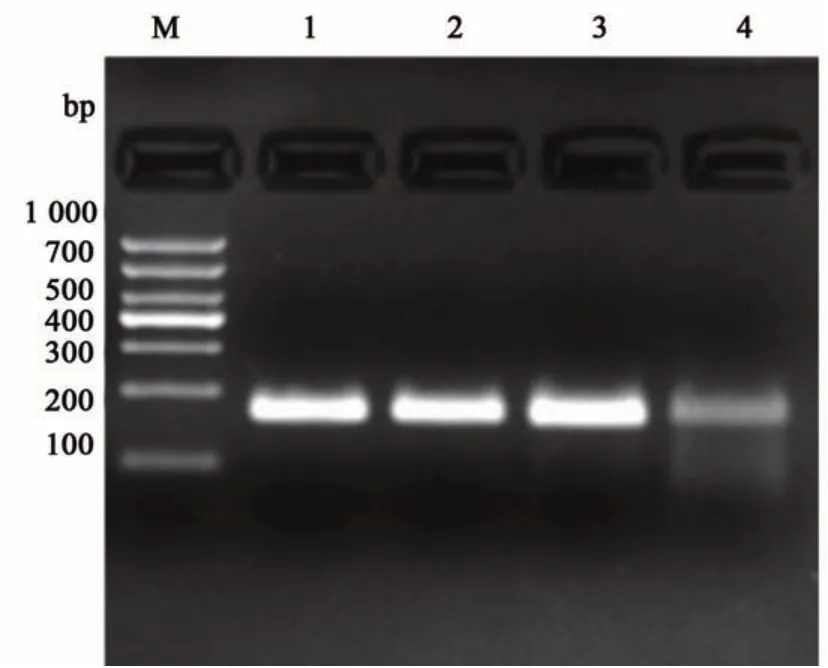
图2 不同体积反应体系的扩增产物Fig. 2 Amplification products of different reaction system
温度对RPA 起着关键的作用。由图3 可知,随着温度的增加(36~39 ℃),条带逐渐变亮且更加清晰;当温度达到40 ℃后,随着温度的增加条带又开始变淡,且出现杂带。由此表明,RPA 对温度要求较低,35~41 ℃范围内均有扩增条带,且特异性较强;当温度为37 ℃时,条带较清晰且无杂带,为最佳反应温度,可用于后续试验。
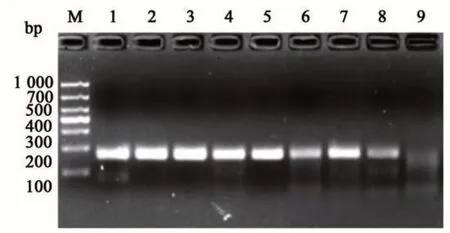
图3 不同反应温度的扩增产物Fig. 3 Amplification products of different reaction temperatures
2.3 RPA特异性检测
为评估引物的特异性,将引物RPA-CP4-4用于检测多种转基因作物,包括含有Cry基因的转基因玉米BT-11、转基因水稻克螟稻(KMD),含有PAT基因的转基因玉米59112、MON863、转基因油菜RF1 及非转基因大豆、玉米等。在37 ℃反应15 min,结果(图4)表明,仅含有CP4-EPSPS基因的转基因棉花MON88913 为阳性,其余不含CP4-EPSPS基因的材料均为阴性。此外,将上述转基因作物进行混样(同等质量1∶1∶1进行混合)后提取DNA 进行检测,结果为阳性。由此可见,引物RPA-CP4-4具有较好的特异性,且条带单一,适宜用于转CP4-EPSPS基因作物的检测。
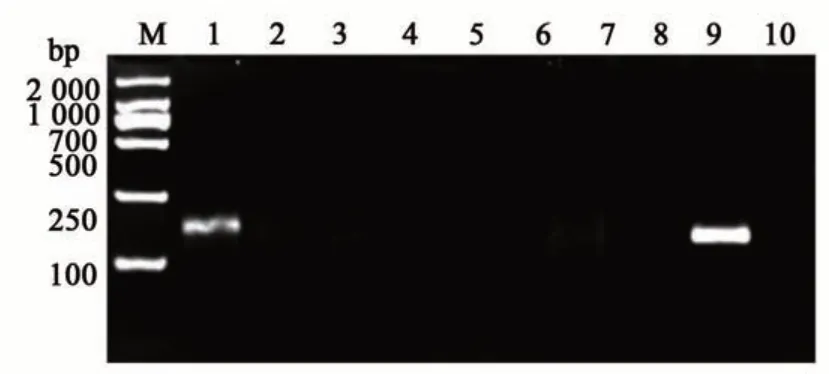
图4 RPA特异性检测Fig. 4 RPA specificity detection
2.4 RPA灵敏度检测
灵敏度检测结果如图5 所示,从4.5×107~4.5×105,其扩增条带均清晰、单一,且亮度基本一致;从104开始逐级递减,条带逐渐变暗;100时未观察到条带。由此可见,RPA 表现出较高的灵敏性,最低检出限为45 拷贝,和荧光定量PCR 的检出限一致。
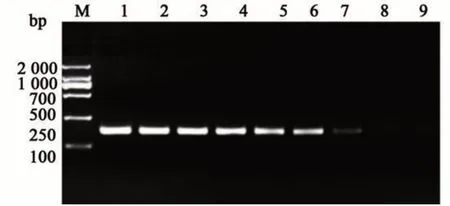
图5 RPA灵敏度检测Fig. 5 RPA sensitivity detection
2.5 转基因产品及其制品检测
为了验证RPA 扩增体系在实际样品检测中的稳定性,对含有CP4-EPSPS的转基因农作物进行检测,选取10份含有CP4-EPSPS的不同种类的转基因农作物,包括苜蓿、大豆、玉米、棉花、甜菜等,用优化后的重组酶聚合酶扩增技术法进行检测,结果(图6)表明,所有样品均能扩增出目的片段,且条带清晰,说明该反应具有良好的稳定性。
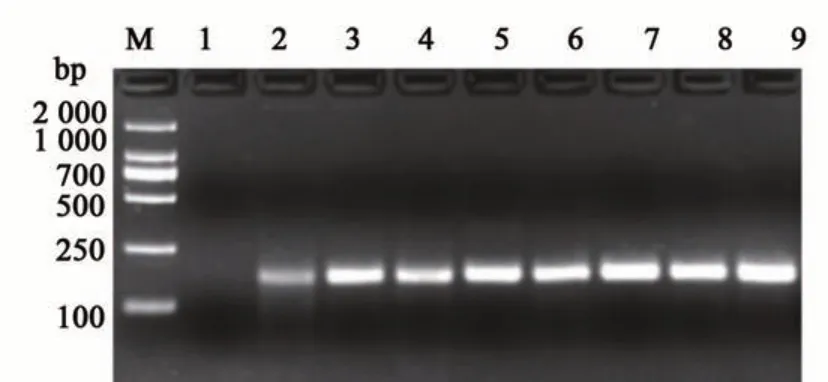
图6 转基因制品检测Fig. 6 Detection of genetically modified products
3 讨论
近年来,越来越多的转基因产品应用于生产实践,因此,各种检测方法也应运而生(表4)。多数转基因产品的检测方法基于PCR 等试验技术,如PCR、实时PCR 或数字PCR 等,这些技术需要特殊的试验条件;而基于蛋白质分析的酶联免疫反应、免疫传感器等需要较长的时间。与上述方法相比,RPA 具有步骤简单、操作方便、结果直观等优点,且不需要昂贵的仪器和复杂的预处理程序。此外,该方法特异性和灵敏度高、稳定性好,有利于转基因作物的检测。RPA 的低温操作(近体温)及其较小的样品制备要求,使得该体系可检测各种生物样品,例如血清、粪便、尿液、牛奶、鼻腔、阴道、血浆、食品、植物和动物组织等。
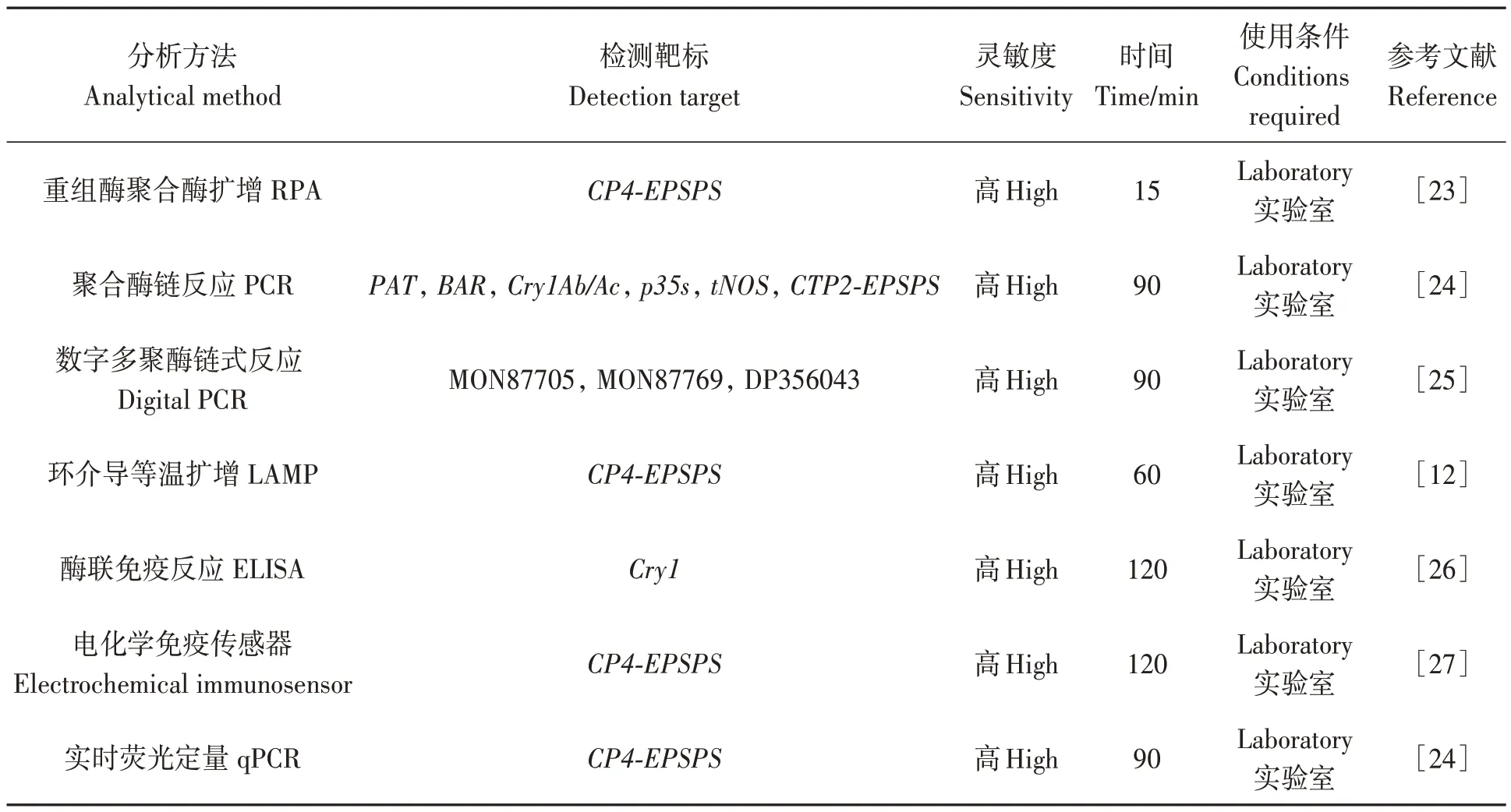
表4 核酸检测方法比较Table 4 Comparison of nucleic acid detection methods
本研究将RPA 应用于转基因生物的快速检测,该方法不仅提高了检测效率(15 min内完成),对CP4-EPSPS的检出限为45个拷贝,具有较高的特异性、准确性和灵敏度。采用LAMP 进行核酸检测时,扩增温度需65 ℃[28],而RPA 只需室温左右即可进行反应,因此更适合用来快速筛选。此外在RPA 检测过程中,其引物对于该反应系统至关重要,本研究发现扩增片段越大,越不易出现DNA 污染现象;且引物设计时,应尽量避免产生二聚体。近年来,CRISPR-Cas(clustered regularly interspaced short palindromic repeats)系统展示了其强大的分子检测潜在能力,未来将RPA 技术与其结合可能会成为新的检测平台,为转基因产业的快速发展保驾护航。
