基于转录组测序筛选鸡蛋绿壳性状相关基因
2023-05-15肖涛李辉罗韦叶涛余欢陈友波石钰仕赵德鹏吴芸
肖涛,李辉,罗韦,叶涛,余欢,陈友波,石钰仕,赵德鹏,吴芸
基于转录组测序筛选鸡蛋绿壳性状相关基因

1高原山地动物遗传育种与繁殖教育部重点实验室/贵州省动物遗传育种与繁殖重点实验室/贵州大学动物科学学院,贵阳 550025;2遵义师范学院生物与农业科技学院,贵州遵义 563006;3安顺市畜牧技术推广站,贵州安顺 561000
【背景】绿壳蛋深受消费者喜爱,蛋壳绿色的深浅在市场上是影响绿壳蛋定价销售的重要参考指标。绿壳蛋的形成受多基因共同调控,蛋壳绿色深浅不一,其分子机理尚不清楚。通过对赤水乌骨鸡蛋壳腺组织进行转录组测序,挖掘其调控绿壳蛋蛋壳颜色深浅的候选基因以及关键信号通路,探究影响蛋壳颜色遗传性,以期发展绿壳蛋的选种选育和提高经济效益。【目的】探讨赤水乌骨鸡的遗传基础,并通过SLCO1B3基因分型对其进行鉴定和筛选,以期通过分子标记在青壳鸡育种规划中提供新的见解,并在后期的选择策略中帮助控制和提高赤水乌骨鸡蛋壳品质的同质性。【方法】以纯系的 280 日龄赤水乌骨鸡为研究对象,屠宰产浅绿色蛋(QL)和深绿色蛋(SL)的母鸡各3只,采集蛋壳腺以RNA-seq技术检测分析,筛选与蛋壳颜色密切相关的差异表达基因(differentially expressed genes, DEGs),并对这些 DEGs进行 GO 和 KEGG 富集分析。利用qRT-PCR技术检测与蛋壳颜色相关的 6 个候选基因的转录水平变化以验证转录组数据可靠性。【结果】在深绿组与浅绿组中共筛选到93个显著DEGs,有 59 个基因在深绿组中显著上调,34个显著下调。DEGs注释到 GO 数据库进行比对,主要显著性富集的是钠离子转运、负离子结合、肌质网膜等。KEGG 分析富集程度最显著的是醛固酮调节钠的重吸收,以及富集的矿物质吸收、亚油酸的新陈代谢等信号通路。通过qRT-PCR验证,结果显示这些基因的表达趋势与转录组的测序结果一致。【结论】经功能分析,TF 基因、SCNN1 家族基因、CYP450 家族基因、SLC 家族基因和FAM 家族基因,以及醛固酮调节钠的重吸收信号通路参与蛋壳色素合成、转运和沉积。上述基因和信号通路可能是影响赤水乌骨鸡蛋壳绿色深浅不一的候选基因和关键信号通路。
转录组测序;赤水乌骨鸡;绿壳蛋;蛋壳颜色;qRT-PCR
0 引言
【研究意义】即使是已通过主效基因选纯的同一群体母鸡,蛋壳颜色之间也存在深浅不一的差异。市场上颜色较深型绿壳蛋价格高于颜色较浅型,消费者也更倾向于蛋壳颜色更绿更均匀的绿壳蛋。因绿壳蛋的颜色深浅直接影响了其市场价格,所以生产者和经营者都亟待提高绿壳蛋蛋壳颜色深绿的均一性,以期发展绿壳蛋的选种选育和提高经济效益。因此,探究绿壳蛋颜色深浅不一的分子机制探究对品种分子选育发展具有重要作用,也具有巨大市场潜力。本研究旨在研究赤水乌骨鸡的遗传基础,通过分型鉴定后再筛选,以便在绿壳蛋鸡的育种规划中通过分子标记提供新的见解,在后期的选种策略上,助力于把控和提高赤水乌骨鸡蛋壳品质均一性。【前人研究进展】原卟啉、胆绿素和胆绿素的锌螯合物这3种色素在蛋壳沉积中比例不同形成不同颜色,原卟啉主要影响形成黄色、粉红色和褐色,而胆绿素及其锌螯合物主要形成蓝色和绿色[1-3]。蛋壳颜色的形成是受多基因调控的,血红素加氧酶(heme oxygenase,HO)、血红素加氧酶基因()和胆绿素还原酶A(Biliverdin Reductase A,)等基因均在蛋壳颜色形成中起到重要调控或运转作用[4-6]。研究表明,绿壳蛋形成的分子机制主要是因内源性逆转录病毒EAV-HP元件以反向插入到溶质载体有机阴离子转运蛋白家族成员的5′-非编码区,启动在蛋壳腺中特异性高表达,导致胆绿素沉积到蛋壳表面形成绿壳蛋[7]。【本研究切入点】鸡蛋绿壳性状的主效基因虽已明确[8],但通过其基因选纯的母鸡所产蛋壳绿色依旧深浅不一,其分子机理尚不清楚,相关研究较少。赤水乌骨鸡又名竹乡鸡,是肉蛋兼用型优良鸡种,因主产于贵州省赤水市而得名。产绿壳蛋是赤水乌骨鸡重要的品种特征,其所产蛋蛋壳颜色类型有白壳型、浅绿色壳型和深绿色壳型3种。目前关于赤水乌骨鸡色素形成的分子研究已有报道[9],但关于赤水乌骨鸡绿壳蛋颜色深浅不一的分子调节机制研究鲜有报道。【拟解决的关键问题】蛋壳腺是蛋壳形成器官,也是胆绿素沉积重要部位[10],因此本研究以赤水乌骨鸡为研究对象,采用RNA-seq技术对产深绿色蛋和浅绿色蛋母鸡的蛋壳腺组织进行RNA-seq分析,筛选调控影响蛋壳颜色深浅的候选基因,通过功能分析挖掘影响绿壳蛋颜色的关键通路,为阐明赤水乌骨鸡绿壳蛋颜色深浅不一的形成提供理论依据,也为鸡、鸭甚至鸟类蛋壳颜色形成的分子机理研究提供参考。
1 材料与方法
试验于2020年12月至2021年11月在贵州大学高原山地动物遗传育种与繁殖教育部重点实验室完成。
1.1 试验动物选取
试验于贵州省赤水市贵州竹乡鸡养殖有限公司采集300只230日龄品种特征明显、发育正常、健康无病的赤水乌骨鸡母鸡,每只鸡均采用翅下采血。通过血液基因组DNA试剂盒(北京天根,DP304)提取血样中的DNA。利用上下游共 3 条引物对目标片段进行扩增(F: GGCAGAGGGTTGATCCAAA GTA,R1: GTGAGCAAGTCCCACCTATTCG,R2: ATAGAGAC AAAACCACAAAGGTAATG),产物用1%琼脂糖凝胶电泳进行检测,产物片段大小与目的片段大小一致,长度为884 bp或732 bp,分别为绿壳纯合(SL/SL),绿壳杂合(SL/W),非绿壳纯合(W/W)以此鉴定绿壳纯系赤水乌骨鸡[11]。根据鉴定结果选取120只绿壳纯系母鸡作为试验动物。
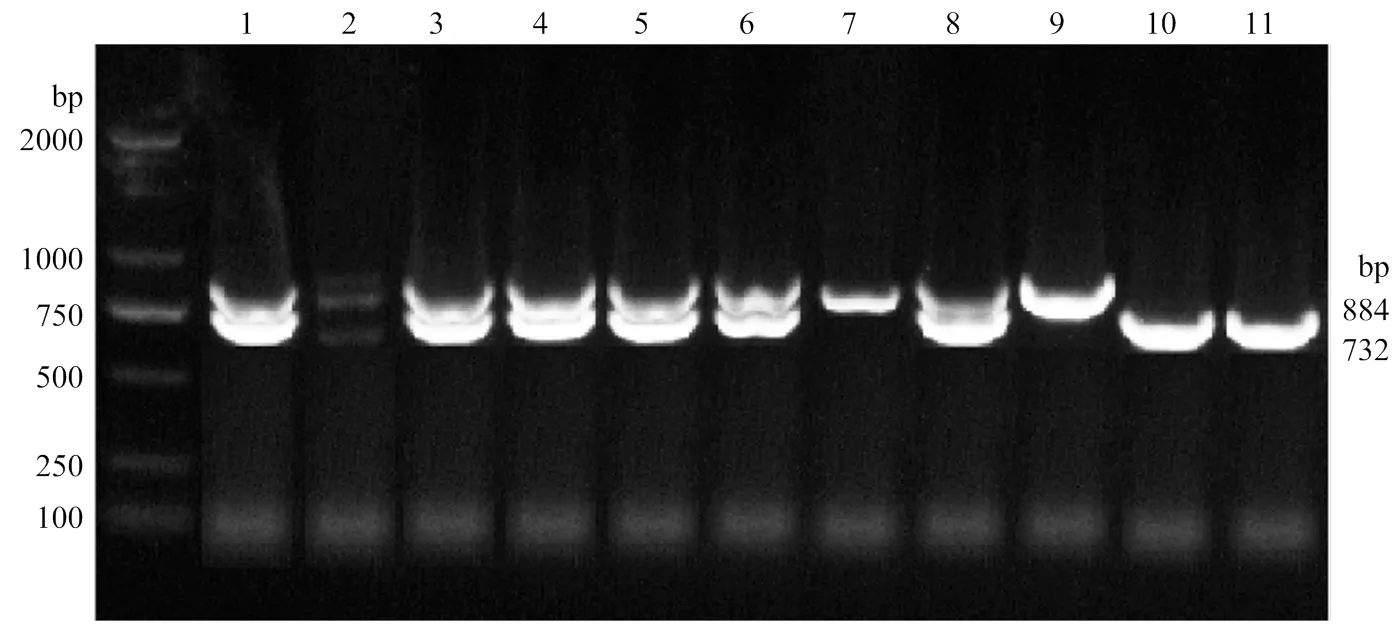
图1 SLCO1B3鉴定图
1.2 鸡蛋和样品采集
所有试验鸡均采用单笼饲养,日常商品蛋鸡饲粮饲喂。连续14 d采用NR 型蛋壳颜色色差计(南京铭奥仪器设备有限公司)测定120只纯系绿壳母鸡所产蛋的蛋壳颜色,最后选取6只(深绿色和浅绿色各3只)产蛋规律且颜色统一的280日龄赤水乌骨鸡母鸡,进行蛋壳腺采集,由贵州竹乡鸡养殖有限公司提供。在鸡产蛋前2.5—3.0 h对其进行电击、放血、解剖。屠宰后,分别采集深绿组(SL)、浅绿组(QL)蛋壳腺组织,将样品收集在无rnase-free管内,立即用液氮冷冻,置于-80℃保存,用于RNA提取。
1.3 提取总RNA
蛋壳腺组织中总RNA用TRIzol法提取(Invitrogen,Carsbad,CA)[12],1%琼脂糖凝胶电泳检测组织总RNA完整性(RNA integrity, RIN),RIN ≥8。总RNA的浓度和质量使用Nanodrop(2000,USA)、Agilent Bioanalyzer(G2938A,美国,安捷伦)进行检测,保证样品浓度≥400 ng·μL-1。
1.4 cDNA测序文库构建、质检及测序
DNase I(Illumina,USA)消化样品总RNA后,使用oligo(dT)磁珠从1μg总RNA中纯化mRNA,然后在ABclonal First Strand Synthesis Reaction Buffer中进行mRNA片段化。随后,以片段化mRNA作为模板,用随机引物和逆转录酶(RNase H)合成cDNA第一链,再用dNTPs、RNAseH、DNA聚合酶I和缓冲液合成cDNA第二链,并连接接头序列,进行PCR扩增。纯化PCR产物,并使用Agilent Bioanalyzer4150评估文库质量。构建好的文库在Illumina Novaseq6000/MGISEQ-T7测序平台上进行测序。测序委托上海中科新生命生物科技有限公司(上海,中国)完成。
1.5 高通量测序数据质量控制
通过测序质量值Phred Quality Score(Q-phred)和碱基识别出错的概率(Probability of Incorrect Base Call)之间的换算,以测序循环为单位,对单个样品所有Reads平行测序的碱基质量值进行检测,可以查看单个样品整体的测序质量。FASTQC软件用于原始数据的质量控制,去除测序接头序列,过滤掉低质量和N(N表示无法确定碱基信息)比例大于5%的reads后,获得clean reads,后续分析均基于clean reads。
1.6 差异表达基因的筛选与功能注释
根据基因的长度计算每个基因的FPKM值(FPKM表示每百万比对片段中比对到转录本每千个碱基的数量)。使用DESeq2软件进行组间基因的差异表达分析,DEGs的默认筛选阈值为|log2FoldChange|>1且<0.05。
1.7 DEGs的GO、KEGG富集分析
分析时利用GO term注释的差异基因对每个term的基因列表和基因数目进行计算,当<0.05时,该GO term显著富集。将所有DEGs注释到KEGG(http://www.kegg.jp/)数据库中,当<0.05时,该KEGG Pathway显著富集。
1.8 DEGs的mRNA表达水平验证RNA-Seq结果
为验证RNA-seq结果的准确性和可靠性,选择表达水平差异较大且与蛋壳颜色深浅相关的DEGs,进行qRT-PCR验证,基因及引物信息见表 1。利用primer 5.0设计特异性引物,采用ABI公司SYBR Green Mix进行定量表达检测,反应体系:2×Taq PCR Master Mix 5 μL,cDNA模板0.5 μL,上、下游引物各0.4 μL,ddH2O补足至10 μL,每个样本设置3个重复。采用PCR程序:UDG酶激活50℃ 2 min;95℃ 2 min;95℃ 15 s;60℃ 15 s,共40个循环,然后 95℃ 15 s;60℃ 60 s;95℃ 15 s用于记录熔解曲线。为内参基因。采用2-△△Ct法(比较Ct值法)计算DEGs相对表达量。

表1 差异表达基因qRT-PCR的特异性引物
2 结果
2.1 蛋壳颜色统计分析
连续14 d用NR 型蛋壳颜色色差计(南京铭奥仪器设备有限公司,中国)测定蛋壳颜色(ESC),蛋壳颜色值用△L*(偏白)和△a*(偏绿)表示,挑选蛋壳颜色差异极显著且产蛋时间规律母鸡作为屠宰对象。如表2所示,蛋壳颜色△L*值在深绿组与浅绿组中差异不显著,而△a*值深绿组极显著小于浅绿组,表示深绿比浅绿颜色更绿。
2.2 样品RNA质检
总RNA的OD260/OD280在1.98—2.02之间,质量较好,RIN值均大于8.5,说明RNA完整性较好,可以用于转录组测序文库的构建(表3)。
2.3 测序数据质量控制及参考基因组比对分析
在Illumina Novaseq 6000 / MGISEQ-T7测序平台对浅绿色组和深绿色组母鸡蛋壳腺组织mRNA进行测序分析,Q20在97.20%—97.26%之间,Q30在92.37%—92.83%之间,如表4所示。对原始数据质量控制后,样本clean reads介于47 722 420—57 099 094之间。clean reads比对到鸡的参考基因组上,样本的Total mapped 都在91%以上,如表5所示。各项数据显示测序质量较好,可进行下一步生物信息学分析。
2.4 DEGs筛选和验证
使用FPKM计算基因表达量,以| log2FC |>1且<0.05为筛选标准,在两组之间获得93个显著DEGs,其中,相对于QL组,59个DEGs在深绿组中显著上调,34个DEGs显著下调(图2)。与浅绿组相比,SLCO1B3基因在深绿组蛋壳腺组织中的表达量高于浅绿组,但并未达到显著差异(>0.05)。
结合形成绿壳蛋的血红素、胆绿素等重要成分检索分析发现,、SCNN1家族基因、CYP450家族基因、SLC家族基因和FAM家族基因可能与蛋壳色素的合成和沉积相关,可能是影响蛋壳颜色深浅差异的候选基因。
为验证RNA-seq测序结果的准确性,选取上调基因和,下调基因、这6个显著DEGs进行验证,采用qRT-PCR方法检测这些DEGs在两组之间的表达趋势(图3),结果显示与RNA-seq检测结果相符。验证了RNA-Seq结果和基因表达数据的真实性和可重复性。
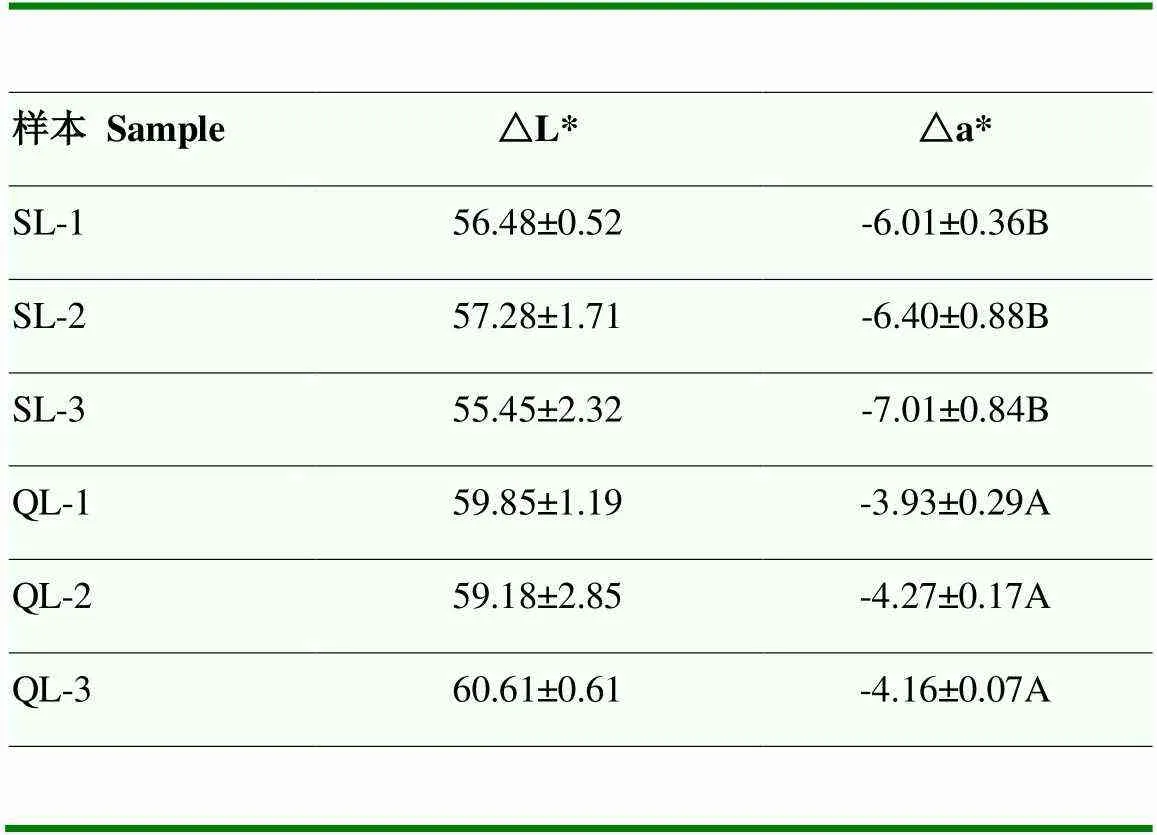
表2 蛋壳颜色统计分析表
同列大写字母不同表示差异极显著(<0.01),无字母表示差异不显著(>0.05)。△L*值代表亮度,其值越大,越偏向白色,反之偏向黑色;△a*值代表绿色程度,其值越小代表越绿,其蛋壳绿色与△L*和△a*的值呈现反比关系,即蛋壳绿色越深△L*与△a*的值越小
Different capital letters in the same column indicate extremely significant difference (<0.01), while no letters indicate insignificant difference (>0.05). △L* represents brightness. The larger the value is, the more it tends to white, and vice versa.△a* value represents the degree of green, and the smaller the value is, the greener the eggshell is. The eggshell green is inversely proportional to △L* and △a*, that is, the darker the eggshell green is, the smaller △L* and △a* are
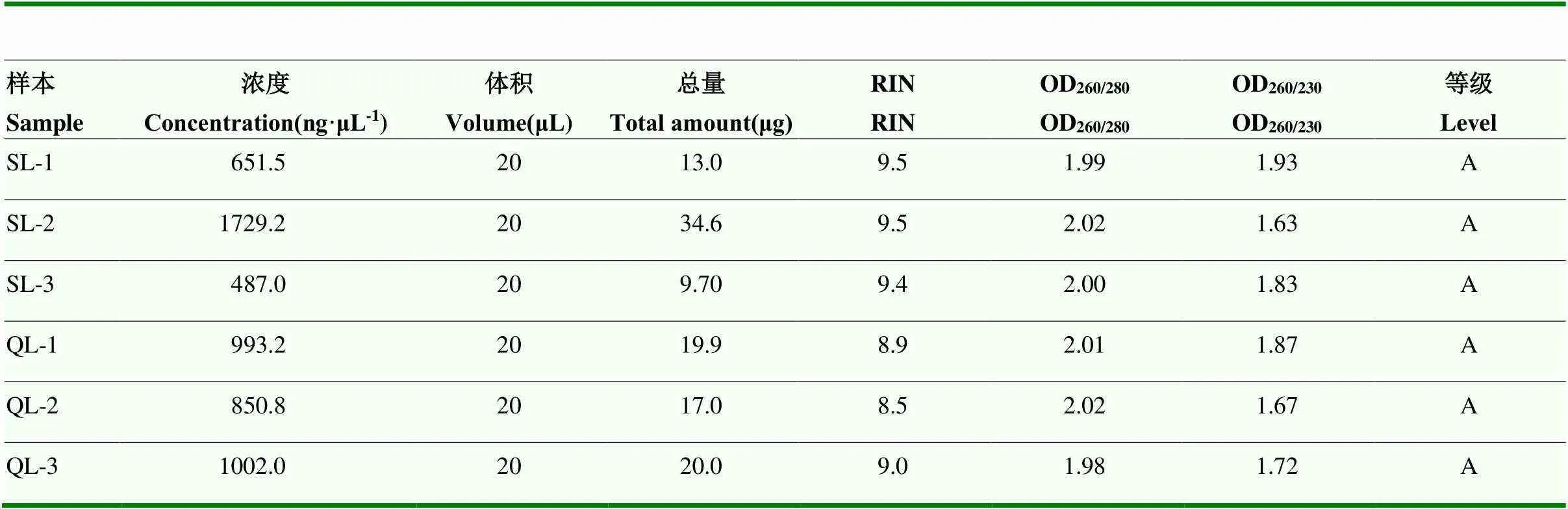
表3 蛋壳腺RNA样品的质量检测
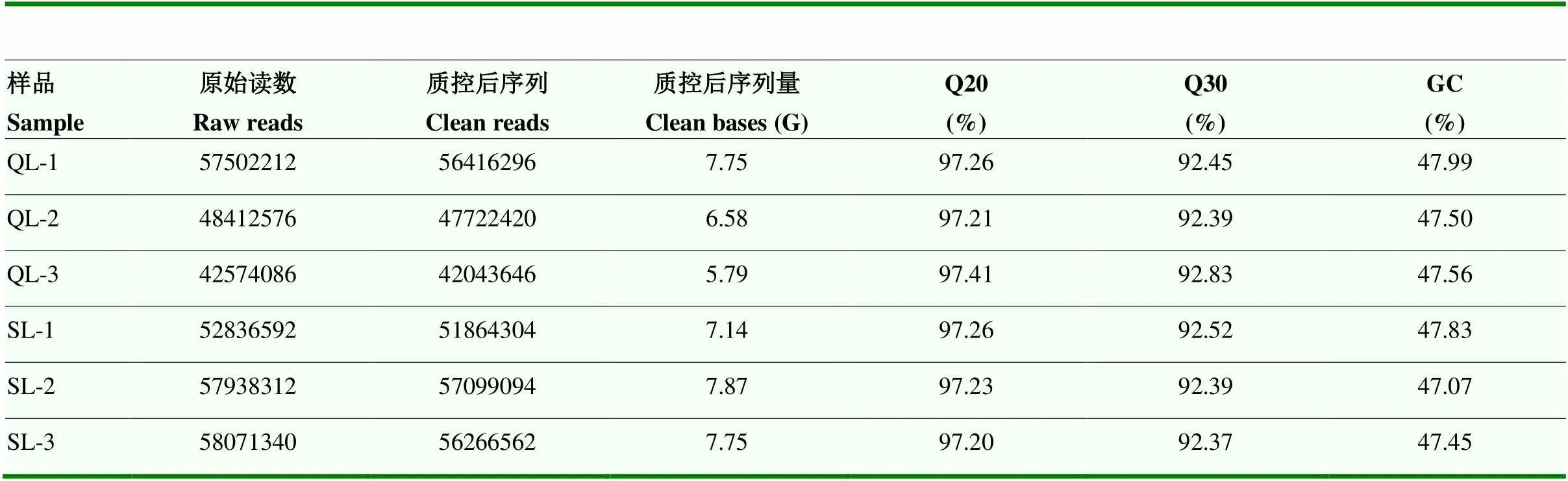
表4 样本序列质量和比对信息统计
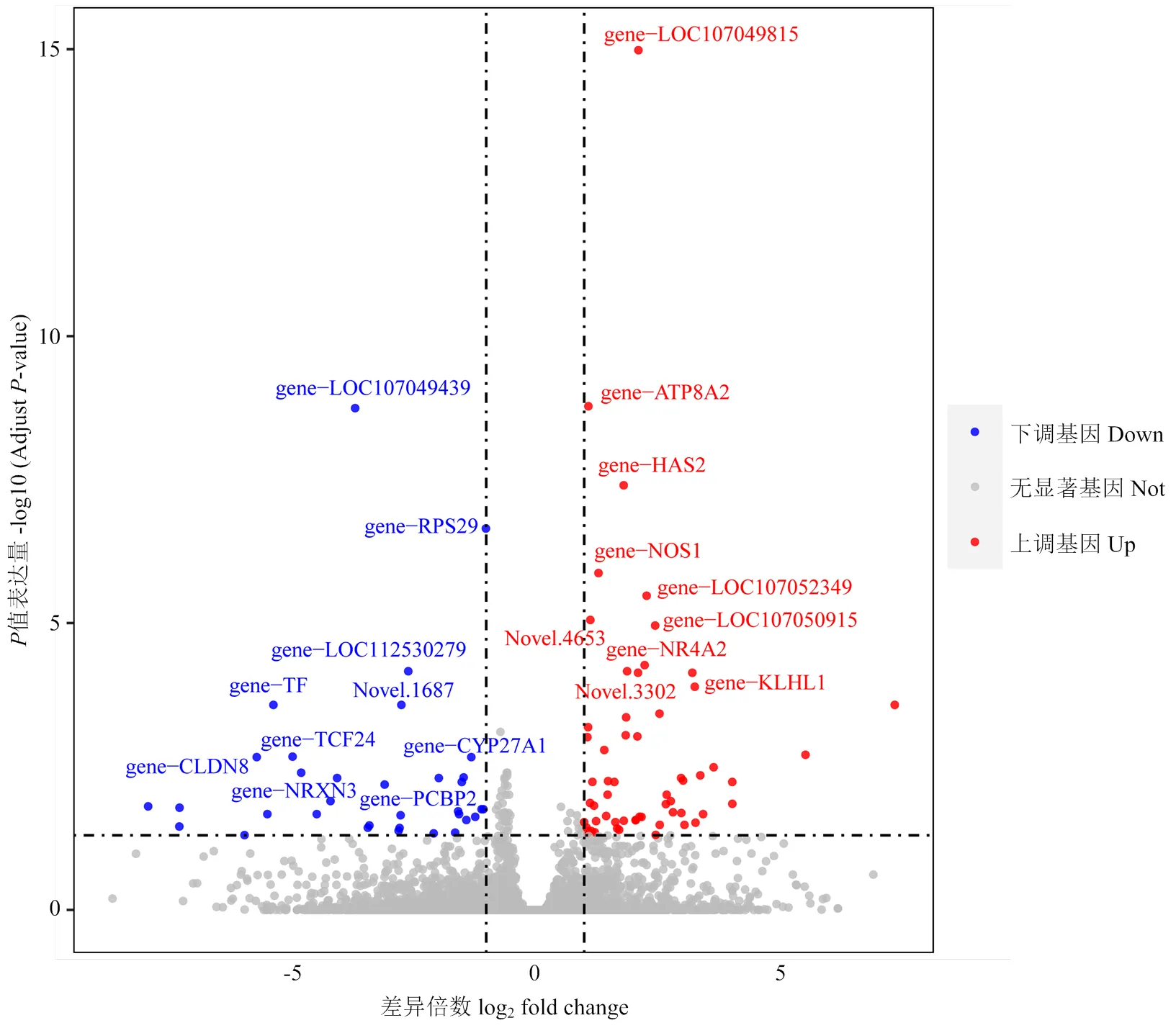
横坐标表示基因在不同实验组中表达倍数变化,纵坐标表示基因表达量变化的统计学显著程度。左侧蓝色代表显著下调基因,右侧红色代表显著上调基因,灰色表示无显著性差异的基因
2.5 DEGs功能富集分析
对93个DEGs 进行 GO 功能富集分析,共显著富集到193个条目,其中生物过程(biological process, BP)132个,细胞组成(cellular component,CC)24个,分子功能(molecular function,MF)37个,前30条显著富集到的 GO 条目如图4所示。生物学过程中主要显著性富集的是钠离子转运和单价无机阳离子转运等,在分子功能类别中主要富集是负离子结合和离子结合等,而对于细胞组成方面,主要富集的是肌质网膜和质膜区域等。通过KEGG富集分析到69条富集通路,前20条KEGG通路条目如图5所示,富集程度最显著的是醛固酮调节钠的重吸收,其富集信号通路上的主要DEGs是和,矿物质吸收通路信号上富集的主要 DEGs是,亚油酸的新陈代谢通路信号上富集的主要 DEG 是。可见,在GO和KEGG 富集通路中主要是离子运转及矿物的吸收。
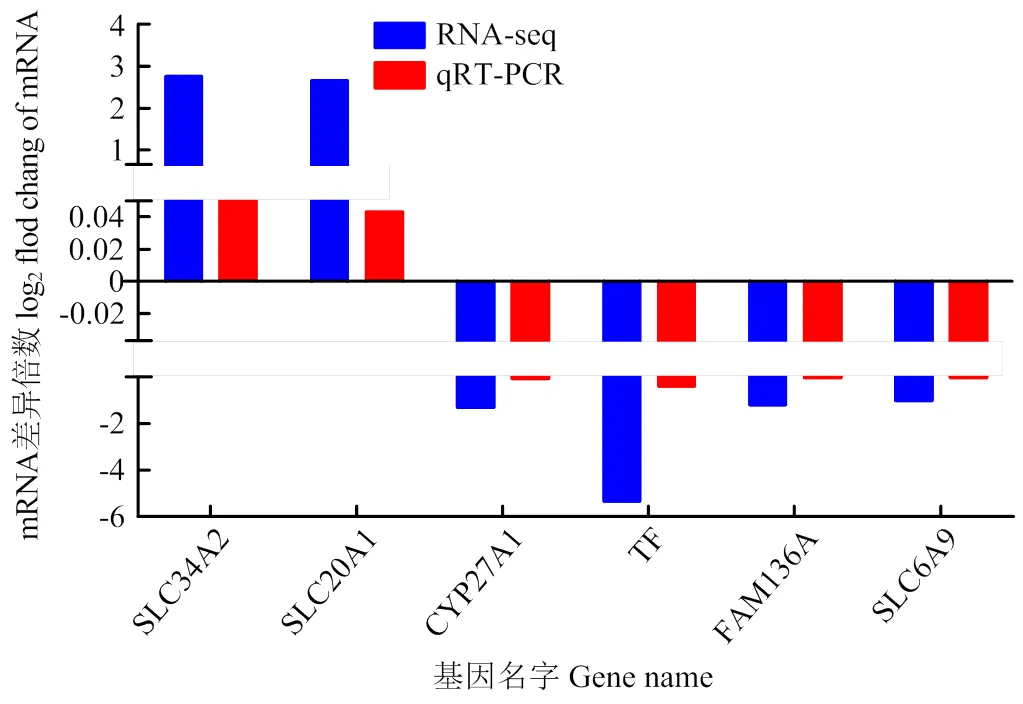
横坐标表示基因名称,纵坐标表示基因表达倍数变化
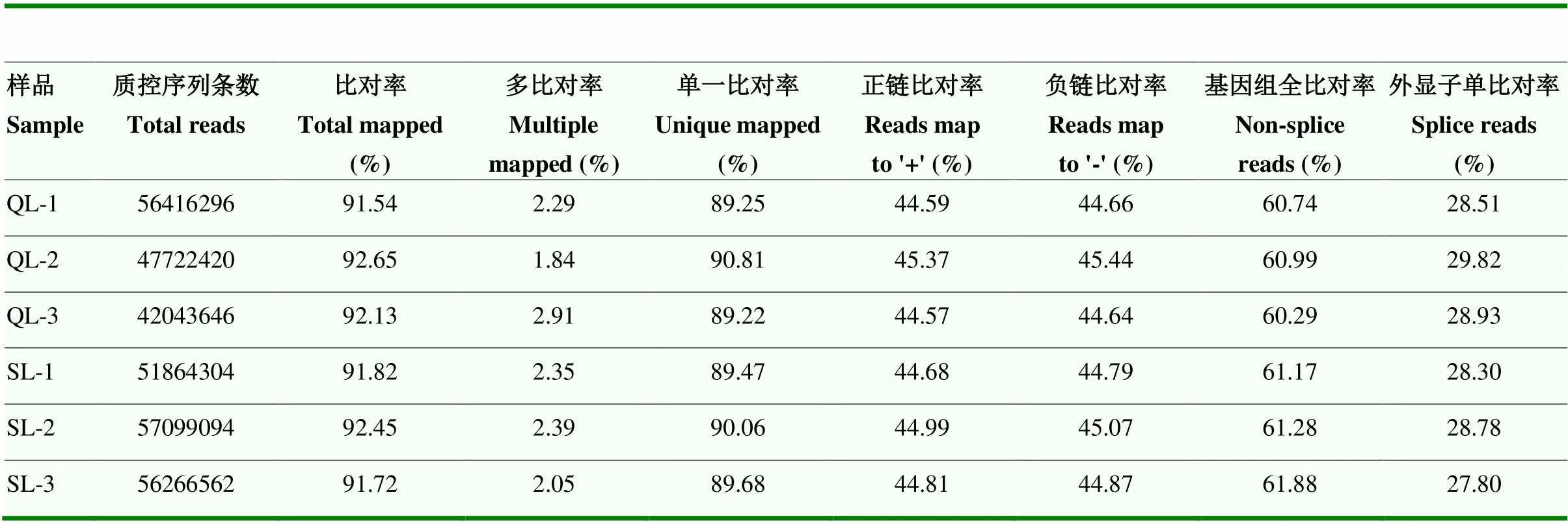
表5 Reads与参考基因组比对情况统计表
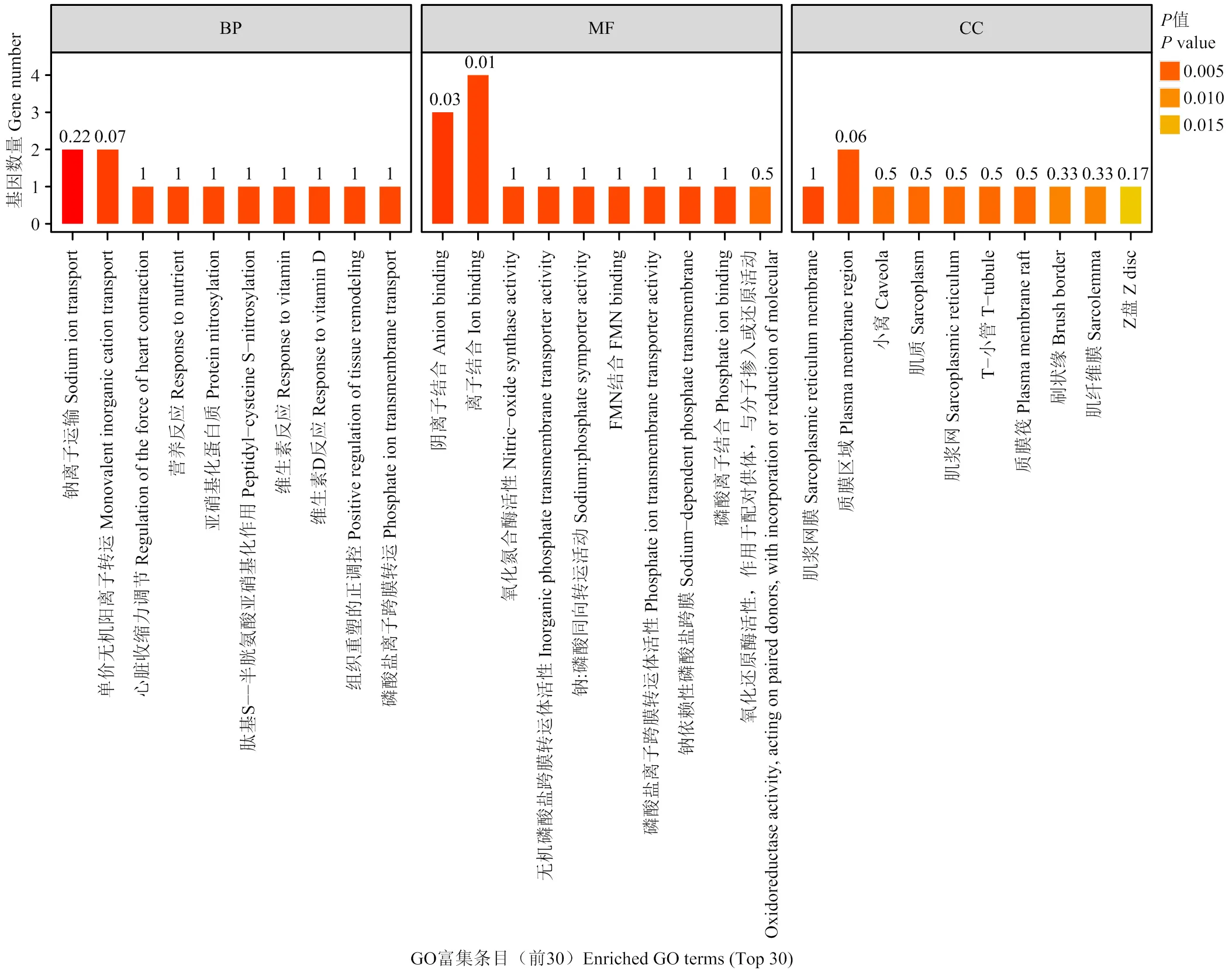
横坐标为-log10 处理后的P值,条目按P值从小到大升序排列。BP表示生物学过程,MF表示分子功能,CC表示细胞组分,纵坐标为具体功能描述
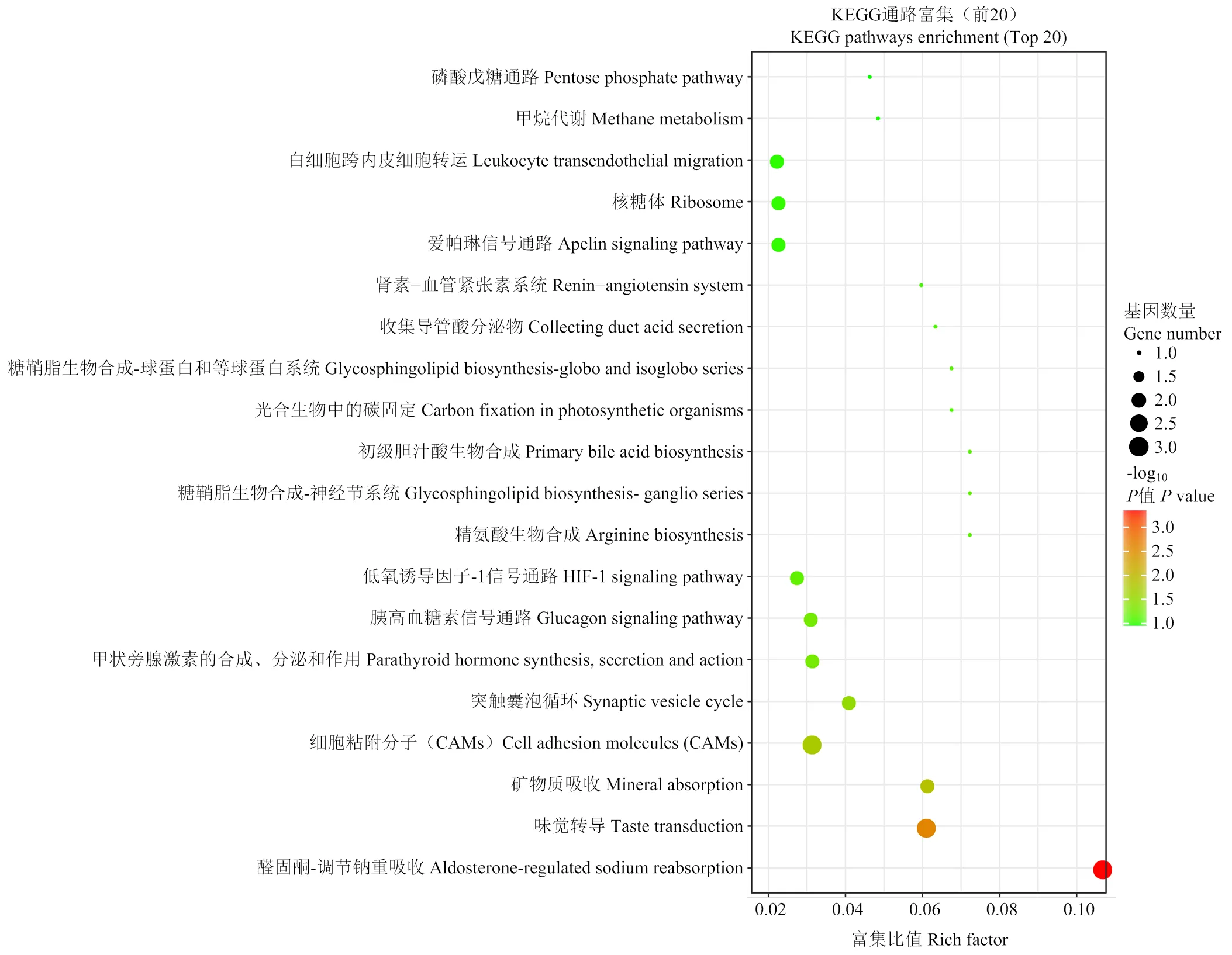
横坐标表示通路对应的富集因子,纵坐标表示通路名称。对数函数计算的 P值大小用点的颜色表示,越小越接近红色,通路中包含的差异基因数量用散点大小表示
2.6 候选基因与蛋壳颜色相关分析
根据基因组织表达量与蛋壳颜色△a*值进行相关分析后发现,和与△a*差异不显著(>0.05);与△a*呈极显著正相关(<0.01),和与△a*呈显著正相关(<0.05);和与△a*呈显著负相关(<0.05),和与△a*呈极显著负相关(<0.01,表6)。
3 讨论
近年来,RNA-seq技术被广泛运用于生命科学领域[13],这为有效挖掘鸡蛋蛋壳颜色性状相关差异表达基因和通路提供了新方向。本研究利用RNA-seq技术,筛选影响蛋壳颜色变化的差候选基因,并对DEGs 进行GO和KEGG功能富集分析,再结合胆绿素合成转运过程,筛选到和等候选基因在深绿组中基因显著下调,、和等候选基因在深绿组中显著上调。通过功能富集,结果暗示离子的结合转运以及矿物质的吸收信号通路存在调控蛋壳颜色深浅程度的可能,且DEGs的qRT-PCR验证结果与RNA-seq检测测序结果相一致,这进一步证明了RNA-Seq分析结果和基因表达数据的真实性和可重复性。本研究选择的虽是显性纯合的个体,但在深绿组表达量高于浅绿组,说明存在其他基因影响的表达,从而导致蛋壳颜色的深浅差异(表7)。将候选基因与蛋壳颜色进行相关分析,其中7个基因与蛋壳颜色具有显著差异性,表明本试验条件符合试验目标,试验结果的可靠性较高。
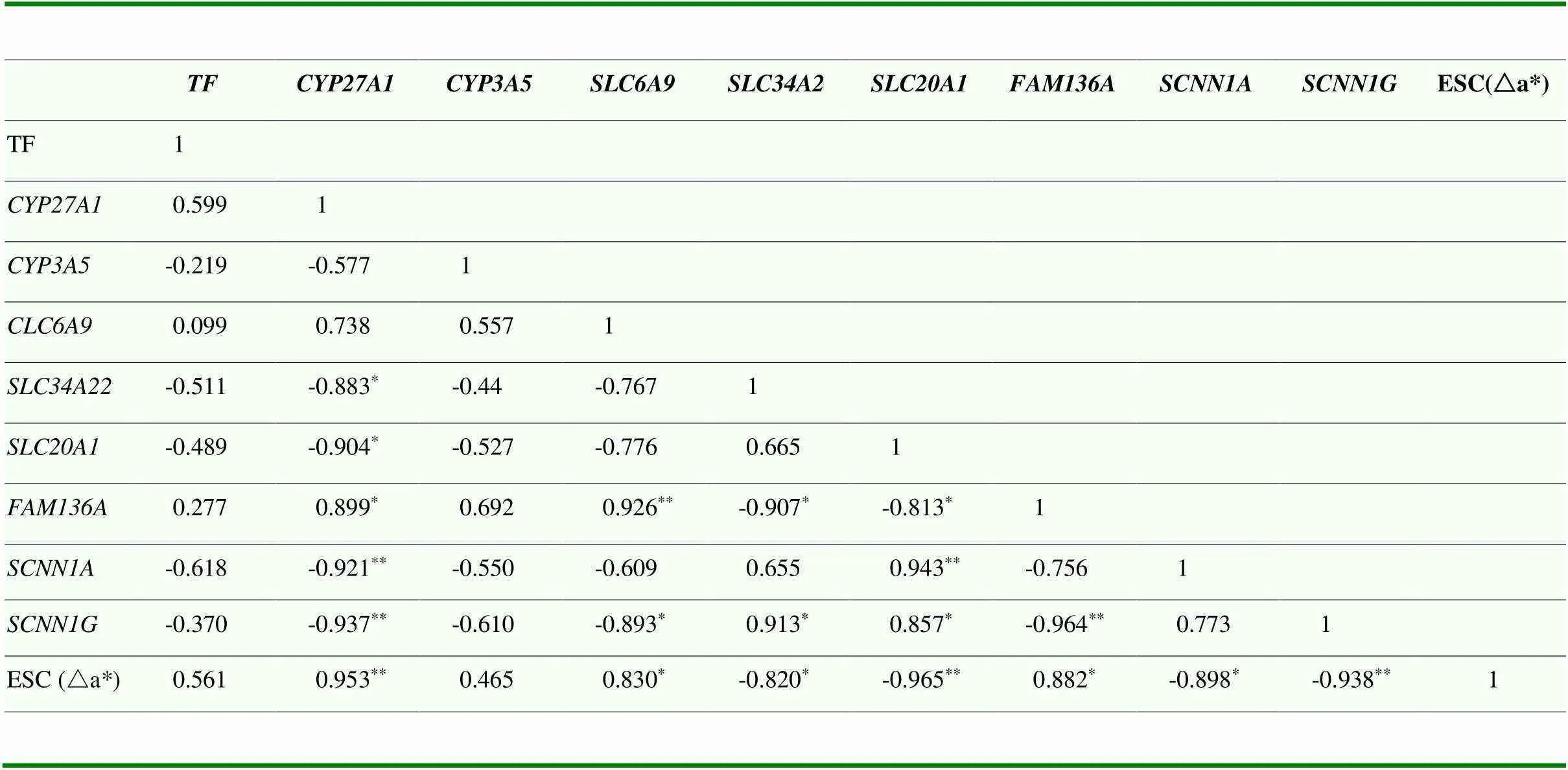
表6 候选DEGs与蛋壳颜色相关分析表
肩标**表示极显著相关,*表示显著相关
Shoulder mark ** means extremely significant correlation(<0.01), * means significant correlation(<0.05)
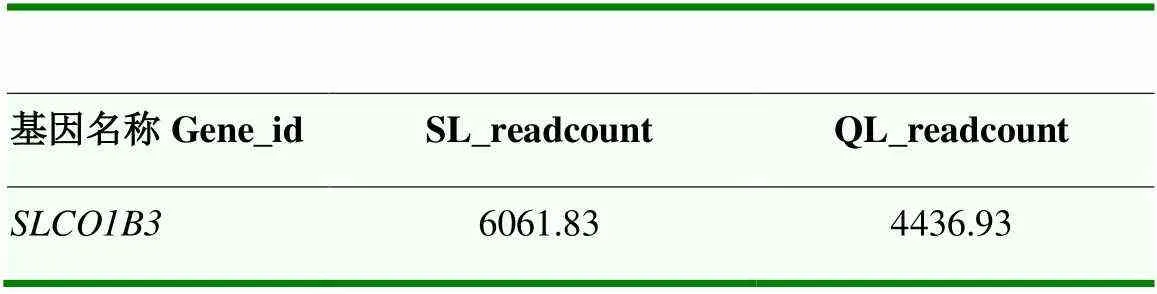
表7 SLCO1B3表达
3.1 醛固酮调节Na+的重吸收影响蛋壳钙化
本研究中,KEGG富集结果显示和显著富集在醛固酮调节钠的重吸收信号通路上。钠离子无电位门控通道1()基因家族是上皮细胞钠离子通道(epithelial sodium channel,ENaC)的编码基因,而醛固酮和血管加压素可调节ENaC,调控Na+的重吸收速率,对于调节血压水平和维持Na+平衡具有重要作用[14-15]。研究表明,在蛋壳形成过程中,蛋壳色素的沉积与整个蛋壳的钙化过程同步进行[16]。和在子宫中高度表达,尤其在蛋壳形成阶段表达迅速增加,会使子宫上皮细胞Na+浓度增高,而在家禽子宫中钠的浓度可以直接影响钙离子的运输和转移[17],从而影响蛋壳表面的钙化[18]。本研究中和在蛋壳腺高表达,且在深绿组中表达量显著高于浅绿组,可能是蛋壳色素的沉积与蛋壳表面的钙化过程有关,使得蛋壳颜色产生差异。
3.2 SLC调节离子运转
鸡是铁结合蛋白家族的一员,其基因主要编码卵转铁蛋白,参与铁离子的转运和平衡[19-20]。血红蛋白分解产生的血红素被氧化、失去铁,使卟啉环打开而形成胆绿素[21]可能影响了胆绿素的形成过程,进而影响胆绿素在蛋壳腺上皮细胞中积累以及在蛋壳中的沉积[22-23]。本研究中筛选到在深绿组中下调,而和显著上调,此3个基因均属于溶质转运载体(SLC)家族基因。SLC34家族和SLC20家族相互作用于磷酸盐转运[24],同时在细胞膜上对转运Na+、Ca2+、Fe3+等离子发挥重要作用[25],其中对生物体钙化具有调控作用[26],并与富集在矿物质吸收的信号通路上,而在调控细胞凋亡和黏附等方面具有调控作用[27]。研究表明离子转运在蛋壳形成过程中起着关键作用[18],在本研究中可能是在红细胞衰老裂解产生蛋壳色素的过程中,通过SLC家族基因的运输作用来调节蛋壳的钙化过程,从而影响胆绿素的沉积。这与绿壳鸭蛋研究中推测家族部分基因通过小分子运输影响蛋壳颜色差异结果相似[28]。
3.3 细胞色素P450的氧化作用
本研究发现细胞色素P450家族的和在浅绿组中显著上调,而富集在亚油酸新陈代谢信号通路上。细胞色素P450 是由多个功能相关的亚铁血红素-硫醇盐蛋白基因组成的超家族蛋白酶[29],也是一种在温和条件下就能将许多惰性化合物氧化的单加氧酶,直接影响血红素与Fe的配位[30-31]。MIHALJEVIĆ等[32]研究中细胞色素P450代谢相关基因的表达可能会导致下游的α-亚麻酸代谢和花生四烯酸代谢通路的改变,张金铭[33]研究表明α-亚麻酸代谢和花生四烯酸代谢通路可反馈调控细胞色素的产生。推测P450家族的和可能通过氧化反应在绿壳蛋胆绿素形成过程中发挥了作用。
3.4 FAM在线粒体内特异性表达
HESHAM[34]研究发现,受转录因子GATA-l的调控,使得其在线粒体内特异表达,这为其参与血红素生物合成提供了可能,并表示它是东乡绿壳蛋绿壳性状的重要候选基因。在本研究中,与浅绿组相比,在深绿组中显著下调,推测家族基因也是影响赤水乌骨鸡浅绿色绿壳蛋形成的候选基因,其可能是通过调控线粒体铁离子转运来参与血红素的生物合成影响绿壳蛋色素的沉积[35-36],但具体的调控机制仍需进一步深入研究。
4 结论
本研究通过RNA-seq技术分析了产深绿色蛋和浅绿色蛋的母鸡蛋壳腺组织表达基因的种类和数量,筛选出调控蛋壳颜色形成的相关候选基因和通路,发现、SCNN1家族基因、CYP450家族基因、SLC家族基因和FAM家族基因,以及醛固酮调节钠离子的重吸收和矿物质吸收的信号通路在绿壳蛋的形成机制中影响着蛋壳色素合成、转运和沉积。该候选基因和信号通路为揭示赤水乌骨鸡不同绿色程度蛋壳形成的调控机制提供了理论参考,为进一步筛选奠定基础,以期提高绿壳蛋的均一性。
[1] 蒙国华. 鸭绿壳蛋表型与候选基因族及主选SLCO2B1基因关联功效研究[D]. 杨凌: 西北农林科技大学, 2017.
MENG G H. Exploring potential relationship underlying blue-green eggshell color of duck eggs associated with candidate genes and major SLCO2B1 gene[D]. Yangling: Northwest A & F University, 2017. (in Chinese)
[2] 周玉. 卢氏绿壳蛋鸡蛋壳颜色变浅机制及调控技术研究[D]. 郑州: 河南农业大学, 2017.
ZHOU Y. Mechanism and regulation technology for the color change of Lushi chicken green shell eggs[D]. Zhengzhou: Henan Agricultural University, 2017. (in Chinese)
[3] GOGER H, DEMIRTAS S E, YURTOGULLARI S. A selection study for improving eggshell colour in two parent lines of laying hens and their hybrids. Italian Journal of Animal Science, 2016, 15(3): 390-395.
[4] ZHAO R, XU G Y, LIU Z Z, LI J Y, YANG N. A study on eggshell pigmentation: biliverdin in blue-shelled chickens. Poultry Science, 2006, 85(3): 546-549.
[5] 王哲鹏, 王晓通, 白激荣,李俊英,邓雪梅,吴常信. 血红素加氧酶-1在绿壳蛋蛋壳色素形成中的作用[C]//全国动物遗传育种学术讨论会, 2009: 476.
WANG Z P, WANG X T, BAI J R, LI J Y, DENG X M, WU C X. Effect of heme oxygenase-1 on eggshell pigment formation in green egg [C]// National Animal Genetics and Breeding Symposium. Shanxi, 2009: 476. (in Chinese)
[6] 王晓庆, 徐廷生, 雷雪芹, 高灵照, 肖赞奇. 鸡血红素加氧酶-1(HO-1)和胆绿素还原酶A(BLVRA)基因表达量对蛋壳颜色的影响. 中国农学通报, 2014, 30(35): 64-68.
WANG X Q, XU T S, LEI X Q, GAO L Z, XIAO Z Q. The effects of the expression levels of H0-1 and BLVRA on the color of egg shells. Chinese Agricultural Science Bulletin, 2014, 30(35): 64-68. (in Chinese)
[7] WRAGG D, MWACHARO J M, ALCALDE J A, WANG C, HAN J L, GONGORA J, GOURICHON D, TIXIER-BOICHARD M, HANOTTE O. Endogenous retrovirus EAV-HP linked to blue egg phenotype in Mapuche fowl. PLoS ONE, 2013, 8(8): e71393.
[8] CHEN J F, DALIRSEFAT S B, HAN D P, DONG X G, HUA G Y, ZHENG X T, XIA T L, SHAO T Q, DENG X M, WU C X. An EAV-HP insertion in the 5ʹ flanking region of SLCO1B3 is associated with its tissue-expression profile in blue-eggshell Yimeng chickens (). Poultry Science, 2020, 99(12): 6371-6377.
[9] 祖盘玉. 赤水乌骨鸡MC1R、TYR、MITF基因多态性分析及其组织表达效应研究[D]. 贵阳: 贵州大学, 2019.
ZU P Y. Polymorphism analysis of MC1R, TYR and MITF genes and their tissue expression in Chishui black-bone chickens[D]. Guiyang: Guizhou University, 2019. (in Chinese)
[10] LI G, SUN C, WU G, SHI F, LIU A, YANG N. iTRAQ-based quantitative proteomics identifies potential regulatory proteins involved in chicken eggshell brownness. PLoS One, 2016, 11(12): e0168750.
[11] 陈林. 赤水乌骨鸡绿壳蛋性状相关基因的差异表达研究[D]. 贵阳: 贵州大学, 2019.
CHEN L. Differential expression of genes related to green-shell egg traits in Chishui silky fowl[D]. Guiyang: Guizhou University, 2019. (in Chinese)
[12] 吴艳, 张昊, 梁振华, 潘爱銮, 申杰, 蒲跃进, 黄涛, 皮劲松, 杜金平. circ-13267通过let-7-19/ERBB4通路调控蛋鸭卵泡颗粒细胞凋亡. 中国农业科学, 2022, 55(8): 1657-1666.
WU Y, ZHANG H, LIANG Z H, PAN A L, SHEN J, PU Y J, HUANG T, PI J S, DU J P. Circ-13267 regulates egg duck granulosa cells apoptosis through let-7-19/ERBB4pathway. Scientia Agricultura Sinica, 2022, 55(8): 1657-1666. (in Chinese)
[13] FU Y Q. Application of Rna-Seq technology in gene expression measurement. MEDS Clinical Medicine, 2021, 2(1): 33-36.
[14] BAINES D. Kinases as targets for ENaC regulation. Current MolecularPharmacology, 2013, 6(1): 50-64.
[15] JACQUILLET G, CHICHGER H, UNWIN R J, SHIRLEY D G. Protease stimulation of renal sodium reabsorptionby activation of the collecting duct epithelial sodium channel (ENaC). Nephrology Dialysis Transplantation, 2012, 28(4): 839-845.
[16] 李光奇. 转录组与蛋白质组联合分析影响鸡蛋蛋壳褐色的遗传因素[D]. 北京: 中国农业大学, 2015.
LI G Q. Integrated analysis of transcriptome and proteome to explore the genetic factors influencing chicken eggshell brownness[D]. Beijing: China Agricultural University, 2015. (in Chinese)
[17] JONCHÈRE V, RÉHAULT-GODBERT S, HENNEQUET-ANTIER C, CABAU C, SIBUT V, COGBURN L A, NYS Y, GAUTRON J. Gene expression profiling to identify eggshell proteins involved in physical defense of the chicken egg. BMC Genomics, 2010, 11: 57.
[18] FAN Y F, HOU Z C, YI G Q, XU G Y, YANG N. The sodium channel gene family is specifically expressed in hen uterus and associated with eggshell quality traits. BMC Genetics, 2013, 14: 90.
[19] AISEN P, LISTOWSKY I. Iron transport and storage proteins. The EMBO Journal, 1980, 49: 357-393.
[20] WILLIAMS J. A comparison of glycopeptides from the ovotransferrin and serum transferrin of the hen. Biochem J, 1968, 108(1): 57-67.
[21] SCHAEFFER E, LUCERO M A, JELTSCH J M, PY M C, LEVIN M J, CHAMBON P, COHEN G N, ZAKIN M M. Complete structure of the human transferrin gene. Comparison with analogous chicken gene and human pseudogene. Gene, 1987, 56(1): 109-116.
[22] COLL J, INGRAM V M. Identification of ovotransferrin as a heme-, colony- and burst-stimulating factor in chick erythroid cell cultures. Circulation Research, 1981, 131(1): 173-184.
[23] RYTER S W, ALAM J, CHOI A M. Heme oxygenase-1/carbon monoxide: from basic science to therapeutic applications. Physiological Reviews, 2006, 86(2): 583-650.
[24] FORSTER I C, HERNANDO N, BIBER J, MURER H. Phosphate transporters of the SLC20 and SLC34 families. Molecular Aspects of Medicine, 2013, 34(2/3): 386-395.
[25] FREDRIKSSON R, NORDSTRÖM K J V, STEPHANSSON O, HÄGGLUND M G A, SCHIÖTH H B. The solute carrier (SLC) complement of the human genome: Phylogenetic classification reveals four major families. FEBS Letters, 2008, 582(27): 3811-3816.
[26] KONNO Y, MOORE R, KAMIYA N, NEGISHI M. Nuclear xenobiotic receptor PXR-null mouse exhibits hypophosphatemia and represses the Na/Pi-cotransporter SLC34A2. Pharmacogenetics and Genomics, 2010, 20(1): 9-17.
[27] 陈家奎. slc20a1b调控斑马鱼造血干祖细胞的功能研究及机制初探[D]. 广州: 南方医科大学, 2021.
CHEN J K. The function and preliminary mechanism of slc20a1b in regulating the hematopoietic stem/progenitor cells of zebrafish[D]. Guangzhou: Southern Medical University, 2021. (in Chinese)
[28] XU F Q, LI A, LAN J J, WANG Y M, YAN M J, LIAN S Y, WU X. Study of formation of green eggshell color in ducks through global gene expression. PLoS ONE, 2018, 13(1): e0191564.
[29] KUBOTA A, KIM E Y, IWATA H. Alkoxyresorufin (methoxy-, ethoxy-, pentoxy- and benzyloxyresorufin) O-dealkylase activities by in vitro-expressed cytochrome P450 1A4 and 1A5 from common cormorant (). Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2009, 149(4): 544-551.
[30] EDWARDS M J, RICHARDSON D J, PAQUETE C M, CLARKE T A. Role of multiheme cytochromes involved in extracellular anaerobic respiration in bacteria. Protein Science, 2020, 29(4): 830-842.
[31] BRIGNAC-HUBER L M, PARK J W, REED J R, BACKES W L. Cytochrome P450 organization and function are modulated by endoplasmicphospholipid heterogeneity. Drug Metabolism and Disposition: the Biological Fate of Chemicals, 2016, 44(12): 1859-1866.
[32] MIHALJEVIĆ Z, MATIĆ A, STUPIN A, FRKANEC R, TAVČAR B, KELAVA V, TARTARO BUJAK I, KOLOBARIĆ N, KIBEL A, DRENJANČEVIĆ I. Arachidonic acid metabolites of CYP450 enzymes and HIF-1α modulate endothelium-dependent vasorelaxation in sprague-dawley rats under acute and intermittent hyperbaric oxygenation. International Journal of Molecular Sciences, 2020, 21(17): E6353.
[33] 张金铭. α-亚麻酸和花生四烯酸对HepG2细胞CYP7A1表达的影响及Nrf2的调控[D]. 哈尔滨: 东北农业大学, 2016.
ZHANG J M. Effects of α-linolenic acid and arachidonic acid on CYP7A1 expression through Nrf2 in HepG2[D]. Harbin: Northeast Agricultural University, 2016. (in Chinese)
[34] HESHAM YOUSSEF AWAD DARWISH.东乡绿壳蛋鸡蛋壳绿色程度相关基因的鉴定[D].北京:中国农业大学, 2019.
HESHAM YOUSSEF AWAD DARWISH. Identification of genes related to eggshell green degree in Dongxiang Green shell laying hens [D]. Beijing:China Agricultural University, 2019. (in Chinese)
[35] FURUYAMA K, KANEKO K, VARGAS P D. Heme as a magnificent molecule with multiple missions: heme determines its own fate and governs cellular homeostasis. The Tohoku Journal of Experimental Medicine, 2007, 213(1): 1-16.
[36] MUHSAIN S N F, LANG M A, ABU-BAKAR A. Mitochondrial targeting of bilirubin regulatory enzymes: an adaptive response to oxidative stress. Toxicology and Applied Pharmacology, 2015, 282(1): 77-89.
Screening of Candidate Genes for Green Shell Egg Shell Color Traits in Chishui Black Bone Chicken Based on Transcriptome Sequencing

1Key Laboratory of Animal Genetics, Breeding and Reproduction in the Plateau Mountainous Region, Ministry of Education/ Guizhou Provincial Key Laboratory of Animal Genetics, Breeding and Reproduction/College of Animal Science, Guizhou University, Guiyang 550025;2College of Biology and Agriculture Technology, Zunyi Normal University, Zunyi 563006, Guizhou;3AnshunCity Animal Husbandary Technology Extension Station, Anshun 561000, Guizhou
【Background】Green shell eggs are loved by consumers, and the green color of eggshell is an important reference index affecting the pricing and sales of green shell eggs in the market. The formation of green shell eggs is regulated by multiple genes, and the color of green shell varies. However, the molecular mechanism of green shell eggs is still unclear. In this study, transcriptomic sequencing was conducted on the eggshell gland tissue of Chishui black bone chicken, and the candidate genes and key signal pathways that regulated the depth and depth of eggshell color of green shell eggs were excavated, so as to explore the heritability of eggshell color, and to develop the seed selection and breeding of green shell eggs and improve economic benefits. 【Objective】The aim of this study was to investigate the genetic basis of Chishui black bone chicken and to identify and then screen them bygenotyping, in order to provide new insights through molecular markers in the breeding planning of green-shelled hens, and to help control and improve the homogeneity of eggshell quality of Chishui black bone chicken in the later selection strategy. 【Method】A pure 280-day-old Chishui black bone chicken was used as the research object. Three hens were slaughtered to produce light green eggs (QL) and dark green eggs (SL), and the eggshell glands were collected and analyzed by RNA-SEQ technology. Selected differentially expressed genes (DEGs) closely related to eggshell color, and analyzed for GO and KEGG enrichment. Qrt-pcr was used to detect the transcriptional level changes of six candidate genes related to eggshell color to verify the reliability of transcriptomic data. 【Result】A total of 93 DEGs were screened in SL group and QL group, among which 59 genes were up-regulated and 34 genes were down-regulated in SL group. DEGs was annotated to GO database for comparison, and sodium ion transport, negative ion binding, and sarcoplasmic reticulum were mainly enriched significantly. KEGG analysis showed that aldosterone regulated sodium reabsorption, enriched mineral absorption, linoleic acid metabolism and other signal pathways. The results of QRT-PCR showed that the expression trend of these genes was consistent with the transcriptome sequencing results. 【Conclusion】By functional analysis,gene,gene,0 gene,gene andgene, as well as the sodium reabsorption signaling pathway regulated by aldosterone, might be involved in eggshell pigment synthesis, transport and deposition. These genes and signal pathways might be candidate genes and key signal pathways affecting the different shades of green in eggshell of Chishui black bone chicken.
transcriptome sequencing; Chishui black bone chicken; green egg; eggshell color; qRT-PCR
10.3864/j.issn.0578-1752.2023.08.014
2021-12-13;
2022-11-16
贵州省地方家禽产业联合攻关项目(黔财农[2020]175号)、贵州省科技支撑计划(黔科合支撑[2019]2285号)、赤水河流域资源保护与开发研究院项目(CSH-[2019]-005)
肖涛,E-mail:798061734@qq.com。通信作者李辉,E-mail:ellenlihui@sina.cn
(责任编辑 林鉴非)
