多孔NiMoO4/NiCo2S4复合材料的制备及其电化学性能
2023-05-15王跃迪仇中柱朱燕艳
王跃迪,仇中柱,吴 渺,朱燕艳,屈 蒙
(上海电力大学,上海 201306)
能源问题一直都与全球人类长久的生存发展紧密相关,随着全球经济的快速增长,各国对资源的需求量已经超出了生态系统的供给能力[1]。因此对化石燃料耗竭、环境污染的担忧以及节能减排的需求促使人们致力于开发高性能的能源转换/存储设备。超级电容器作为专门用于储能的设备,具有较高功率密度、更长循环寿命、快速充放电等优点,既弥补了传统电介质电容器的低能量密度,又弥补了化学电池的低功率密度[2]。超级电容器虽然能解决传统电介质电容器和电池的一些缺点,但其本身也有很多缺点,其中能量密度低是限制其发展的重要原因。超级电容器电极储存能量的能力取决于其材料的性质,故目前的研究方向主要是研制出具有高电化学性能的电极材料[3]。通常,碳材料及其衍生物用于双电层电容器[4];过渡金属氧化物[5]、过渡金属硫化物[6]、具有含氧和含氮表面官能团的碳材料[7]和导电聚合物[8]则被用作赝电容电容器的电极材料。
过渡金属氧化物由于其超高的理论电容、优异的稳定性和多种化合价态,被认为是最有前途的正极材料之一[9]。在潜在的正极电极材料中,过渡金属钼酸盐,例如MnMoO4[10]、CoMoO4[11]和NiMoO4[12],是一类新兴的电极材料。它结合了不同金属阳离子的优点,并且因其资源丰富、成本低、催化特性优异和化学性能稳定而受到广泛关注。其中NiMoO4为单斜晶系材料,由于镍离子和钼离子的高导电性、极高的氧化还原活性和低成本,是目前认为极具发展前途的电极材料之一。但是NiMoO4材料仍存在许多缺点,比如,Seevakan 等[13]采用简单的微波燃烧法合成了NiMoO4纳米颗粒,以NiMoO4制成的电极在2 mA/cm2的电流密度下具有450 F/g的比电容,且在1000 次循环后仍能保持94%的比电容。但是通过SEM 表征可以发现,由于纳米粒子之间的磁相互作用,粒子聚集在一起构成纳米棒状结构,由于合成过程中颗粒的不均匀堆积和晶粒的不均匀生长导致纳米棒的尺寸不均,且发生了团聚现象,使得材料表面积降低,导致实际比容量比理论比容量低很多,因此需要通过对NiMoO4进行改性以获得更高的电化学性能。常见的改进方法分为两种,一是通过改变制备条件或制备工艺以改变材料形貌,二是将材料与其他具有优异电化学性能的材料进行复合,各组分发挥协同效应,从而获得更加优异的电化学性能。
近年来,过渡金属硫化物作为电极材料已被广泛研究,因为它们比氧化物材料具有更高的电子导电性和更好的可逆电化学性能[14],比如CoS[15]、NiS[16]、CuS[17]和MnS[18]。Zhang等[19]采用两步水热法制备纳米杂化结构NiMoO4/Ni3S2,超薄的纳米片上点缀着丰富的纳米颗粒,可以增加更多的电化学活性位点。NiMoO4/Ni3S2作为超级电容电极时,在0.5 mA/cm2的电流密度下具有1195 C/g的高电容。相比于二元硫化物,由于两种金属离子的协同作用,三元硫化物具有更高的导电性,并提供比二元硫化物更丰富的氧化还原反应[20],比如NiCo2S4[21]、MnCo2S4[22]和NiMoS4[23],其中NiCo2S4具有较高的理论比电容和电导率,表现出优异的电化学性能。Yu 等[24]合成了空心棱镜状NiCo2S4,在2 A/g 电流密度下,电容达到834.4 F/g。Chen 等[25]报道了高导电性的NiCo2S4海胆状纳米结构,在4 A/g电流密度下,电容高达1062 F/g。将NiCo2S4与NiMoO4复合,由于钴的较高氧化电位,镍的较高电化学活性,钼的较多化学价态,多种离子之间发挥协同作用,加上硫化物的高导电性,使得复合材料具有优异的电化学性能。因此,NiCo2S4/NiMoO4复合材料作为超级电容器电极材料具有广阔的应用前景。
本工作选用六水合硝酸镍和六水合氯化钴作为镍源和钴源,采用简易的水热法及热处理,制备出纳米棒状的NiMoO4,随后与NiCo2S4进行复合制备出具有纳米多孔形态的NiMoO4/NiCo2S4复合材料,并对材料的组成、结构和形貌进行分析表征,其独特的形貌结构一方面解决了NiMoO4易团聚的问题,另一方面增加了材料的比表面积及活性位点,从而增加了材料的电化学性能。对NiMoO4/NiCo2S4电极及与活性炭(AC)组成的非对称超级电容器进行电化学性能测试,结果表明NiMoO4/NiCo2S4复合材料是一种具有发展前景的超级电容器电极材料。
1 实验材料与方法
1.1 材 料
本工作所用药品皆为分析纯,六水合硝酸镍[Ni(NO3)2·6H2O],六水合氯化钴(CoCl2·6H2O),六水合氯化镍(NiCl2·6H2O),以上试剂均购自上海展云化工有限公司;九水合硫化钠(Na2S·9H2O),尿素[CO(NH2)2],无水钼酸钠(NaMoO4),无水乙醇(C2H5OH),聚偏二氟乙烯(PVDF,99.9%),N-甲基吡咯烷酮(NMP),氢氧化钾(KOH),以上试剂均购自上海阿拉丁生化科技股份有限公司;乙炔黑(电池级),隔膜(水系隔膜),以上均购自山西力源电池材料有限公司;活性炭(分析纯),国药集团化学试剂有限公司。
1.2 分析测试仪器
电化学工作站,CHI660E型,上海辰华仪器有限公司;蓝电电池测试系统,CT3001A1U 型,武汉市蓝电电子股份有限公司;X-射线材料衍射分析仪,rigaku Ultima IV 型,日本理学;X-射线光谱仪,EACALAB Xi+型,赛默飞世尔科技;扫描电子显微镜,ZEISS GeminiSEM 300 型,卡尔蔡司股份公司;EDS能谱仪,Xplore型,牛津仪器科技(上海)有限公司;多站扩展式全自动比表面积与孔隙度分析仪,ASAP 2460 2.01 型,麦克默瑞提克仪器有限公司。
1.3 NiMoO4/NiCo2S4复合材料的制备
1.3.1 NiMoO4的制备
称量 0.5816 g Ni(NO3)2·6H2O 和0.4118 g 无水NaMoO4,依次溶于60 mL 去离子水中,并在室温下磁力搅拌20 min。随后将透明液体转入100 mL以聚四氟乙烯为内衬的反应釜中,在160 ℃下反应6 h。反应结束后,将所得产物分别用去离子水、无水乙醇清洗3 遍,并将洗涤后的样品放在60 ℃真空干燥箱内真空干燥6 h。将干燥产物移至玛瑙研钵研磨成细腻的粉末。最后,将所得的NiMoO4前驱体移至马弗炉中,以2 ℃/min 的升温速率在400 ℃高温下煅烧2 h,自然退火到室温,得到NiMoO4材料。
1.3.2 NiMoO4/NiCo2S4的制备
研磨后的NiMoO4溶于60 mL 去离子水中,再称量0.952 g CoCl2·6H2O、0.476 g NiCl2·6H2O 和2.4 g 尿素,依次加入到溶液中,通过恒温磁力搅拌机搅拌混合溶液,直至溶剂完全溶解。随后将透明液体转入反应釜中,在100 ℃下反应8 h。反应结束后,将所得产物分别用去离子水、无水乙醇清洗3 遍,并将洗涤后的样品放在60 ℃真空干燥箱真空干燥6 h。将干燥材料转移至玛瑙研钵中,研磨约20 min,再将其溶于50 mL去离子水中,并称量1.6 g Na2S·9H2O,将其溶入溶液中,并在室温下磁力搅拌30 min。将溶液转入反应釜中,在160 ℃下反应6 h,冷却至室温后转入离心机,以12000 r/min的转速离心5 min。将产物用去离子水和无水乙醇洗涤3 次后放在60 ℃真空干燥箱真空干燥6 h。将得到的NiMoO4/NiCo2S4前驱体转移至玛瑙研钵中研磨成细腻的粉末,随后移至马弗炉中,以2 ℃/min 的升温速率在400 ℃高温下煅烧2 h,自然退火到室温,得到NiMoO4/NiCo2S4材料,其中NiMoO4与NiCo2S4的摩尔质量比为1∶1,标记为NiMoO4/NiCo2S4-1。在保持NiMoO4浓度不变的情况下,将CoCl2·6H2O、NiCl2·6H2O 和尿素的浓度减半或者增加到原来的2 倍,从而改变生成的NiCo2S4的质量,重复上述实验步骤,生成的复合材料分别标记为NiMoO4/NiCo2S4-0.5 和NiMoO4/NiCo2S4-2,同时不加入NiMoO4以相同的制备方法制备NiCo2S4单质材料。
1.4 电极片制作及超级电容器组装
将活性物质、乙炔黑和PVDF以8∶1∶1的质量比转移至玛瑙研钵中,加入适量NMP 进行研磨混合,然后将电极浆料均匀涂覆在泡沫镍上,置于60 ℃真空干燥箱真空干燥12 h,NiMoO4、NiCo2S4及NiMoO4/NiCo2S4电极片活性物质负载量分别为2 mg/cm2、2.5 mg/cm2、2.4 mg/cm2。随后用压片机裁剪出直径为10 mm 的圆形电极片。以制备的NiMoO4/NiCo2S4复合材料电极片为正极,活性炭电极片为负极,隔膜采用水系隔膜,2 mol/L KOH溶液为电解液,使用2032型电极壳,组装成2032型纽扣式超级电容器电池。
1.5 电化学测试
在25 ℃环境下,使用CHI660E 电化学工作站进行循环伏安测试(CV)、恒电流充电-放电测试(GCD)和电化学阻抗谱测试(EIS),在三电极系统中,使用2 mol/L KOH溶液作为电解液,分别以制备的NiMoO4、NiCo2S4和NiMoO4/NiCo2S4复合材料的电极片作为工作电极,铂丝为对电极、饱和甘汞电极为参比电极,扫描速率为10 mV/s、20 mV/s、50 mV/s。EIS测试电压振幅为5 mV,频率为0.01~105Hz。采用CT3001A1U 型号的蓝电电池测试进行超级电容器电池恒流充放电循环性能测试,电解质为2 mol/L KOH溶液,电流密度为1 A/g。
2 实验结果与讨论
2.1 NiMoO4/NiCo2S4材料结构与形貌表征
图1(a)为NiMoO4/NiCo2S4复合材料的X-射线衍射(XRD)图。图中复合材料NiMoO4/NiCo2S4所有的衍射峰都与单斜NiMoO4标准卡(PDF#86-0361)以及NiCo2S4标准卡(PDF#73-1704)对应较好,未检测到任何杂质,且可以看出衍射峰是清晰的,并且具有良好的结晶度。图1(a)所示的样品在2θ=14.3°、16.0°、19.0°、23.9°、25.3°、26.6°、28.7°、32.6°、33.9°、38.8°、41.1°、43.8°、47.5°、53.5°、56.4°、57.9°、61.9°和66.4°处的衍射峰分别对应(110)、(-111)、(-201)、(-112)、
(021)、(-211)、(220)、(022)、(222)、(202)、(040)、(330)、(-204)、(510)、(024)、(242)、(-352)和(534)晶面(JCPDS 卡号86-0361)。同时,位于16.3°、26.8°、31.6°、38.3°、47.4°、50.5°、55.3°处观察到尖锐的衍射峰,分别对应(111)、(220)、(311)、(400)、(422)、(511)和(440)晶面,证实了NiMoO4和NiCo2S4共存,没有其他杂质,合成了纯度较高的NiMoO4/NiCo2S4复合材料,且衍射峰尖锐,峰宽较窄,说明NiMoO4/NiCo2S4复合材料中结晶区域所占的比例较高,结构不易破坏。为了进一步分析复合材料中各个元素的占比情况,对复合材料进行了能谱分析。使用牛津Xplore型号的能谱仪、Inlens 及ET 二次电子探测器、和EDS能谱仪的探测器,在氮气气氛下,通过能量色散X-射线光谱(EDS)分析证实了二维有序纳米多孔NiMoO4/NiCo2S4的组成。如图1(b)所示,在该光谱中观察到Ni、Mo、Co、S和O峰,表明样品主要由Ni、Mo、Co、S和O组成。
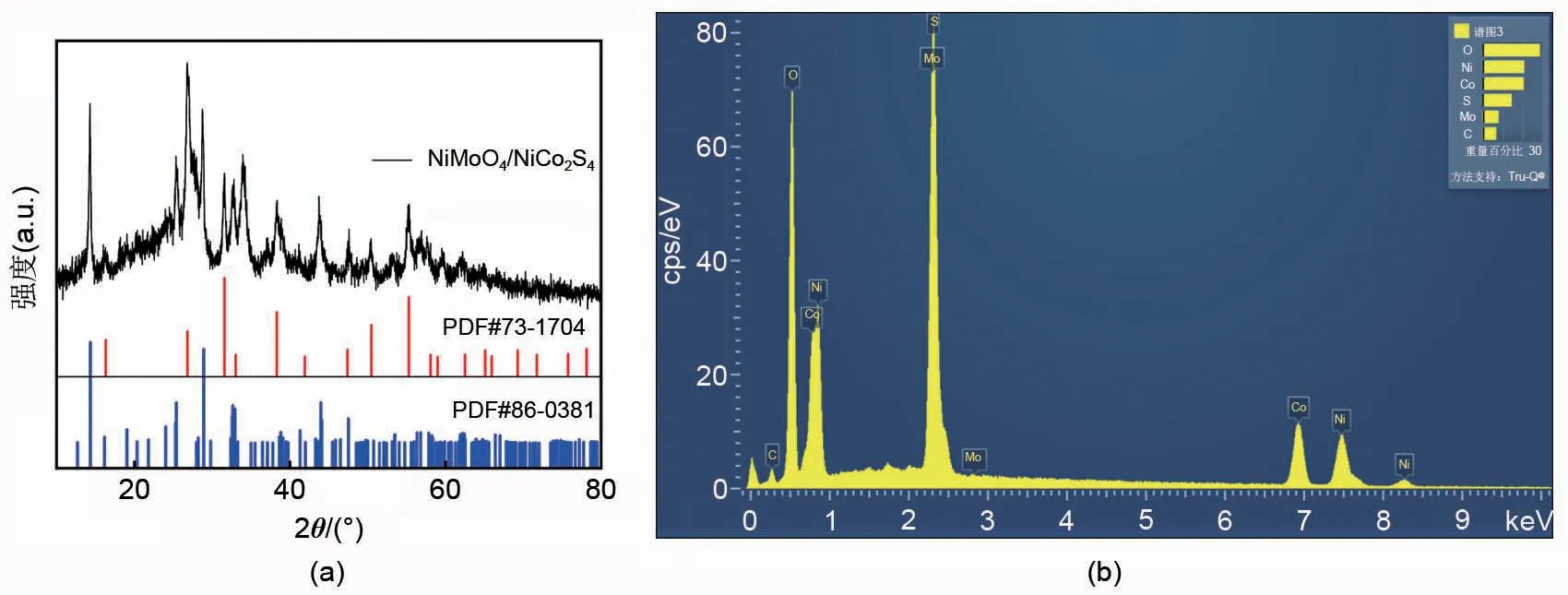
图1 NiMoO4/NiCo2S4复合材料的 (a) XRD图谱;(b) EDS能谱图Fig.1 NiMoO4/NiCo2S4 Composite (a) XRD patterns; (b) EDS spectra
图2 为NiMoO4/NiCo2S4复合材料的X-射线光电子能谱(XPS)图谱。XPS 可以进一步详细反映NiMoO4/NiCo2S4复合材料的各个元素组成以及氧化态。分析图2(a)共有6 个峰,分别位于855.1 eV、781.1 eV、530.15 eV、283.5 eV、231 eV、167.4 eV对应着Ni 2p、Co 2p、O 1s、C 1s、Mo 3d、S 2p,可以看出制备的材料中含有Ni、Co、O、Mo、S 五种元素,全光谱中的峰283.5 eV 归因于仪器的碳碱,此外并没有其他的元素杂质,说明本实验采用三步水热法+一步煅烧法成功制备了NiMoO4/NiCo2S4复合材料。如图2(b)所示,核心能级光谱共有4个峰值,在874.5和855.1 eV对应的两个峰的自旋轨道证明存在归因于Ni3+,而在881.2 和862.45 eV 处对应的峰则归因于Ni2+,同时,在861.5和856.6 eV两处的振荡卫星峰则表明不同化学价态的Ni2+和Ni3+是共存的。图2(c)中有两个主要峰,即235.5和232.4 eV对应的两个峰,之间的能量相差约为3.1 eV,这是钼酸盐离子中Mo6+氧化状态的特征。图2(d)中位于804.15和787.4 eV结合能处的两个峰证实了Co2+的存在,798.5 和782.3 eV处的两个峰证明了Co3+的存在。如图2(e)所示,一个氧化峰表明在NiMoO4样品中可能只存在一种类型的含氧物质。531.4 eV处的较大峰对应于M—O—M,这是NiMoO4材料中典型的晶格氧。如图2(f)所示,峰值位于168.8 eV,对应于样品中的金属硫键(M—S)。因此,所制备材料的化学成分包含Ni2+、Ni3+、Co2+、Co3+、Mo6+,进一步证实了NiMoO4/NiCo2S4的存在。
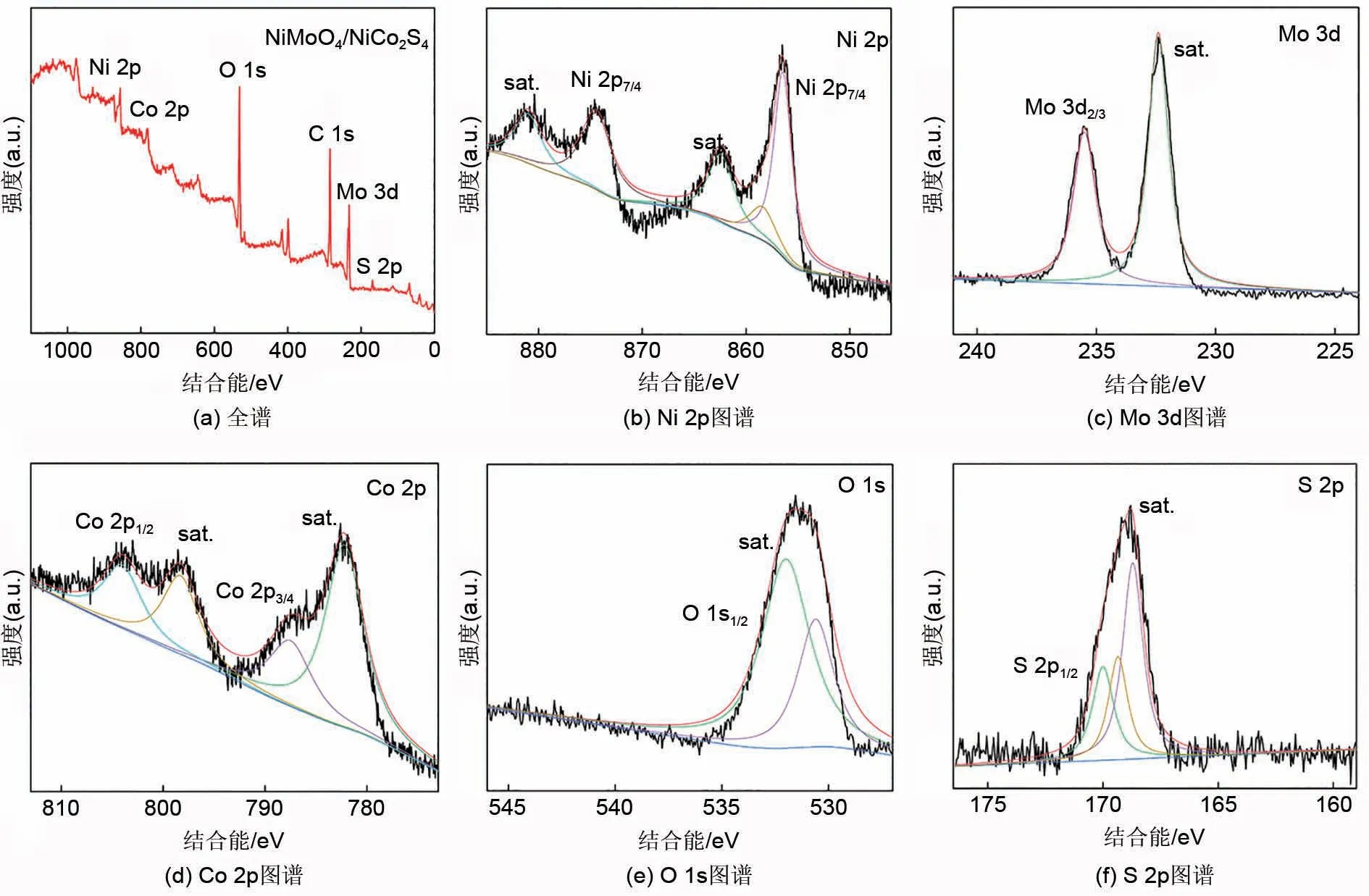
图2 NiMoO4/NiCo2S4复合材料的XPS图谱Fig.2 XPS Spectra of NiMoO4/NiCo2S4 Spectra
为研究材料微观形貌,对NiMoO4及NiMoO4/NiCo2S4进行扫描电子显微镜(SEM)表征。图3(a)~(b)为NiMoO4材料的不同倍率的SEM图。从图3(a)可以看出,所制备的NiMoO4呈现纳米棒状,且均匀地分散开,基本没有出现大量颗粒团聚的现象,颗粒也较为均一、杂质很少。从较大放大倍数图3(b)可以更清楚地看到产物材料的颗粒细小,并且材料的纯度较高。这种结构可以缩短电极与电解液之间的扩散路径,有助于电解液离子进入活性材料的整个表面。
图3(c)~(d)为NiMoO4/NiCo2S4复合材料的不同倍率的SEM 图。从图3(c)可以看出,所制备的材料颗粒呈现纳米多孔结构。从较大放大倍数图3(d)可以更清楚地看到NiMoO4/NiCo2S4复合材料由纳米片组成的多孔网络结构,使得材料的比表面积增加。虽然电极材料的孔隙中的离子迁移率与电解质溶液中的离子迁移率存在差异,但是电极材料的孔径对电解液内离子的整体迁移率有很大影响,若电极材料的孔尺寸较小,可以更方便地接触到电解液[26]。而且具有高导电性的多孔NiCo2S4骨架为活性材料构建了导电通路,可以有效提高电极材料的导电性。其次,用二维层状阵列构建稳定的三维网络,既能增加与电解液接触的内部空间,提供流畅的离子通道,又能承受电化学存储过程中的体积变化,并且增加了氧化还原反应的电化学活性位点[27]。

图3 NiMoO4与NiMoO4/NiCo2S4的SEM图Fig.3 SEM images of NiMoO4 and NiMoO4/NiCo2S4
图4(a)为NiMoO4、NiCo2S4及NiMoO4/NiCo2S4复合材料的氮气吸脱附等温曲线,从图4(a)可以看出NiMoO4/NiCo2S4的氮气吸脱附等温曲线为Ⅳ型等温曲线,且在0.8~1.0的相对压力范围内可以观察到H3型滞后环,滞后环的存在表明介孔的存在,且H3 型滞后环一般由片状材料给出,由片状粒子堆积形成狭缝孔,表明片状的NiCo2S4的加入增加了孔隙,形成多孔结构。通过氮气等温吸脱附曲线,采用BET模型测得NiMoO4/NiCo2S4复合材料的比表面积为49.81 m2/g,高于NiMoO4的10.39 m2/g 及NiCo2S4的33.59 m2/g。图4(b)为NiMoO4/NiCo2S4复合材料的孔径分布曲线,从图4(b)可以看出NiMoO4/NiCo2S4复合材料以介孔为主,孔径分布主要为1.7 nm、3.6 nm、22.3 nm,并采用BJH方法计算出孔体积为0.19 cm3/g。因此这种多孔特性促进了电解液离子的扩散,暴露更多的电活性位点,从而可以进行快速的可逆氧化还原反应。
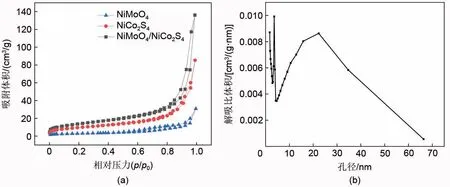
图4 (a) 氮气吸脱附等温曲线;(b) NiMoO4/NiCo2S4复合材料的孔径分布曲线Fig.4 (a) N2 adsorption desorption isotherms; (b) pore-size distribution curves of NiMoO4/NiCo2S4
2.2 电化学性能测试
为了弄清电极的电化学性能,使用三电极测试系统对NiMoO4、NiCo2S4及NiMoO4/NiCo2S4进行电化学性能测试。图5(a)是以NiMoO4材料为工作电极的三电极测试的充放电循环伏安(CV)曲线,可以观察到NiMoO4电极的CV 曲线在电压0.85 V 左右存在一个比较宽的还原峰,在电压1.07 V左右存在一个氧化峰。这明显的氧化还原峰是因为Ni3+与Ni2+之间的转化所导致的,其机理如下所示:
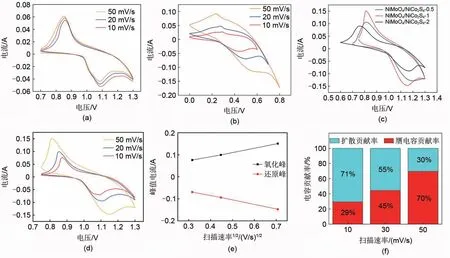
图5 (a) 不同扫描速率下的NiMoO4循环伏安特性曲线;(b) 不同扫描速率下的NiCo2S4循环伏安特性曲线;(c) 不同浓度下制备的NiMoO4/NiCo2S4循环伏安特性曲线;(d) 不同扫描速率下的NiMoO4/NiCo2S4循环伏安特性曲线;(e) NiMoO4/NiCo2S4电极的氧化还原峰的峰电流与扫描速率的平方根的线性拟合;(f) 不同扫描速率下的电容贡献率Fig.5 (a) CV curve of NiMoO4 at different scan rates; (b) CV curve of NiCo2S4 at different scan rates; (c) CV curve of NiMoO4/NiCo2S4 prepared at different solution concentrations; (d) CV curve of NiMoO4/NiCo2S4 at different scan rates; (e) Linear fitting between the peak current of the redox peak of NiMoO4/NiCo2S4electrode and the square root of the scanning rate; (f) Capacitance contribution rate at different scanning rates
伴随着扫描速率的增加,得到的CV 曲线基本保持了一致,这说明所制备的纳米棒状NiMoO4材料作为超级电容器的电极具有良好的可逆充放电性能和稳定的充电放电性能。在反应过程中,不发生钼原子的氧化还原反应,但钼元素对提高三元金属氧化物的导电性和获得增强的电化学性能也起着巨大作用[28]。
图5(b)是以NiCo2S4材料为工作电极的三电极测试的CV曲线,可以观察到在电压0.29 V左右存在一个还原峰,在电压0.45 V 左右存在一个氧化峰。这种明显的氧化还原峰是因为Ni3+与Ni2+和Co3+与Coi2+之间的转化所导致的,其机理如下所示[29]:
图5(c)为不同浓度下制备出的NiMoO4/NiCo2S4复合材料在50 mV/s 扫描速率下的CV 曲线,可以看出NiMoO4/NiCo2S4-1 的CV 曲线围成的面积最大,说明NiMoO4与NiCo2S4摩尔质量比为1∶1 时制备的材料比电容最高。图5(d)是以NiMoO4/NiCo2S4-1 为工作电极时不同扫描速率下的CV 曲线,可以观察到在电压0.85 V左右存在一个较宽的还原峰,在电压1.1 V 左右存在一个氧化峰。基本保持对称的氧化还原峰,表明氧化还原反应具有很大的可逆性。伴随着扫描速率的增加,CV 曲线所显示的积分面积有所变大,氧化峰和还原峰对应的电压位置有所偏移,但偏移较小,这可能由于在较大的扫描速率下,有较大的电流响应,一些相对较慢的离子不能充分发生氧化还原反应造成的。但不同的扫描速率下得到的CV 曲线基本保持了一致,这说明所制备的多孔纳米状的NiMoO4/NiCo2S4复合材料作为超级电容器的电极具有良好的可逆充放电性能和稳定的充电放电性能。并且如图5(e)所示,氧化还原峰值电流与对应的扫描速率的平方根近似线性关系,这表明NiMoO4/NiCo2S4电极的氧化还原反应是扩散控制的,且如图5(f)所示,赝电容贡献率和扩散贡献率在10 mV/s、20 mV/s、50 mV/s 时分别为29% 和71%、45% 和55%、70%和30%。
在保持活性材料质量不变的条件下,调节放电电流及放电电压来进行恒电流充放电测试,所制备材料的恒电流充放电曲线如图6(a)~(d)所示,根据比电容计算公式:
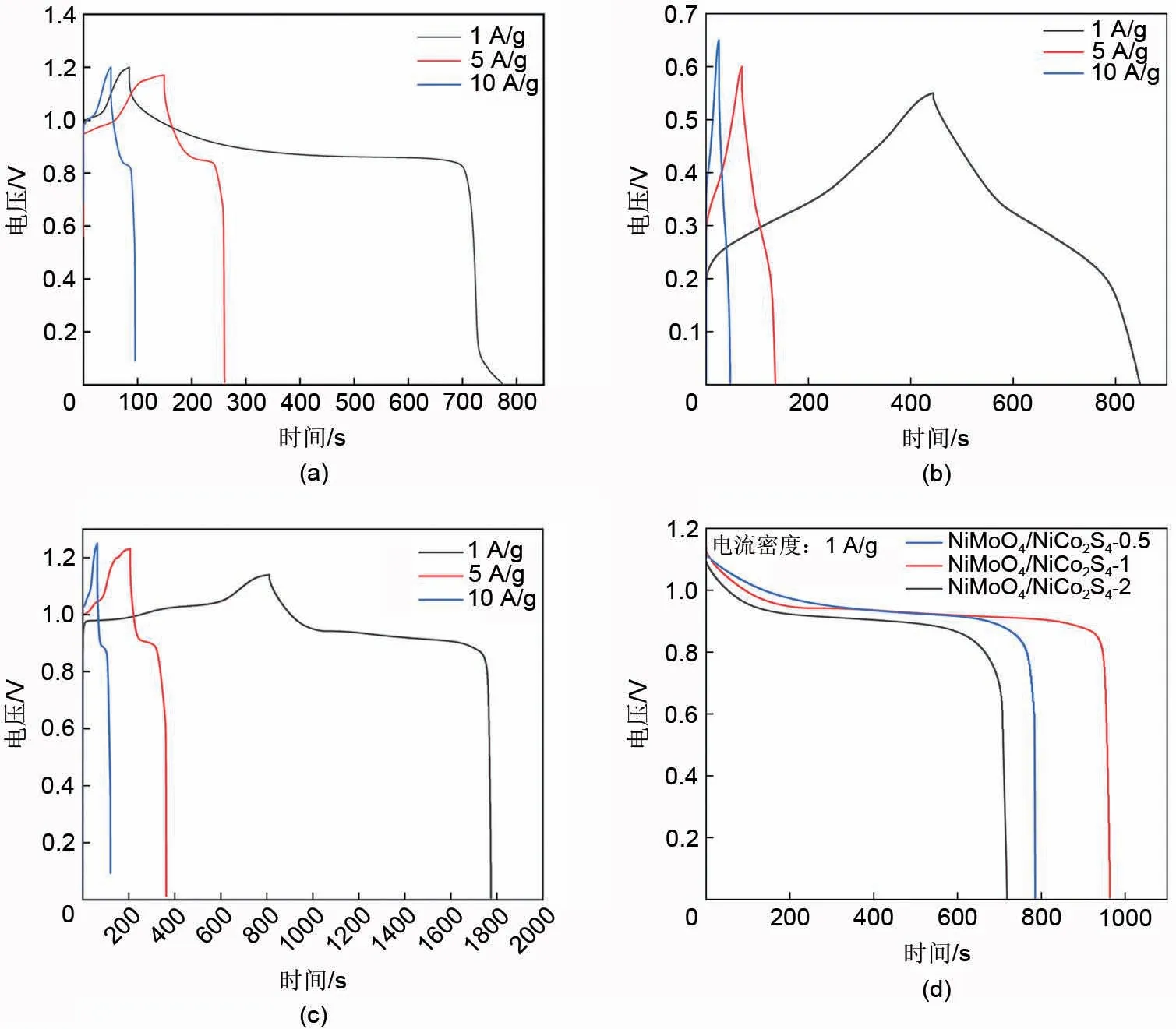
图6 (a) 不同电流密度下的NiMoO4充放电性能曲线;(b) 不同电流密度下的NiCo2S4充放电性能曲线;(c) 不同电流密度下的 NiMoO4/NiCo2S4充放电性能曲线;(d) 不同浓度下制备的NiMoO4/NiCo2S4充放电性能曲线Fig.6 (a) GCD curve of NiMoO4 at different current densities; (b) GCD curve of NiCo2S4 at different current densities; (c) GCD curve of NiMoO4/NiCo2S4 at different current densities; (d) GCD curve of NiMoO4/NiCo2S4 prepared at different solution concentrations
式中:I为放电电流(A);Δt为放电时间(s);m为活性材料质量(g);ΔV为放电电压(V)。
从图6(a)可知,以NiMoO4作为电极材料,在1 A/g、5 A/g、10 A/g 的电流密度下的比电容分别为576.1 F/g、482.8 F/g、376.7 F/g;从图6(b)可知,以NiCo2S4作为电极材料,在1 A/g、5 A/g、10 A/g 的电流密度下的比电容分别为734.3 F/g、545.5 F/g、341.5 F/g;从图6(c)可知,以NiMoO4/NiCo2S4-1作为电极材料,在1 A/g、5 A/g、10 A/g的电流密度下的比电容分别为847.2 F/g、654.2 F/g、466.7 F/g。在1 A/g、5 A/g、10 A/g 的电流密度下,NiMoO4/NiCo2S4复合电极材料的比电容相比于NiMoO4纯样电极材料分别提升了47.1%、35.5%、23.9%;相比于NiCo2S4纯样电极材料分别提升了15.4%、19.9%、36.6%,证实了复合后的电极材料电化学性能更优异。这主要是因为多孔结构可以有效增大电极材料的比表面积,缩短电极和电解质之间电子/离子传输的传输路径,增加了氧化还原反应的活性点位,此外,NiMoO4与NiCo2S4发挥协同效应,从而改善了电化学性能。随着电流密度的增加,比电容也随之下降。这是由于电极表面的有限扩散,以及在较高电流密度下参与氧化还原反应的活性材料不足,电容随着电流密度的增加而降低,但NiMoO4/NiCo2S4电极在10 A/g 的高电流密度下依旧有55%的保留率。图6(d)为不同浓度下制备的NiMoO4/NiCo2S4在1 A/g 的电流密度下的恒电流充放电曲线,通过计算可得,NiMoO4/NiCo2S4-0.5和NiMoO4/NiCo2S4-2的比电容分别为693.9 F/g和648.6 F/g,都低于NiMoO4/NiCo2S4-1。这是因为若复合的NiCo2S4纳米片的量太少,则不能显著提高比电容;若NiCo2S4纳米片的量太多,则会导致NiCo2S4纳米片厚度过大,无法有效渗透电解液,暴露的电化学活性位点减少,导致比电容降低。
笔者还对NiMoO4、NiCo2S4与NiMoO4/NiCo2S4进行电化学交流阻抗谱(EIS)测试,从图7(a)~(c)可以看出,在高频区域是一段弧度,看到不完整的半圆,这是由于电极/电解质界面处的法拉第电荷转移,在低频区域,曲线为有一定斜率的直线,其中NiMoO4/NiCo2S4的欧姆内阻(Rs)为0.68 Ω(低于NiMoO4的0.85 Ω 及NiCo2S4的0.76 Ω);电荷转移电阻(Rct)为2.82 Ω(低于NiMoO4的12.35 Ω 及NiCo2S4的34.39 Ω);扩散电阻(CPEw)的导纳Y0为0.2283 Ω-1·cm-2·S1/2(高于NiMoO4的0.0411 Ω-1·cm-2·S1/2及NiCo2S4的0.0316 Ω-1·cm-2·S1/2),根据公式(7)[30]可知:Y0越大,扩散电阻越低,因此NiMoO4/NiCo2S4的扩散电阻低于NiMoO4及NiCo2S4。
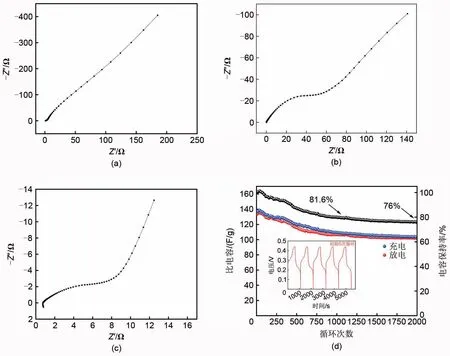
图7 (a) NiMoO4交流阻抗曲线;(b) NiCo2S4交流阻抗曲线;(c) NiMoO4/NiCo2S4交流阻抗曲线;(d) NiMoO4/NiCo2S4||AC超级电容器循环性能曲线Fig.7 (a) EIS curve of NiMoO4; (b) EIS curve of NiCo2S4; (c) EIS curve of NiMoO4/NiCo2S4; (d) Cycle performance curve of NiMoO4/NiCo2S4||AC supercapacitor
式中:Y0为常相位角元件参数值(Ω-1·cm-2·SN);ω为角频率(rad/s);j为虚数单位;N为弥散系数,当N=0.5时,CPE相当于Warburg(扩散)阻抗。
更低的Rs、Rct、CPEw意味着NiMoO4/NiCo2S4复合电极材料的导电性更强,电解质和质子能够更有效地扩散。
以NiMoO4/NiCo2S4复合电极为正极,活性炭为负极,在2 mol/L的KOH溶液中组装了非对称超级电容器。对NiMoO4/NiCo2S4||AC 非对称超级电容器进行长循环测试。从图7(d)中可以明显看出一开始电容不稳定甚至有些增加然后再减少,渐渐趋向稳定,这是因为一开始电极材料活化不稳定。在不断循环之后,电极材料在不断的氧化还原后其微观结构发生细微变化,导致电容的减少。在1000 次循环后电容保持81.6%,2000 次循环后电容依旧保持76%,证实了以NiMoO4/NiCo2S4作为正极材料的超级电容器具有优异的循环稳定性。
3 结论
采用水热法结合退火煅烧工艺制备了多孔三维网络结构的NiMoO4/NiCo2S4材料,这种独特的结构增加了材料的比表面积及反应活性位点,有利于与电解液相接触。与NiMoO4相比,NiMoO4/NiCo2S4展现出优良的电化学性能,GCD测试结果显示,在1 A/g、5 A/g、10 A/g 的电流密度下,NiMoO4/NiCo2S4电极的比电容分别为847.2 F/g、654.2 F/g、466.7 F/g,相比于NiMoO4电极分别提升了47.1%、35.5%、23.9%;相比于NiCo2S4电极材料分别提升了15.4%、19.9%、36.6%。以NiMoO4/NiCo2S4复合电极为正极,活性炭为负极组装的非对称超级电容器在1 A/g 的电流密度下,在经过1000 次循环后电容保持81.6%,2000 次循环后电容依旧保持76%,具有良好的循环稳定性。这些优异的电化学性能证明NiMoO4/NiCo2S4作为超级电容器电极材料具有广阔的应用前景。
