CRM1和SOCS1在胃癌发生发展中作用及与预后的关系
2023-05-08刘王静孙端阳王兴枝子龙喜带赵志文黄炳臣
刘王静,孙端阳,王兴枝子,龙喜带,赵志文,黄炳臣
(1. 右江民族医学院研究生学院,广西 百色 533000;2. 右江民族医学院附属医院病理科,广西 百色 533000)
胃癌是起源于黏膜上皮或腺上皮的具有高度异质性的消化道常见恶性肿瘤之一,在我国胃癌的发病率和死亡率仅次于肺癌[1-2]。细胞信号转导通路的异常激活或抑制与胃癌细胞的恶性增殖密切相关。出核因子(chromosome maintenance region1,CRM1),也称输出蛋白1(XPO1),是多种肿瘤抑制蛋白和致癌蛋白进行核输出载体蛋白,其异常可引起细胞失去正常功能并与肿瘤性转化相关。细胞因子信号传导抑制因子1(SOCS1),参与JAK/STAT信号通路发挥抑制作用,JAK/STAT信号通路可以被多种细胞因子、激素及生长因子刺激诱导,刺激SOCS1的表达,继而又对细胞因子信号转导进行反馈抑制,SOCS1也可直接抑制STAT的受体与相应的结合位点结合,参与多种肿瘤的发生发展。本研究以免疫组织化学方法检测低级别上皮内瘤变、高级别上皮内瘤变、进展期胃癌及对应癌旁组织中CRM1、SOCS1的表达变化,分析其与患者临床病理特征的关系及预后。
1 资料与方法
1.1病例 选择右江民族医学院附属医院2019年4月至2020年8月期间胃镜下活检取材低级别上皮内瘤变胃组织标本27例、高级别上皮内瘤变组织标本26例、胃癌组织标本67例及对应癌旁胃黏膜组织标本67例( 距胃癌组织≥5cm)。67例胃癌患者中,男性44例,女性23例,年龄范围29~79岁,平均年龄(55.67±11.92)岁,<60岁44例,≥60岁23例;肿瘤最大直径≥5 cm有40例,<5 cm有27例;T分期:T1期12例,T2期14例,T3期29例,T4期12例;淋巴结转移51例,无淋巴结转移16例;HP感染阳性12例,阴性55例;Laurén分型:肠型22例,弥漫型40例,混合型5例。所有病例术前均未接受放化疗、生物治疗或靶向治疗,不伴有其他严重内科疾病或恶性肿瘤,研究经伦理委员会审查。
1.2随访 所有患者均通过电话进行术后总生存时间(overall survival,OS)随访,以月为单位并记录相应的生存时间。以胃癌确诊时间为起点,观察终止时间为患者死亡日期或肿瘤复发转移或失访,随访时间范围为0.36~37.98个月,中位生存11.96个月,失访患者有19例,11例死亡,37例存活。
1.3方法 内镜小活检标本离体30 min内经10%中性福尔马林固定6~12 h,手术切除标本离体30 min内切开固定24~36 h,常规石蜡包埋,3 μm连续切片,HE染色后于镜下观察;免疫组织化学染色采用EnVision法,鼠抗人CRM1和SOCS1单克隆抗体、免疫组化显色试剂盒均购自福州迈新生物技术有限公司,具体操作均严格按照试剂盒说明书执行。
1.4结果判读 CRM1和SOCS1阳性为肿瘤细胞胞核和/或胞浆着色。以肿瘤细胞胞浆或胞核染色强度计分: 0分不着色;1分淡黄色;2分棕黄色;3分棕褐色。任取10个高倍视野(HPF),按阳性表达的肿瘤细胞占所有肿瘤细胞百分比计分: 0分为阴性;1分为阳性细胞数≤25%;2分为26%~50%;3分为51%~75%;4分为阳性肿瘤细胞≥76%。最后两项记分相乘得分≤3分为低表达,>3分为高表达。
1.5统计学方法 应用SPSS 20.0统计分析软件对实验数据进行统计分析。癌组织与癌旁组织间CRM1、SOCS1表达情况的比较使用配对χ2检验,CRM1、SOCS1表达情况与临床病理特征的关系采用χ2检验或连续性校正χ2检验。采用Kaplan-Meier Plotter绘制生存曲线图,多因素Cox分析胃癌CRM1及SOCS1表达与患者生存期之间的关系。
2 结果
2.1CRM1在癌旁组织、低级别瘤变、高级别瘤变和胃癌中的表达 细胞核和/或胞浆着色呈淡黄、棕黄及棕褐色为CRM1阳性表达,见图1。CRM1在癌旁组织、低级别上皮内瘤变、高级别上皮内瘤变及胃癌组织中的高表达率分别为7.46%(5/67)、62.96%(17/27)、73.08%(19/26)和64.18%(43/67),CRM1在低级别上皮内瘤变、高级别上皮内瘤变及胃癌组织中的高表达率均明显高于癌旁组织,差异具有统计学意义(分别为χ2=33.068,P<0.001;χ2=42.118,P<0.001;χ2=46.874,P<0.001),而在低级别、高级别上皮内瘤变和癌组织中的高表达率组间差异无统计学意义(P>0.05),见表1。

注:A.CRM1在癌旁组织中的上皮细胞核及胞浆未见表达;B.CRM1在低级别上皮内瘤变细胞核及胞浆呈淡黄色表达;C.CRM1在高级别上皮内瘤变细胞核及胞浆黄色表达;D.CRM1在胃癌组织中细胞核及细胞浆棕黄色表达。
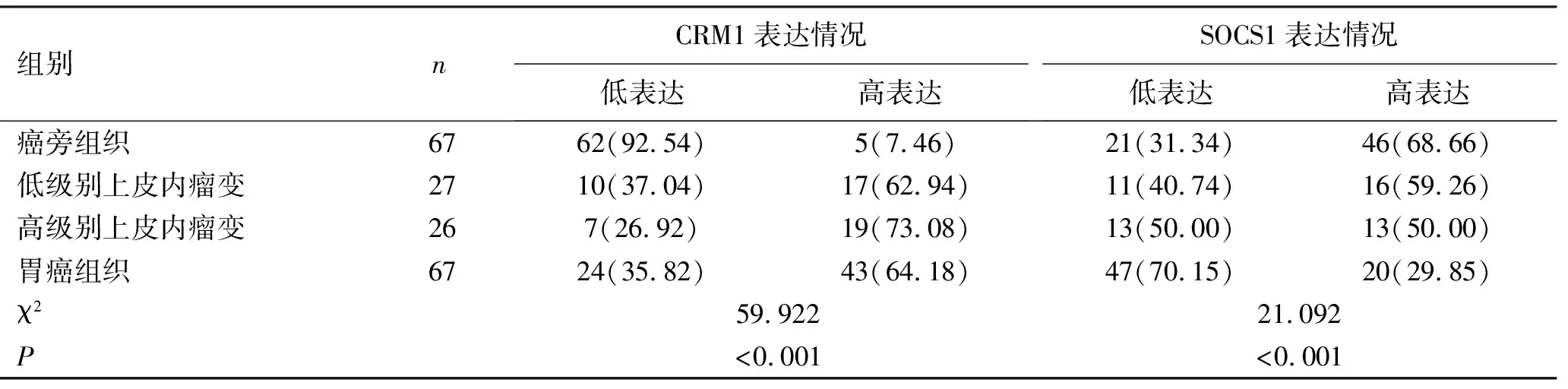
表1 胃癌不同演进阶段的CRM1、SOCS1表达情况
2.2SOCS1在癌旁组织、低级别瘤变、高级别瘤变和胃癌中的表达 细胞核和/或胞浆着色呈淡黄、棕黄及棕褐色为SOCS1阳性表达,见图2。SOCS1在癌旁组织、低级别上皮内瘤变、高级别上皮内瘤变及胃癌组织中的高表达率分别为68.66%(46/67)、59.26%(16/27)、50.00%(13/26)和29.85%(20/67),SOCS1在癌组织中的高表达明显低于在癌旁组织和低级别瘤变中的表达,差异具有统计学意义(分别为χ2=20.184,P<0.001;χ2=7.043,P=0.008),见表1。

注:E.SOCS1在癌旁组织中细胞核及细胞浆棕褐色表达;F.SOCS1在低级别上皮内瘤变细胞核及细胞浆呈黄色表达;G.SOCS1在高级别上皮内瘤变中部分细胞核及细胞浆淡黄色表达;H.SOCS1在胃癌组织中细胞核及细胞浆表达极低或不表达。
2.3胃癌组织中CRM1及SOCS1的表达与患者临床病理参数的关系 结果显示,T1+T2期和T3+T4期的高表达率分别为42.31%(11/26)和78.05%(32/41),CRM1在T3+T4期组的高表达率明显高于T1+T2组的高表达率(χ2=8.841,P=0.003),有淋巴结转移和无淋巴结转移的高表达率分别为76.47%(39/51)和25.00%(4/16),CRM1在有淋巴结转移的高表达率明显高于无淋巴结转移组(χ2=14.035,P<0.001)。与患者年龄、性别、肿瘤大小、是否HP感染及Laurén分型临床病理参数无关(P>0.05),见表2。
2.4胃癌组织中CRM1表达与SOCS1表达的相关性 胃癌组织中CRM1与SOCS1共同低表达22例、共同高表达3例、CRM1高表达而SOCS1低表达40例、SOCS1高表达而CRM1低表达2例,Spearman相关分析显示,CRM1与SOCS1表达无相关性(R=-0.025,P=0.842)。
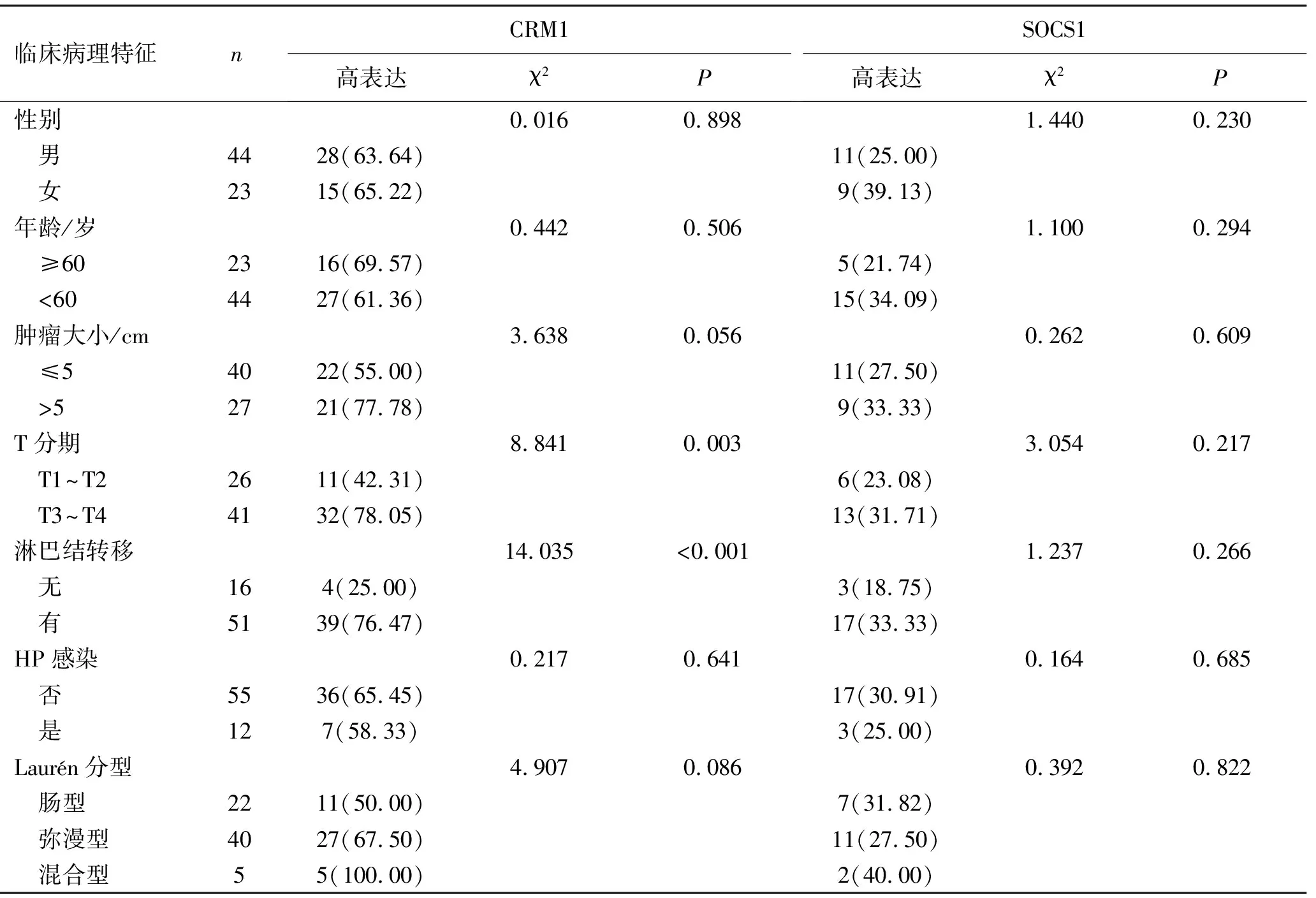
表2 胃癌组织CRM1及SOCS1的表达患者临床病理特征的关系
2.5胃癌组织中CRM1及SOCS1表达与患者生存预后相关 对67例胃癌患者进行随访,CRM1低表达患者中位生存期为21.31个月,高表达患者中位生存期为8.31个月,Kaplan-Meier Plotter生存分析结果表明CRM1高表达胃癌患者生存时间明显低于低表达胃癌患者(χ2=4.198,P=0.040),说明CRM1高表达意味预后不良,见图3。SOCS1低表达患者中位生存期为13.73个月,高表达患者中位生存期为7.62个月,SOCS1高表达胃癌患者与低表达胃癌患者生存时间无明显差异(χ2=1.042,P=0.307),见图4。以预后状态为因变量,赋值0=生存,1=死亡,将各项临床病理特征、CRM1表达及SOCS1表达纳入单因素Cox分析,赋值情况:性别:0=男性,1=女性;年龄:0=≤60岁,1=>60岁;肿瘤大小:0=≤5 cm,1=>5 cm;浸润深度:0=T1~T2期,1=T3~T4期;HP感染:0=否,1=是;淋巴结转移:0=无,1=有;CRM1:0=低表达,1=高表达;SOCS1:0=低表达,1=高表达。结果发现性别(P=0.044,HR=0.123,95%CI:0.016~0.948)、肿瘤大小(P=0.005,HR=6.044,95%CI:1.701~21.470)、浸润深度(P=0.009,HR=7.794,95%CI:1.667~36.434)具有统计学意义(P<0.05)。将以上P<0.05的变量纳入多因素Cox回归分析,得出肿瘤大小具有统计学意义(P<0.05),是影响预后的危险因素,见表3。
3 讨论
多数胃癌伴有上皮内瘤变的异常增生阶段,从低级别到高级别瘤变和癌形成伴随众多基因的参与并表现为形态、功能的一系列改变,分子表型和生物学行为均具有明显异质性。CRM1也称为核输出蛋白1(XPO1),是由XPO1基因编码的染色体区域维持蛋白1,其主要功能是促进包括肿瘤抑制蛋白在内的分子从细胞核输出到细胞质从而使其失活的主要蛋白体。在真核细胞中介导特定蛋白质从细胞核到细胞质的转运,细胞内的核蛋白运输对于引导重要蛋白质和RNA在细胞核和细胞质之间的运输至关重要,蛋白质从细胞核的输出主要受CRM1基因调控,由于旺盛的代谢需求,恶性肿瘤细胞对蛋白质的核质运输具有更高的依赖性,在肿瘤中CRM1活性增高,CRM1对关键抑制因子和致癌蛋白细胞内定位的失调有利于肿瘤的发展和进展。文献报道[3-7],CRM1在多种人类肿瘤如胶质瘤、胰腺癌、卵巢癌及大细胞淋巴瘤中均表达上调,且CRM1高表达与预后不良相关,CRM1突变可能是B细胞淋巴瘤和B细胞白血病的驱动因子[8]。
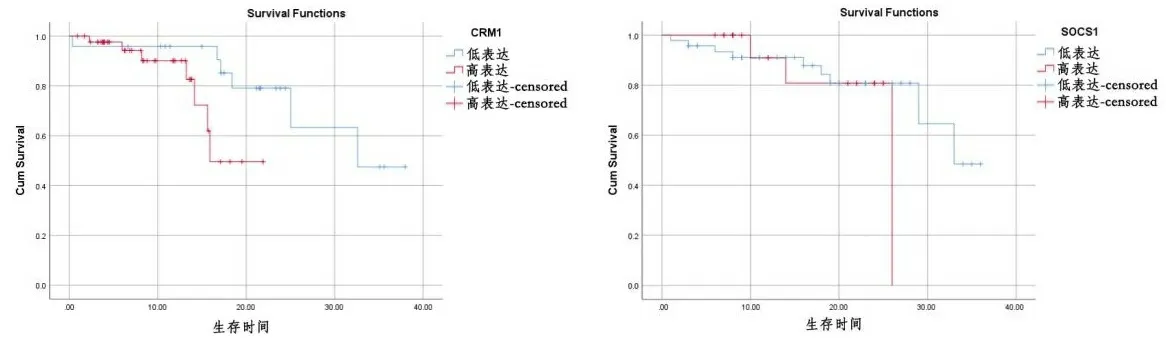
图3 CRM1表达与术后总生存期的关系 图4 SOCS1表达与患者总生存期的关系
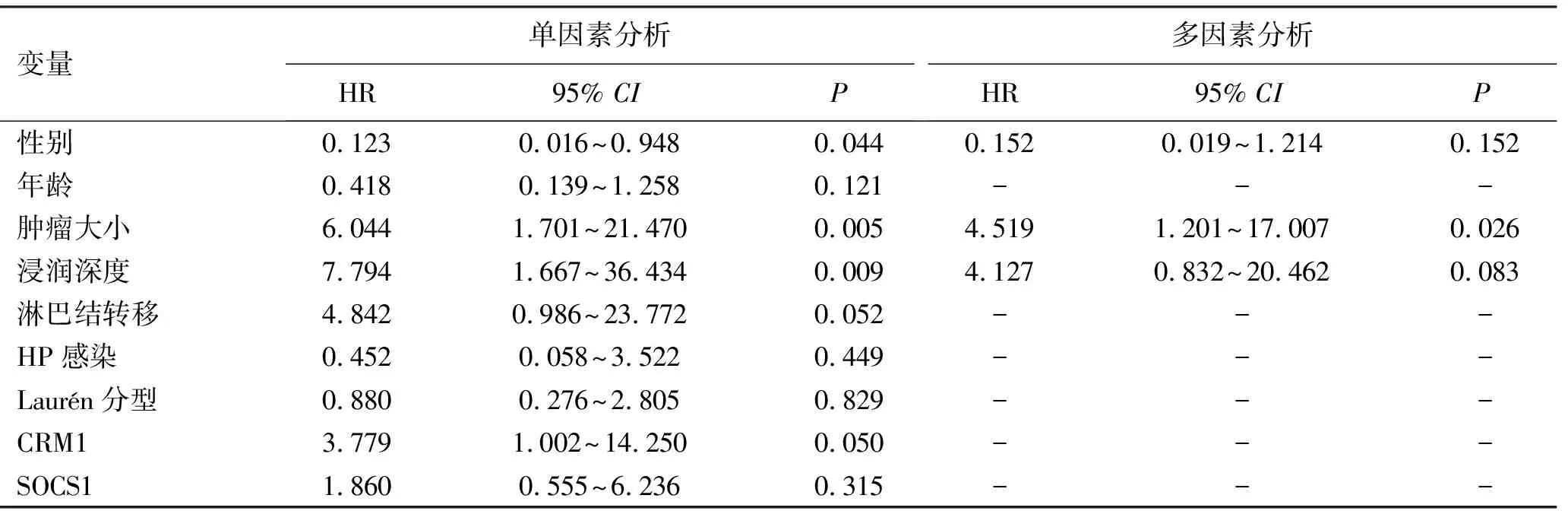
表3 67例GC患者单因素和多因素Cox分析
PIK3/AKT信号通路可提高肿瘤生长速度和侵袭能力[9],PAN L J等[10]应用神经母细胞瘤研究verdinexor(KPT-335)的体外抗肿瘤作用中发现,verdinexor抑制剂抑制CRM1后,细胞P13K/AKT信号通路受到抑制,进而抑制FOXO1和RB1在神经母细胞核内积累,抑制神经母细胞瘤的增殖、诱导细胞凋亡,并通过激活P53功能,诱导G0/G1细胞周期阻滞,高表达CRM1的神经母细胞瘤与患者的恶性进展有关。以上研究结果提示,CRM1可能参与人类多种肿瘤的发生发展,在促进肿瘤增殖、侵袭和转移等生物学行为发挥重要生物学作用。本研究结果显示,在低级别、高级别上皮内瘤变和胃癌组织中的CRM1的表达均显著高于癌旁组织,提示CRM1蛋白高表达可能参与胃黏膜上皮瘤变和癌变过程,在对CRM1表达的观察中,胃癌组织的染色阳性强度比低级别瘤变的腺体更强呈棕黄色,而在低级别瘤变和高级别瘤变普遍呈淡黄色或黄色,这种染色的增强,说明CRM1基因表达增强和蛋白含量的增加,可能有助于病理医师识别胃黏膜小活检组织中对于上皮内瘤变和胃癌识别。CRM1在胃癌组织中高表达与浸润深度、淋巴结转移呈明显相关,Kaplan-Meier Plotter生存分析显示,高表达CRM1患者的中位生存期为8.31个月,低表达患者中位生存期为21.31个月,前者生存时间更短。单因素及多因素Cox回归分析显示肿瘤大小是影响胃癌患者预后的因素。
SOCS1是SOCS蛋白家族中的一员,具有N末端区域、SH2区和SOCS盒结构域,参与信号蛋白的磷酸化和靶蛋白的泛素-蛋白酶体途径,是细胞内负性调节信号传导的关键蛋白之一,主要调控JAK /STAT和TLR信号传导途径,JAK-STAT途径是调节基因表达、细胞活化、增殖和分化的细胞因子的重要通路,SOCS1可以靶向结合未磷酸化的JAK,阻止JAK的磷酸化而抑制信号传导[11]。甲基化、突变等各种原因导致SOCS1表达减少或抑制SOCS1可促进JAK/STAT信号通路的持续激活,并启动与增殖和侵袭相关基因的转录;作为泛素化过程的参与蛋白,SOCS1介导泛素化底物的降解和调节细胞的生长,异常DNA甲基化造成的SOCS1沉默有助于各种肿瘤的发生。文献报道,SOCS1在子宫颈癌、卵巢癌、肝癌表达下调[12-14]。王兴等[15]应用免疫组织化学检测正常子宫内膜、子宫内膜增生和子宫内膜癌中SOCS1的表达研究中发现,子宫内膜癌组中SOCS1阳性表达率较增生组和正常组降低,其表达的缺失与肿瘤肌层浸润、淋巴结转移和高Ki67增殖指数相关。胃癌是与炎症相关密切的肿瘤,有研究表明,幽门螺杆菌感染胃癌患者的SOCS1启动子区CpG岛异常甲基化显著增高[16]。本实验结果显示,癌组织SOCS1阳性表达率显著低于癌旁组织,在胃黏膜的低级别和高级别上皮内瘤变向进展期癌演进过程中,SOCS1表达水平逐渐降低,提示其可能作为胃癌的抑癌基因,由于SOCS1是细胞因子和生长因子的重要调节因子,缺失会激活致癌信号通路[17]。体外研究证实,沉默SOCS1基因后的食管癌细胞凋亡减少,而细胞增殖、迁移和侵袭能力明显增强[18]。本实验结果并未发现SOCS1表达缺失与胃癌患者临床病理特征及预后存在相关性,这可能与本组研究的病例较少和随访时间短有关,需扩大样本量深入研究。
综上所述,CRM1及SOCS1在胃癌组织及癌旁组织中表达具有显著性差异,CRM1高表达与浸润深度、淋巴结转移及预后具有相关性,肿瘤大小是影响胃癌患者预后的危险因素;SOCS1在低级别上皮内瘤变及胃癌组织中的表达有差异,本次研究表明二者对于胃癌的诊断有一定的临床价值,CRM1与SOCS1的表达无相关性,提示两者在胃癌的发生发展过程中可能不存在相互调控关系,其在胃癌进展过程中的机制仍需进深入研究。
